基于JAK/STAT3信号通路探讨右归丸对骨关节炎模型大鼠软骨细胞凋亡的影响❋
2022-10-20包程公杨永菊马贤德关雪峰
包程公, 杨永菊, 马贤德, 郑 曲, 张 宇, 关雪峰△
(1.辽宁中医药大学, 沈阳 110847;2.辽宁中医药大学附属医院, 沈阳 110032)
骨性关节炎(osteoarthritis,OA)属于慢性退行性关节病,主要病理特征为关节软骨退变以及关节周围骨质增生[1]。OA多见于中老年人群,女性较男性更多,资料显示该病在我国>40岁人群中的发病率达10%~17%,并且随着肥胖人口增加和人口老龄化发展,其发病率逐年升高[2]。关节疼痛、肿胀、活动不利等为OA主要表现,晚期可致残。临床多采用非甾体类抗炎药、保护软骨药物等对症治疗,但副作用明显且无法控制其进展[3],目前亟需寻找更为安全有效的药物。中医认为OA属于“痹证”“骨痹”范畴[4],多由年老肾阳不足、又感受风、寒、湿外邪、气血瘀滞所致,治疗以温补肾阳、化瘀除痹为原则,针灸、中药复方、中成药等多种方法治疗该病取得了较好的效果[5-7]。右归丸是温补肾阳法的代表方,在OA的临床治疗中疗效肯定[8],但其相关作用机制尚未完全明确。本次研究以Janus激酶(janus kinase,JAK)2/信号传导和转录激活因子(signal transducer and activator of transcription,STAT)3信号通路为切入点,探讨右归丸对OA大鼠软骨细胞凋亡的影响。本研究通过辽宁中医药大学实验动物伦理委员会批准(批号21000042021052)。
1 材料
1.1 动物
SPF级雄性SD大鼠48只,8周龄,体质量240~280 g,由辽宁中医药大学实验动物中心提供,实验动物许可证号SCXK(辽)2019-0001。将大鼠分笼饲养,环境温度、湿度分别保持在(21±1)℃和(50±5)%,昼夜交替时间为12 h,保证充足饮水与标准饲料,适应性饲养5 d后开始实验。
1.2 药物
右归丸药物组成:熟地黄24 g,鹿角胶、山药、杜仲、菟丝子各12 g,山茱萸、当归、枸杞子各9 g,附子、肉桂各6 g,购自辽宁省中医医院药剂科,煎煮并制成浓度为2 g/mL的右归丸药液,4 ℃冰箱保存。塞来昔布胶囊(辉瑞制药有限公司,国药准字J20140072,每粒0.2 g)采用0.9%氯化钠溶液制成0.4 mg/mL塞来昔布悬液,即用即配。
1.3 主要试剂与仪器
TUNEL细胞凋亡检测试剂盒(货号GOY-9884)、通用SP检测试剂盒(货号GOY-D12592),上海谷研实业有限公司;HE染色试剂盒(货号H1200KT)、DAB显色试剂盒(货号YDJQ3587)、ECL试剂盒(货号YDJQ3429),上海羽哚生物科技有限公司;PVDF膜(上海嵘崴达实业有限公司,货号3010040001);BCA试剂盒(南京莱富赛生物科技有限公司,货号PA001);兔抗大鼠JAK2,STAT3、B淋巴细胞瘤(B-lymphoma,Bcl)-2、Bcl-XL关联XL蛋白(Bcl-2 associated X protein,Bax-XL)抗体、β-肌动蛋白(β-actin)抗体、山羊抗兔二抗,货号分别为FNab04432、FNab08299、FNab00840、FNab00811、FNab00873、FNab09778,武汉菲恩生物科技有限公司。
DCM8型光学显微镜,德国Leica公司;ELITE300PLUS型垂直电泳仪、E-Blotter型湿转槽,美国WEALTEC公司。
2 方法
2.1 分组、造模及给药方法
随机将大鼠分为假手术组12只和造模组36只。全部大鼠仰卧固定,1.5 mL/kg腹腔注射3%戊巴比妥钠,麻醉之后打开右侧后肢膝关节的关节腔,造模组剪断内侧副韧带和前后交叉韧带,验证前抽屉试验呈阳性,同时将内侧半月板完整摘除;假手术组仅打开关节腔,不进行其他操作;青霉素冲洗创口后缝合。术后给予青霉素肌肉注射3 d抗感染。术后第2 天开始,定时驱赶动物以强迫其活动后肢30 min,每日1次[9]。6周后,假手术组取1只大鼠、造模组取2只大鼠,采用HE染色法观察患肢膝关节软骨组织,判定模型是否建立成功。
造模过程中有1只大鼠死亡。将造模成功的33只大鼠分为模型组、右归丸组及塞来昔布组各11只。模型组、假手术组分别给予0.9%氯化钠溶液,右归丸组给予2 g/mL右归丸溶液,塞来昔布组给予0.4 mg/mL 塞来昔布悬液,各组大鼠均灌胃给药,体积为10 mL/kg,连续8周。
2.2 标本采集与处理
末次干预后第2天麻醉处死大鼠,完整取出患侧膝关节的软骨组织,洗涤后切取1/2置于10%甲醛内固定,14 h后取出置于脱钙液内处理24 h,石蜡包埋,切片机制成5 μm切片,以备HE、免疫组化以及TUNEL染色观察;另外1/2软骨组织冻存于-80 ℃冰箱,以备Western blot检测。
2.3 HE染色法观察大鼠软骨形态
将软骨组织石蜡切片取出,常规采用二甲苯处理脱蜡,100%~95%~85%乙醇依次处理水化,之后HE试剂盒染色、脱水、透明、封片。在光学显微镜下观察染色结果并拍照,参照文献采用Mankin评分评估各组软骨损伤情况[10]。
2.4 TUNEL染色法观测大鼠软骨组织细胞凋亡情况
取软骨组织石蜡切片并脱蜡、水化,3%H2O2处理3 min。按照TUNEL试剂盒说明书进行染色、脱水、透明、封片[11],采用光学显微镜观察并采集图像。凋亡阳性细胞呈棕黄色,对切片中随机5个视野的凋亡细胞、总细胞进行计数并取平均值。细胞凋亡指数(apoptotic index,AI)=凋亡细胞数/总细胞数×100%。
2.5 免疫组化法检测大鼠软骨组织JAK2、STAT3、Bcl-2、Bcl-XL表达
取软骨组织石蜡切片,抗原修复,3% H2O2去除内源性过氧化氢酶,5%牛血清白蛋白溶液封闭,分别用JAK2(1∶200)、STAT3(1∶100)、Bcl-2(1∶200)、Bcl-XL(1∶100)一抗工作液处理2 h,山羊抗兔二抗工作液(1∶100)处理1 h,DAB显色,苏木素复染,脱水、透明、封片[11]。采用光学显微镜观察,阳性细胞被染成棕黄色,计数JAK2、STAT3、Bcl-2、Bcl-XL阳性细胞数和总细胞数,分别计算阳性表达率并取平均值。
2.6 Western blot法测定大鼠软骨组织JAK2、STAT3、Bcl-2、Bcl-XL蛋白表达
将冻存的软骨组织剪碎加入细胞裂解液,BCA法确定总蛋白浓度;SDS-PAGE凝胶电泳,湿转法转至PVDF膜上;封闭后分别用JAK2、STAT3、Bcl-2、Bcl-XL、β-actin一抗(1∶500)4 ℃孵育过夜;山羊抗兔二抗(1∶3000)室温孵育1 h,ECL试剂盒显色[12]。
采用ImageLab软件分析各条带灰度值,计算JAK2、STAT3、Bcl-2、Bcl-XL灰度值与β-actin的比值。
2.7 统计学方法
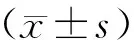
3 结果
3.1 各组大鼠软骨组织病理学观察
图1示,HE染色显示,假手术组大鼠关节面及滑膜结构完整,软骨细胞呈水平排列,关节软骨边缘光滑;模型组大鼠关节软骨边缘严重破坏,软骨层细胞变薄、排列紊乱,软骨下骨增生,可见脱水固缩坏死的软骨细胞,各层软骨结构无法分辨;右归丸组和塞来昔布组大鼠软骨结构趋于正常,软骨细胞排列偶欠规整,关节软骨表面欠光滑。
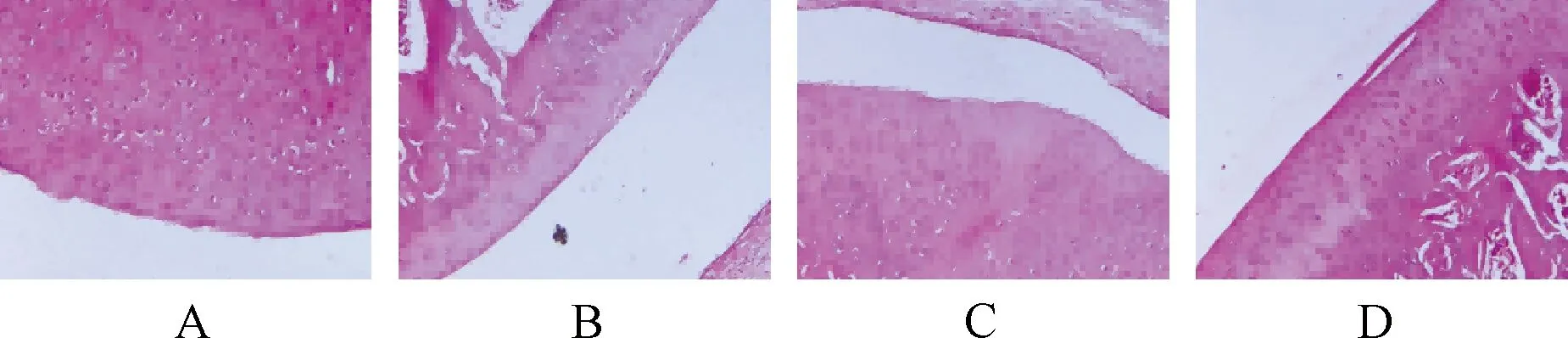
注:A.假手术组;B.模型组;C.右归丸组;D.塞来昔布组图1 各组大鼠软骨组织病理学结果比较(HE染色 ×200)
表1示,与假手术组比较,模型组大鼠软骨Mankin评分升高(P<0.05);与模型组比较,右归丸组及塞来昔布组大鼠软骨Mankin评分降低(P<0.05)。
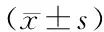
表1 各组大鼠软骨Mankin评分比较
3.2 各组大鼠软骨组织AI比较
表2图2示,TUNEL染色结果显示,与假手术组比较,模型组大鼠软骨AI明显升高(P<0.05);与模型组比较,右归丸组及塞来昔布组大鼠软骨AI明显降低(P<0.05)。
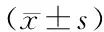
表2 各组大鼠软骨组织AI比较
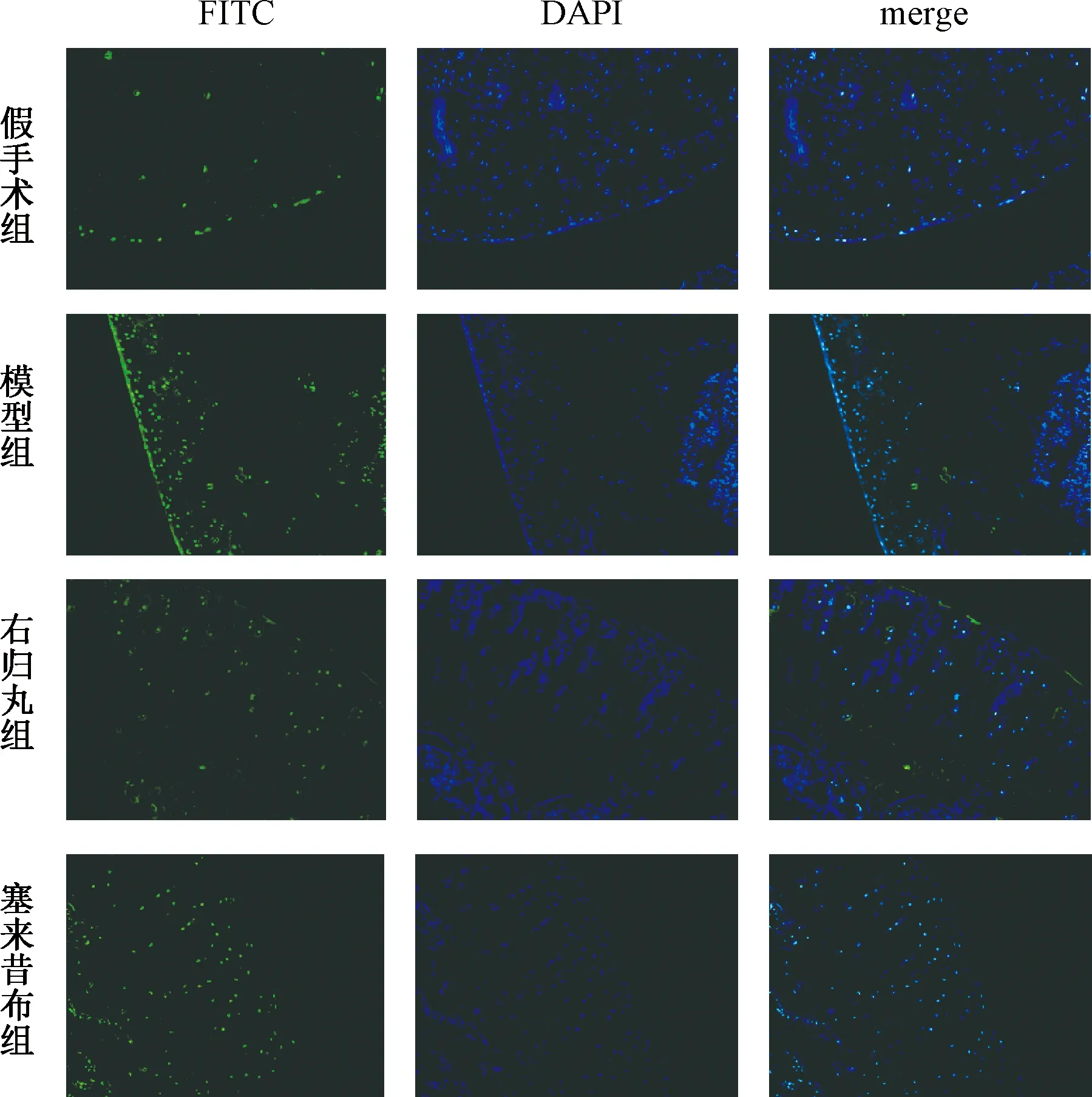
图2 各组大鼠软骨组织细胞凋亡结果(TUNEL染色 ×200)
3.3 各组大鼠软骨组织JAK2、STAT3、Bcl-2、Bcl-XL阳性表达率比较
表3图3示,免疫组化染色结果显示,与假手术组比较,模型组大鼠软骨JAK2、STAT3、Bcl-2、Bcl-XL阳性表达率明显降低(P<0.05)。与模型组比较,右归丸组及塞来昔布组大鼠软骨JAK2、STAT3、Bcl-2、Bcl-XL阳性表达率明显升高(P<0.05)。
表3 各组大鼠软骨组织JAK2、STAT3、Bcl-2、Bcl-XL阳性表达率比较
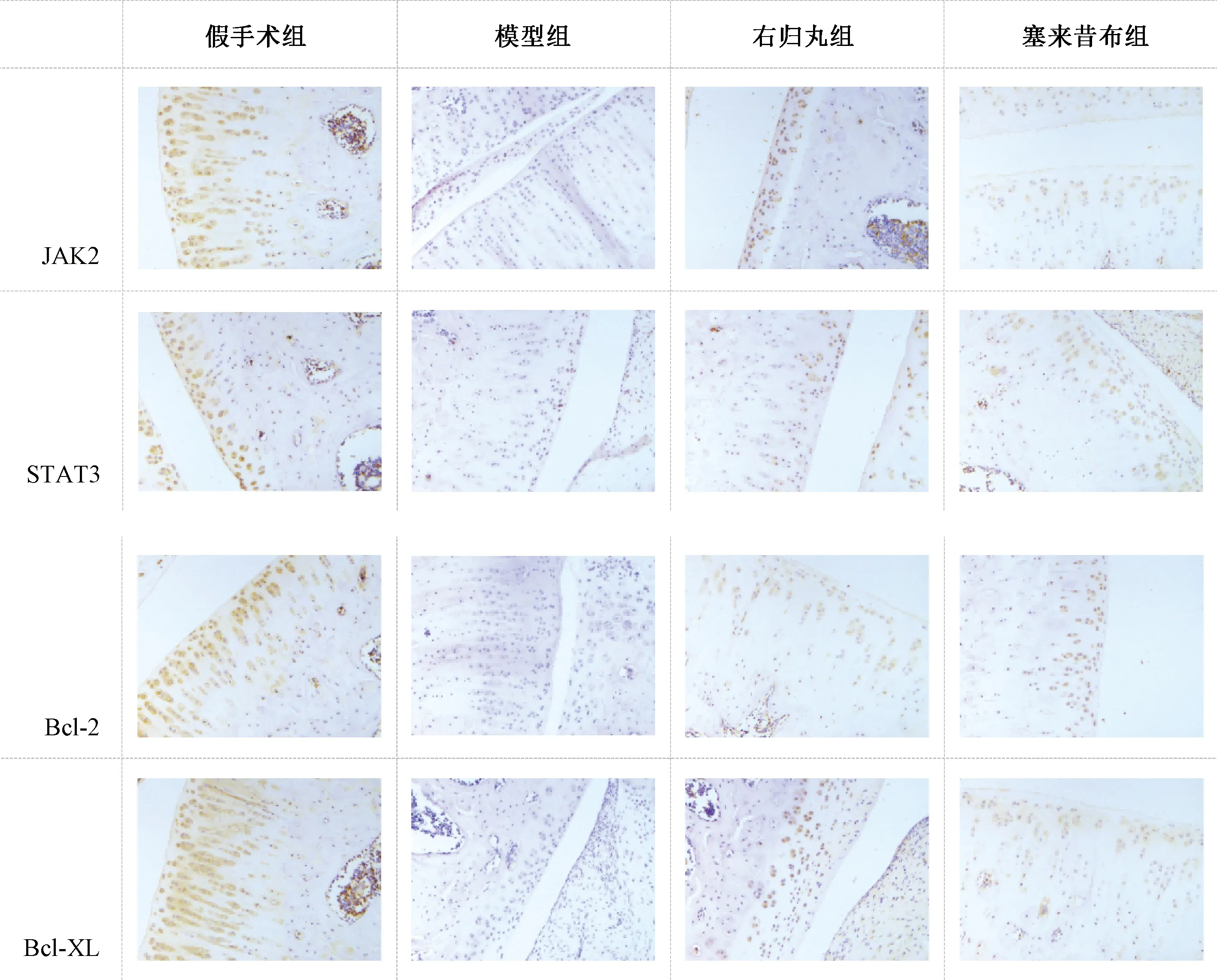
注:Janus激酶(Janus kinase,JAK)2,信号传导和转录激活因子(signal transducer and activator of transcription,STAT)3,B淋巴细胞瘤(B-lymphoma,Bcl)-2,Bcl-2关联XL蛋白(Bcl-2 associated X protein,Bax-XL)图3 各组大鼠软骨组织JAK2、STAT3、Bcl-2、Bcl-XL免疫组化染色结果(×400)
3.4 各组大鼠软骨组织JAK2、STAT3、Bcl-2、Bcl-XL蛋白表达水平比较
表4图4示,与假手术组比较,模型组大鼠软骨JAK2、STAT3、Bcl-2、Bcl-XL蛋白表达水平明显降低(P<0.05)。与模型组比较,右归丸组及塞来昔布组大鼠软骨JAK2、STAT3、Bcl-2、Bcl-XL蛋白表达水平明显升高(P<0.05)。
表4 各组大鼠软骨组织JAK2、STAT3、Bcl-2、Bcl-XL蛋白表达水平比较
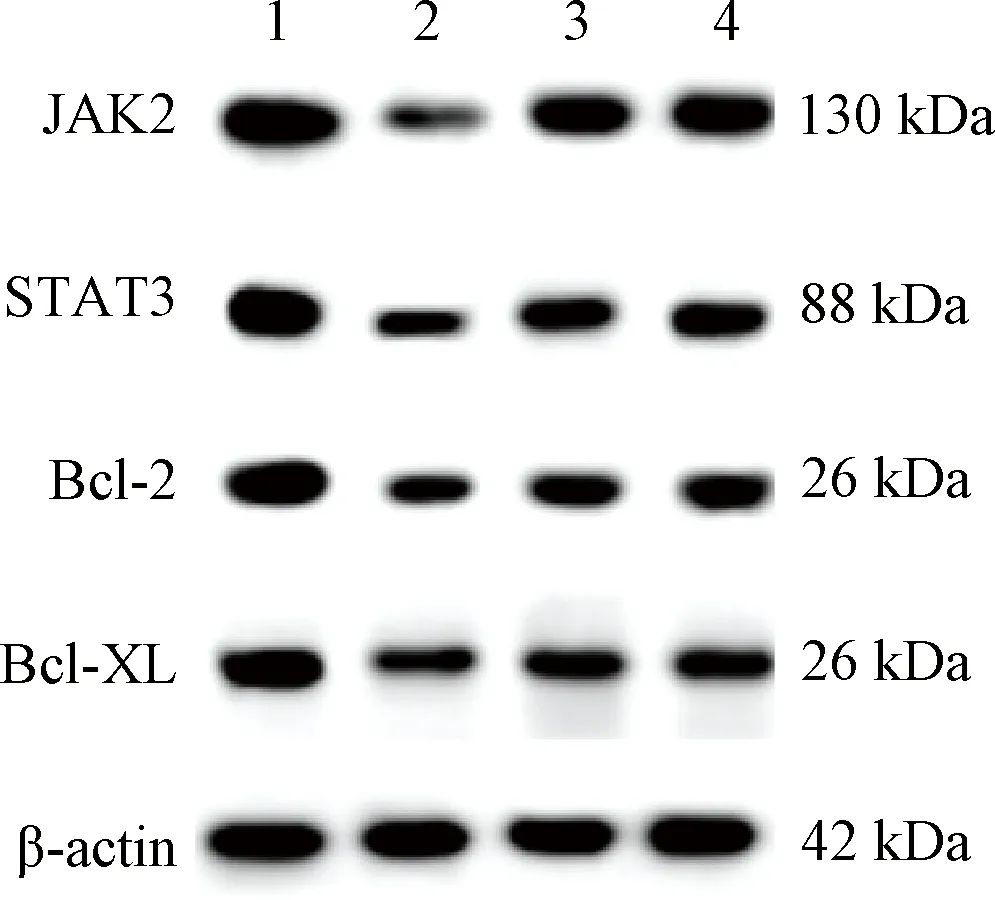
注:1.假手术组;2.模型组;3.右归丸组;4.塞来昔布组;Janus激酶(Janus kinase,JAK)2,信号传导和转录激活因子(signal transducer and activator of transcription,STAT)3,B淋巴细胞瘤(b-lymphoma,Bcl)-2,Bcl-2关联XL蛋白(bcl-2 associated X protein,Bax-XL)图4 各组大鼠软骨组织JAK2、STAT3、Bcl-2、Bcl-XL 免疫印迹结果
4 讨论
OA的发生与年龄、创伤、肥胖、过度负重等有关,其发病机制尚未完全阐明。目前认为主要涉及基质金属蛋白酶降解、细胞因子、细胞凋亡、水通道蛋白等多个方面[13-15],其中软骨细胞凋亡可直接导致关节软骨退变、钙化,对关节功能造成不良影响,是近年来的研究热点。通过抑制软骨细胞凋亡进而阻断关节退变对于OA的防治具有重要意义,也是新药研究的主要方向之一。
OA属于中医“痹证”“骨痹”“痿证”范畴,常见病机为肾阳不足、气血瘀滞。本研究针对此病机采用温补肾阳之右归丸治疗。右归丸方中附子温阳散寒止痛,肉桂温阳通脉、散寒止痛,鹿角胶有填精养血、温补肝肾之效[16],三者相配能补肾中元阳并温中驱寒,是为君药;熟地黄填精益髓、滋阴养血;枸杞滋肝补肾;山药既补肾固精养阴又益脾肺之气;山茱萸补肝益肾,四者养阴补肾健脾,取“阴中求阳”之意,是为臣药;再加杜仲补肝肾强筋骨,当归补血活血止痛,菟丝子补益肝肾3味佐药,全方共奏温肾补阳、益精填血之效。现代药理研究发现,鹿角胶中的多肽、氨基酸等有效成分可抑制软骨细胞凋亡,促进受损软骨修复,还能抗炎镇痛[17];当归有改善微循环的药理作用,亦能减少软骨细胞凋亡,促进骨关节炎缓解[18]。由此可见,用右归丸治疗OA具有一定的理论基础。本研究成功建立了OA大鼠模型,模型组大鼠软骨组织出现与人类OA类似的病理变化,Mankin评分升高,软骨细胞AI也显著增加,证实OA存在软骨损伤及细胞凋亡增多的情况;而经右归丸治疗后,大鼠Mankin评分、软骨细胞AI均低于模型组,且与塞来昔布组比较差异无统计学意义,表明右归丸能够有效减轻OA引起的软骨组织损伤程度,抑制软骨细胞凋亡,发挥较好的治疗效果。
本研究从JAK/STAT3信号通路入手,分析右归丸发挥作用的具体机制。JAK/STAT3信号通路广泛参与机体炎症及细胞分化、凋亡及炎症反应过程,与OA的发病关系密切。JAK及相关受体、STAT为该通路关键成分,可将细胞外化学信号处理后传递给细胞核,调节细胞增殖、损伤、凋亡等重要基因的转录和表达,产生相应生物学效应。刘军等[19]对OA小鼠模型软骨细胞JAK2/STAT3信号通路相关蛋白分组检测发现,抑制软骨细胞凋亡对软骨细胞线粒体的抗氧化应激能力有增强作用,而该通路参与软骨细胞凋亡的调节过程。胡炯等[20]检测OA模型大鼠及健康大鼠关节软骨中磷酸化-JAK2、磷酸化-STAT3、Bcl-2、Bax 蛋白表达水平发现,与健康大鼠比较,OA大鼠的JAK2/STAT3信号通路被显著抑制,软骨细胞凋亡速度提高。本研究结果显示,与模型组比较,右归丸组及塞来昔布组大鼠软骨组织JAK2、STAT3、Bcl-2、Bcl-XL表达均高于模型组,Bcl-2和Bcl-XL均属于抗凋亡蛋白,对各种原因诱发的细胞凋亡均有抑制作用。该结果证实,右归丸能够激活JAK2/STAT3信号通路,上调软骨组织Bcl-2、Bcl-XL表达,对细胞凋亡发挥抑制作用。这可能是右归丸治疗OA的机制之一。
综上所述,右归丸能够有效减轻OA大鼠软骨组织损伤,减少软骨细胞凋亡,其作用可能与激活JAK/STAT3信号通路、上调抗凋亡蛋白Bcl-2、Bcl-XL表达有关。
