一株G4P[X]型猪A群轮状病毒的分离与鉴定
2022-10-19傅安静黄名英张斌
傅安静,黄名英*,张斌
一株型猪A群轮状病毒的分离与鉴定
傅安静1,黄名英1*,张斌2**
1. 成都农业科技职业学院, 四川 成都 610041 2. 西南民族大学畜牧兽医学院, 四川 成都 610041
为了分离并鉴定一株A群猪轮状病毒(PoRV)。本文通过MA-104细胞分离培养、间接免疫荧光鉴定、RT-PCR鉴定以及全基因序列遗传进化对一份PoRV阳性粪便样本进行了分离与鉴定。经RT-PCR和间接免疫荧光证实为PoRV,命名为JC-3,基因型为G4-P[X]-I5-R1-C1-M1-A8-N1-T7-E1-H1,根据同源性比对分析发现,JC-3株、、、、和基因与PoRV相似性最高,高达95.4%~99.7%,而、、、与人源A群轮状病毒(GAR)相似性最高,达94.6%~98.5%,表明该病毒基因组发生了重排。本研究成功分离一株猪源PoRV,基因型为,为以后对该毒株的致病性研究奠定了基础。
猪; A群轮状病毒; 分离; 鉴定
轮状病毒(Rotavirus,RV)属于呼肠孤病毒科轮状病毒属,为双股RNA病毒[1]。轮状病毒首次于1969发现存在于腹泻的犊牛粪便中,随后在人、猪、绵羊、马、犬、猫、兔、鼠、猴及家禽均有发现,全球均有相关报道[2,3]。猪轮状病毒(Porcine rotavirus,PoRV)是引起仔猪病毒性腹泻的常见病原体之一,主要临床症状为黄色水样粪便并伴有呕吐。由于其流行范围广且发病率高,如果与其他病原体混合感染会导致病情加重,死亡率升高,给畜牧业造成严重经济损失[4,5]。
轮状病毒包含6种结构蛋白(VP1~4,VP6~7)和5种非结构蛋白(NSP1~5)[6]。衣壳抗原VP6是一种群体特异性抗原,决定了RV血清群的特异性,是一种关键的免疫原性蛋白。根据VP6,轮状病毒被分为七个血清群和血清型,包括A-G。其中A群又被称为典型轮状病毒,其余6个血清群又称为非典型性轮状病毒或副轮状病毒(Pararotavirus)。此前,猪轮状病毒被分为四个血清群(A、B、C和E)[7]。VP4结构蛋白由RV基因组的第4号基因编码,它是一种非糖基化的胰蛋白酶敏感蛋白,具有血凝特性。它使一种病毒粘附蛋白会使病毒具有致病性。在有胰蛋白酶的情况下,VP4会裂解成两个亚单位蛋白,从而增强轮状病毒感染宿主细胞的能力,增加猪轮状病毒对体外细胞的适应性,并增强病毒自身的生长和复制能力。VP7结构蛋白由RV基因组的第7、8或9号基因编码(取决于不同的病毒株)[8]。它是病毒外膜的一个主要糖蛋白,也是轮状病毒的一个重要中和抗原。它包含一个开放阅读框(ORF),长度约为1062 bp,约占病毒蛋白总量的30%。此外,VP7有糖基化位点,其作用和糖基化位点对VP7的抗原性可能有不同的影响,VP7的糖基化可能会降低抗体结合能力。由于VP7是Ca2+结合的主要蛋白,对PoRV的形状、包膜蛋白的稳定性和病毒的成熟度非常重要[9],VP7抗原决定簇多为构象性,空间形态复杂,对开发针对猪轮状病毒的疫苗构成了挑战。
轮状病毒的感染具有明显的季节性,多发生于晚秋、冬季和早春。在少数地区全年流行,在世界范围内广泛存在[10]。A群轮状病毒存在I型、P型和G型三种基因型,其中I型18种,P型37种,G型27种。中国报道的I型有3种,以I5型最为普遍,P型有6种,以P[13]型、P[23]型和P[19]型为主,G型7种[11]。本研究从仔猪腹泻粪便样本中检测出一株猪A群轮状病毒,对其开展分离、鉴定和进化分析,为后续PoRV的流行病学、病原学、分子生物学和疾病防控研究奠定基础。
1 材料与方法
1.1 主要试验材料
疑似轮状病毒阳性腹泻仔猪的粪便样本;恒河猴肾细胞系(MA-104细胞);DMEM培养基和胎牛血清购自GIbco;胰蛋白酶购自Sigma;氯仿和异丙醇购自天津智源化学试剂有限公司。PrimescriptTM、pMD19-T克隆载体、TrizolTM Reagent、和2×Taq PCR Master Mix均购自TaKaRa;DNA Marker II购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 病料处理及病毒的分离培养对来自四川省某养殖场所送检的疑似PoRV感染的仔猪粪便样本参照1:5的比例与PBS预混液涡旋混匀,置于-80 ℃冰箱反复冻融3次,使细胞破裂析出病毒。1000 rpm/min 4 ℃离心10 min,去沉淀,3000 rpm/min 4 ℃离心10 min,取上清过0.22 μm滤器除去细菌。接毒前,将MA-104细胞在细胞瓶中铺满约90%单层细胞,接毒时,在处理后的样本上清液中加入10 μg/μL的胰蛋白酶,放入37 ℃、5%CO2恒温培养箱激活1 h后,用灭菌后的PBS将铺好单层细胞的培养瓶清洗2遍后,将已激活的样本添加进培养瓶,在恒温培养箱中孵育1 h后将有胰蛋白酶的无血清DMEM培养液补足5 mL。最后,在细胞培养箱中静置培养,每天观察细胞病变,当CPE达到80%以上时收集病毒液,反复冻融3次,重复以上操作连续传代5次后,再进行3次蚀斑纯化,成功得到单一病毒,收集后置于-80 ℃保存。
1.2.2 间接免疫荧光细胞在96孔板中形成CPE后,弃细胞维持液,用PBS(pH=7.4)冲洗3次,每次1 min;每孔加入1 µL 80%冰丙酮,在4 ℃下固定10 min;弃80%冰冷的丙酮,用PBS冲洗3次,每次1 min;每孔加入1 µL 3% BSA,室温下放置30 min。弃BSA液体,用PBS冲洗3次,每次1 min;在每个孔中加入1 µL1:400稀释的一抗(抗轮状病毒基因多克隆抗体),在37 ℃孵育45 min。孵育后,用PBS清洗3次,每次1 min;加入1:1000稀释的FITC标记的兔抗羊IgG第二抗体。孵化后,用PBS洗3次,每次3 min,用荧光倒置显微镜观察细胞核周围的有无特异性绿色荧光。
1.2.3 PoRV的全基因扩增用TRIzol法提取病毒总RNA,用PrimeScriptTM RT试剂盒逆转录成cDNA,以cDNA为模板,根据参考文献[12]中发表的猪轮状病毒A组全基因的扩增引物合成引物。PCR反应体系和PCR反应条件(表1),用纯化的PCR产物连接pMD19-T载体,转入大肠杆菌DH5α感受态细胞,将阳性重组质粒在生物工程(上海)有限公司进行测序。全基因组在NCBI进行了比对和分型。
PCR的反应条件:94 °C 欲变性 2 min;94 °C变性15 s,51 °C退火20 sec,68 ℃延伸1 min,35个循环,72 ℃ 8 min,16 ℃(或4 ℃)保存。

表 1 RT-PCR 扩增全基因的反应体系
1.2.4 分离病毒分子特征分析使用SimPlot、MEGA X、Megalign、RDP4和其他程序将序列与从GenBank下载的完整PoRV基因序列比较;使用RotaC V2.0在线分型工具对病毒分离物进行基因分型,使用MEGA X用接近法构建系统发育树,使用RDP4和SimPlot重组分析程序进行重组分析。
2 结果与分析
2.1 病毒的分离与鉴定
将疑似PoRV感染仔猪粪便样本用胰酶处理后,用MA-104细胞接种,盲传五代。接毒48 h后,出现典型的CPE,主要表现为细胞变圆和拉网现象,细胞脱落随时间增加。正常的MA-104细胞没有发生CPE,经过三代噬斑纯化和RT-PCR检测,初步确定分离出了一个PoRV菌株。对照组MA-104细胞生长良好,细胞形态清晰。经过三代噬斑纯化后,通过RT-PCR检测结果,初步确定分离出一株PoRV毒株。对病毒进行间接免疫荧光检测(IFA),并在倒置的荧光显微镜下观察。在背景干净的正常细胞中没有检测到荧光(图1A),这说明阴性对照成立;在分离株感染细胞胞浆中发现了特定的绿色荧光(图1B)。结果表明,成功从仔猪粪便中分离出一株PoRV。为了进一步观察分离出的病毒的形态,用2%的磷钨酸对浓缩的细胞培养物进行负染,进行电子显微镜检查,在透射电镜下观察到有直径约为70 mm的似典型的车轮状病毒颗粒(图2)。

图 1 PoRV分离株IFA鉴定

图 轮状病毒电镜图
2.2 分离株全基因组遗传分子特征分析
根据参考文献[12]设计引物,采用RT-PCR对分离株全基因进行扩增,经转化克隆测序后,得到全基因全长17453 bp,将该毒株命名为JC-3,对分离株的全基因分段进行序列分析,并利用在线分型工具RotaC v2.0对其基因型进行鉴定,结果显示分离株的基因型为G4-P[X]-I5-R1-C1-M1-A8-N1-T7-E1-H1。选取不同G4谱系的GAR株,利用MEGA7.0中临近法构建进化树,结果表明,JC3与RVA/Pig-wt/VNM/14226_39越南株亲缘关系最近,同源性最高,可达到98.3%,同为G[4]型。通过遗传进化树分析(图3),分离株的与GenBank上公布的序列同源性最高仅85%,不足以确定其P型,所以暂定为P[X]。而分离株的、、、、、与猪源的、、、、、同源性更高,分别为98%、94.6%、95.4%、97.2%、99%、99.7%。而、、节段与人源、、的同源性更高,同源性分别为98.5%、96.2%、97.3%,提示JC3可能为人猪重配毒株。利用RDP4和SimPlot软件对分离株JC3的全基因组进行重组分析,发现该毒株不满足重组毒株条件,所以为非重组毒株。
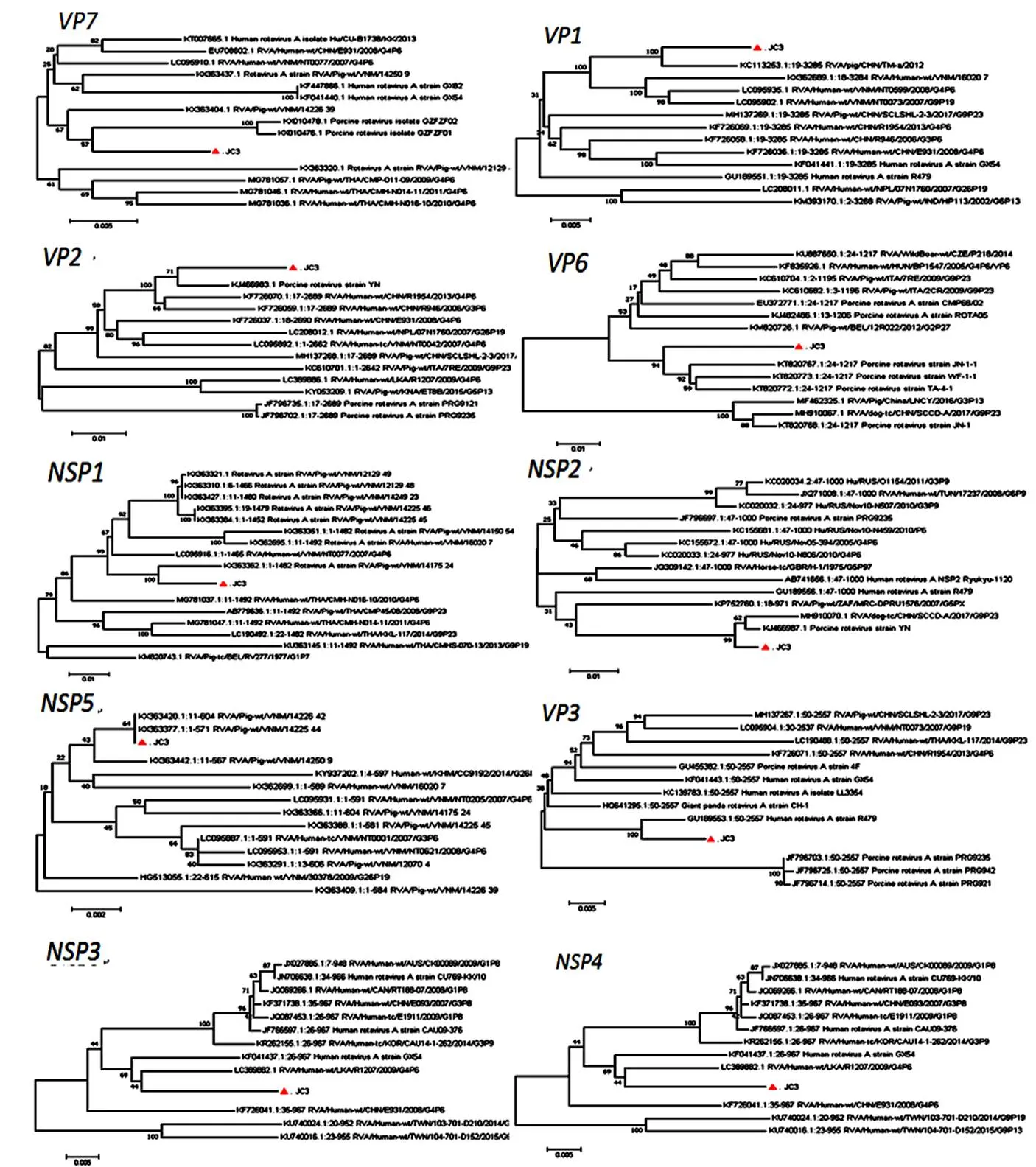
图 3 分离株JC3与参考毒株的遗传进化关系
3 讨论
猪轮状病毒(Porcine rotavirus, PoRV)、猪传染性胃肠炎病毒(Porcine transmissible gastroenteritis, TGEV)和猪流行性腹泻(Porcine epidemic diarrhea, PEDV)是引起仔猪腹泻的三种重要原因[13]。RV在体内通常是感染绒毛上皮细胞,在体外可用恒河猴肾细胞系(MA-104细胞)培养。Bohi EH等[14]用MA-104细胞成功分离出轮状病毒。后相继有学者应用人克隆细胞CaCo-2[15]、Vero细胞[16]、恒河猴胎肾细胞(Marc-145细胞)[17]和猪小肠细胞IRBSⅡ等成功分离出轮状病毒[18]。
由于其VP4基因编码的衣壳蛋白阻碍了病毒在细胞培养物上的生长,所以RV在体外不易获得,并且难以分离培养[19]。而体外分离培养中,胰酶的加入可以使衣壳蛋白VP4裂解为VP5和VP8,从而有助于病毒脱壳感染细胞,因此胰酶的处理对于分离轮状病毒至关重要。故本实验先用10 μg/μL的胰蛋白酶与病毒液混合后于37 ℃激活1 h,后接种于本实验室保存的MA-104传代细胞,盲传至出现以细胞界限不清、固缩、破裂为典型的CPE,经RT-PCR检测结果为阳性。该结果证明了,PoRV已经成功在MA-104细胞生长繁殖。根据PoRV的分子流行病学调查,全世界存在不同的猪轮状病毒A组G和P基因型,在不同的地理区域发现了新的PoRV血清群,越来越多的报告表明PoRV的流行病学非常复杂且动态性很强,现在PoRV的流行率和遗传多样性比以前更高。
RV在其进化过程中很容易发生不同基因段之间的重组。在一些发展中国家,特别是在人类和动物栖息地相近或相交的地方,RV的种间传播也很常见。在中国,不同的牲畜养殖方式并存和复杂的生态环境为RV物种的传播和变异创造了条件。根据JC-3的进化树和同源性分析结果显示,该分离株有部分基因与人源轮状病毒和猪源轮状病毒同源性非常高,推测进化过程中这些病毒发生过重组,可能在人与动物之间发生交叉感染,对于人类一般不感染猪源轮状病毒的认识给予一定的质疑,可以作为新的研究方向。
4 结论
这项研究成功地分离出了轮状病毒JC-3,并在MA-104细胞上产生了稳定的病变,为猪轮状病毒A的流行病学、发病机制和分子生物学奠定了基础,同时对病毒感染机理和传播范围的认识以及对于疾病的防控也具有重要意义。
[1] 陆承平.兽医微生物学[M].北京:中国农业出版社,2012:408-409
[2] Kim HH, Matthijnssens J, Kim HJ,. Full-length genomic analysis of porcine G9P [23] and G9P [7] rotavirus strains isolated from pigs with diarrhea in South Korea [J].Infect Genet Evol, 2012,12(7):1427-1435
[3] Tomas L, Camacho M, Zayas M,. Silencing the morphogenesis of rotavirus [J]. J Virol, 2005,79(1):184
[4] 文程,王薇,余丽芸,等.HRV间接ELISA检测方法的建立及大庆市区腹泻患儿HRV感染率的调查[J].黑龙江八一 农垦大学学报,2012,24(5):60-64
[5] 陈健雄.仔猪常见病毒性腹泻的流行特点和控制措施——警惕导致哺乳仔猪死亡严重的病毒性腹泻病[J].猪业科 学,2011,28(10):94-98
[6] 张贺伟,王鑫,夏铭崎,等.猪A群轮状病毒LN012013株的分离与鉴定[J].中国兽医科学,2014(5):470-475
[7] Saikruang W, Khamrin P, Chaimongkol N,. Genetic diversity and novel combinations of G4P[19] and G9P[19]. Porcine rotavirus stains in Thailand [J]. Vet Microbiol, 2013,161(3-4):255-262
[8] 温乐英.轮状病毒蛋白的研究进展[J].国外医学:病毒学分册,1996,3(3):65-67
[9] 苏琦华.轮状病毒蛋白的作用[J].天津医科大学学报,2001,7(2):299-300
[10] 葛建强.轮状病毒病的防控[J].畜牧与饲料科学,2010,31(11-12):148-149
[11] Shi H, Chen J, Li H,. Molecular characterization of a rare G9P [23] porcine rotavirus isolate from China [J]. Arch Viral, 2012,157(10):1897-1903
[12] Nan Y, Cheng T, Ruici K,. Genome analysis of a G9P[23] group A rotavirus isolated from a dog with diarrhea in China [J]. Infection, Genetics and Evolution, 2019,70:67-71
[13] 陈晓春,吴华伟,张广川,等.猪轮状病毒的分离与鉴定[J].中国兽药杂志,2013,47(9):4-9
[14] Bohi EH, Theil KW, Saif LJ. Isolation and serotyping of porcine rotaviruses and antigenic comparison whit other rotaviruses [J].J Clin Microbiol, 1984,19(2):105-111
[15] Theli KW, Bohi EH, Agnes AG. Cell culture propagation of porcine rotavirus ( reovirus-like agent ) [J].Am J Vet Res, 1977,38(11):1765-1768
[16] Bautista D, Rodriguez LS, Franco MA,. Caco-2 cells infected with rotavirus release extracellular vesicles that express markers of apoptotic bodies and exosomes [J].Cell Stress Chaperones, 2015,20(4):697-708
[17] 范秀娟,孙艳,孙振鹏,等.生物反应器培养轮状病毒基因重配株Ls条件的优化[J].微生物学免疫学进展,2015(6):18-21
[18] 杨文宇,朱玲,周远成,等.猪轮状病毒四川株的分离与鉴定及增值规律[J].畜牧兽医学报,2014,34(2):192-198
[19] 原霖.猪A群轮状病毒的分离与鉴定[J].中国畜牧兽医,2016,43(12):3306-3313
Isolation and Identification of One Strain ofPorcine A Group Rotavirus
FU An-jing1, HUANG Ming-ying1*, ZHANG Bin2**
1.610041,2.610041,
To isolate and identify a group A porcine rotavirus (PoRV). A PoRV-positive stool sample was isolated and identified by MA-104 cell isolation and culture, indirect immunofluorescence identification, RT-PCR identification and sequence analysis. After screening the virus strain by ordinary PCR, PoRV was confirmed by RT-PCR and indirect immunofluorescence, named JC-3, and the genotype was G4-P [X] -I5-R1-C1-M1-A8-N1-T7-E1-H1. Homology analysis showed that the gene identities of,,,,andof JC-3 strain were the highest with PoRV, up to 95.4% ~ 99.7%, while,,andhad the highest similarity with human group A rotavirus (GAR), up to 94.6% ~ 98.5%, indicating that the virus may be a human-pig reassortant strain and may have undergone recombination phenomenon. However, no recombination phenomenon was found by recombination analysis. In this study, we successfully isolated a pig-derived PoRV with genotype], which laidthe foundation for subsequent studies on its pathogenicity.
Pig;A group rotavirus; isolation; identification
S828/S852.2
A
1000-2324(2022)04-0629-05
10.3969/j.issn.1000-2324.2022.04.020
2022-03-04
2022-04-14
成都农业科技职业学院院级孵化(自然科学)重点项目(22ZR107)
傅安静(1976-),男,硕士研究生,高级兽医师,研究方向:预防兽医学. E-mail:603006944@qq.com
黄名英(1977-),女,硕士研究生,正高级兽医师,研究方向:预防兽医学. E-mail:376979067@qq.com
Author for correspondence. E-amil:binovy@sina.com
