气相色谱-质谱法测定辣椒中虫螨腈残留及消解动态
2022-10-19刘晓鹏刘秋蕊马翠华
刘晓鹏,刘秋蕊,马翠华
气相色谱-质谱法测定辣椒中虫螨腈残留及消解动态
刘晓鹏1,刘秋蕊1,马翠华2*
1. 滨州市检验检测中心, 山东 滨州 256600 2. 博兴县综合检验检测中心, 山东 博兴 256500
为建立虫螨腈在辣椒基质残留的气相色谱-质谱检测方法,并研究虫螨腈在辣椒中的消解动态和最终残留量。样品经乙腈提取、N-丙基乙二胺吸附剂(PSA)净化,通过辣椒基质标准曲线外标法进行定量,对不同采收阶段的辣椒样品残留量进行测定。结果表明:辣椒基质中虫螨腈在20~500 μg/kg范围内具有良好的线性关系,线性方程为=1930.5-2.1123,=0.9983;在0.02,0.30和0.60 mg/kg 3个添加水平下辣椒基质中虫螨腈添加回收率为76.95%~106.5%,相对标准偏差为4.97%~8.29%。虫螨腈在辣椒中消解动态试验结果表明:两地辣椒基质中虫螨腈降解均符合一级动力学方程,山东潍坊为=0.0849e-0.131t,半衰期为2.65 d;湖南张家界为=0.1088e-0.152t,半衰期为2.02 d;施药后7 d,辣椒中虫螨腈降解率达100%。虫螨腈在辣椒中最终残留试验结果表明:两地辣椒中虫螨腈最高残留量均小于CAC规定的辣椒中虫螨腈的最大残留限量。通过建立虫螨腈在辣椒中的分析方法,研究其消解动态规律和最终残留量,明确虫螨腈在辣椒种植过程中施用不会造成危害性残留,为虫螨腈在辣椒上的安全使用提供依据。
虫螨腈; 农药残留; 测定
虫螨腈是一种吡咯类杀虫剂,能够作用于害虫体内细胞的线粒体上、通过抑制多功能氧化酶发挥作用,主要是抑制其ADP(二磷酸腺苷)向ATP(三磷酸腺苷)转化,破坏其能量传导[1,2]。该药对害虫具有胃毒及触杀毒性[3,4],具有一定的内吸作用,对于抗性害虫具有毒杀能力,且具有防效高、持效长、杀虫谱广、安全的特点[5]。虫螨腈是一种中度危险杀虫剂[6],自2018年起国内陆续出现虫螨腈急性中毒报道[7,8]。
中国农业信息网登记的虫螨腈类农药共有137个产品,主要以悬浮剂为主,也有部分原药;登记的作物主要包括十字花科蔬菜、大白菜、大葱、姜、小白菜、柑橘、梨、甘蓝、节瓜、芥蓝、芦笋、苹果、茄子、茶树、菠菜(保护地)、观赏菊花、豆角、豇豆、韭菜、黄瓜等20余种,主要作用对象包括小菜蛾、甜菜夜蛾、蓟马、斜纹夜蛾、韭蛆、梨木虱等[9-13]。张爱娟等[14]研究了虫螨腈在芦笋中的残留消解,施药后间隔3 d的残留量为0.14 mg/kg,低于日本指定的芦笋中虫螨腈最大残留限量(0.5 mg/kg);王坦等[15]研究了甘蓝中虫螨腈的残留消解动态,结果表明甘蓝中虫螨腈的消解动态符合一级动力学方程,半衰期为4.1~11 d,采收间隔14 d后最终残留量(0.488 mg/kg)可低于我国国家标准GB 2763规定的最大残留限量(1 mg/kg);此外,也有虫螨腈在西兰花[16]、青菜[17,18]、菜苔[19]、猕猴桃[20]、金银花[21]、韭菜[22]、茶叶[23]、姜[24]、南瓜和秋葵[25]等作物上残留代谢行为的相关研究,而对于虫螨腈在辣椒中的残留及消解行为尚未见有相关报道。目前,国际食品法典委员会(CAC)已制定虫螨腈在辣椒中的最高残留限量值(MRL)为0.3 mg/kg,欧盟已制定虫螨腈在辣椒中的MRL为0.05 mg/kg,韩国已制定虫螨腈在辣椒中的MRL值为0.7 mg/kg,我国未制定虫螨腈在辣椒中的MRL值。
有研究表明,虫螨腈对于蓟马防治具有显著效果[26-28],为将虫螨腈应用于防治辣椒蓟马病,必须要明确其在辣椒作物上的残留以及消解行为。目前,在虫螨腈残留检测时,甘蓝[29]、芥蓝[30]、平菇[31]、土豆[32]以及青菜、生菜、杭白菜、菠菜[33]等都采用QuEChERS法进行样品前处理,检测方法主要是GC-ECD、GC-MS、HPLC-MS等。因此本实验以40%螺虫乙酯·虫螨腈悬浮剂(有效成分:螺虫乙酯25%,虫螨腈15%)中虫螨腈为研究对象,建立了QuEChERS-GC-MS检测方法,研究了其在辣椒基质中的消解动态及最终残留,为虫螨腈相关农药在辣椒种植上的安全合理使用提供科学依据。
1 材料与方法
1.1 材料与试剂
虫螨腈标准品,纯度99.4%,美国CHEM SERVICE公司;乙腈,色谱纯,美国Fisher公司;无水硫酸镁、无水醋酸钠,分析纯,上海试剂厂;氯化钠、无水乙酸钠,分析纯,北京化工厂;PSA分散固相萃取净化剂、C18分散固相萃取净化剂,天津博纳艾杰尔科技有限公司。
1.2 仪器与设备
GC 2010 PLUS气相色谱仪、TQ 8040质谱仪,日本岛津公司;万分之一天平,瑞士Mettler Toledo公司;IKA-2高速匀浆机,德国IKA公司;高速离心机,美国Thermo公司。
1.3 实验方法
1.3.1 田间试验设计田间试验于2018年在山东潍坊(辣椒品种:威师一号)和湖南张家界(辣椒品种:本地种)2地进行。供试药剂为40%螺虫乙酯·虫螨腈悬浮剂(有效成分:螺虫乙酯25%,虫螨腈15%),按NY/T 788-2004《农药残留试验准则》的要求进行。
1.3.1.1 消解动态试验设试验小区3块,单块面积为15 m2;施药剂量:120 g·a.i/ha(制剂量:20 g/667 m2);施药1次后0(在施药后2 h之内)、1、3、7、10、14 d采集辣椒样本。另设置空白对照区,采集对照辣椒样品。
1.3.1.2 最终残留实验设试验小区3块,单块面积为15 m2;施药剂量:120 g·a.i/ha(制剂量:20 g/667 m2);预计离采收期10 d左右最后一次施药后,间隔7、10 d采集辣椒样品。另设置空白对照区,采集对照辣椒样品。
1.3.1.3 田间采样在每个试验小区内随机采集6个以上不同部位、正常生长、无病害的辣椒,总重量不少于2000 g;将辣椒切成1~2 cm大小的碎块,混匀后采用四分法分取2份各150 g,-20 ℃保存。
1.3.2 样品前处理(1)提取。称取5 g试样(精确到0.01 g)于50 mL离心管中,加入10 mL乙腈,均质匀浆提取1 min,加入5 g氯化钠,涡旋振荡混匀,于5000 r/min下离心5 min。
(2)净化。取5 mL上层清液加入300 mg PSA,150 mg C18,900 mg无水硫酸镁,振荡3 min,5000 r/min离心5 min,取上清液2 mL,氮吹至近干,用1 mL丙酮复溶,过0.22 μm有机滤膜,用于气相色谱-质谱测定。
1.3.3 仪器条件(1)气相色谱条件。气相色谱柱:DB-5ms(30 mm×250 μm×0.25 μm);柱流量:1.2 mL/min;进样量:1 µL;进样口温度:280 ℃;进样方式:不分流;柱温箱升温程序:90 ℃保持1 min,以30 ℃/ min升温至240 ℃,以10 ℃/ min升温至290 ℃,保持1 min。传输线温度:280 ℃。
(2)质谱条件。离子源:EI;数据采集模式:SIM;离子源温度:230 ℃;四级杆温度:150 ℃;定性离子(m/z):328/408;定量离子(m/z):247。
2 结果与分析
2.1 方法评价
2.1.1 标准曲线溶剂标准曲线:将100.0 mg/L的虫螨腈标准溶液用丙酮稀释配得0.01 mg/L、0.02 mg/L、0.05 mg/L、0.10 mg/L、0.20 mg/L系列溶剂标准溶液,在上述检测条件下进行测定,以虫螨腈标准溶液浓度为x,监测离子峰面积为绘制溶剂标准曲线,线性方程及相关系数如表1。
基质标准曲线:将100.0 mg/L的虫螨腈标准溶液用空白基质溶液稀释配得0.02 mg/kg、0.05 mg/kg、0.10 mg/kg、0.20 mg/kg、0.50 mg/kg系列基质标准溶液。在上述检测条件下进行测定,以虫螨腈基质标准溶液浓度为,监测离子峰面积为绘制基质标准曲线,线性方程及相关系数如表1。
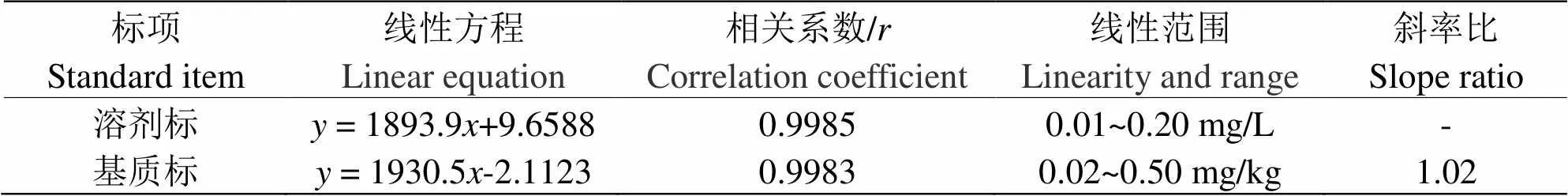
表 1 标准曲线方程和相关系数
由表1可知,在对应的线性范围内,溶剂标与基质标都具有良好的线性相关性,相关系数分别为0.9985和0.9983;采用基质标准曲线斜率和溶剂标准曲线斜率之比来评价基质效应,结果表明,在该前处理条件下,辣椒基质效应对虫螨腈检测结果基本没有干扰。
2.1.2 添加回收实验为评价方法的准确度和精密度,设计了辣椒基质中0.02 mg/kg、0.30 mg/kg、0.60 mg/kg 3个水平、5次平行的添加回收实验,结果如表2。

表 2 虫螨腈在辣椒中的添加回收率(n=5)
由实验结果可知,虫螨腈在辣椒中的添加回收率在76.95%~106.5%之间,相对标准偏差在4.97%~8.29%之间,说明本方法能够满足辣椒中虫螨腈残留检测要求。
2.2 残留消解动态
辣椒上虫螨腈的残留消解动态试验于2018年在山东潍坊和湖南张家界2地进行。结果表明,两个试验点最后一次施药后0(在施药后2 h之内)、1、3 d采集的辣椒样本检出有虫螨腈残留,残留量均低于CAC以及韩国制定的虫螨腈在辣椒中的最高残留限量值(0.3 mg/kg、0.7 mg/kg),但高于欧盟制定的虫螨腈在辣椒中的最高残留限量值(0.05 mg/kg);两地间结果存在一定差异,可能与当地气候以及辣椒品种有关。经分析,两个试验点虫螨腈在辣椒中的残留均与施药后采样间隔时间呈指数关系,消解动态符合一级动力学方程,如图1。经拟合后,获得消解动力学方程:山东潍坊试验点为=0.0849e-0.131t,2=0.8136,原始沉积量为0.12 mg/kg,半衰期为2.65 d;湖南张家界试验点为=0.1088e-0.152t,2=0.8201,原始沉积量为0.16 mg/kg,半衰期为2.02 d,结果如表3。由残留消解动态试验结果可知,虫螨腈在辣椒上具有较快的代谢活动,能够在较短时间内消解掉,3 d内消解率能达到50%以上,7 d内消解率达到100%。

图 1 辣椒上虫螨腈的消解动态曲线
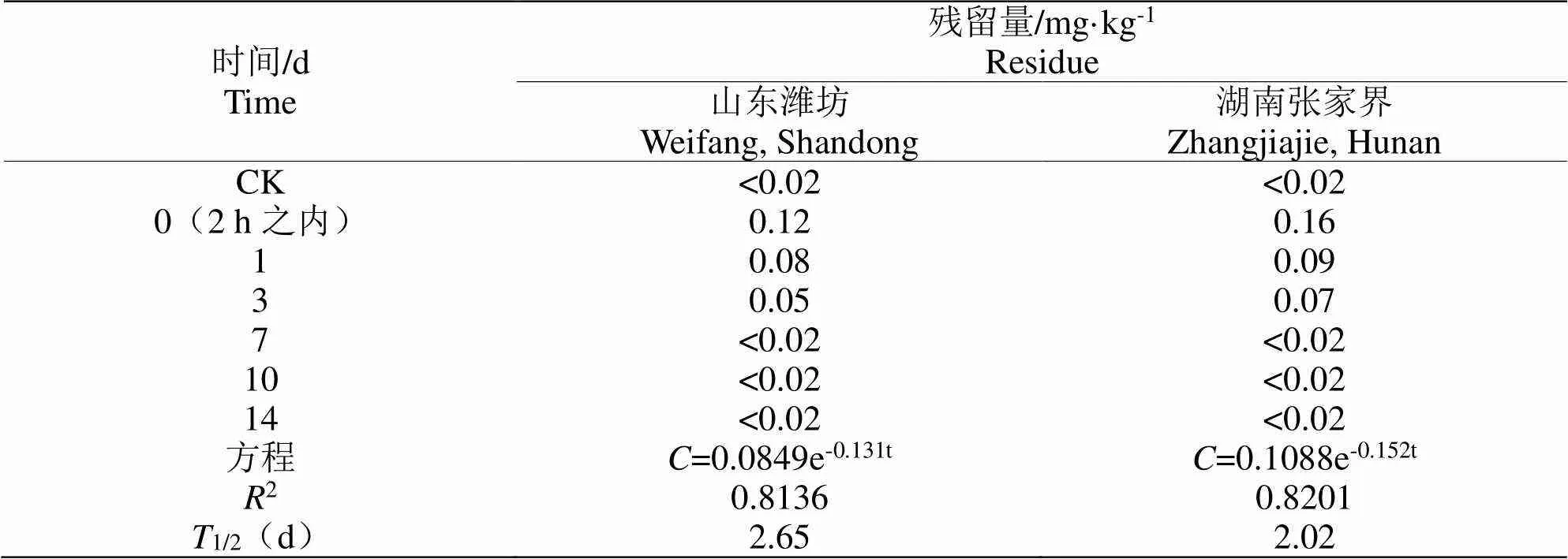
表 3 辣椒上虫螨腈的残留消解动态
《化学农药环境安全评价试验准则第1部分:土壤降解试验》(GB/T 31270.1-2014)根据农药的消解行为将农药分为四级:1/2<30 d,易于降解;30 d<1/2<90 d,中等降解;90 d<1/2<180 d,较难降解;1/2>180 d,极难降解。蒋丽君等在青菜中虫螨腈的消解动态研究表明,10%虫螨腈悬浮剂在施药剂量为40 mL/667 m2、施药一次的情况下,消解动态符合一级动力学方程为=1.614e-0.11t,原始沉积量为2.02 mg/kg,半衰期为4.3 d;Sherif等研究了虫螨腈在南瓜和秋葵中的消解动态,结果都符合一级动力学方程,果实中的半衰期在0.20~6.58 d之间,叶片上的半衰期在2.11~4.63 d之间。结合我们的实验结果,可以表明虫螨腈属于一种易降解农药。
2.3 最终残留实验
辣椒上虫螨腈的最终残留试验于2018年在山东潍坊和湖南张家界2地进行。结果表明,两个试验点预计离采收期10 d左右最后一次施药后,间隔7、10 d采集的辣椒样品中均未检出有虫螨腈残留,结果如表4。由最终残留试验结果可知,施药7 d后虫螨腈在辣椒上不会造成残留污染。

表 4 辣椒上虫螨腈的最终残留
3 结论与讨论
本研究基于QuEChERS样品前处理技术,建立了虫螨腈在辣椒基质残留的气相色谱-质谱检测方法,并根据NY/T 788-2004《农药残留试验准则》相关要求设计田间试验,研究其在辣椒中的消解动态和最终残留量。建立的QuEChERS-GC/MS方法在0.02~0.50 mg/kg范围内具有良好的线性,添加回收率在76.95%~106.5%之间,相对标准偏差在4.97%~8.29%之间,其检出限、准确度、精密度均可满足辣椒中虫螨腈检测需求;两地的消解动态试验结果符合一级动力学方程,半衰期分别为2.65 d和2.02 d,7 d内消解率可达100%;辣椒中虫螨腈的最终残留量低于方法检出限(0.02 mg/kg),均低于CAC及各国限量标准。通过本次研究,表明该药物对于辣椒作物属于一种易降解农药,且施药7 d后采收不会存在残留风险,为虫螨腈在辣椒上的安全合理使用提供理论依据和技术支持。
[1] Saif U, Sarfraz AS. Toxicity of insecticides, cross-resistance and stability of chlorfenapyr resistance in different strains ofCosta (Hemiptera: Lygaeidae) [J]. Crop Prot, 2017,99:132-136
[2] 张前锋,王玉建,徐汉虹.虫螨腈对斜纹夜蛾细胞的毒力及对线粒体膜电位的影响[J].农药学学报,2008,10(2):243-246
[3] 张云琛,杨雪群,胡艺英,等.虫螨腈中毒文献病例分析[J].中华卫生杀虫药械,2021,27(5):400-403
[4] 张瑞明,李祥英,陈崇波,等.虫螨腈对斑马鱼的急性毒性及生物富集性[J].生态毒理学报,2014,9(3):430-436
[5] 伍灿.虫螨腈环境安全性评价[D].长沙:湖南农业大学,2016
[6] WHO. The WHO recommended classification of pesticides by hazard and guidelines to classification 2009 [EB/OL]. [2020-10-19]. http:// www.who.int / ipcs/publications/ pesticides _hazard /en.
[7] 李田,苗俊东,张再伟.虫螨腈中毒诱发急性心肌损伤合并窦性停搏一例[J].中国循环杂志,2020,35(2):198-199
[8] 吴敬芳,谭清实,李爽,等.儿童虫螨腈中毒致死一例并文献复习[J].中华急诊医学杂志,2021,30(7):892-894
[9] 中国农药信息网[DB/OL].http://www.chinapesticide.org.cn/.
[10] 顾建革,张伟,于天丛.28%噻虫胺‧虫螨腈悬浮剂对韭蛆的田间试验效果[J].基层农技推广,2021,11:31-33
[11] 孙丰收.虫螨腈及其代谢物在多种基质中残留检测方法建立及膳食风险评估[D].泰安:山东农业大学,2021
[12] 韦日健.12%甲维‧虫螨腈对草地贪夜蛾的防治效果试验[J].农业与技术,2020,40(7):31-32
[13] 常芳娟,刘珍,范巧兰,等.虱螨‧虫螨腈对甘蓝甜菜夜蛾的田间防效[J].中国植保导刊,2020,8:66-68
[14] 张爱娟,卞艳丽,冯义志,等.虫螨腈和噻虫嗪在芦笋中的残留消解及膳食摄入风险评估[J].农药,2021,60(9):654-658
[15] 王坦,孙强,沈沁怡,等.超高压液相色谱法测定水果和蔬菜中虫螨腈及其代谢物以及在甘蓝中的残留评价应用 [J].分析测试学报,2021,40(12):1707-1712
[16] 王翠翠,陈安琪,董文阳,等.虫螨腈与Bt混配对小菜蛾的田间防效及虫螨腈在西兰花上的残留消解动态[J].农药学 学报,2021,23(5):922-929
[17] 蒋丽君,陆萍,仇婷婷,等.虫螨腈在青菜中的残留量及其消解动态[J].贵州农业科学,2020,48(8):129-131
[18] 李晓贝,赵晓燕,李健英,等.阿维菌素·虫螨腈在青菜上的残留特性及其膳食摄入风险评估[J].食品安全质量检测学 报,2020,11(13):4185-4190
[19] 冯义志,李瑞娟,王晓玉,等.田间条件下虫螨腈在菜苔中的残留消解及膳食风险评估[J].农药,2020,59(9):665-669
[20] 袁一宸.虫螨腈在猕猴桃上的残留风险评估[D].合肥:安徽农业大学,2019
[21] 王鹏思,薛健,侯少岩,等.虫螨腈在中药材金银花上的残留检测方法与消解动态研究[J].中国药学杂志,2020,55(1):58-61
[22] Li X, Chen XX, Hu JY. Dissipation behavior, residue distribution and dietary risk assessment of chlorfenapyr and clothianidin in leek using RRLC-QqQ-MS/MS technique [J]. Chinese Chem Lett, 2019,30:107-110
[23] Yang J, Luo FJ, Zhou L,. Residue reduction and risk evaluation of chlorfenapyr residue in tea planting, tea processing, and tea brewing [J]. Sci Total Environ, 2020,738:1-6
[24] 冯义志,梁林,张爱娟,等.虫螨腈在姜中的残留量及消解动态研究[J].农药科学与管理,2020,41(2):21-24,9
[25] Ghaniab SBA, Abdallahcd OI. Method validation and dissipation dynamics of chlorfenapyr in squash and okra [J]. Food Chem, 2016,194:516-521
[26] 张静,陈礼浪,叶火春,等.20%虫螨腈‧唑虫酰胺微乳剂对豇豆蓟马的杀虫活性[J].热带农业科学,2019,39(1):75-78,91
[27] 王定军.茶树施用10%虫螨腈SC等4种杀虫剂防治茶棍蓟马效果试验[J].农家参谋,2019,16:209
[28] 魏书艳,黄延昌,张庆文,等.虫螨腈与噻嗪酮对花蓟马毒力筛选及田间防效[J].农药,2014,53(11):836-838
[29] 孙丰收,罗媛媛,张文文,等.甘蓝中虫螨腈及其代谢物的残留检测[J].农业科学与管理,2020,41(7):37-41
[30] 林慧纯,王瑞,禹绍周,等.气相色谱-质谱法测定芥蓝中虫螨腈残留量的不确定度评定[J].食品安全质量检测学报,2020,11(14):4795-4799
[31] 甘玉晶.基于QuEChERS-气相色谱法测定平菇中虫螨腈残留研究[J].现代农业科技,2020,10:196-198
[32] 高玉雪,于晓龙,冷金蔓,等.气相色谱-质谱法测定马铃薯中虫螨腈的残留量[J].农药,2021,60(6):432-435
[33] 占绣萍,黄兰淇,陈建波,等.QuEChERS-GC/ECD法测定叶类蔬菜百菌清、毒死蜱、虫螨腈等农药的残留[J].农业科 学与管理,2021,42(4):30-36,23
Determination of Residues and Digestion Dynamics of Chlorfenapyr in Pepper by GC-MS
LIU Xiao-peng1, LIU Qiu-rui1, MA Cui-hua2*
1.256600,2.256500,
A gas chromatography-mass spectrometry method was established for the detection of chlorfenapyr residues in pepper. The degradation dynamics and final residues in pepper were evaluated. The samples were extracted with acetonitrile, cleaned up with N-propylethylenediamine adsorbent (PSA), and quantified by matrix standard curve external standard method to determine the residual amount of different samples. The results showed that the method had a good linear relationship in the range of 20-500 μg/kg. The linear equation was=1930.5-2.1123 and the the correlation coefficient was 0.9983. The recoveries at spiked levels of 0.02, 0.30, 0.60 mg/kg were in the range of 76.95%~106.5%, with relative standard deviations of 4.97%~8.29%. The degradation dynamic test in pepper showed that the degradation conformed to the first-order reaction kinetics. The first-order reaction kinetic of Weifang was=0.0849e-0.131tand the half-life was 2.65 d. The first-order reaction kinetic of Shijiazhuang was=0.1088e-0.152tand the half-life was 2.02 d. After 7 days of application, the degradation rate of chlorfenapyr in pepper reached 100%. The final residue test in pepper showed that the maximum residue level of chlorfenapyr was lower than the maximum residue limit of CAC. By establishing an analytical method for chlorfenapyr in peppers, degradation dynamics and final residues were studied. It shows that no harmful residues will be caused during the planting process, which provides a basis for the safe use of pesticides.
Chlorfenapyr; pesticide residues; determination
S481+.8
A
1000-2324(2022)04-0543-05
10.3969/j.issn.1000-2324.2022.04.007
2022-05-04
2022-05-27
刘晓鹏(1977-),女,大学本科,研究方向为农产品、畜产品、水产品、食品检测. E-mail:380894468@qq.com
Author for correspondence. E-mail:595207091@qq.com
