松香烷型二萜在农药及药学中的研究进展
2022-10-19罗家锱宋习习李梅珊王恒山
罗家锱, 宋习习, 李梅珊, 王恒山*
(1.广西师范大学 化学与药学学院, 广西 桂林 541004; 2.省部共建药用资源化学与药物分子工程国家重点实验室(广西师范大学), 广西 桂林 541004; 3.药用资源化学与药物分子工程教育部重点实验室(广西师范大学),广西 桂林 541004; 4.广西民族药省部共建协同创新中心 (广西师范大学), 广西 桂林 541004)
松香烷型二萜具有三环二萜结构,其分子结构新颖多样,普遍存在于植物和微生物体内,具有广泛的生物活性[1]。松香烷型二萜主要来源于松香,是一类应用广泛的化工产品。以三环二萜结构为基础进一步合成或者修饰的松香化工产品已经广泛应用于助焊剂、涂料、油墨、胶黏剂、表面活性剂等领域[2]。近年来的研究表明,以三环二萜类松香酸及其衍生物为主要成分的松香具有抗肿瘤、抗菌、抗病毒等生物活性[1, 3-7],在药物制剂中常用作药用辅料、药物载体等[8],在杀虫、除草,抗菌等农业用药方面也大有用途[9]。
本课题组对松香烷型二萜的发现及其结构改造的研究已持续十多年。结合本课题组的研究工作,本文从药学、农药科学、药剂学、手性药物检测、活性化合物结构与性质关系5个方面综述松香烷型二萜在药学研究中的应用。
1 松香烷型二萜在农药中的应用
近年来,随着人民生活水平的提高,化学农药的副作用引起人们的关注,使传统化学农药的使用受到很大限制,天然农药或佐剂是减少化学农药用量的新选择。松香具有来源广、价格低、应用广泛等多种优势,在农业中常用作农药助剂、杀菌剂等,松香烷型二萜在农业发展中有望得到更广泛应用。
1.1 松香烷型二萜在农药制备中的应用
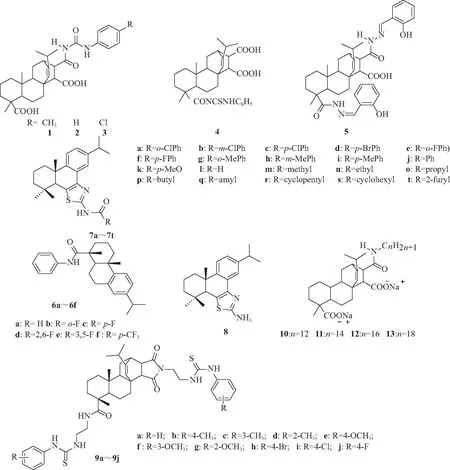
图1 化合物1~13的结构Fig.1 Chemical structures of 1-13
由细菌感染、真菌感染、植物病毒侵袭和害虫引起的农作物疾病是当前农业面临的难题之一。松香及其衍生物是林产业的主要产品,其抑菌、抗虫等活性较强,在农药应用方面已受到广泛关注。王恒山等[10]用松香和马来酸酐反应,得到马来酐海松酸,再引入苯脲、硫脲、酰腙等活性基团得到马来海松酸的取代苯脲、酰腙和酰胺基硫脲等3类共5个化合物,为通过马来酰海松香酸的结构修饰制备新型农药提供了工作基础。Rao等[3]以脱氢枞酸为底物设计合成6种去氢枞基酰胺类衍生物(6a~6f)(见图1),诱食活性实验显示,目标化合物对斜纹夜盗蛾具有一定诱食活性,有望开发成为新型诱食剂。陈乃源等[4]设计合成得到20个新型去氢枞酸基B环并噻唑-酰胺化合物(7a~7t),初步生物活性测试表明,50 mg/L的最终产物去氢枞酸B环并噻唑-苯甲酰胺(7j)和反应中间体去氢枞酸B环并噻唑-胺(8)对苹果轮纹病菌的抑制率分别为90.0%和92.4%,可有效防治苹果轮纹病。Liu等[6]设计合成一系列松香基酯,粘虫拒食实验结果表明,合成的大多数松香基酯在0.01 g/mL具有显著的拒食活性,24 h的摄食威慑值均在70%以上,多数化合物的拒食活性随碳链的增长而更好,且有部分粘虫死亡,推测这些合成松香酯对粘虫有胃毒作用,有望作为粘虫防治制剂。岑波等[11]以天然产物松香为底物,设计合成10个新型马来松香基双硫脲-酰胺化合物(9a~9j),初步生物活性测试表明,50 mg/L目标化合物对苹果轮纹、花生褐斑、黄瓜枯萎、小麦赤霉和番茄早疫等5种植物病原菌显示出一定的抗菌活性,多数化合物对苹果轮纹病菌的抑制率大于60%,其中化合物9i的抑制率达71.4%,对有效防治苹果轮纹病具有重要意义。翟兆兰等[12]设计合成马来海松酸酰胺二钠(Cn-MPA-2Na,n=12(10), 14(11), 16(12), 18(13)),采用浸叶法研究Cn-MPA-2Na及Cn-MPA-Na(n=12,14,16)对小地老虎幼虫的拒食活性,结果表明:室温下Cn-MPA-2Na和Cn-MPA-Na均具有良好的水溶性,其烷烃链长和羧酸钠个数对小地老虎拒食活性均无明显影响,C12-MPA-2Na、C18-MPA-2Na、C14-MPA-Na对小地老虎具有较强的拒食活性,其拒食中浓度(AFC50) 分别为0.51、0.54和0.77 g/L,说明该系列化合物对小地老虎的防治有一定的作用。Mao等[13]以天然松香产物为基础合成4类脱氢表二酰基-1,3,4-噻二唑衍生物(14~19),抑菌活性实验表明,化合物14e(见图2)对核盘菌、灰葡萄孢菌、尖孢镰刀菌和稻瘟病菌的EC50为0.618 mg/L,明显低于阳性对照多菌灵(0.649 mg/L);生理生化研究表明,化合物14e对尖孢镰刀菌的主要作用机制是改变菌丝形态,增加细胞膜通透性,抑制菌丝内麦角甾醇的合成;定量构效关系研究表明,分子中的前线轨道能量通过化合物14e与靶标受体之间的共轭和静电相互作用在抗真菌活性中起关键作用,显示该类化合物在抗菌方面的应用潜力巨大。

图2 化合物14~19的结构Fig.2 Chemical structures of 14-19
1.2 松香烷型二萜作为农药助剂的应用

随着研究的不断深入,松香烷型二萜类化合物的理化性质不断被发现,该类化合物未来有望广泛应用于农药及农药助剂。
2 松香烷型二萜在药物制备中的应用
松香是一种传统中药,具有抗肿瘤、抗菌、抗病毒等广泛生物活性[19-23],经结构改造后的松香基化合物有望作为临床药物。
2.1 抗肿瘤活性

图3 化合物20~35的结构Fig.3 Chemical structures of 20-35
据统计,癌症的死亡率已经超过心血管类疾病成为头号杀手。但是癌症的具体发病机理尚未明确,临床上比较难治愈,因此,寻找新的癌症治疗策略是药物化学的热门研究方向。喹啉类化合物临床应用非常广泛[24-25]。童碧海等[26]以顺式-12-氨基脱异丙基脱氢松香甲酯为中间体,合成了2种脱氢松香基喹啉衍生物20、21(见图3),在开发生理活性物质方面极具潜力。张业等[27]以脱氢松香酸甲酯为底物合成了(4R,12bS)-4,12b-二甲基-1,2,3,4,4a,5,6,12b-八氢化萘并[1,2-g]喹啉-4-羧酸甲酯(22)和(7R,10aS)-7,10a-二甲基-5,6,6a,7,8,9,10,10a-八氢化萘并[2,1-f]喹啉-7-羧酸甲酯(23),为研究脱氢松香基喹啉衍生物的生物活性、开发其药用价值、进一步提高脱氢松香酸的利用价值提供实验基础。呋咱类化合物的硝基类衍生物可以用作荧光探针[28],并且具有预防白血病、抗癌[29-31]、抗病毒扩散等生物活性[32]。张业等[33]以脱氢松香酸为底物合成一种新型化合物12-溴-13,14-脱氢松香酸甲酯氧化呋咱(24),该化合物具有良好的抗肿瘤活性。根据呋咱化合物的良好抗肿瘤活性和前期实验基础,张业等[34]在脱氢松香酸芳环上建构噻唑啉、噻二唑环和噻三唑杂环,设计并合成6个尚未有文献报道的含氮杂环衍生物(25~30),以期发现具有重要生理活性的新药先导化合物。杨新平等[35]以脱氢松香酸为原料,设计并合成5个12位含氮脱氢松香酸衍生物(31~35),并对4种人体肿瘤细胞株进行初步体外抗肿瘤活性评价,结果表明部分化合物具有良好的抗肿瘤活性,具有深入研究的价值。
Huang等[36]设计合成一系列具有DHA(dehydroabietic)结构的新型α-氨基磷酸衍生物(36a~36q)(见图4),体外生物活性测试结果显示,大部分化合物对NCI-H460(人肺癌细胞)、A549(人肺腺癌细胞)、HepG2(人肝癌细胞)和SK-OV-3(人卵巢癌细胞)细胞株的抑制活性比抗癌药物5-氟尿嘧啶(5-Fu)强,其中36c对NCI-H460细胞株的抑制活性最显著(IC50=3.33±0.58 μmol/L),其可诱导NCI-H460细胞凋亡,主要在G1期阻滞NCI-H460细胞的增殖,能有效抑制癌细胞生长。在此研究基础上,Huang等[37]在DHA结构上再引入羰基和肟基,合成一系列具有DHA结构的新型硫脲α-氨基磷酸衍生物(37a~38o),体外生物活性测试结果显示,部分化合物对NCI-H460、A549、HepG2和SK-OV-3等人癌细胞株的抑制作用比阳性对照药5-氟脲嘧啶更显著,其中化合物38f(IC50=7.00±0.04 μmol/L)能诱导A549细胞凋亡,证实了在DHA结构中引入α-氨基磷酸、羰基、肟等活性基团可显著增强DHA的抗肿瘤活性。
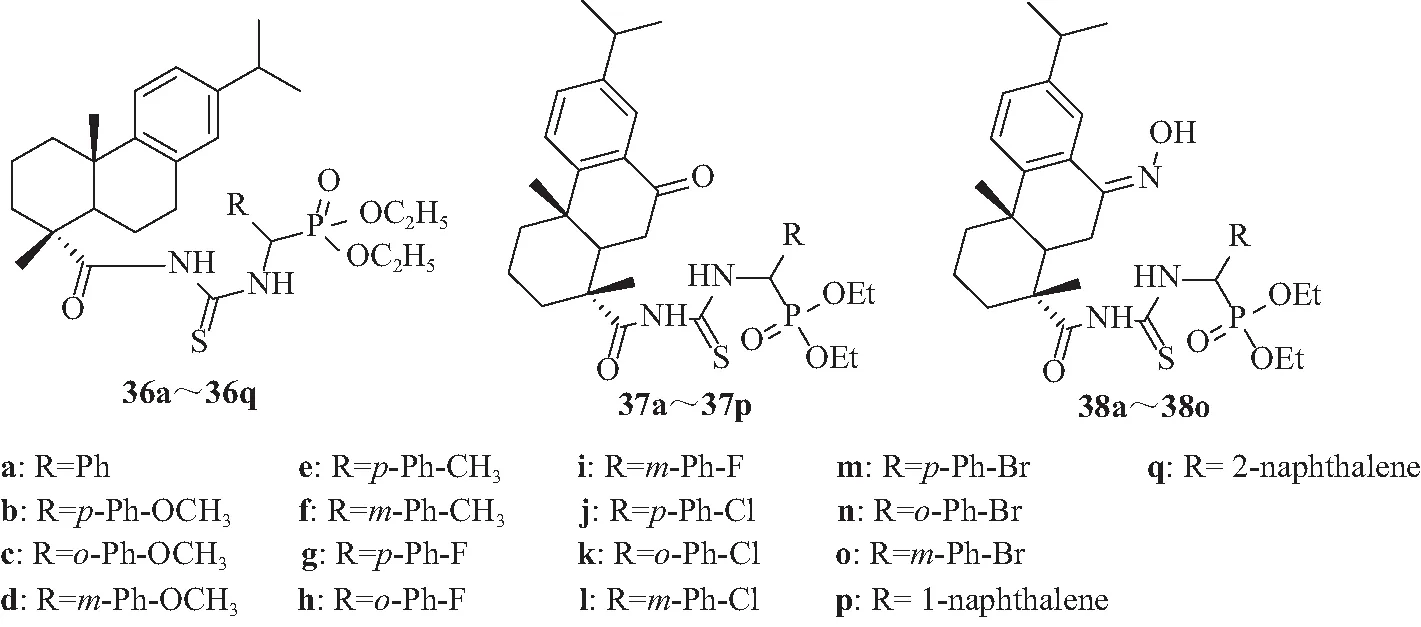
图4 化合物36~38的结构Fig.4 Chemical structures of 36-38
Huang等[38]设计合成一系列脱氢丙烯酸二肽衍生物(39a~39s)(图5),抗肿瘤活性筛选结果表明,许多化合物对NCI-H460、HepG2、SK-OV-3、BEL-7404、HeLa和HTC-116肿瘤细胞株均表现出中等至高水平的抑制作用,其中一些化合物的抑制活性比商用抗癌药物5-Fu强,化合物39b通过线粒体途径诱导HeLa细胞凋亡。在此研究基础上,Huang等[39]在DHA结构上再引入羰基和肟基,合成一系列DHA手性二肽衍生物 (40~41),生物活性实验结果表明,许多化合物对 NCI-H460、HeLa和 MGC-803 3株人癌细胞系显示出中到高水平的抗肿瘤活性,与抗癌药物5-Fu相比显示出更显著的抑制效果。通过四甲吖啶/溴化乙锭染色、Hoechst 33258 染色、JC-1线粒体膜电位染色、TUNEL测定、流式细胞术以及Western Blot实验,证明细胞凋亡与线粒体膜电位的丧失、线粒体肌高铁血红素释放和细胞内ROS产生的增强、Bax表达的升高、Bcl-2的下调以及caspase-9和-3的激活有关。并且通过比对化合物之间的IC50值,证实新型脱氢枞酸(DHA)手性二肽衍生物的D-,L-两种构型对抗肿瘤活性存在差异。

图5 化合物39~41的结构Fig.5 Chemical structures of 39-41

图6 化合物42~44的结构Fig.6 Chemical structures of 42-44
Liu等[40]对植物华北大戟中的新化合物42(图6)研究表明,其对NCI-H460和MCF-7的IC50为19.5和18.6 μmol/L,证明华北大戟具有抗肺癌、乳腺癌潜力。Jin等[41]设计合成一系列脱氢丙烯酸(DHAA)酰基硫脲衍生物(43a~44o),对其体外抗肿瘤活性研究表明,这些化合物对Hela、SK-OV-3和MGC-803等肿瘤细胞株都有比较强的细胞毒性,对人体正常细胞株HL-7702的细胞毒性较低;化合物43n(IC50= 6.58 ± 1.11 μmol/L)对Hela细胞比商业药物5-Fu(IC50=36.58 ± 1.55 μmol/L)具有更强的抑制作用,通过细胞机制研究发现,43n可以使细胞停滞在S期阶段,Western Blot实验发现该化合物通过线粒体途径诱导Hela细胞凋亡,该化合物的抗肿瘤活性优于5-Fu,极具开发成为抗肿瘤新药的潜力。
Huang等[42]设计合成一系列含磺酰胺基团的DHAA 二肽衍生物(45a~45i,46a~46u)(图7),活性实验表明这些化合物在低浓度时对MMPs表现出较好的抑制活性;对最具活性的46k研究表明,其磺酰胺部分和二肽基对提高活性起着重要作用,其至少部分通过抑制MMP-3的活性和诱导细胞凋亡;伤口愈合实验发现,46k处理HepG2细胞后,其体外迁移受到抑制,细胞周期阻滞于G1期,对HepG2细胞的凋亡有明显的促进作用。因此,推测含磺酰胺部分的DHAA二肽衍生物可能是潜在的具有抑制细胞迁移能力的MMPs抑制剂。
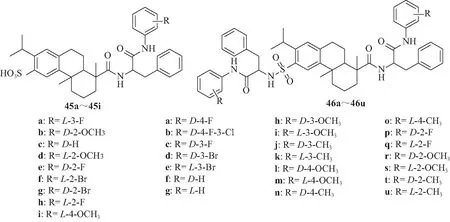
图7 化合物45a~45i, 46a~46u的结构Fig.7 Chemical structures of 45a-45i, 46a-46u

图8 化合物47~50的结构Fig.8 Chemical structures of 47-50
李芳耀等[43]设计合成一系列脱氢枞酸硝酸酯类化合物(47a~47r)(图8),活性实验表明,47j和47n分别对CNE-2和BEL-7402癌细胞株具有显著的抑制效果,且对人体正常细胞显示出较低细胞毒性。因此,脱氢枞酸硝酸酯类化合物有望开发成一种新的抗肿瘤药物。Li等[44]设计合成2个脱氢松香衍生物N-(5-脱氢枞酸基-1,3,4-噻二唑)基-吡啶-2-甲酰胺 (DTPC48)和二-N-(5-脱氢枞酸基-1,3,4-噻二唑)-基-吡啶-2,6-甲酰胺 (DDTPC49)。体外MTT法测试表明,DTPC表现出更好的细胞毒性,DTPC对A431细胞系的抗增殖作用强于临床使用的顺铂和奥沙利铂;DTPC和DDTPC的细胞毒性与其DNA结合能力密切相关,DTPC有望开发为新型抗肿瘤药物。Fei等[45]合成2个基于脱氢松香酸与二价铜离子、三价铁离子的配合物Cu2(μ2-O)(L)4(DMF)2(A)和[Fe3(μ3-O(L)6(CH3OH)2(CH3O)]·H2O(B)。化合物A的细胞毒性(MCF-7)比化合物B要好,且与抗癌药物顺铂和奥沙利铂相当,化合物A的抗肿瘤机理表明其通过产生氧化应激、损伤DNA、促进脂质过氧化和蛋白质羰基化、诱导细胞凋亡和自噬等外源性与内源性相结合来杀死MCF-7细胞;B显示出抗转移活性,抑制细胞侵袭和迁移,以及抗血管生成特性。表明基于松香衍生物的铜络合物作为金属类抗肿瘤药物值得开发。Chen等[46]设计合成基于脱氢枞酸的B环稠合噻唑的芳基甲胺衍生物(50a~50r),体外细胞活性测定结果表明,化合物50j和50n对癌细胞具有一定的抑制活性,对正常细胞的细胞毒性较弱,细胞机制研究发现该类化合物对PI3K/AKT/mTOR信号通路具有抑制活性,有望成为该信号通路的抑制剂。
通过在松香烷型二萜骨架中引入杂环、肟、肽类以及酰胺等活性结构,得到许多更具生物活性的松香烷型二萜类衍生化合物。这些研究在一定程度上可解决合成活性松香烷型二萜类衍生化合物的盲目性,为今后研究松香烷型二萜类化合物具有指导意义。
2.2 抗炎活性
炎症反应会导致组织部位的微环境发生变化,通常表现为红、肿、热、痛等症状,过度的炎症反应会导致机体的肠道、关节、血管等身体部位受损,甚至会导致肿瘤细胞的产生。因此,更多高效和低毒副作用的抗炎药物有待发现。Zhao等[47]从大戟科植物圆叶乌桕中分离到一系列新的松香烷型二萜、三萜类化合物(51~64)(图9)。活性测试表明,与阳性对照minocycline (IC50= 16.1 μmol/L) 相比,化合物56、60、63表现出中等抑制活性,其IC50值分别为35.9、17.0、31.5 μmol/L,表明该植物具有很好的生物利用价值。

图9 化合物51~64的结构Fig.9 Chemical structures of 51-64
2.3 抗氧化活性

图10 化合物65,66的结构Fig.10 Chemical structures of 65,66
自由基会在体内导致氧化损伤,给机体带来一系列疾病,如:常见的心血管疾病、糖尿病、癌症等。为了更好地预防这些疾病的产生,抗氧化治疗至关重要,因此,亟待寻找更多的抗氧化剂。雷茜等[48]以脱氢松香酸为原料,经溴代、硝化、甲酯化等步骤合成7-羰基-12-脱氢松香酸甲酯硫醚(65)(图10),发现其具有较好的自由基清除活性,其IC50值为1.23×10-7mol/L,且清除时间较短,其快速的反应速率和良好的效果使其有望开发为良好的抗氧化剂。王凯等[49]以脱氢松香酸为底物合成目标化合物66,发现其对Cu2+和 Fe2+均表现出良好的螯合性能,对Cu2+与Fe2+的耦合常数分别为 102.9 L/mol和168.3 L/mol,有望开发为通过螯合作用而抑制自由基产生的潜在抗氧化剂。
2.4 其他
为发现更多生物活性化合物,张贵杰等[50]对臭牡丹植物的化学成分进行研究,分离得到10个化合物,包括一个新的松香烷二萜(67)(图11)和一个长链脂肪酸化合物(68)。该研究不仅丰富了天然小分子化合物库的多样性,也为进一步研究该植物的药用价值提供了物质基础。

图11 化合物67,68的结构Fig.11 Chemical structures of 67,68
松香烷型二萜类化合物作为具有广泛生物用途的天然化合物,其分子多样性不断被丰富,更多的药理活性等待发掘。
3 松香烷型二萜在药物制剂中的应用
目前对松香及其衍生物在药物制剂方面的研究较少。松香聚合物、聚乙二醇松香衍生物等松香衍生物具有缓释或控释药物的作用,因此松香聚合物、聚乙二醇松香衍生物等松香衍生物在药物制剂中常用作药物薄膜包衣剂、缓释微球、片剂表面涂覆材料等[8,51]。松香烷型二萜在药物制剂的应用鲜有报道。
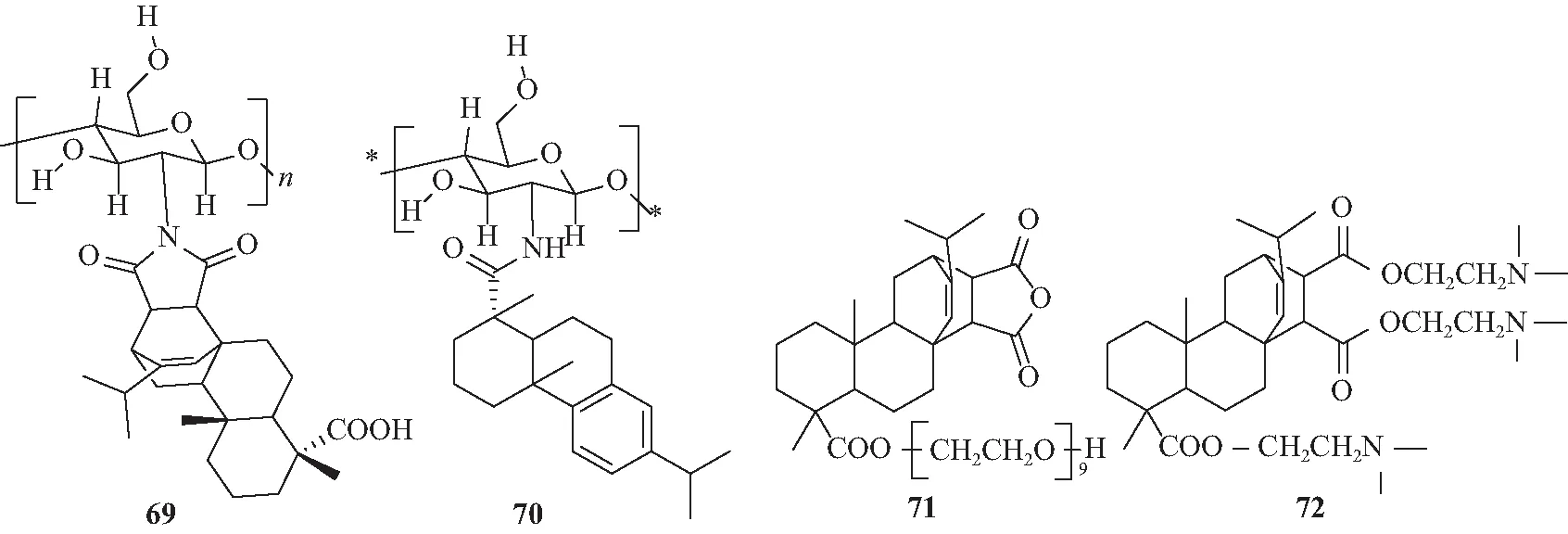
图12 化合物69~72的结构Fig.12 Chemical structures of 69-72
段文贵等[52]以壳聚糖和松香为原料,合成一种新型壳聚糖衍生物马来松香酰化壳聚糖69(MRCI)(图12),并研究壳聚糖和 MRCI 作为药物非诺洛芬钙缓释制剂的载体及缓释性能。结果表明,MRCI 载体在人工肠液中有良好的缓释作用。次年,该课题组[53]再次合成另一种新型脱氢松香壳聚糖衍生物70(DAMC),该聚合物作为菲诺洛芬钙的载体显示出比MRCI更好的控释效果。5-ASA(5-氨基水杨酸)容易在上消化道的酸性环境下渗透,针对酸性下5-ASA 的延迟释放,Singh等[54]通过纳米沉淀法制备了平均尺寸为 267 nm 的羧甲基纤维素-松香胶混合纳米粒子(CRNPs),在模拟胃液 (SGF) 和肠液 (SIF) 中监测了5-ASA从CRNPs的结肠特异性靶向体外释放,与天然羧甲基纤维素或松香胶在5 h或8 h内全部释放相比,CRNPs在SGF中前 2h的释放速率非常慢,而在 SIF中,释放速率较快,72%的药物在12 h内以受控方式释放,其延迟释放对提高药物在结肠中的生物利用度很有帮助。Morkhade等[55]合成2个聚乙二醇松香衍生物(PRDs)D1和D2,PRDs(71)(图12)可生物降解和可生物兼容,制备含PRDs-司帕沙星的缓释抗菌薄膜可用于治疗牙周炎。Lin等[56]以松香为原料合成一种具有3个亲水基团和1个刚性疏水基团的新型松香基酯叔胺RETA(72)。RETA具有独特的pH响应,在pH=5.76、8.04和9.38时,其分别自组装成类蠕虫胶束、直径为130 nm的球形胶束和直径为2 μm的大球形类蠕虫聚集体。由于RETA对pH的特别响应性,细胞毒性较小,在传递盐酸阿霉素(DOX)中具有潜在的应用前景。
茶树精油是一种天然抗菌化合物,但因为其成分大多为挥发油等易挥发物质,未能得到有效利用。Qiu等[57]通过胺化介孔二氧化硅和松香钠的静电或化学作用,制备了含有茶树精油且具有生物兼容性的低挥发性载体。通过测量最小抑菌浓度(MIC)和最小杀菌浓度(MBC)值来评价茶树精油与载体结合体的抗菌性能,实验结果为:对大肠杆菌的MIC值和MBC值分别为0.3和0.6 g/L;对金黄色葡萄球菌的MIC和MBC分别为0.15和0.3 g/L。更引人注目的是,茶树精油与该载体结合后还显示了长期的抗菌性能。因此,这项研究为挥发性抗菌药物的传递提供一种新的途径,以达到缓释和长效抗菌效果。
以松香衍生物为基础合成的材料作为一些药物的覆膜或者缓释剂,已经取得阶段性成就,将来有望在药物制剂中得到广泛应用。
4 松香烷型二萜在手性药物检测中的应用
手性药物研究是药学研究领域的重要内容之一。当前许多手性药物仍然以消旋体的形式出售和使用[58],为了进一步了解手性药物对映体之间的构效差异,手性药物检测识别与拆分具有重大研究意义。
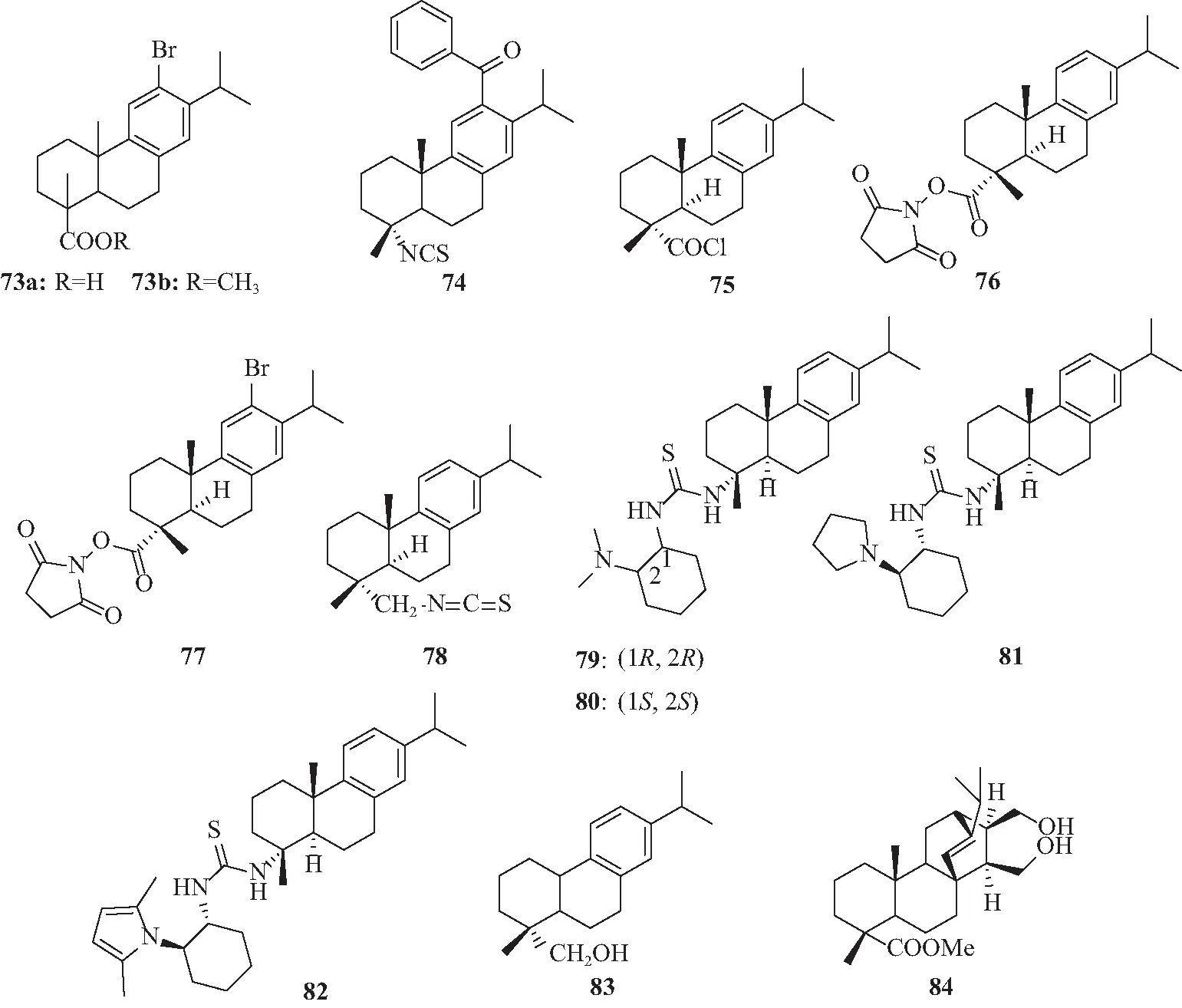
图13 化合物73~84的结构Fig.13 Chemical structures of 73-84
农容丰等[59]利用核磁共振波谱手段对12-溴代脱氢松香酸的立体结构和溶液构像进行研究,并对其一维谱图进行归属,总结了天然脱氢松香酸及其C-12位取代化合物的骨架分子构型规律,为进一步深入研究天然脱氢松香酸及其C-12位取代化合物的理化性质提供了理论基础。王恒山等[60]利用脱氢松香酸天然手性骨架,将其改造并制备12-溴代脱氢松香酸化合物(73a,73b)(图13),以手性衍生试剂的形式将73a用于手性化合物的检测和分离中,取得良好效果。农容丰等[76]首次报道了化合物73a、73b的NMR数据,用二维核磁共振波谱法对其立体结构和溶液构像进行鉴定,为进一步设计新型手性试剂提供了理论和实验依据。Zhao等[61]和Wang等[62]设计并合成降解脱氢松香基异硫氰酸酯(DDHA-NCS)和脱氢松香基异硫氰酸酯(DHA-NCS),将这2个手性衍生试剂应用于毛细管电泳分离氨基酸对映体取得较好效果。但其发色基团为苯环,被检测的灵敏度不高,因此,王迎春等[63]用硫酸二甲酯酯化后,通过傅克酰基化反应,直接在松香芳环12位上构建苯甲酰基团,再通过水解、酰氯化、Curtius反应等步骤,合成一种新型手性荧光衍生试剂12-苯甲酰基脱氢松香异硫氰酸酯(74),显著增强其检测灵敏度。冯少波等[64]设计并合成异硫腈酸酯类、酰氯类和琥珀酰亚胺酯类共4个手性衍生试剂(75~78)用于胺类消旋体拆分,对比研究它们与消旋体的衍生性能及在毛细管电泳和高效液相色谱(HPLC)下对氨基酸消旋体的拆分能力。研究表明,脱氢松香异硫腈酸酯(DHA-NCS)对D,L-半胱氨酸和D,L-丙氨酸衍生后通过毛细管电泳得到较好的拆分;酰氯、琥珀酰亚胺酯类等目标化合物可与上述氨基酸进行衍生并在HPLC条件下达到基线分离,有效提高了氨基酸消旋体的拆分能力。Jiang等[65]利用高对映选择性的含松香基硫脲衍生物(79~82)催化得到具有高光学活性的螺[恶唑啉-3,3′-羟吲哚]类化合物,使用急性神经炎症模型对几种螺恶唑啉进行初步生物学评估,结果显示化合物具有不错的解热活性,为发现新的解热剂提供了机会。吴强等[66]以松香为底物通过3步反应高收率合成手性单醇(83)和手性二醇(84),将它们用于手性助剂制备有机膦衍生试剂,分别对单官能团手性化合物(单醇、单胺)和双官能团化合物(双醇、双胺及氨基醇)进行衍生,经31P NMR 测定,均能够在测定条件下实现对映体峰的基线分离,对单官能团手性化合物有比较好的分离效果。

图14 化合物85~112的结构Fig.14 Chemical structures of 85-112
杨达等[67]利用天然松香为原料合成4个甜菜碱类化合物85~91(图14)和1个阴离子化合物87,并对目标产物的临界胶束浓度(CMC)、临界胶束浓度的表面张力值(VCMC)、乳化性质(EP)和泡沫性质(FP)进行测定和比较,结果表明91具有良好的乳化能力和表面活性,有望应用到化合物手性分离中。王恒山等[68]设计并合成1个新型N-芳香基马来海松酸二酰亚胺,首次发现松香骨架的衍生物在溶剂中能够进行构型的动力学翻转,并利用二位核磁共振波谱确定其trans(92)和cis(93)在溶液中的构像,对深入研究和开发松香化合物的手性用途具有重要意义。姚贵阳等[69]合成2个化合物24,24-二苯基马来海松酸酐单甲酯(94)和21,21,24,24-四苯基马来海松酸酐单醇(95),化合物94的X-ray单晶衍射数据验证格氏加成的区域选择性,同时实验结果表明格氏反应对松香环式原有的立体结构没有影响,化合物94和95有望开发成手性衍生试剂。韦京辰等[70]设计合成一个新的手性酸(96),与马来海松酸对比,化合物96对胺的识别效果显著增强,有望作为手性识别试剂。黄国保等[71]以脱氢松香酸为原料,通过酯化、水解、异构化、溴代等反应合成磁各向异性更强的6-溴-7-异丙基-1,10-二甲基-1,2,3,4-四氢蒽-1-羧酸(97),该类化合物容易利用核磁数据检测分析。花世鲜等[72]合成一系列脱氢松香基12位芳基取代衍生物(98~101),对化合物99和101的光谱性质进行研究,发现与脱氢松香酸甲酯相比,其最大紫外吸收波长、激发波长和发射波长都有很大程度的红移,表明紫外吸收和荧光得到很大程度的改善,有望进一步改造成优良的手性荧光衍生试剂。黄胜梅等[73]以脱氢松香酸为底物合成7-异丙基-1,10-二甲基-1,2,3,4-四氢蒽-1-羧酸酰氯(102),利用核磁共振波谱技术研究其对外消旋α-苯乙胺的手性识别能力,结果表明主体手性酰氯对外消旋的手性胺表现出良好的识别效果,与其手性碳相连的甲基碳原子的化学位移差异值高达0.33,显著增强了核磁共振波谱技术对外消旋手性胺类化合物的识别。陈华妮等[74]合成一系列马来海枞酸二酰亚胺模型化合物(103~109),发现当引入手性背景后,其二酰亚胺环平面发生扭曲,导致能垒下降,并且N-杂萘基二酰亚胺体系的阻转能垒较低,在室温下即可产生位阻异构现象,有利于纯化异构体及对异构体的理化性质研究。金乐等[75]合成一系列N-芳基马来海松香二酰亚胺,纯化得到光学纯的N-(1-萘基)马来海松酸二酰亚胺(110)及其甲酯(111),具有多个手性中心的松香二萜架构引入二酰亚胺后使异构体能够通过非对映体形式用普通硅胶色谱分离,从中获得单一构型的产物,从而达到手性识别效果。王恒山等[76]以松香为原料设计合成手性二醇5-苄氧甲基-5,9-二甲基-13β,14β-二羟基甲基-16-异丙基四环[10.2.2.01,10.04,9]十六烷-15-烯,制备用作NMR手性膦试剂,分别对单官能团手性底物(单醇、单胺)进行衍生,通过测定31P NMR化学位移差异值检验松香基手性膦试剂的手性识别能力,其芳基底物对映体衍生物的膦化学位移差异值在0.14~0.41,均能在测定条件下实现对映体峰的基线分离。
松香烷型二萜类化合物结构中存在多个手性中心,对某些特定结构具有较好的选择性,因此,该类化合物在手性试剂检测与手性拆分试剂方面拥有比较好的应用前景。
5 松香烷型二萜的结构与性质关系
结构改造是开发和利用天然产物的重要手段。天然产物研究为药物先导化合物提供重要的结构基础,在天然产物研究的基础上对先导化合物结构进行修饰,以增强其生物活性是药学研究的重要内容。脱氢松香酸(DHA)是一种天然二萜类化合物,以往研究表明,DHA具有增强抗癌药物在多种细胞中抑制活性的特性,如宫颈癌细胞、肝癌细胞和乳腺癌细胞等[1-2, 22]。在DHA结构上引入各种官能团以达到提高DHA各种生物活性的研究已经有较多报道(图15)。
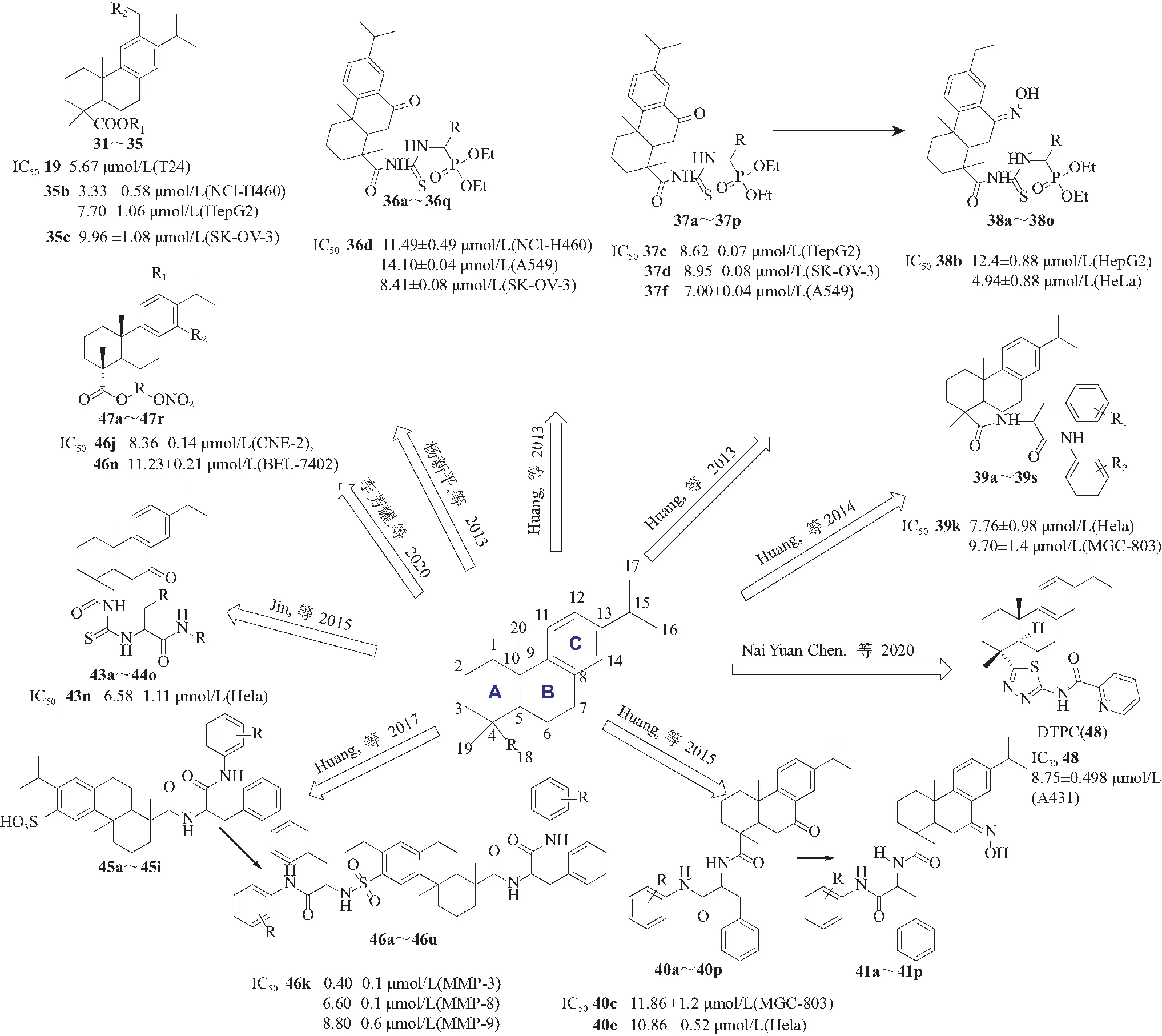
图15 化合物构效关系Fig.15 Compounds structure-activity relationship
5.1 对DHA C-12位的修饰
杨新平等[35]在DHA的C-12位引入苯并咪唑、邻苯二甲酰亚胺、萘酰亚胺、吖啶酮等含氮活性基团,得到的5个化合物都具有一定的抗肿瘤活性,其中化合物35对T24细胞株显示出显著的抑制效果(IC50= 5.67 μmol/L)。Huang等[42]分别在DHA的C-12位引入一个二肽磺胺衍生物基团和C-18位引入二肽衍生物基团得到一系列化合物,经体外MTT法测试筛选得到抑制作用较好的化合物,IC50值为0.4 ± 0.1 μmol/L(MMP-3)、 6.6 ± 0.1 μmol/L(MMP-8)、 8.8±0.6 μmol/L(MMP-9),实验结果显示DHA的C-12碳原子上的二肽磺胺基团对化合物的MMPs蛋白酶抑制作用有重要影响。 此外,实验结果进一步证明氨基酸D-,L-构型对其生物活性有一定影响。
5.2 对DHA C-18位的修饰
Huang等[36]将氨基磷酸活性基团引入DHA的C-18位后得到一系列具有α结构的新型α-氨基磷酸DHA衍生物。Jin等[41]在DHA结构C-18位引入酰基硫脲基,得到系列具有DHA结构的硫脲肽衍生物,经体外MTT法测试,化合物(44n)对癌细胞生长显示出较强的抑制作用,IC50= 6.58 ± 0.11 μmol/L(HeLa)。李芳耀等[43]将硝氧基引入脱氢枞酸酯的C-18位,得到一系列抗肿瘤活性明显提高的硝酸酯类化合物,IC50值为8.36 ± 0.14 μmol/L(CNE-2), 11.23 ± 0.21 μmol/L(BEL-7402)。Li等[44]将脱氢枞酸作为基团引入N-噻二唑-吡啶-2-甲酰胺中,得到的化合物对A431细胞系的抗增殖作用强于临床使用的顺铂和奥沙利铂。
5.3 对DHA C-7位的修饰
Huang等[37]对具有DHA结构的氨基磷酸衍生物进行更深入的结构改造,在DHA结构中C-7位分别再引入羰基和肟基。引入羰基和羟胺基后部分化合物对人肺癌细胞(A549)和人卵巢癌细胞(SK-OV-3)的抑制作用显著增强,IC50分别为7.00 ± 0.04、8.41 ± 0.08 μmol/L。Huang等[38]在DHA结构C-7位引入二肽衍生物得到系列具有DHA结构的二肽衍生物,经MTT法测得所有化合物的抗肿瘤活性,化合物39b显示出较好的抗肿瘤活性,IC50值为4.94 ± 0.88 μmol/L(HeLa)。在此工作基础上,Huang等[39]在具有DHA结构的二肽衍生物的C-7位引入羰基和肟基,得到系列抗肿瘤活性好而对正常细胞毒性比较小的二肽衍生物,并且实验证明在DHA结构引入二肽的D-、L-两种构型对癌细胞的抑制作用存在明显差异。Chen等[46]将脱氢枞酸的B环稠合噻唑芳基甲胺,最终产物对人体正常细胞毒性较小且对癌细胞有一定抑制作用,IC50为24.41 ± 0.26 μmol/L(HepG2), 21.79 ± 0.34 μmol/L(SCC9)。显而易见,未经过结构修饰的松香烷型二萜类化合物与结构修饰过后的松香烷型二萜类衍生物的生物活性差异甚大,有的化合物结构修饰后的生物活性提高了几十倍。因此,结构修饰能够有效提高化合物母核的生物活性。未来可以以一定的构效关系作为结构修饰研究导向,对松香烷型二萜类化合物进行更深入的结构修饰研究,更进一步开发和利用该类化合物的潜在价值。
6 结论与展望
本文综述近年来松香烷型二萜在农药学、药学、药物制剂、手性药物检测以及构效关系方面的研究进展。松香烷型二萜来源非常广泛,具有廉价易得的优点,同时该类化合物又具有广泛的生物活性,如:抗肿瘤、抗炎、抗菌和抗病毒等活性。对该类化合物进行初步的结构改造,发现其生理活性可以得到很大提高,并对其抗肿瘤等机制进行了研究,为更深入研究其构效关系和寻找生物活性优异的先导化合物提供了理论基础。查阅文献资料和整理本团队研究内容时发现:当前报道松香烷型二萜在手性试剂、表面修饰剂、工业辅料等方面的应用比较多,但是其生物活性明确活性靶点的应用比较少;其结构手性中心多,在手性拆分试剂方面应用比较有前景;但由于其分子量大,溶解性不好,对底物适应性较差,其应用缺乏广谱性。对其结构修饰的位置,已有的报道显示在C环C-12和A环C-18位进行修饰的比较多,对B环的修饰相对较少。因此,在未来对松香烷型二萜类化合物的研究当中,期望能够改善其溶解性问题,寻找更多生物活性明确的活性靶点,扩大其在药学研究中的应用。
近几年来,多靶点治疗被认为是提高治疗效果的有效策略,尤其是双靶点治疗。松香烷型二萜经过结构修饰后具有K+通道开启作用[22],可作为K+通道的激动剂。基于本团队已经完成的一些松香烷型二萜的生物活性作用机制研究,进一步对松香烷型二萜的离子通道活性筛选将有助拓展新的先导化合物,为实现松香类药用资源开发提供新方向。
