卵巢储备功能减退患者卵泡液外泌体对小鼠卵母细胞体外成熟的影响
2022-10-19沈开元杨冠群罗平代小丽黄萍梁媛媛李顺陈立群曲晓力
沈开元,杨冠群,罗平,代小丽,黄萍,梁媛媛,李顺,陈立群,曲晓力
(柳州市人民医院生殖医学科,柳州 545006)
卵巢储备功能减退(DOR)能够造成女性生育力下降甚至不孕,因此如何修复、改善女性卵巢储备提高辅助生殖技术(ART)成功率是亟待解决的重要问题之一。DOR患者生育力低下不仅体现在窦卵泡数的减少,而且卵泡液中活性氧(ROS)增多、卵巢颗粒细胞的异常凋亡、线粒体功能异常等也会影响卵母细胞的成熟和发育潜能[1-3]。外泌体是参与细胞间通讯的膜性囊泡,细胞在正常和病理条件下都能分泌特异的外泌体,卵泡液中同样存在大量的外泌体。本课题组非常关注DOR患者卵泡液外泌体是否参与调控了卵母细胞发育过程。因此本研究尝试通过构建小鼠卵母细胞体外成熟模型,观察卵母细胞成熟的相关指标来探究外泌体对卵母细胞成熟的影响,以期为女性因DOR导致的生育功能降低和不孕症的诊疗提供新的科学实验数据。
材料与方法
一、实验动物和材料
1.实验动物:SPF级4~6周龄C57BL/6J未孕雌性小鼠20只,体重25~30 g,购自广东省医学实验动物中心[生产许可证编号:SCXK(粤)2018-0002]。动物购入后在人工控制环境下进行1周的适应性喂养,保持14 h光照/10 h黑暗的光周期,室温24℃,随后纳入实验。
2.卵泡液样本:DOR患者卵泡液收集标准和方法参考之前发表论文所述方法[4]。纳入标准:(1)年龄≤35岁,均有排卵证据;(2)月经周期第3天窦卵泡计数(AFC)≤5~7个;(3)抗苗勒管激素(AMH)<0.5~1.1 ng/ml、基础FSH>10 U/L。以上3项符合2项并排除输卵管梗阻或男方因素导致不孕的患者纳入研究。排除标准:(1)合并有其他女性内外科疾病如多囊卵巢综合征(PCOS)、高泌乳素血症和盆腔输卵管炎症等;2)存在不良生活习惯(抽烟、酗酒等)和体重超重(体质量指数BMI≥25 kg/m2)的患者。
符合纳入标准的患者取卵手术时收集第一管澄清无血染的卵泡液,每3个患者卵泡液样本合并为一份,均一混合样本用于外泌体的提取纯化。本研究共收集3管上述样本。所有患者均签署知情同意书,本研究通过柳州市人民医院医学伦理委员会审查[审批号2020(KY-E-18-01)]。
3.主要试剂:外泌体提取纯化试剂盒(上海宇玫博生物科技);孕马血清促性腺激素(PMSG)、人绒毛膜促性腺激素(HCG)、M2培养液、透明质酸酶和未成熟卵培养液(南京爱贝生物科技);Dio细胞膜荧光探针试剂盒(南京凯基生物科技);RNA提取试剂盒(TaKaRa MiniBEST Universal RNA Extraction Kit)、反转录试剂盒(PrimeScriptTMRT Master Mix)以及荧光定量试剂盒(TB GreenFast qPCR Mix)(Takara,日本)。
4.主要仪器:体视显微镜(SMZ745,Nikon,日本);倒置荧光显微镜(T2R,Nikon,日本);qPCR仪(Lightcycler 480,Roche,瑞士);酶标仪(VarioskanTMLUX,Thermo,美国)。
二、研究方法
1.未成熟卵母细胞收集及体外成熟培养(IVM):小鼠腹腔注射PMSG 10 U,46~48 h后颈椎脱臼处死小鼠,75%乙醇消毒小鼠腹部,眼科剪剪开小鼠腹部,只剪取小鼠卵巢并去除周围脂肪团,分离的卵巢立即转入M2培养液中清洗,随即转入做有数个200 μl M2培养液微滴的培养皿中;在显微镜下用1 ml无菌注射器针头戳破卵巢上的卵泡,用合适直径的巴氏吸管挑选培养皿底部卵丘颗粒细胞完整、大小均一的卵丘-卵母细胞复合物(COCs)转入含有不同浓度外泌体的体外成熟培养皿中,进行体外成熟培养;COCs体外培养14~16 h后评估卵母细胞卵丘扩展情况,随后COCs转入0.1%透明质酸酶中消化30 s,烧制直径为100 μm的巴氏吸管将卵母细胞吸出,在M2培养液中吹打掉多余的颗粒细胞,使卵母细胞完全裸露并清洗3次,统计卵母细胞第一极体排出的情况。
2.卵母细胞卵丘扩展指数:参考Vanderhyden等[5]和Fagbohun等[6]提出的方法来评估卵母细胞卵丘扩展情况,卵丘扩展评分标准:0级,卵丘没有扩展,卵母细胞贴到培养皿底部;1级,只有最外层的1~2层卵丘颗粒细胞扩展;2级,外层的卵丘颗粒细胞呈放射状扩展,观察到整个COC较蓬松;3级,放射冠部分不扩展,其余的均扩展;4级,全部卵丘颗粒细胞扩展。卵丘扩展指数=[(0级卵母细胞数×0)+(1级卵母细胞数×1)+(2级卵母细胞数×2)+(3级卵母细胞数×3)+(4级卵母细胞数×4)]/卵母细胞总数。
3.体内成熟小鼠COCs收集方法:在小鼠腹腔注射PSMG 10 U,46~48 h后再次腹腔注射HCG 10 U,16 h后处死小鼠剪取小鼠的输卵管,在M2培养液中清洗并在显微镜观察下使用1 ml注射器针头划破输卵管膨大的壶腹部让COCs流出,收集体内成熟COCs使用PBS清洗掉培养液后备用。
4.外泌体摄入验证实验:外泌体提取方法同样参考之前论文所述方法[4]。卵泡液上清离心去除细胞和组织碎片,使用剂盒提取纯化后添加PBS进行重悬,并将重悬液分为每管50 μl,-80℃冰箱保存备用。卵泡液外泌体用Dio荧光探针进行染色,参考文献[7-8]的方法并进行了相应修改,具体步骤如下:50 μl外泌体储存液中添加工作浓度为1 μg/ml Dio探针,37℃孵育30 min后使用外泌体提取试剂盒的纯化柱子,12 000 r/m、4℃离心10 min去除多余的荧光染料;设置含有相同浓度Dio探针的等体积PBS液体为阴性对照组,与外泌体处理组同时进行相应处理;各挑选新鲜的10枚未成熟COCs分别放入含有工作浓度为20 μg/ml Dio标记外泌体和阴性对照PBS的体外成熟培养液微滴(5枚COCs/微滴)中孵育16 h,共孵育在5%CO2、38℃的培养箱中进行;将与外泌体共孵育后COCs转入4%多聚甲醛中,37℃固定15 min,PBS清洗3次转入500 μl Hoechst 33342中避光孵育5 min对细胞核进行染色;最后PBS清洗3次,在荧光显微镜下观察COCs摄入外泌体的情况。
5.外泌体处理浓度筛选实验:卵泡液外泌体使用PBS重悬并纯化后,每份外泌体样本取20 μl并加入20 μl RIRP-PMSF(100∶1)的裂解液,冰上放置20 min后,4℃条件下12 000 r/m离心10 min,取上清液20 μl使用BCA法在酶标仪上测定蛋白浓度;用IVM体外成熟培养液配制外泌体工作液,根据测定的外泌体蛋白浓度,设置不同浓度分组:0、50、100和150 μg/ml 4个浓度处理小鼠未成熟卵母细胞,每组均进行3次生物学重复试验。根据卵母细胞成熟情况确定外泌体的最佳添加浓度并用于下一步的实验。
6.研究分组:实验设置3个组,小鼠体内成熟的COCs为对照组(control)、小鼠COCs体外成熟过程中添加外泌体为添加组(exo+),COCs体外成熟过程中未添加外泌体设置为未添加组(exo-)。每组每次收集COCs约25~30枚,共3次生物学重复试验。
7.荧光定量PCR:收集各组成熟后的COCs按照试剂盒的实验步骤提取总RNA后测浓度并逆转录为cDNA作为PCR模板备用。使用荧光定量PCR的方法分别测定卵丘扩展相关基因Has2、Tnfaip6和Ptgs2以及凋亡因子Bax、Bcl2的mRNA相对表达水平,引物详情见表1。采用两步法进行PCR反应,扩增条件为:94℃预变性30 s(1个循环);扩增反应94℃ 5 s,60℃ 10 s(40个循环)。反应结束后使用2-ΔΔCt方法进行相对定量分析,以H2A.Z作为内参基因。

表1 引物序列
三、统计学分析
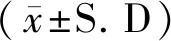
结 果
一、COCs摄入外泌体验证试验
为了验证COCs能否摄入卵泡液外泌体,我们将标记有Dio染料的外泌体在COCs体外成熟培养过程中共孵育16 h后进行拍照观察,结果显示,卵丘颗粒细胞中有Dio荧光信号,而卵母细胞中没有发现荧光信号,说明卵泡液外泌体能够被卵丘颗粒细胞摄入(图1)。
放大图中白色三角符号示Dio标记的外泌体。图1 COCs摄入外泌体验证试验
二、DOR患者不同浓度卵泡液外泌体对小鼠卵母细胞体外成熟的影响
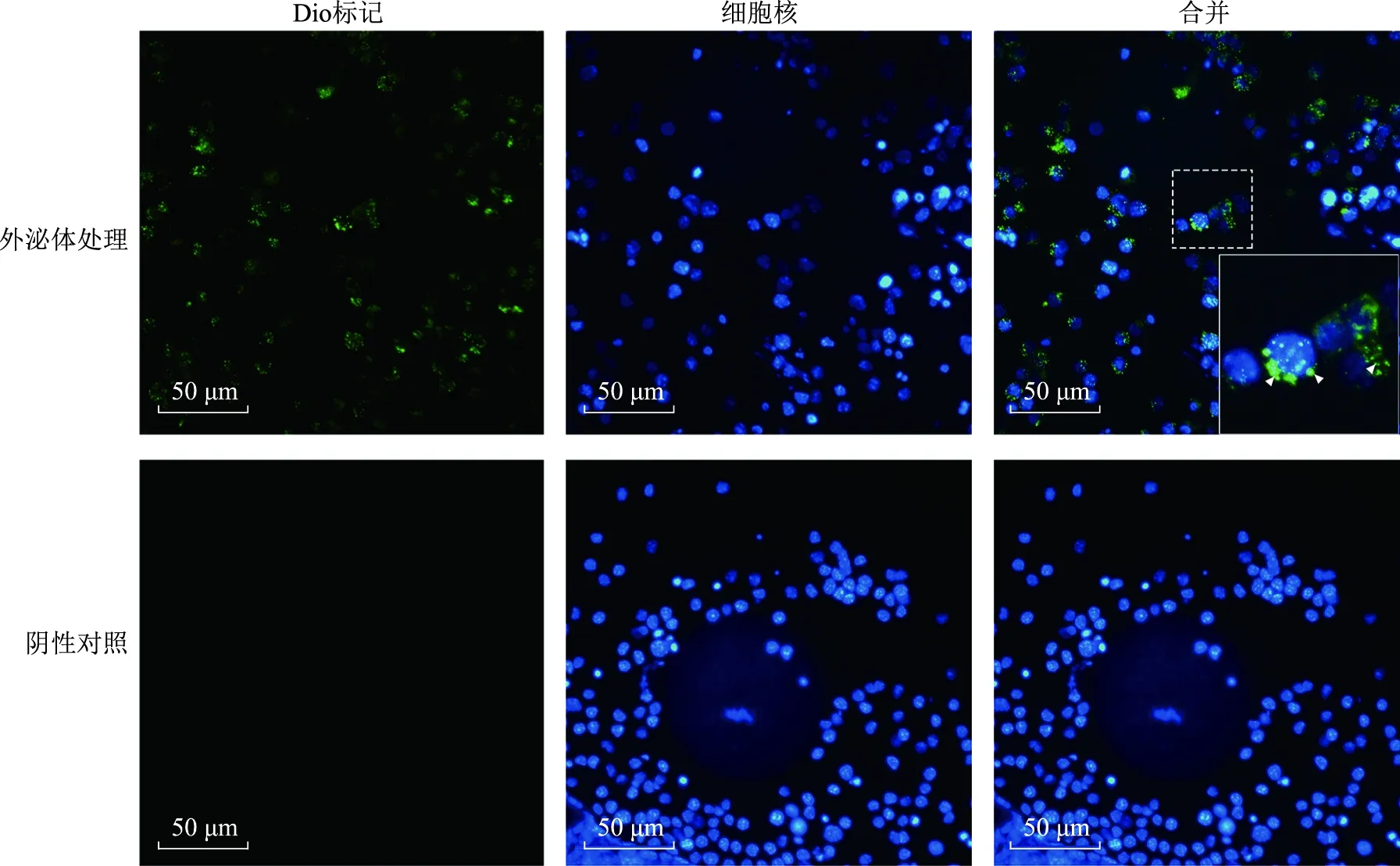
不同卵丘扩展分级情况如图2A所示。随着卵泡液外泌体添加浓度的升高,低卵丘扩展等级的卵母细胞数量逐渐增多(图2B);此外添加不同浓度外泌体处理小鼠未成熟COCs 16 h后,各添加组COCs的卵丘扩展指数显著低于0 μg/ml组(P<0.05),并且随着浓度的升高扩展指数逐渐降低(图2C)。
不同浓度外泌体处理组的GV期卵母细胞百分比均显著高于0 μg/ml组(P<0.05),而MⅡ期卵母细胞百分比均显著低于0 μg/ml组(P<0.05)。进一步分析发现随着外泌体浓度的增加,卵母细胞阻滞在GV期的比率呈显著升高的趋势,发育至MⅡ期卵母细胞的比率呈显著降低的趋势(P<0.05)。当添加浓度达到150 μg/ml,体外成熟后的GV期卵母细胞百分比显著高于0 μg/ml组,MⅡ期卵母细胞百分比则显著低于0 μg/ml组(P<0.01)(表2)。因此选择150 μg/ml作为后续实验的工作浓度。
A:卵丘扩展级别(a:0级;b:1级;c:2级;d:3级;e:4级);B:不同浓度外泌体处理组的卵丘扩展状况;C:不同浓度外泌体处理组的卵丘扩展指数比较。与0 μg/ml组比较,*P<0.05,**P<0.01。图2 卵母细胞体外成熟培养后卵丘扩展级别和卵丘扩展指数
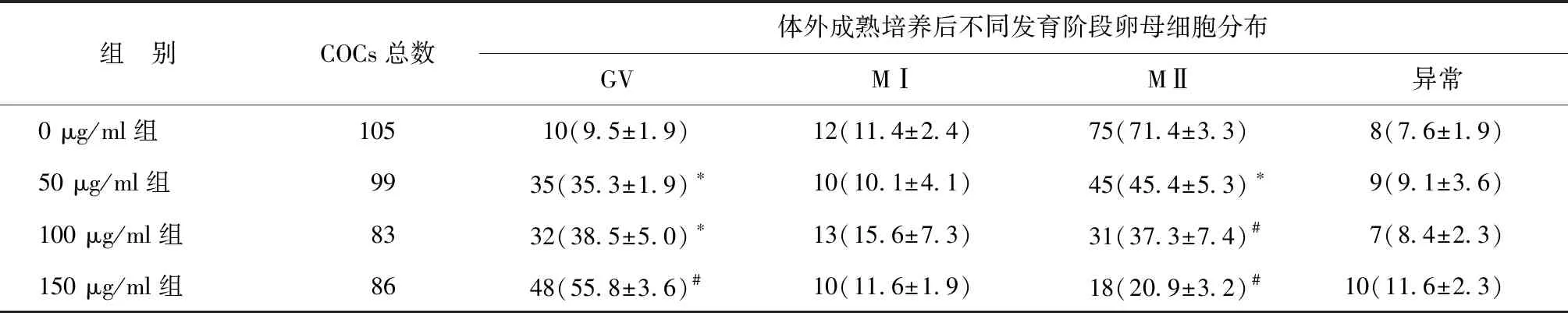
表2 不同浓度卵泡液外泌体处理对卵母细胞体外成熟的影响[n(%)]
三、外泌体对小鼠COC卵丘扩展和细胞凋亡相关基因mRNA表达水平的影响
各组小鼠COCs中卵丘扩展相关基因Has2的mRNA表达水平的差异无统计学意义(P>0.05);exo+组和exo-组的Tnfaip6、Bcl2和BaxmRNA表达水平均显著低于control组(P<0.05或P<0.01),exo+组Ptgs2的mRNA表达水平显著低于control组(P<0.05);此外,exo+组Tnfaip6、Ptgs2和Bcl2的mRNA表达水平均显著低于exo-组(P<0.05或P<0.01)(图3)。
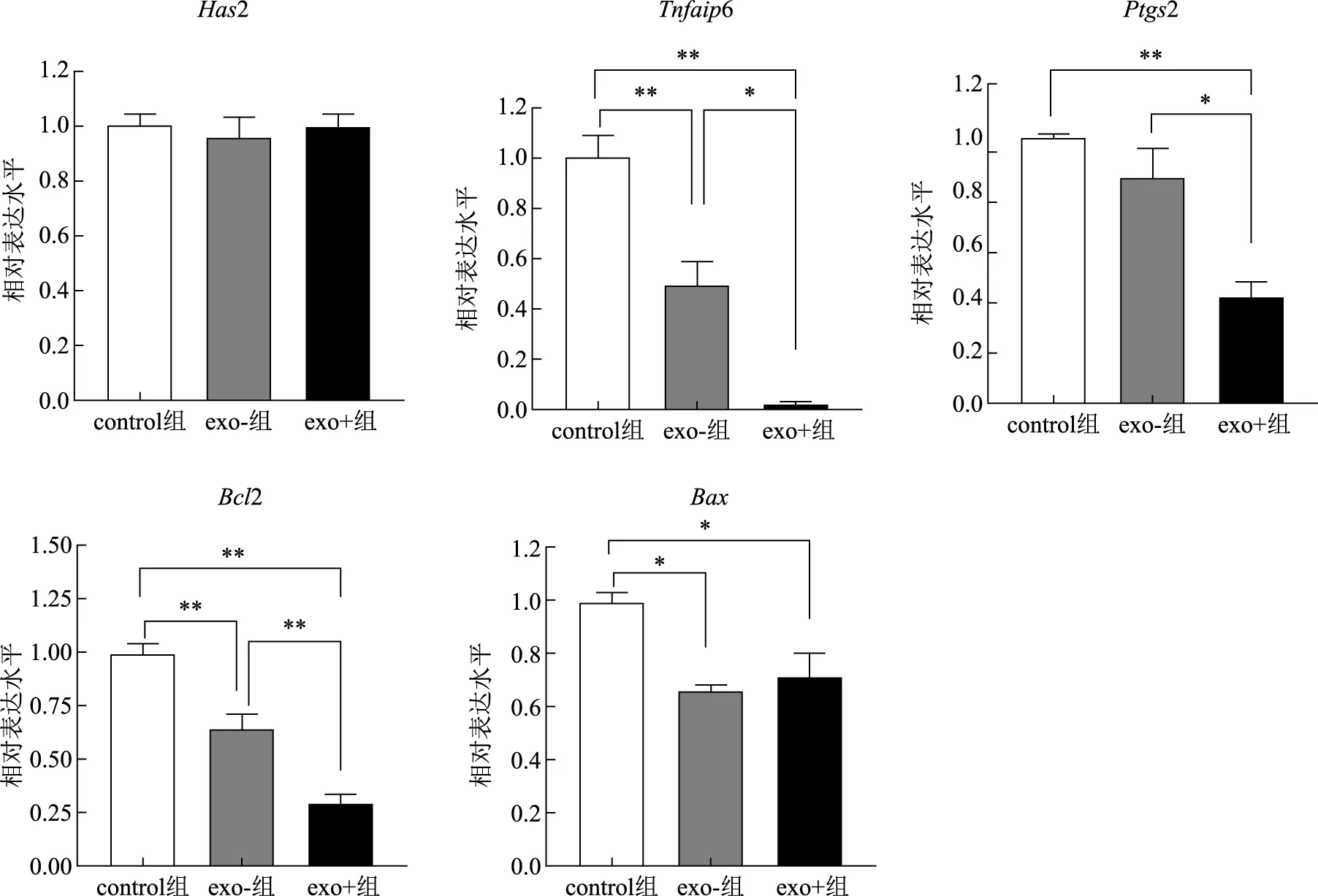
组间比较,*P<0.05,**P<0.01。图3 各组小鼠COCs中卵丘扩展和细胞凋亡相关基因mRNA表达水平
讨 论
卵巢储备功能减退患者表现为较少的卵巢储备和激素低反应,同时也存在卵母细胞发育潜能受损的现象[1,9]。卵泡液含有卵母细胞发育所需的激素、蛋白质以及转录因子等,为维持和促进卵母细胞的发育成熟物质交换和信号传递的提供微环境。因此研究卵泡液成分的传递模式有助于了解影响卵母细胞成熟和发育潜能的调控机制。外泌体作为细胞间信号交流的重要工具,对许多细胞生命活动都起到调控作用。近年来研究发现卵泡液外泌体存在特异表达的非编码RNA,辅助生殖助孕患者卵泡液外泌体存在可能与卵巢功能异常相关的微小RNA(microRNA,miRNA)和长链非编码RNA(lncRNA)差异表达谱[10-11]。我们之前的研究也发现与卵巢功能正常卵泡液样本相比,DOR卵泡液中外泌体存在差异miRNA表达谱,这种表达差异也许是影响DOR患者卵母细胞的发育潜能的原因之一[4]。本研究目的是了解DOR患者卵泡液外泌体是否对卵母细胞成熟产生影响,为此我们设计构建小鼠的卵母细胞体外成熟模型,通过与DOR患者卵泡液外泌体共孵育培养来观察卵母细胞成熟的变化。
卵丘扩展和第一极体排出是卵母细胞核和细胞质成熟的重要标志,并且与卵母细胞的受精能力和发育能力密切相关[12]。在体外环境中卵丘可以在卵泡刺激素(FSH)和表皮生长因子(EGF)的刺激下发生扩展,进而调控卵母细胞的成熟[13]。因此我们选择卵丘扩展指数作为卵泡成熟的判断指标来观察外泌体对卵母细胞成熟的影响。我们首先使用Dio荧光探针标记外泌体后与未成熟COCs共孵育培养,结果证实外泌体能够被COCs周围的卵丘颗粒细胞摄取;其次,随着外泌体浓度的升高,卵丘扩展指数呈现显著降低的趋势,同时成熟培养后阻滞在GV期的卵母细胞显著增多,发育至MⅡ期的卵母细胞显著减少。这提示我们DOR卵泡液外泌体的加入影响了卵丘的扩展,并阻碍了卵母细胞的核成熟。Hung等[14]认为成熟卵泡的卵泡液外泌体可以支持卵丘颗粒细胞的扩展。临床研究中也发现PCOS患者和子宫内膜异位症患者的卵母细胞卵丘扩展能力减低、获卵数减少[15-16]。据此我们推测DOR患者卵泡液外泌体中含有阻碍卵丘扩展的和卵母细胞成熟的相关因子。
卵丘扩展受到多种酶和细胞因子的调控,其中乙酰透明质酸合酶2(HAS2)、前列腺素合成酶2(PTGS2)和肿瘤坏死因子诱导蛋白6(TNFAIP6)等是卵丘基质形成和卵丘扩展维持的主要调控因子。为了进一步了解DOR卵泡液外泌体是否对卵丘颗粒细胞扩展相关的基因起到抑制作用,我们检测了与外泌体共孵育COCs中相关基因mRNA表达水平的变化。qPCR的结果发现,与体内成熟的COCs相比,外泌体处理的COCs中Ptgs2和Tnfaip6表达水平均显著降低。据文献报道人卵丘颗粒细胞中Has2影响着卵母细胞的发育潜能,Has2表达较高的卵母细胞受精后发育至囊胚的几率更高,反之则容易阻滞在卵裂胚阶段[17];卵巢组织中过高的Has2表达会通过TGF-β1、VEGF及 NF-κB等信号通路作用造成PCOS大鼠卵巢颗粒细胞增殖失控[18]。Yang等[19]通过生物信息学分析发现PCOS患者卵丘颗粒细胞中Has2表达下调,Has2可能是PCOS导致的排卵障碍潜在的治疗靶点和诊断生物标记。我们使用DOR卵泡液外泌体处理小鼠COCs后发现Has2的表达没有显著变化,提示外泌体可能没有携带影响Has2的表达调控的因子。Ptgs2、Tnfaip6都是参与维持卵丘颗粒细胞间基质的形成促进卵丘扩展的关键分子。相关研究指出,促进Ptgs2和Tnfaip6的表达能够有效提高体外成熟及随后的胚胎发育效果[20-22]。子宫内膜异位症患者的颗粒细胞中Ptgs2的表达与正常对照相比显著降低,抑制了卵丘扩展从而导致患者获卵数降低[16]。卵泡液外泌体也参与卵丘扩展的调控,Hung等[14]发现从直径>9 mm的牛成熟卵泡中提取的卵泡液外泌体能够促进小鼠和牛体外成熟卵母细胞卵丘扩展和相关基因的表达。我们发现DOR卵泡液外泌体能显著抑制小鼠COCs中Ptgs2和Tnfaip6基因的表达,这提示外泌体可能携带了Ptgs2和Tnfaip6基因的抑制因子从而导致COCs卵丘扩展的缺陷。这可能是卵巢因素相关不孕症患者卵母细胞成熟度和发育潜能较低的原因之一,具体的调控机制值得我们进一步深入研究。
颗粒细胞的凋亡同样影响着卵母细胞卵丘扩展和成熟。Bcl2及Bax是细胞凋亡抑制/促进经典的标志基因,Bax的过度表达可拮抗Bcl2的保护效应而使细胞趋于死亡。我们检测了小鼠COCs中Bcl2及Bax的表达情况,发现外泌体抑制了体外成熟小鼠COCs中Bcl2的表达;而外泌体处理并没有影响小鼠COCs的Bax表达。Bcl2及Bax对颗粒细胞的凋亡调控作用影响卵母细胞的成熟状态和发育潜能[23],在卵巢功能相关的疾病研究中,PCOS患者卵巢窦卵泡中颗粒细胞Bcl2表达下调会引起颗粒细胞凋亡增多[24];卵巢功能不全患者经药物处理后颗粒细胞Bcl2表达上调、Bax表达下调,减少了细胞的凋亡从而改善了卵巢储备功能[25]。此外,很多研究也证实外泌体能通过转移非编码RNA来调控细胞中Bcl2的表达,Deng等[26]发现间充质干细胞外泌体携带的长链非编码RNA LINC00461通过靶向抑制miR-15a/miR-16表达,促进Bcl2的表达,诱导多发性骨髓瘤细胞的增殖并抑制细胞凋亡;C26癌细胞系分泌的外泌体可通过转移miR-195a-5p/miR-125b-1-3p对Bcl2的负调控作用促进了细胞凋亡,从而诱导了结肠癌恶病体质引起的骨骼肌萎缩的发生过程[27]。综上所述,我们推测DOR卵泡液外泌体通过调控Bcl2介导的颗粒细胞凋亡调控过程,并且造成卵丘扩展和卵母细胞成熟阻滞。
本研究发现DOR患者卵泡液外泌体能够抑制小鼠卵母细胞体外成熟过程中卵丘扩展和减数分裂恢复的现象,并且对卵丘扩展相关基因Ptgs2和Tnfaip6和细胞凋亡抑制基因Bcl2产生了显著的抑制效果;据此推测DOR患者卵泡液中外泌体可能通过转移miRNA调控卵丘扩展和颗粒细胞凋亡相关基因的表达。我们今后将进一步挖掘外泌体非编码RNA的作用机制,为卵巢储备功能减退和卵母细胞发育潜能降低所致不孕患者的诊疗提供新的思路。
