NNMT在大肠腺癌与大肠腺瘤的表达对比及对大肠腺癌短期生存的影响*
2022-10-19王超陈见苏刘兰仔
王超 陈见苏 刘兰仔
当前研究认为,肿瘤的发生发展属于一个较为复杂的过程与阶段,实际是由各类肿瘤相关基因表达失常或诸多肿瘤抑制基因失活引起,因此,在临床工作中若需要了解整个肿瘤癌变过程中的基因表现以及基因动态改变,则需要研究整个基因组在癌症进展过程中的改变及其所带来的基因表达动态变化[1-2]。在既往的临床工作中,采用了基因芯片对肾癌及其癌旁组织进行了相应的大规模基因筛查试验及相关研究,发现烟酰胺N-甲基转移酶(NNMT)在肾癌等组织中呈现出较高的表达水平,且其表达水平明显高于周围正常组织[3]。同时有研究对NNMT在各类消化系统癌症疾病中的研究进行分析发现,NNMT在诸多肿瘤组织中也呈现出异常升高的改变水平,且与癌旁组织相比明显升高[4]。本研究就NNMT在大肠腺癌与大肠腺瘤的表达及大肠腺癌的预后进行分析,旨在为疾病的治疗及预后判断提供可靠依据,现报告如下。
1 资料与方法
1.1 一般资料
选取2017年2月-2019年2月福建省立医院南院外科手术或内镜下取材的正常大肠黏膜、大肠腺瘤及大肠腺癌各50例。纳入标准:患者因疑似大肠病变来院接受检查;生命体征平稳,认知功能正常;具有完整的临床资料。排除标准:合并其他类型的肿瘤性疾病、消化系统疾病;对本研究试验不耐受或持反对态度。正常大肠黏膜组,男28例,女22例;年龄20~72岁,平均(56.25±4.12)岁。大肠腺瘤组,男27例,女23例;年龄22~73岁,平均(56.80±4.02)岁。大肠腺癌组,男26例,女24例;年龄23~70岁,平均(56.10±4.92)岁。三组一般资料相比,差异均无统计学意义(P>0.05),具有可比性。本次试验符合医学伦理会审核批准,患者知情同意本次试验。
1.2 方法
采用S-P免疫组化技术对NNMT进行检测,方法:将正常大肠黏膜、大肠腺瘤及大肠腺癌组织留取部分标本放入福尔马林溶液中,将其送病理检查由此进一步对病理类型进行判断,将其余剩下的组织修剪成大小为 0.2 cm×0.2 cm×0.5 cm 的组织块,使用生理盐水对其反复冲洗3次以尽可能地去除残留的粪质及血凝块,分块后放入EP管内转入液氮罐中保存备用[5]。PT-PCR对各标本中NNMT mRNA的表达情况进行测量,首先利用Trizol法对组织中的总RNA进行提取,随后应用紫外分光光度计法对定量RNA进行测量。按照逆转录试剂盒的说明对cDNA进行合成,并进行逆转录反应,在37 ℃的环境中进行15 min的反应,随后进行逆转录酶的失活反应,反应需要在5 ℃环境中进行5 s。从基因GeneBank中查找出相关的引物序列进行RT-PRC反应,反应条件为:95 ℃环境中进行预变形10 s,1 Cycle,PCR 反应为 95 ℃,5 s,85 ℃,反应 20 s,40 Cycle,融解曲线为 55 ℃,80 Cycle。PCR 产物的定性条件:取PCR的产物2 μl放置在2.5%琼脂糖凝胶中进行电泳,之后采用全自动凝胶成分分析系统对其拍照,将NNMT/β-actin比值×100作为NNMT mRNA的相对表达量。Westem-blot对上述各个标本中的NNMT蛋白的表达情况进行检测,具体操作:将组织剪碎后,向其加入细胞裂解液对其充分裂解,该裂解操作需要在冰上操作进行;随后进行离心处理,离心速度为12 000 r/min,共离心15 min,提取血清后转移到新管中,采用BCA法对NNMT蛋白含量进行测量[6]。使用40 μg的蛋白质作为上样量,常规SDS聚丙烯酰胺凝胶实施封闭处理。将人NNMT多克隆抗体,小鼠抗人β-actin抗体作为一抗,将山羊抗兔IgG及山羊抗小鼠作为二抗。ECL发光,X线胶片感光,将自动洗片机进行洗片,检测NNMT蛋白的表达水平,采用全自动凝胶成像系统测定各个组别的蛋白电泳积分光度值,NNMT/β-actin比值代表NNMT蛋白相对表白量[7]。
1.3 观察指标
对比NNMT mRNA及其蛋白在正常大肠黏膜组、大肠腺瘤组及大肠腺癌组组织中相对表达量,分析NNMT表达与大肠腺癌临床病理因素的关系,对比不同NNMT表达情况下大肠腺癌患者短期生存率。
1.4 统计学处理
采用SPSS 22.0软件对所得数据进行统计分析,计量资料用(±s)表示,多组比较采用方差分析,两两组间比较采用LSD-t检验;计数资料以率(%)表示,比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 NNMT mRNA及其蛋白在各个组织中相对表达量对比
三组NNMT mRNA及其蛋白表达量相比,差异均有统计学意义(P<0.05);大肠腺瘤组、大肠腺癌组NNMT mRNA及其蛋白表达量均高于正常大肠黏膜组,大肠腺癌组NNMT mRNA及其蛋白表达量均高于大肠腺瘤组,差异均有统计学意义(P<0.05),见表1。
表1 NNMT mRNA及其蛋白在各个组织中相对表达量对比(±s)
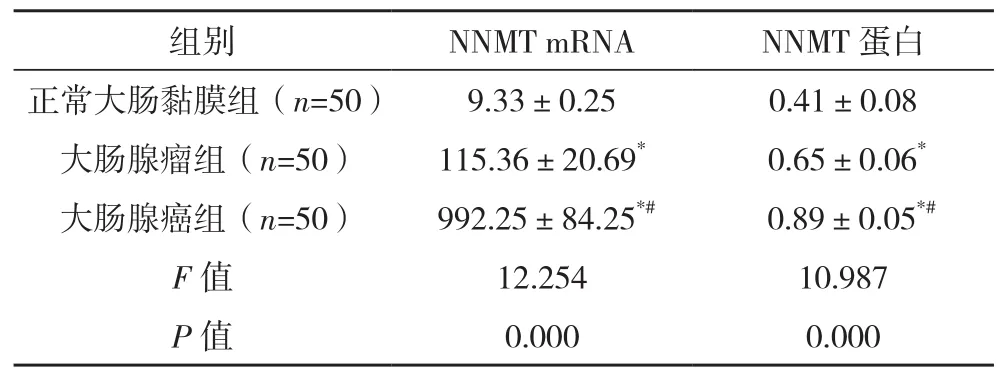
表1 NNMT mRNA及其蛋白在各个组织中相对表达量对比(±s)
*与正常大肠黏膜组比较,P<0.05;#与大肠腺瘤组比较,P<0.05。
组别 NNMT mRNA NNMT 蛋白正常大肠黏膜组(n=50) 9.33±0.25 0.41±0.08大肠腺瘤组(n=50) 115.36±20.69* 0.65±0.06*大肠腺癌组(n=50) 992.25±84.25*# 0.89±0.05*#F值 12.254 10.987 P值 0.000 0.000
2.2 NNMT表达与大肠腺癌临床病理因素的关系
不同NNMT表达情况大肠癌患者的淋巴结转移情况、Dukes分期、组织学类型及浸润深度比较,差异均无统计学意义(P>0.05);不同NNMT表达情况大肠癌患者的组织学分级比较,差异有统计学意义(P<0.05),见表 2。
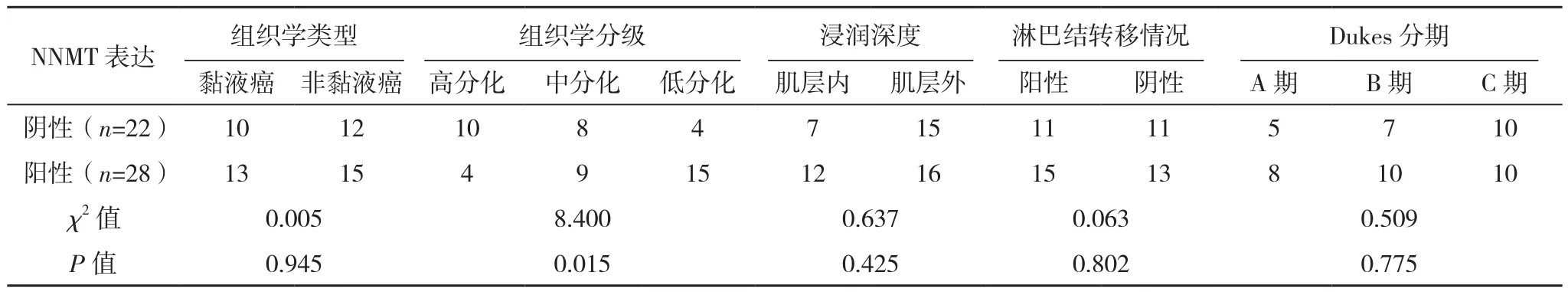
表2 NNMT表达与大肠腺癌临床病理因素的关系(例)
2.3 不同NNMT表达情况大肠腺癌患者短期生存期对比
大肠腺癌患者均接受为期3年的随访,NNMT阳性表达患者3年生存率为50.00%(14/28),低于NNMT阴性表达患者的90.91%(20/22),差异有统计学意义(χ2=9.475,P=0.002)。
3 讨论
大肠腺癌作为临床上一类较为常见的恶性肿瘤性疾病,近年来随着社会的不断发展,诱发因素的不断增多,发病率也呈现不断升高的趋势,同时据报道显示,超过80%的大肠腺癌患者多由腺瘤性息肉不断恶变及进展而来[8]。也有临床资料显示,肿瘤的发生发展属于一个比较复杂且变化较快的过程,实际上是由多种肿瘤的相关基因表达或抑癌基因失去活性所致[9]。因此,采取科学有效的指标评价大肠腺瘤的发生发展及对大肠腺癌病情的影响具有重要的临床意义。寻找并探讨克隆相关基因是一个世界范围的重要课题。既往临床资料显示,NNMT最早在1994年于肝脏组织内发现的一种新型物质,被证实与肝癌细胞的克隆与复制具有密切的相关性,随后发现其基因位于11号染色体的短臂,其由三个外显子及两个内含子构成,因此所编码的mRNA分子长度为952个核苷酸,分子量为29.6 KD[10-11]。在既往报道中发现,NNMT与各类疾病间均具有密切的关系,不过这些研究进行的帕金森与NNMT的分析相对较多。近年来,随着对大肠腺癌研究的不断深入,发现NNMT与癌症的发生发展具有密切的相关性,同时发现NNMT在甲状腺癌组织中的表达水平明显高于癌旁组织,不过关于NNMT与甲状腺癌发病机制之间相关研究仍然较少[12]。随后有研究开始就NNMT在大肠腺癌中的表达水平进行分析,发现NNMT多在大肠腺癌的患者中以分泌型的形式存在,也被认为是大肠腺癌的一种血清标志物,但具体发病机制也仍值得分析与探讨[13]。
在本次研究中,就NNMT在大肠腺瘤和大肠癌中的表达及与大肠腺癌的预后分析,结果显示,三组NNMT mRNA及其蛋白表达量相比,差异均有统计学意义(P<0.05);大肠腺瘤组、大肠腺癌组NNMT mRNA及其蛋白表达量均高于正常大肠黏膜组,大肠腺癌组NNMT mRNA及其蛋白表达量均高于大肠腺瘤组,差异均有统计学意义(P<0.05)。NNMT mRNA在大肠腺癌患者中会表现出较高的表达水平,结果显示随着大肠黏膜上皮细胞损害,腺瘤向着腺癌的进展过程中也会开始出现NNMT表达水平升高的情况,由此也进一步说明了NNMT的高表达会在腺瘤性息肉中存在,这也证实了NNMT的高表达可能是导致大肠腺癌发生发展的一个重要的机制,也可被认为是导致腺瘤向着腺癌转化的作用,与既往研究报道基本一致[14]。同时,本研究就NNMT表达与大肠腺癌临床病理因素的关系进行分析,不同NNMT表达情况大肠癌患者的组织学分级情况比较,差异有统计学意义(P<0.05)。大肠腺癌组织分级越低,细胞凋亡调控机制障碍程度较高,癌细胞增殖情况越强,病情越重,NNMT表达水平就越高,患者的预后表现也就越差[15]。另外,大肠腺癌患者均接受了为期3年的随访,NNMT阳性表达患者3年生存率为50.00%(14/28),低于NNMT阴性表达患者的90.91%(20/22),差异有统计学意义(P<0.05)。结果可见,NNMT阳性表达患者的预后情况相对较差,证实了上述研究。不过由于本次研究样本量较少,随访时间有限,在收集数据上可能存在缺陷,在接下来的研究中可深入分析。
综上所述,NNMT在大肠腺瘤与大肠腺癌组织中的表达存在明显的差异性,NNMT阳性表达患者的短期生存率较低。
