外源保幼激素对异色瓢虫卵巢发育及生殖相关基因转录水平的影响
2022-10-18冯朝阳何运转
韩 慧, 冯朝阳, 张 硕, 何运转
(河北农业大学植物保护学院, 河北保定 071000)
异色瓢虫Harmoniaaxyridis属鞘翅目(Coleoptera)瓢虫科(Coccinellidae),是重要的捕食性天敌昆虫之一,对多种害虫具有良好的生物防治效果(王东昌等, 2001; Koch, 2003; 王媛等, 2015; 巫鹏翔等, 2017)。天敌昆虫规模化繁育是生物防治的关键环节之一,而利用自然猎物进行饲养扩繁受高成本限制,因此人工饲料的研究及应用尤为重要(Coudronetal., 2002; 徐学农和王恩东, 2007)。研究发现以猪肝为原料的人工饲料可以使异色瓢虫完成世代发育,但存在产卵前期延长和产卵量低等生殖障碍(郭建英和万方浩, 2001; 李辰新等, 2017)。路玉婷(2016)研究发现,异色瓢虫取食添加保幼激素(juvenile hormone, JH)类似物的饲料后,可提升成虫生殖能力,如卵巢发育加快、交配次数多和产卵量增多等现象。
研究表明JH受体methoprene-tolerant (Met)和下游转录因子krüppel homolog 1 (Kr-h1)在JH调控昆虫生殖和卵黄发生过程中发挥重要作用(Royetal., 2018; Wuetal., 2021)。通过RNA干扰技术发现在蝗虫类(Songetal., 2014; Gijbelsetal., 2019, 2020)、飞虱类(Linetal., 2016; Huetal., 2019)、蝇类(Yueetal., 2018)、蛾类(Miaoetal., 2020)和瓢虫类(Huangfuetal., 2021)等昆虫中Met或Kr-h1基因的缺失抑制了卵黄原蛋白(vitellogenin, Vg)和卵黄原蛋白受体(vitellogenin receptor, VgR)基因转录水平,延缓卵巢发育,并显著降低了产卵量。这些发现表明JH信号通路上关键基因(Met和Kr-h1)在昆虫繁殖中的关键作用。Liu等(2019)将15 μg的JH类似物注射到新羽化的滞育性大猿叶虫Colaphellusbowringi雌成虫体内,结果表明JH通过Met-Kr-h1通路诱导VgR的转录,VgR是卵黄原蛋白(Vg)摄取和生殖发育所必需的。由此可见,Met,Kr-h1,Vg和VgR在JH调控雌性昆虫生殖过程中占据重要地位。
本课题组前期未发表数据表明异色瓢虫卵黄发生主要由体内JH进行调控,但从分子层面研究其对异色瓢虫雌成虫Met,Kr-h1,Vg和VgR基因转录水平的影响未见报道。鉴于此,本研究通过对取食人工饲料的异色瓢虫雌成虫点滴不同剂量的JHⅢ之后,采用解剖学和qPCR的方法分别进行卵巢发育和生殖相关基因转录水平的研究,以期了解靶标基因是否参与JH调控通路,为探究JH在异色瓢虫生殖调控分子机制以及规模化人工饲料扩繁异色瓢虫提供一定的理论依据。
1 材料与方法
1.1 供试昆虫
异色瓢虫为室内饲养的种群,在人工气候箱内以温度25±1℃,相对湿度65%±5%,光周期16L∶8D的条件下,使用萝卜蚜Lipaphiserysimi进行饲养,待其成虫产卵后,选择发育整齐的初孵幼虫备用。按照本课题组室内以猪肝为原料的人工饲料配方进行饲养初孵幼虫(陈洁, 2011),每日更换饲料直至成虫羽化。随后将同日龄的成虫按照雌雄1∶1比例进行配对。分别置于一次性塑料圆盒里(半径5 cm,高6 cm)饲养,并每天更换新饲料。饲养温度为25±1℃,相对湿度为65%±5%,光周期为16L∶8D。选取羽化后第2天的雌成虫作为供试昆虫。
1.2 主要试剂
JHⅢ(65%)购自美国Sigma公司;总RNA提取试剂盒RNAprep Pure Tissue Kit购自天根生化科技(北京)有限公司;cDNA反转录试剂盒PrimeScriptTMRT Reagent Kit with gDNA Eraser购自TaKaRa公司;Fast Super EvaGreen®qPCR Master Mix试剂购自苏州宇恒生物科技有限公司。
1.3 JHⅢ处理后异色瓢虫雌成虫卵巢发育观察
用丙酮将JHⅢ溶解成2 mg/mL的母液,以本课题组前期筛选的JHⅢ浓度为参考(未发表数据),再用丙酮稀释母液至浓度为160, 240和320 ng/μL的稀释液备用。当异色瓢虫雌成虫羽化后第2天在其腹部第1-2节节间点滴0.5 μL的不同浓度JHⅢ,相当于每头雌成虫点滴JHⅢ为80, 120和160 ng/头。点滴后1, 3, 5, 7和9 d的雌成虫于Ringer’s生理盐水里进行解剖,并将卵巢置于载玻片上,利用SteRE0 Discovery.V20体视显微镜(ZEISS,德国)拍照并测量卵巢长度,并进一步测量处理后5, 7和9 d的卵巢第一卵室的长度和宽度,每个处理下每个时间点解剖10~15头。空白对照组为萝卜蚜饲喂的雌成虫,溶剂对照组为点滴同体积丙酮溶液的雌成虫。溶剂对照组和不同浓度JHⅢ处理组点滴处理后均按1.1节方法用人工饲料继续饲养。
1.4 最适剂量JHⅢ处理后雌成虫生殖信号通路中关键基因表达水平检测
根据异色瓢虫转录组数据库(未发表),已成功鉴定得到了HaMet(GenBank登录号: MH619532),HaKr-h1(GenBank登录号: MK629763),HaVg(HaVg1和HaVg2 GenBank登录号分别为KY933792和KY794939)和HaVgR(GenBank登录号: MG787232)。基于不同剂量JHⅢ处理后卵巢发育情况,选取1.3节120 ng/头处理后1, 5和9 d的雌成虫整虫进行靶标基因表达水平分析,对照组为点滴同体积丙酮溶液的雌成虫整虫。每个处理3次重复,每个重复1头试虫。按照总RNA提取试剂盒RNAprep Pure Tissue Kit说明书分别提取每个样品总RNA,使用1.0%琼脂糖凝胶电泳和紫外分光光度计检测RNA的完整性和浓度。按照cDNA反转录试剂盒PrimeScriptTMRT Reagent Kit with gDNA Eraser的要求,以上述总RNA为模板合成cDNA第1链。
根据qPCR引物设计要求,利用DNAMAN软件设计靶标基因的定量引物(表1),并用已报道的异色瓢虫HaEF1为内参基因(Liangetal., 2019)。每个处理3次重复,每个重复1头试虫。每样品技术重复3次。qPCR反应体系: Fast Super-EvaGreen®qPCR 10 μL, 正反向引物(10 mmol/L)各0.5 μL, cDNA模板1 μL, ddH2O水补足至20 μL。利用Bio-Rad CFX96荧光定量PCR仪进行程序扩增,反应程序: 95℃预变性2 min; 95℃变性5 s, 56℃退火30 s, 72℃延伸30 s,共40个循环,最后以每5 s上升0.5℃的速度从65℃到95℃记录熔解曲线,通过2-ΔΔCt方法进行相对定量数据分析(Livak and Schmittgen, 2001)。
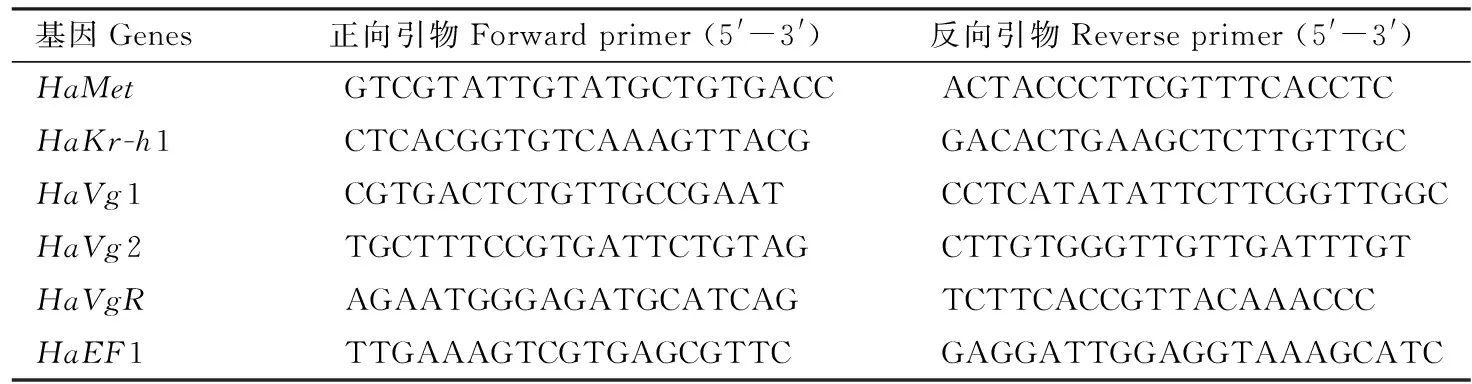
表1 引物信息Table 1 Primer information
1.5 数据分析
采用SPSS19.0软件(IBM, Armonk, NY, 美国)对实验数据进行统计分析,卵巢长度以及第一卵室长度和宽度使用单因素方差(oneway ANOVA)分析中的Tukey氏多重检验进行各组之间的显著性分析,靶标基因表达量采用Student氏t检验分析差异显著性;利用GraphPad Prism 8.0(GraphPad, San Diego, California, 美国)软件制图。
2 结果
2.1 不同剂量JHⅢ对异色瓢虫卵巢发育的影响
由图1可知,在不同剂量JHⅢ处理异色瓢虫羽化后第2天雌成虫后1 d时卵巢中卵室出现,尚无卵黄沉积,与点滴丙酮的溶剂对照组相比,80和120 ng/头JHⅢ处理后卵巢发育加快,处理后5 d卵巢管基部浑浊,开始有少量卵黄沉积,处理后7 d卵巢中出现大量卵黄沉积,处理后9 d卵巢整体亮黄色,大量成熟卵出现,而160 ng/头JHⅢ处理下,卵巢中只出现卵泡,并无明显的卵黄沉积现象。120 ng/头JHⅢ处理7和9 d时卵巢发育状态与萝卜蚜饲喂的空白对照组的相似。
对不同剂量JHⅢ处理后1, 3, 5, 7和9 d的异色瓢虫雌成虫的卵巢长度进行测量分析,发现卵巢长度均随着处理时间的增加而持续变长,溶剂对照组、80和160 ng/头JHⅢ处理9 d雌成虫卵巢长度最长,分别为2.08, 2.00和2.01 mm;而萝卜蚜饲喂组和120 ng/头JHⅢ处理7 d卵巢长度出现值峰,分别为2.39和2.57 mm,均高于溶剂对照组,其中120 ng/头JHⅢ处理下卵巢长度显著高于溶剂对照组(P<0.05)(表2)。
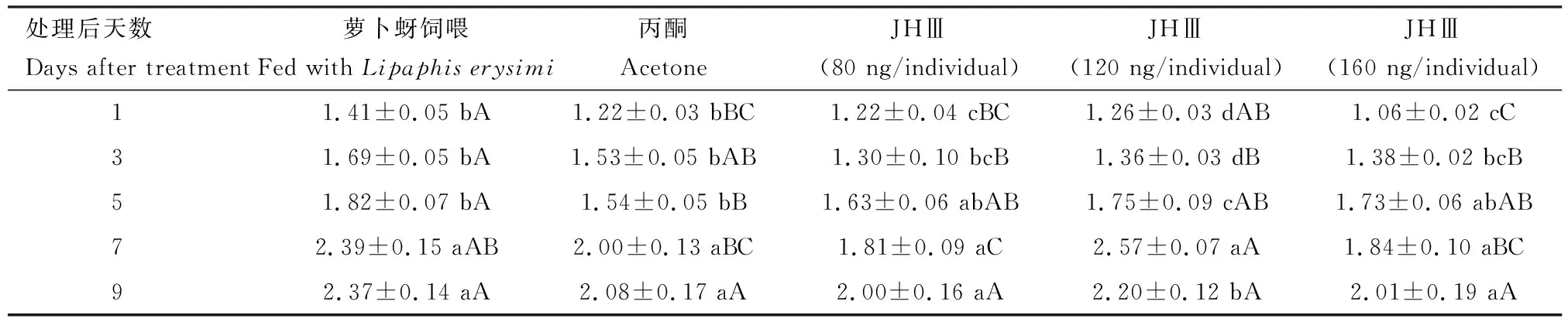
表2 不同剂量JHⅢ处理后不同天数对异色瓢虫雌成虫卵巢长度(mm)的影响Table 2 Effects of different doses of JHⅢ on the ovarian length (mm) of female adultsof Harmonia axyridis at different days after treatment
对不同剂量JHⅢ处理后不同天数的异色瓢虫雌成虫卵巢第一卵室的长度和宽度分别进行了测量,结果表明,120 ng/头JHⅢ处理下第一卵室长度和宽度均高于萝卜蚜饲喂的空白对照组和溶剂对照组,其中处理后5和7 d时有显著差异(P<0.05);160 ng/头JHⅢ处理9 d时雌成虫第一卵室长度和宽度均显著低于其他处理组的(P<0.05)(表3和4)。
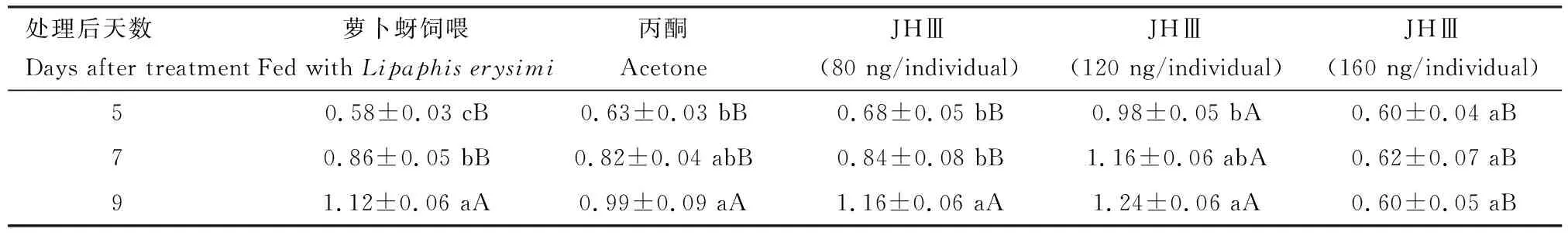
表3 不同剂量JHⅢ处理后不同天数对异色瓢虫雌成虫第一卵室长度(mm)的影响Table 3 Effects of different doses of JHⅢ on the first egg chamber length (mm) of female adultsof Harmonia axyridis at different days after treatment
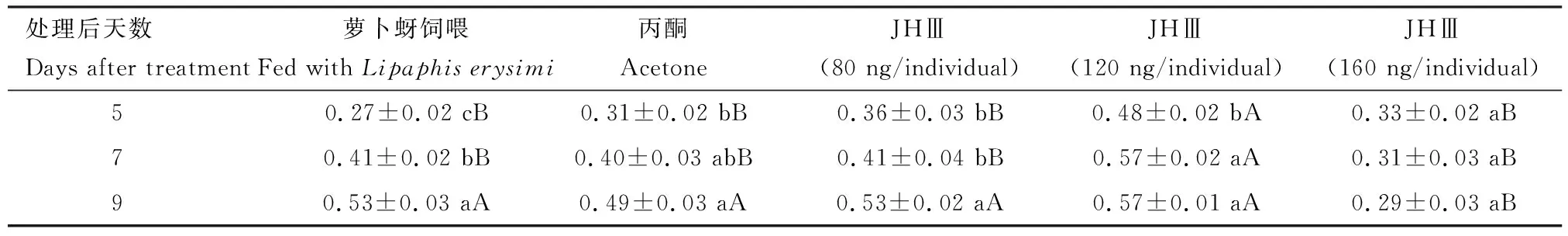
表4 不同剂量JHⅢ处理后不同天数对异色瓢虫雌成虫第一卵室宽度(mm)的影响Table 4 Effects of different doses of JHⅢ on the first egg chamber width (mm) of female adultsof Harmonia axyridis at different days after treatment
2.2 JHⅢ对异色瓢虫生殖相关基因表达水平的影响
与对照组(丙酮处理组)比较,120 ng/头JHⅢ处理后1 d异色瓢虫雌成虫中HaMet基因表达量无显著差异(P>0.05),处理后5和9 d雌成虫中HaMet的表达量极显著上调,分别为对照组的2.78和2.36倍(P<0.01)(图2: A);120 ng/头JHⅢ处理1, 5和9 d的异色瓢虫雌成虫HaKr-h1的表达量高于对照组,但无显著差异(P>0.05),分别为对照组的1.66, 1.02和1.70倍(图2: B)。
120 ng/头JHⅢ处理下异色瓢虫生殖基因HaVg1,HaVg2和HaVgR表达水平趋势整体相似,处理后1 d异色瓢虫雌成虫HaVg1,HaVg2和HaVgR的表达量分别下调91.47%, 64.24%和62.41%,与对照组有极显著差异(P<0.01);处理后5 d雌成虫HaVg1,HaVg2和HaVgR的表达量极显著增加(P<0.01),分别是对照组的13.14, 21.48和8.28倍;处理后9 d雌成虫HaVg1,HaVg2和HaVgR的表达量高于对照组,其中HaVg1和HaVgR的表达量极显著上调(P<0.01),分别约为对照组的1.85和2.01倍(图3: A, B, C)。
3 讨论
目前,饲喂人工饲料是异色瓢虫大量扩繁的主要饲养方法之一,但取食该饲料后无法满足异色瓢虫产卵需求,导致其生殖力下降(陈洁, 2011; 李辰新等, 2017)。本研究发现,在人工饲料饲喂异色瓢虫雌成虫基础上点滴80和120 ng/头JHⅢ后卵巢发育明显加快,其中120 ng/头JHⅢ处理后7 d雌成虫卵巢长度和第一卵室长宽度均显著高于点滴丙酮的对照组(P<0.05)(表2~4),达到萝卜蚜饲养条件下卵巢发育状态,而高剂量(160 ng/头)则抑制卵巢发育,结果表明JHⅢ剂量为120 ng/头对卵巢发育表现为正效应,而160 ng/头可能超出异色瓢虫接受阈值表现为负效应。Gao等(2022)通过点滴2 μL保幼激素类似物甲氧普烯(15 μg/μL)于生殖滞育的异色瓢虫雌虫体表之后,发现卵巢发育加快以及卵泡长度显著增加,使其达到正常生殖状态,验证了外源保幼激素类似物可在一定程度上影响卵巢发育。
为进一步了解JH对异色瓢虫生殖的调控机制,本实验利用qPCR技术从分子水平检测了JH信号调控通路上的关键基因表达水平,结果发现120 ng/头JHⅢ处理后异色瓢虫雌成虫体内HaMet,HaKr-h1,HaVg1,HaVg2和HaVgR的表达量与对照组有所差异(图2和3)。这些差异表现在JHⅢ处理后1 d的异色瓢虫雌成虫HaMet,HaVg1,HaVg2和VgR的表达量低于对照组,其中HaVg1,HaVg2和HaVgR的表达量极显著低于对照组(P<0.01),卵巢处于卵黄未沉积状态(图1);处理后5和9 d的雌成虫HaMet,HaKr-h1,HaVg1,HaVg2和HaVgR的表达量上调,卵巢分别处于卵黄开始沉积和卵黄大量沉积状态(图1~3),推测上述靶标基因在JH调控卵巢发育中发挥重要作用,且这些基因表达量均呈上调趋势方可促进卵巢卵黄生成。在沙葱萤叶甲Galerucadaurica成虫3或5日龄注射浓度为2.5 μg/μL剂量的JH类似物后前4或6 d,GdMet,GdKr-h1和GdVg的表达量均呈显著上调趋势,表明JH对其信号通路上相关基因和生殖基因的表达有正向调节作用(Maetal., 2021a, 2021b)。Yue等(2018)研究发现JH类似物处理后显著诱导桔小实蝇Bactroceradorsalis的JH信号通路中Met和Kr-h1基因的上调表达和Vg基因的转录,进而促进卵巢发育。这些结果表明,外源性JH及其类似物(JH analogues, JHAs)可以发挥内源性JH的作用,并可能直接作用于JH受体进而调控昆虫生殖行为(Huangetal., 2018)。在雄性昆虫中也发现JH可调控相关基因表达量,如将JHII注射到小地老虎Agrotisipsilon初羽化的雄成虫体内,可诱导Met1,Met2和Kr-h1等基因的转录,使雄性附腺的长度增加(Gassiasetal., 2021)。这些结果表明,JH对其信号通路上相关基因和生殖基因的表达在昆虫中相对保守。
本研究同时也发现外源JHⅢ处理异色瓢虫雌虫后第5天,HaVg1和HaVg2的表达量极显著增加(P<0.01)(图3: A, B)。Parthasarathy等(2010)发现在赤拟谷盗Triboliumcastaneum雌性卵黄发生前期用10 μg/μL JHⅢ处理后Vg2 mRNA表达量是对照组(丙酮处理组)的9倍。七星瓢虫Coccinellaseptempunctata在取食基础人工饲料的雌成虫点滴和喂食ZR-512保幼激素类似物,Vg的合成在高峰期比取食人工饲料对照组分别增加44倍和67倍,JH对Vg合成有明显的促进作用,并作用于转录水平(张建中和翟启慧, 1985)。15 μg的JHA对处于生殖滞育中的大猿叶虫C.bowringi卵巢发育具有促进作用,同时在JHA诱导24 h后,Vg1和Vg2的mRNA水平都增加了10倍以上(Liuetal., 2016)。这些结果表明,在雌性生殖过程中,Vg基因表达上调是对JH信号的响应。在大多数昆虫物种中JH对其生殖是正相关的,但在社会性昆虫欧洲熊蜂Bombusterrestris中,JH和Vg水平呈负相关,这是因为JH已从促性腺激素转变为不育工蚁的成熟和分工调节器,Vg的功能似乎也扩大到类似的角色(Amsalemetal., 2014)。Vargo和Laurel(1994)研究还发现JH还可以通过刺激Vg的摄取进而影响卵子形成,本研究也发现120 ng/头JHⅢ处理下HaVgR表达量在处理后5和9 d异色瓢虫雌成虫中极显著上升(P<0.01)(图3: C),分别为溶剂对照组的8.28和2.01倍。有研究也表明外源JH处理后也可以诱导褐飞虱Nilaparvatalugens和红火蚁SolenopsisinvictaVgR的表达(Chenetal., 2004; Luetal., 2015)。
综上所述,外源保幼激素可调控取食人工饲料的异色瓢虫成虫卵巢发育,120 ng/头剂量JHⅢ处理后5和9 d时雌成虫HaMet,HaKr-h1,HaVg和HaVgR的表达量上调,表明上述基因参与了外源JH调控异色瓢虫雌成虫卵巢发育及卵黄形成的过程,但与内源JH本身对该过程的影响之间是否存在某种联系及其具体的调控机制,有待进一步研究。
