活性氧/c-Jun氨基末端激酶/核因子-κB信号分子通过调控凋亡参与牙周炎诱导肝损伤
2022-10-18曹牛奔刘笑梦邓愉刘歆婵辛雨于维先
曹牛奔 刘笑梦 邓愉 刘歆婵 辛雨 于维先,3,4
1.吉林大学口腔医院牙周病科,长春 130021;2.吉林大学口腔医院种植科,长春 130021;3.吉林大学口腔医院老年口腔科,长春 130021;4.吉林省牙发育及颌骨重塑与再生重点实验室,长春 130021
牙周炎是破坏牙周支持组织的细菌感染性疾病,我国第四次口腔健康流行病学调查结果显示,约90%的成年人罹患牙周病,其中将近30%的成年人患有重度牙周炎[1]。重度牙周炎不仅危害局部口腔健康,而且与2型糖尿病、阿尔茨海默病和类风湿性关节炎等多种系统性疾病的发生和发展密切相关[2]。非酒精性脂肪性肝病(nonalcoholic fat‐ty liver disease,NAFLD)是最常见的慢性肝病之一,在全球范围内患病率约为25.2%[3]。近期一项流行病学调查研究发现,在1 226 例患有NAFLD的成人人群中,牙周探诊深度(probing depth,PD)≥4 mm的比率显著,且NAFLD的发病率随牙周炎严重程度的增加而上升[4]。由此可见牙周炎与NAFLD关系密切,但其具体机制尚未明了。
氧化应激微环境是一系列慢性疾病的基础[5],也是牙周炎和NAFLD 共同致病因素。活性氧(re‐active oxygen species,ROS)在氧化应激反应过程中发挥至关重要的作用,被认为是氧化应激反应的“马达”[6]。研究[7]表明,ROS 作为丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子-κB(nuclear factor kappa-B,NFκB)的上游调节因子,参与调控该信号分子的表达。其中,c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)是MAPK 家族成员之一,介导对外界应激信号做出反应的基本生物过程,被认为是炎症反应和先天免疫反应的重要调节因子[8]。当JNK 信号分子被多种细胞应激活动如氧化应激、遗传毒性应激和渗透应激等激活后可促进炎症介质的释放,进而加剧胞内的炎症反应和凋亡,最终造成组织损伤[9]。此外,NF-κB 作为JNK 的下游信号因子,在传导细胞凋亡和炎症信号中亦发挥了关键作用[10-11]。由于JNK/NF-κB 信号分子在多种细胞功能调节中发挥核心作用,因此当JNK/NFκB 信号分子被ROS 过度激活后可引发机体内环境紊乱。
目前针对NAFLD 的防治依旧缺乏有效的措施和特异性药物,未来以牙周炎为靶点可能为NAFLD的防治提供一种新的策略。因此,深入探讨牙周炎诱导NAFLD的相关机制,对于NAFLD的防治具有重要意义。综上,本研究旨在探讨ROS/JNK/NFκB信号分子在牙周炎诱导肝损伤中的作用。
1 材料和方法
1.1 材料和设备
Micro-CT系统(SCANCO公司,瑞士);油红O 试剂盒(北京索莱宝科技有限公司);MitoSOX red 试剂(Thermo Fisher Science 公司,美国);超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)、丙二醛(malondial‐dehyde,MDA)、谷丙转氨酶(alanine aminotrans‐ferase,ALT)和谷草转氨酶(aspartate aminotrans‐ferase,AST)生化试剂盒(南京建成生物工程研究所);Hoechst 染液(Sigma 公司,美国);逆转录试剂盒(TaKaRa 公司,日本);引物由上海生工生物工程有限公司合成;抗体JNK、磷酸化c-Jun 氨基末端激酶(phosphorylation of c-Jun N-ter‐minal kinase,P-JNK)、NF-κB、半胱氨酸天冬氨酸蛋白酶3(Caspase-3)(Cell Signaling Technolo‐gy 公司,美国);BCL2-Associated X 的蛋白质(BCL2-Associated X,Bax)、B 淋巴细胞瘤-2 基因(B-cell lymphoma-2,Bcl-2)、β-肌动蛋白(β-ac‐tin)、二抗(Proteintech公司,美国);实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪、石蜡切片机(Ther‐mo 公司,美国);实时荧光定量扩增仪(Agilent公司,美国);RIPA 裂解液、BCA 试剂盒、末端脱氧核苷酸转移酶dUTP 缺口末端标记(terminal deoxynucleotidyl transferase dUTP nick end labeling,TUNEL)试剂盒和电化学发光(electrochemilumi‐nescence,ECL)显色液(上海碧云天生物技术有限公司);光学显微镜、荧光显微镜(Olympus 公司,日本);全自动化学发光凝胶成像显影仪(北京君意东方电泳设备有限公司)。
1.2 方法
1.2.1 大鼠牙周炎模型的构建 12 只SPF 级雄性Wistar大鼠(6 周龄,200~220 g)随机分为对照组和牙周炎组,每组各6只(购于吉林大学动物实验中心)。牙周炎组大鼠在2%戊巴比妥钠腹腔注射麻醉后,采用0.2 mm 正畸结扎丝在双侧上颌第一磨牙颈部结扎构建牙周炎模型。8周后检查牙周临床指标并处死,然后迅速采集上颌骨、肝脏和血液用于后续实验[12]。动物实验经吉林大学基础医学院伦理委员会批准(批准编号:2021 年研审243号)。
1.2.2 牙周临床指标检查 探查各组大鼠上颌第一磨牙牙龈状况,并记录牙周临床指标,具体如下。1)PD:用牙周探针在上颌第一磨牙颊腭侧的近远中及中央6 个位点进行探诊,记录PD 测量结果并取均值。2)牙齿动度(tooth mobility,TM):用镊子检查上颌第一磨牙TM 情况。评价标准为0:生理动度;1:仅颊腭向松动;2:颊腭及近远中向松动;3:颊腭、近远中向及垂直向均松动。3)出血指数(bleeding index,BI):将牙周探针轻探入龈沟或袋底,取出探针30 s 后,观察有无出血及出血程度,以Mazza 出血指数为评价标准,0:牙龈健康,无炎症和出血;1:牙龈轻度水肿,探诊不出血;2:探诊后有点状出血;3:探诊后出血沿龈缘扩展;4:探诊后出血并溢出龈沟;5:自发性出血[13]。
1.2.3 Micro-CT 分析 采用Micro-CT 系统扫描上颌骨。Micro-CT 系统设置参数为70 kV、200 mA和300 ms 曝光时间(体素大小为10 μm×10 μm×10 μm),使用IPL软件进行图像处理并重建牙槽骨三维结构。Image J 软件分析上颌第一磨牙近中、中央及远中釉牙骨质界到牙槽嵴顶的距离并取平均值。
1.2.4 苏木精-伊红(hematoxylin-eosin,HE)染色 采集大鼠上颌骨及肝组织,上颌骨置于10%乙二胺四乙酸溶液中脱钙后,制作石蜡切片;肝组织经4%多聚甲醛溶液固定后制作石蜡切片。常规进行HE染色后镜下观察并拍照。
1.2.5 油红O(oil red O)染色 采用油红O 试剂盒对肝脏冰冻切片染色,以评估肝组织脂肪变性。4%多聚甲醛固定肝组织冰冻切片,冲洗后滴加油红O 染液染色10 min,之后用60%异丙醇分化至间质清晰并流水冲洗,苏木精复染5 min,冲洗后甘油明胶封片,最后在光学显微镜下观察并拍照。采用Image-Pro Plus 6.0 软件对图像进行分析并计算肝脏脂肪光密度总和。
1.2.6 MitoSOX red 染色 4%多聚甲醛固定肝脏冰冻切片,冲洗后滴加MitoSOX red 试剂。在37 ℃黑暗环境中孵育30 min,Hoechst 染液对细胞核进行染色,最后在荧光显微镜下观察并拍照。
1.2.7 肝功能和氧化应激指标的测定 采用商用生化试剂盒检测血清中肝功指标AST 和ALT 及肝组织中氧化应激指标SOD、MDA 和GSH,实验步骤按照说明书指示进行。
1.2.8 qRT-PCR 检测 Trizol 试剂提取肝组织中总RNA,逆转录为cDNA 后采用SYBRPrime-Script-TM qRT-PCR Kit 试剂盒进行qRT-PCR 反应,检测白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factorα-α,TNF-α)、NF-κB、Bax 和Bcl-2 mRNA 表达情况,引物序列见表1。采用2-ΔΔCt法计算基因相对表达量。

表1 基因序列Tab 1 Genetic sequence
1.2.9 Western blot 检测 RIPA 裂解液提取新鲜肝组织总蛋白,BCA 试剂盒检测蛋白浓度。10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,湿转法转移到聚偏二氟乙烯膜上,5%脱脂牛奶室温封闭1 h,TBST 洗涤后加入抗体JNK(1∶2 000)、
P-JNK(1∶2 000)、NF-κB(1∶2 000)、Caspase-3(1∶2 000)、Bax(1∶8 000)、Bcl-2(1∶2 000)、β-actin(1∶8 000)4 ℃孵育过夜,TBST 洗膜后与二抗(1∶8 000)室温孵育1 h,最后使用ECL显色并通过Image J软件分析灰度值。
1.2.10 TUNEL 染色 根据TUNEL 试剂盒说明书对肝组织石蜡切片进行染色,Hoechst 染液对细胞核进行染色后,在荧光显微镜下观察细胞并拍照。
1.3 统计学分析
利用GraphPad Prism 6.0软件进行统计学分析,所有数据用xˉ±s来表示,组间比较采用t检验分析,P<0.05则认为差异具有统计学意义。
2 结果
2.1 成功构建牙周炎模型
肉眼观察对照组牙龈呈粉红色,形态菲薄,质地坚韧(图1a);而牙周炎组牙龈充血红肿,龈缘肥厚,质地松软(图1b)。牙周组织切片HE 染色结果显示,与对照组相比,牙周炎组牙周组织上皮连续性破坏,固有层中有大量炎症细胞浸润,牙槽嵴吸收明显(图1c、d)。Micro-CT显示牙周炎组牙槽骨骨质较对照组吸收明显(图1e、f),且釉牙骨质界到牙槽嵴顶的距离(1.06 mm±0.09 mm)明显大于对照组(0.68 mm±0.02 mm)(t=3.934,P=0.017)。此外,牙周炎组牙周临床指标PD、BI 和TM 值均明显升高(表2)。以上结果表明,本研究成功构建牙周炎模型。

表2 大鼠牙周临床指标Tab 2 Periodontal clinical indices of rats xˉ±s
2.2 肝大体照及组织病理学检测结果
肉眼观察牙周炎组肝脏较对照组体积增大,颜色变浅,边缘圆钝(图2a、b)。肝组织HE 染色结果显示,牙周炎组肝索排列紊乱,小叶内及汇管区可见炎症细胞浸润,肝细胞胞浆内可见白色脂肪空泡(图2c~f)。油红O 染色结果显示,牙周炎组肝组织胞浆内红色脂滴明显多于对照组(图3)。以上结果表明牙周炎可诱导肝组织发生结构改变。
2.3 MitoSOX red染色结果
线粒体是产生ROS 的主要场所,MitoSOX red试剂可靶向检测ROS含量。MitoSOX red是一种线粒体超氧化物荧光染料,被超氧化物氧化后可呈现红色荧光,从而评估ROS含量。实验结果示,牙周炎组肝组织中红色荧光强度较对照组明显增强,表明牙周炎组肝组织中ROS含量升高(图4)。
2.4 氧化应激标志物和肝功检测结果
SOD 和GSH 是生物体内重要的抗氧化剂,MDA 是脂质过氧化的最终产物。AST 和ALT 是评价肝功能损伤的重要指标。结果显示,与对照组相比,牙周炎组肝组织中SOD、GSH 含量显著降低,MDA 含量升高。血清中AST、ALT 含量升高,差异具有统计学意义(P<0.05)。以上结果表明牙周炎可诱导肝组织中发生氧化应激反应且损害肝功能(表3)。
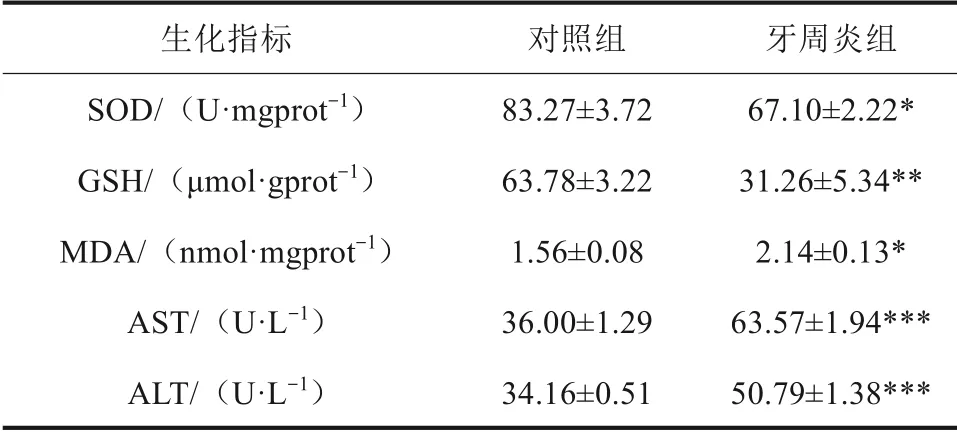
表3 生化指标检测结果Tab 3 Biochemical index test results xˉ±s
2.5 qRT-PCR检测结果
qRT-PCR 检测肝组织中IL-6、TNF-α、Bax、NF-κB 和Bcl-2 mRNA 表达水平。结果显示,与对照组相比,牙周炎组肝组织中IL-6、TNF-α、Bax和NF-κB mRNA 表达水平显著升高,Bcl-2 mRNA表达水平显著下降,差异具有统计学意义(P<0.05)。以上结果表明牙周炎组肝组织中炎症介质和凋亡相关mRNA表达水平较对照组升高(图5)。
2.6 Western blot检测结果
提取肝组织总蛋白,Western blot 检测肝组织中P-JNK/JNK、NF-κB、Caspase-3、Bax 和Bcl-2表达水平。与对照组相比,牙周炎组肝组织中PJNK/JNK、NF-κB、Caspase-3、Bax 表达水平明显增高,Bcl-2 表达水平降低,Bax/Bcl-2 比值升高,差异具有统计学意义(P<0.05)。以上结果表明,与对照组相比,牙周炎组肝组织中JNK/NF-κB 信号分子被激活,且凋亡相关蛋白表达水平显著升高(图6)。
2.7 TUNEL染色结果
TUNEL 染色可将凋亡细胞呈现绿色荧光。结果显示,牙周炎组肝组织中绿色荧光强度较对照组增强,表明牙周炎组肝组织中凋亡水平升高(图7)。
3 讨论
牙周炎和NAFLD 均为慢性炎症性疾病,有共同的危险因素,两者间相互作用,均表现为组织内部发生氧化应激反应,然而牙周炎诱发肝损伤的具体机制尚不清楚。因此,本研究以氧化应激为切入点,探讨牙周炎诱导肝损伤的具体机制。
ROS 在机体内发挥“双刃剑”作用:一方面ROS 本身具有杀菌抗菌能力,在生理状态下可以帮助杀死入侵机体的病原菌。另一方面,当ROS被过度激活在体内大量积累会引起机体氧化-抗氧化失衡,导致机体内发生氧化应激反应,最终引起组织损伤[16]。Mohs 等[17]研究报道,ROS 的过度产生可导致脂质稳态的破坏,从而导致肝细胞内脂质的过度积累。因此,氧化应激是NAFLD 发病和进展的重要因素之一。
流行病学调查结果发现,牙周炎患者龈沟液、唾液和血清中氧化应激生物标志物水平较牙周健康者显著升高[18]。而通过手术或非手术治疗等方式对牙周炎进行干预可有效降低全身氧化应激生物标志物水平[19]。基于以上研究猜测牙周炎不仅能改变牙周局部氧化应激水平,也可影响全身氧化还原状态。本研究根据肝组织病理学检测结果以及肝功指标水平变化发现牙周炎可诱导肝脏发生结构改变和功能障碍,表明本研究成功构建大鼠牙周炎相关肝损伤模型。在此模型基础上,通过MitoSOX red染色和检测肝组织中氧化应激生物标志物水平进一步证实我们的猜想。结果显示,牙周炎组肝组织中ROS 含量升高,且氧化应激生物标志物SOD 和GSH 水平降低,MDA 水平升高,表明牙周炎可诱导肝组织中发生氧化应激反应。
An 等[7]研究发现,ROS 大量积累可触发JNK/NF-κB 信号分子的激活,进而引起一系列细胞反应。前文所述,由于JNK/NF-κB 信号分子可参与多种信号的传导,当该通路被过度激活时可导致内环境紊乱。本研究结果显示,牙周炎组肝组织中JNK 蛋白磷酸化水平和NF-κB 基因及蛋白表达水平明显较对照组升高,表明JNK/NF-κB 信号分子在牙周炎诱导肝损伤过程中可能发挥重要作用。因此,根据以上研究结果初步认为牙周炎可能通过诱导肝脏中ROS 大量积累,导致肝组织内发生氧化应激反应,进而激活JNK/NF-κB 信号分子,最终造成肝损伤。
细胞凋亡是机体的一种生理机制,在维持内环境稳态过程中发挥关键作用[20]。然而,当机体受到氧化应激等信号刺激导致凋亡水平上升时,巨噬细胞无法清除过多的凋亡细胞,未清除的凋亡细胞可加剧体内炎症反应[7]。Zhou 等[21]研究发现,在NAFLD 进展中伴随细胞凋亡水平增加。此外,Veskovic等[22]通过改善促凋亡和抗凋亡介质平衡可有效缓解肝脏炎症和损伤。由此可见NAFLD发病机制与细胞凋亡水平改变密切相关。本研究通过探讨JNK/NF-κB 信号分子对细胞凋亡的调控作用,进一步揭示牙周炎诱导肝损伤的具体机制。目前研究[23]发现,JNK信号分子在细胞内源性和外源性凋亡途径中发挥至关重要的作用。激活后的JNK 通过磷酸化14-3-3α 或14-3-3ζ 蛋白(bax 的胞质锚定蛋白)介导bax 活化并将其转位到线粒体,进而诱导线粒体外膜渗透。线粒体外膜渗透可导致细胞色素C 和其他促凋亡蛋白从线粒体膜间空间释放,触发Caspase-9 级联反应[24]。同时,JNK也可通过磷酸化Bim 和Bmf 蛋白,从而抑制Bcl-2及其同系物的抗凋亡活性,最终诱导细胞凋亡[20]。此外,NF-κB 作为一种重要的转录因子,通过传导凋亡和炎症信号参与细胞损伤过程[11]。本实验结果显示牙周炎组肝组织中凋亡细胞数量明显增多,促凋亡介质Bax 和Caspase-3 表达水平显著升高,抗凋亡介质Bcl-2 表达水平下降,且炎症因子表达水平亦明显上升。综上,牙周炎可能通过诱导肝组织中发生氧化应激反应,激活JNK/NF-κB 信号分子,导致肝组织中细胞凋亡水平上升,促进炎症介质大量释放,最终引起肝损伤。
本研究存在一定的局限性,即未使用JNK/NFκB 信号分子的阻断药物观察牙周炎诱导的肝损伤是否得到有效缓解。然而大量研究证实,通过抑制JNK/NF-κB 信号分子可有效减轻ROS 大量积累对组织和细胞造成的氧化损伤。Chen 等[25]研究发现,在心肌缺血-再灌注期间,ROS 大量积累造成心肌细胞受损和功能障碍,而Zhou 等[26]通过体内应用阻断药物抑制JNK/NF-κB 信号通路可以有效减轻心肌组织功能障碍和免疫紊乱。由于氧化应激是缺血-再灌注损伤和牙周炎诱导的NAFLD 的共同致病因素之一,上述结果在为后续通过使用阻断药物抑制JNK/NF-κB 信号通路从而缓解牙周炎诱导的肝损伤的过程中提供强有力的理论支撑。
综上所述,本研究发现ROS/JNK/NF-κB 信号分子可能在牙周炎诱导肝损伤过程中发挥了重要作用,未来可通过应用JNK 和NF-κB 的靶向药物做进一步研究。期待以牙周炎为靶点为NAFLD 的防治提供新策略。
利益冲突声明:作者声明本文无利益冲突。
