基于CT影像组学对胰腺浆液及黏液性囊性肿瘤鉴别诊断*
2022-10-18陈井亚崔文静王中秋
陈 帅 陈 晓 陈井亚 崔文静 王中秋
南京中医药大学附属医院(江苏省中医院)放射科 (江苏 南京 210029)
胰腺囊性肿瘤(PCN)包含很多亚型,包括胰腺浆液性囊腺瘤、黏液性囊性肿瘤、导管内乳头状肿瘤及实性假乳头状肿瘤等,不同类型的囊性肿瘤生物学行为存在差异,临床处理也不同。胰腺浆液性囊腺瘤(SCN)几乎为良性肿瘤,死亡率接近0%,大部分SCN仅需随访[1]。胰腺黏液性囊性肿瘤(MCN)均有恶性潜能,部分甚至可进展为胰腺癌[2];对于MCN患者,肿瘤直径大于40mm,或者无论肿瘤大小,患者出现相关症状或肿瘤存在壁结节时均推荐手术切除,即使对于无上述高风险特征的患者仍需终身随访观察[1]。因此,术前鉴别SCN与MCN对临床处理方式的选择尤为重要。
SCN典型表现为多囊,而MCN常表现为单囊,在常规CT上容易鉴别,但是部分SCN表现不典型,有少于10%的病例表现为单囊,易误诊为MCN[3-5]。应用计算机辅助诊断技术,对形态学相似的疾患进行诊断和鉴别诊断,提高诊断效能已经在一些领域开展(肺、肾良恶性肿瘤鉴别等),一些学者报道,较常规CT及MRI等影像技术相比,能改善诊断效能[6-8]。本研究基于胰腺门脉期CT图像,应用多种机器学习方法联合影像组学参数,建立多组影像组学模型,鉴别胰腺SCN与MCN,试图进一步提高对该两种疾患的诊断能力。
1 资料与方法
1.1 一般资料本研究回顾性地收集了从 2012年10月至 2018年10月间在术前做过影像学检查的胰腺41例SCN与30例MCN患者的影像资料,这些患者来自南京中医药大学附属医院及常州市第一人民医院。
纳入标准为:患者经手术病理证实为SCN及MCN;患者术前30天内做过腹腔CT增强(包括门脉期)检查。排除标准:例图像质量不佳或缺少DICOM数据的患者;病理诊断资料不充分的患者;CT未见明显囊性占位,仅表现出间接征象的患者。本研究最终纳入65例患者,包括37例SCN患者及28例MCN患者(见图1)。
1.2 检查方法纳入本研究的65例胰腺 SCN与MCN患者的影像资料均包含CT扫描图像(门脉期)。使用的多排螺旋CT有64排螺旋GE Optima CT680及128排Philips Brilliance ICT。扫描参数为:管电压为120kV,管电流应用自动毫安秒技术,扫描层厚及层间距设为2mm,准直器宽度是0.625mm,矩阵是512 x 512,螺距是0.85、球管旋转时间是0.5s。CT的增强扫描应用双管高压注射器,经肘前静脉注射非离子型造影剂,增强扫描的剂量按1.5mL/kg计算,造影剂浓度为300mg/mL,注射速率为3.5~4mL/s。增强扫描的方法应用固定延迟时间法,本研究将开始注射造影剂后的65秒设置成门脉期。此外在CT检查前患者会禁食空腹,患者以仰卧位扫描。
1.3 影像组学模型的建立与分析本研究应用门脉期图像作为影像组学分析资料,CT图像采用Dicom格式图像,从PACS系统导入。因多种扫描设备得到的图像可能存在异质性,对来源于多中心图像,均进行均质化校准预处理;预处理应用的软件是AIKit软件(Artificial Intelligence Kinetics,Version 3.6.0)。具体方法是使用相邻插值算法重采样图像使图像矩阵中的体素具备各向同性,并使用灰度离散化处理降低噪声在图像中的异质性影响。本研究应用Radiant DICOM 软件(https://www.radiantviewer.com)观察目标图像资料,仔细观察肿瘤的形态特征,并确定肿瘤边界与范围。在本研究中,对病变的VOI进行分割的方法是:使用ITK.SNAP软件在病变显示的所有横断面图像上沿着病变边缘手动绘制ROI,然后将其合成为VOI文件并保存(见图1),期间,本研究尽量使ROI包含病变的所有区域,并避免相邻的非病灶组织,如病变周围的脂肪,正常胰腺组织或强化的血管等。
应用AK软件从勾画好的ROI中提取720个影像组学参数,包括形态特征参数(9个)、直方图参数(42个)、灰度共生矩阵参数(Grey Level Co-occurrence Matrix,GLCM,288个)、步长矩阵参数(Run Length Matrix,RLM,360个)、灰度区域大小矩阵(Grey Level Size Zone Matrix,GLSZM,11个)、Haralick参数(10个)。因手动勾画可能使VOI范围存在异质性,本研究从样本中随机选择26期图像,分别由一名研究生(观察者1)和一名具有 7 年工作经验的主治医师(观察者2)对患者资料未知的情况下独立勾画肿瘤的VOI,提取影像组学参数以进行组间相关一致性检验,2个月后观察者1对这26期图像重新勾画VOI,提取影像组学参数与第一次比较以进行组内相关一致性检验。本研究以ICC>0.8的参数认定为一致性良好,而ICC<0.8者一致性较差,并剔除。在进行影像组学分析前,本研究对影像组学参数进行标准化预处理,以消除不同参数之间因性质、量纲及数量等级上的差异,标准化方法为标准差标化法(Z-score标准化法)。
将纳入的65名患者按照7:3随机分为训练组及验证组,并进行影像组学参数的降维分析。第一步,经过上述组内、组间一致性检验后留下的影像组学参数进行单变量分析,即独立样本T检验,P值大于0.05者认为没有鉴别的统计学意义,并剔除。第二步,应用Spearman相关性检验,设置阈值为0.9,假如某两种影像组学参数之间相关系数大于0.9,则认为二者存在较大的相关性,并剔除其中一个。第三步,本研究应用Lasso降维方法进行降维,使用十折交叉验证来计算具有最小交叉验证误差的lambda系数,并参考lambda系数对上述步骤留下的参数进行筛选,以获得鉴别胰腺SCN与MCN最优的影像组学参数。
对降维后的影像组学参数进行机器学习建模并评估模型的效能。在训练组中分别应用Logistic回归、随机森林、引导聚集算法(Bagging)、支持向量机(SVM)、人工神经网络及朴素贝叶斯6种机器学习方法创建模型,对验证组数据进行预测。通过建立ROC曲线并计算ROC曲线下面积(area under the curve,AUC)、准确性、特异性及敏感性参数比较各个模型的诊断效能。
1.4 统计分析所有的统计学检验均由3.3.1版本R语言软件和SPSS 24.0实施。本研究应用"glmnet"包进行 Lasso及Logistic回归模型分析。应用"randomForest"包进行随机森林模型分析。应用"ipred"包进行Bagging模型分析。应用"e1071"包进行SVM及朴素贝叶斯模型分析。应用"nnet"包进行人工神经网络模型分析。应用"pROC"包绘画ROC曲线。双边P<0.05考虑为有统计学意义。
2 结 果
2.1 一般资料本研究共纳入28例MCN及37例SCN,两组患者均表现出女性好发,SCN组女性患者有31例(84%),MCN组女性患者有24例(86%),SCN与MCN在性别没有统计学差异(P=0.831)。M C N 组患者年龄为5 0.9 6±1 5.2 6 岁,S C N 组患者年龄为56.92±12.20岁,两组患者在年龄没有统计学差异(P=0.085)。
2.2 影像组学模型的建立及评价720个影像组学参数在组内、组间一致性检验中,有10个参数ICC值小于0.8,被认为一致性较差并剔除,因此共有710个参数进行降维过程(图1)。在降维分析后,门脉期有11个影像组学参数被筛选出,包括4个步长矩阵参数:ShortRunHighGreyLevelEmphasis_angle0_offset1、RunLengthNonuniformity_AllDirection_offset3_SD、HighGreyLevelRunEmphasis_AllDirection_offset4_SD、ShortRunHighGreyLevelEmphasis_angle135_offset1;5个灰度共生矩阵参数:InverseDifferenceMoment_AllDirection_offset4_SD、HaralickCorrelation_angle45_offset4、Correlation_AllDirection_offset9_SD、Inertia_AllDirection_offset9_SD、Correlation_angle45_offset7;2个形态特征参数:Sphericity、Maximum3DDiameter。图3显示门脉期Lasso降维的可视化表现。
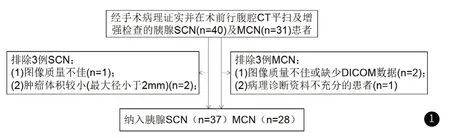
图1 本研究患者的纳入排除标准

图2 本研究设计的流程图

图3 图3A:通过基于最小标准的10倍交叉验证在Lasso模型中选择调整参数(λ)。来自Lasso回归交叉验证程序的二项式偏差被绘制为log(λ)的函数。纵轴表示二项式偏差。下方横轴表示log(λ)。上方横轴轴的数字表示预测变量的平均数量。红点表示具有给定λ的每个模型的平均偏差值,穿插红点的竖线表示偏差的上限值和下限值。垂直的黑线定义了λ的最佳值,其中模型为数据提供了最佳拟合。选择log(λ)=-2.03时的最佳λ值为0.131。图3B:720个纹理特征的Lasso系数曲线。垂直虚线画在图3A中使用10倍交叉验证选择的值处。图4 6种机器学习模型分别在训练组及验证组中鉴别胰腺SCN与MCN的ROC曲线
6种机器学习方法分别门脉期的验证组中进行预测,评价模型的AUC值、准确性、特异性及敏感性展示在表1中。结果显示人工神经网络的AUC表现最佳(AUC=0.920),准确性、特异性及敏感性也表现较好,分别为0.895、0.999及0.750。门脉期筛选出用于创建模型的影像组学参数及6种机器学习模型的ROC曲线显示在图4。
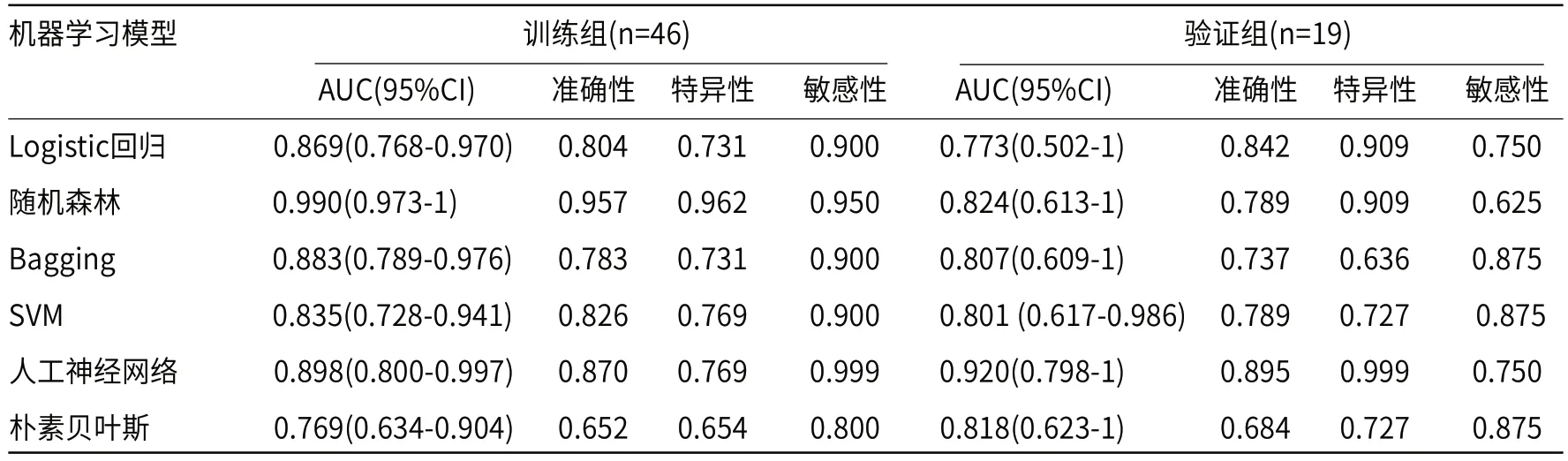
表1 6种机器学习建模方法效能比较
3 讨 论
常规CT和MRI能够提供疾患的形态学信息,而影像组学可以挖掘数字图像深层次的高通量定量参数,从而探索疾患内部的微环境特征[9]。目前已有研究显示出影像组学在胰腺囊性肿瘤诊断中的应用优势[10-16]。单变量分析、Spearman相关分析及Lasso等降维方法能够解决大量参数带来的冗余问题,并能筛选出最优参数,以建立效能更好的模型。随机森林、Bagging、人工神经网络、支持向量机及朴素贝叶斯属于机器学习方法,在数据的分析和挖掘有很好的应用,而Logistic回归是传统的数据挖掘手段,是一种广义的线性回归分析模型。
Ran Wei等人应用影像组学鉴别胰腺SCN与非SCN囊性肿瘤(IPMN、MCN及SPN),其设置独立验证组,应用Lasso降维筛选出12个参数,并应用SVM建模在验证组表现出较好的效能(AUC=0.837、敏感性=0.667、特异性=0.818)[14];Jing Yang等人应用随机森林联合Lasso降维后的参数建立模型鉴别胰腺SCN与MCN,并将不同扫描层厚分组,设置独立验证组显示出模型有较好的效能(2mm层厚组:AUC=0.66,敏感性=0.86,特异性=0.71,准确性=0.74;5mm层厚组:AUC=0.75,敏感性=0.85,特异性=0.83,准确性=0.83)[13];Huihui Xie等人对MCN与大囊型SCN应用Logistic回归联合影像组学参数建立影像组学模型,并联合影像组学模型与影像学特征建立联合模型获得较好的鉴别效果(ACU=0.994,敏感性=96.8 %,特异性=100 %,准确性=98.2%)[10],但其没有设置独立验证组。以往的研究多应用单一机器学习建模方法,未明确哪种建模方法更有优越性。本研究应用多种降维方法筛选最优影像组学参数,应用Logistic回归、随机森林、Bagging、人工神经网络、支持向量机及朴素贝叶斯建模方法鉴别SCN及MCN,并设置内部验证组预测及比较模型效能,结果发现人工神经网络建立的模型鉴别效能最佳(AUC为0.920,敏感性为0.750,特异性为0.999,准确性为0.895),显示出人工神经网络鉴别胰腺SCN与MCN相比其他机器学习方法有更好的优越性。Ruimeng Yang等人基于4期CT图像,应用28种降维方法及8种机器学习分类器,共创建3360组模型鉴别肾癌与乏脂肪错构瘤,结果发现平扫的影像组学模型较其他期象表现更好,“SVM+t_score” 及“SVM+relief”的组合有最高的AUC(AUC=0.90)[17]。
对于胰腺SCN及MCN的一般资料,本研究仅作少量指标比较。在本研究中,SCN组患者女性有31例,约占总人数的84%,MCN组女性有24例,约占本组总人数的 86%,性别在两组间没有统计学差异(P=0.831),两种疾病均为女性好发。本研究中SCN组患者的年龄为56.92±12.20,MCN组患者年龄为50.96±15.26,年龄在两组间没有统计学差异(P=0.085)。这与以往的研究相符[15-16]。
本研究存在一些局限性。第一,本研究的病例数较少,未做外部验证,影像组学的应用需要更多的病例数据支持,未来的研究方向可基于大病例数以创建内部验证及外部验证。第二,本研究的病例来源于两家医院,因此可能存在不同机器扫描产生的异质性影响,尽管应用预处理减少异质性,但仍可能存在影响,未来的方向在于单中心来源数据研究。第三,本研究应用手动勾画感兴趣区的方式,可能对后续的影像组学参数的提取及统计分析造成影响,未来的影像组学感兴趣区勾画可能依托于计算机自动分割技术。
综上所述,本研究基于胰腺门脉期CT图像,应用6种机器学习方法为胰腺SCN与MCN的鉴别进行影像组学分析,对于影像学表现相似的病例,人工神经网络模型能够提高术前对SCN与MCN的鉴别诊断效能。
