蚕豆花水提取物的UPLC-ESI-QTOF质谱联用分析及抗氧化活性研究
2022-10-17李程勋徐晓俞李爱萍郑开斌
李程勋, 徐晓俞, 李爱萍*, 郑开斌
蚕豆花水提取物的UPLC-ESI-QTOF质谱联用分析及抗氧化活性研究
李程勋1, 徐晓俞1, 李爱萍1*, 郑开斌2*
(1. 福建省农业科学院作物研究所,福州 350013;2. 福建省农业科学院,福州 350003)
为阐明蚕豆()花水提取物的药效作用基础,采用超高效液相色谱-高分辨飞行时间质谱(UPLC-ESI-QTOF-MS)联用技术对其水提取物进行分析鉴定,并测定其抗氧化活性。结果表明,从蚕豆花水提取物中鉴定出178种化学成分,其中相对含量大于0.01%的成分有107种,相对含量较高的成分有野黄芩素-7-新橘皮糖苷、3-吲哚基--d-葡糖苷酸环己胺盐、螺环内脂E、芦丁、海藻酸丙二醇酯、山柰酚-3--d-半乳糖甙、4,8-二羟基喹啉-2-甲酸等。蚕豆花水提取物的主要成分以黄酮类和生物碱类为主,分别有16和17种,相对含量分别为36.53%和34.33%。清除DPPH和ABTS+自由基的IC50值分别为26.5 和25.0g/mL。黄酮类和生物碱类是蚕豆花发挥功效的主要物质基础,蚕豆花水提取物具有较强的抗氧化活性,蚕豆花具有较高的应用价值。
蚕豆; 花; 水提物; 化学成分;抗氧化
蚕豆(),别名兰花豆、胡豆、南豆等, 为豆科(Leguminosae)豌豆属一年生草本植物[1–2]。蚕豆大多数品种具有无限开花的习性,但多花不多实,其有效结荚数不足现蕾数的15%[3],蚕豆开花后,营养需求增大,植株营养供应不足造成大量落花落荚现象,在生产过程中会对蚕豆进行疏花处理,保证蚕豆有效荚的营养供应,疏花过程中摘除的蚕豆花一般都直接舍弃在农田中,没有加以利用,对蚕豆花进行开发利用,将实现废弃资源的利用,创造出额外的经济价值,提高企业和农民的经济收入,具有重要的意义。
关于蚕豆化学成分的研究,前人报道种子中含有大豆皂苷 I、大豆皂苷bg和赤豆皂苷IV等成分[4–5]; 蚕豆叶片中含有山柰酚-3--葡萄糖-7--鼠李糖苷[6];蚕豆地上部分含有10个由槲皮素和山奈酚皂苷组成的黄酮皂苷[7–8];蚕豆种皮中含有6个原花青素低聚物[9],8个儿茶素及其衍生物的单体和二聚体[10]。蚕豆种子提取物中的缩合单宁、蚕豆地上部分提取物中的多酚类化合物和蚕豆皮提取物中的原花青素具有良好的抗氧化活性[11–12]。此外蚕豆提取物还具有抑制人类肿瘤细胞株增殖[13]、链脲霉素诱导的糖尿病活性[14]和黄嘌呤氧化酶活性[7]等功效。
蚕豆花具有凉血止血、降血压、防癌抗癌等功效[15–16],目前,关于蚕豆花的研究主要集中在花荚脱落[17]、形成过程[17–18]和功效成分[16,19]等方面。郭向群等[16]报道蚕豆花中含有槲皮素和山奈酚等黄酮类化合物,郑开斌等[20]报道蚕豆花中含有左旋多巴,然而蚕豆花水提取液中是否含有其他种黄酮类、氨基酸类成分以及其他类型化学成分尚未明确,尚没有关于蚕豆花水提取物成分和功效作用方面的相关研究,使蚕豆花难以得到进一步开发利用。
UPLC-ESI-QTOF质谱联用技术目前已被广泛应用于化学成分的表征研究中[21–24],UPLC具有检测速度快、灵敏度高、分离能力强的优点, QTOF具有分辨率高、分子量上限高、定性能力强等优点[25–26]。因此,本研究利用UPLC-ESI-QTOF质谱联用技术首次对蚕豆花水提取物中的化学成分进行分析鉴定,进一步测定其抗氧化活性,以阐明蚕豆花药效物质基础,为蚕豆花的应用提供科学依据。
1 材料和方法
1.1 试验材料和仪器
蚕豆()鲜花于2019年2月25日采自福建省连江县丹阳试验基地。
超高效液相色谱UPLC-TripleTOF串联飞行时间质谱仪(美国AB SCIEX公司);Denver TP-214电子天平(丹佛仪器有限公司);Centrifuge5804R离心机(Eppendorf公司);T6新世纪紫外-可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 样品制备
称取5 kg蚕豆鲜花置于100 L蒸馏罐中,加入20 kg纯水,加热回流提取2 h,过滤,即得蚕豆花水提取物,待用。
1.3 UPLC-MS分析
分别移取5 mL蚕豆花提取物样品,真空浓缩抽干,加入500L提取试剂(乙腈∶甲醇∶水=2∶2∶1)超声提取15 min,重复提取3次,提取物于4 ℃,1 200×离心10 min,取上清液,真空抽干,用100L复溶液(乙腈∶水=1∶1)复溶,得上机样品,待用。
色谱条件 色谱柱:BEH C18柱(100 mm× 2.1 mm, 1.7m);柱温:45 ℃;流动相A:水(含0.1%甲酸),流动相B:乙腈/异丙醇(含0.1%甲酸)= 1∶1;梯度洗脱程序:0~3 min 5%~25% B;3~9 min 25%~95% B;9~13 min 95% B;13~13.1 min 95%~ 5% B, 并保持3 min;流速:0.40 mL/min,进样量:10L。
质谱条件 样品质谱信号采集采用正离子扫描模式,电喷雾毛细管电压:1.0 kV,进样电压:40 V,碰撞电压:6 eV;离子源温度:120 ℃,去溶剂温度:500 ℃;载气流量:900 L/h;质量扫描范围:50~1 000,扫描时间:0.1 s,间隔时间:0.02 s。
1.4 抗氧化活性研究
DPPH自由基清除能力测定 参照Baltrusai- tyte等[27]的方法,取蚕豆花提取物旋蒸抽干,用纯水配置成10、20、30、40、50g/mL蚕豆花提取物溶液。取蚕豆花提取物溶液和DPPH自由基溶液(39.40g/mL)等量混合均匀,静置30 min,测定混合液在517 nm波长下的吸光度,计算蚕豆花提取物溶液对DPPH自由基的清除率,每个样品重复3次。DPPH自由基的清除率=(1-1/2)×100%, 式中,1为DPPH自由基与蚕豆花提取物混合溶液的吸光值;2为DPPH自由基与纯水混合溶液的吸光值。
ABTS+自由基清除能力测定 参照管瑛等[28]的方法,取76 mg ABTS和13 mg过硫酸钾配置成20 mL溶液,室温下暗室静置反应16 h,将溶液稀释50倍后待用。取蚕豆花提取物溶液和ABTS+自由基溶液混合均匀,静置30 min,测定混合液在波长734 nm下的吸光值,计算蚕豆花提取物溶液对ABTS+自由基的清除率,每个样品重复3次。ABTS+自由基清除率=(1-3/4)×100%, 式中,3为ABTS+自由基与蚕豆花提取物混合溶液的吸光值;4为ABTS+自由基与纯水混合溶液的吸光值。
1.5 数据处理和分析
UPLC-MS分析的原始数据经Progenesis QI (Waters Corporation, Milford, USA)代谢组学处理软件处理,最终得到1个保留时间、质荷比和峰强度的数据矩阵,再与HMDB数据库和Metlin数据库进行比对,根据得分进行筛选,阈值选择为60分,对代谢物质进行定性分析[29–30]。参照徐晓俞等[31]的方法,采用峰面积归一化法计算代谢物质的相对含量。采用Microsoft Excel 2003和SPSS 19.0软件进行数据分析。
2 结果和分析
2.1 提取物成分鉴定分析
利用UPLC-ESI-QTOF质谱联用技术从蚕豆花水提取物中鉴定出178种化学成分(表1),总离子流图见图1,其中相对含量0.01%以上的成分有107种, 相对含量0.1%以上的成分有66种(表2)。
2.1.1 氨基酸类和肽类化合物
化合物1278.122 5 [M + H]+,分子量277,失去1分子果糖基(162)产生碎片116.086 5, 进一步失去NH3(17)、HCOOH (46),产生碎片53.068 1,分子式C11H19NO7,结合文献[32]推测为-(1-脱氧- 1-果糖基)脯氨酸。
化合物2294.154 0 [M + H]+,分子量293,失去1分子果糖基产生碎片132.036 9,进一步失去NH3、HCOOH,产生碎片69.046 2,分子式C12H23NO7,结合文献[32]推测为-(1-脱氧-1-果糖基)亮氨酸。
化合物3130.048 7 [M + H]+,分子量129,失去1分子HCOOH、NH3产生碎片84.050 0、113.088 6,分子式C5H7NO3,结合文献[33]推测为d-焦谷氨酸。
化合物4289.138 6 [M + H-2H2O]+,分子量324,失去1分子半乳糖基(162)产生碎片127.061 4,分子式C12H24N2O8,结合HMDB数据库推测为半乳糖基羟基赖氨酸。
化合物5326.122 1 [M + H-H2O]+,分子量343,失去1分子果糖基产生碎片164.081 1, 进一步失去NH3(17)、HCOOH (46),产生碎片101.013 8,分子式C15H21NO8,结合文献[32]推测为-(1-脱氧- 1-果糖基)酪氨酸。
化合物6203.137 7 [M + H]+,分子量202,失去1分子HCOOH、NH3产生碎片157.055 9、186.056 3,分子式C9H18N2O3,结合Metlin数据库推测为丙氨酰基-dl-亮氨酸。
化合物7205.095 4 [M + H]+,分子量204, 失去1分子HCOOH、NH3产生碎片159.063 4、188.056 9,分子式C11H12N2O2,结合Metlin数据库推测为l-色氨酸。

表1 蚕豆花水提取物化学成分的种类和相对含量

图1 蚕豆花水提取物总离子流图

表2 蚕豆花水提取物的化学成分和相对含量

续表(Continued)
化合物8322.091 6 [M + H-H2O]+, 分子量339, 失去1分子葡萄糖基(162)产生碎片160.052 4, 分子式C15H19NO9,结合HMDB数据库推测为环多巴葡萄糖苷。
化合物9257.053 9 [M + H]+,分子量256,失去1分子HCOOH、NH3产生碎片211.053 9、240.044 3,分子式C8H14N2O5,结合HMDB数据库推测为l-羟基脯氨酸。
化合物10346.196 4 [M + H]+,分子量345,失去1分子HCOOH、NH3产生碎片300.138 1、329.095 9,分子式C15H27N3O6,结合Metlin数据库推测为亮氨酸-缬氨酸-天冬氨酸。
化合物11290.170 2 [M + H]+,分子量289,失去1分子HCOOH、NH3产生碎片244.079 7、273.067 9,分子式C12H23N3O5,结合Metlin数据库推测为丝氨酸-亮氨酸-丙氨酸。
化合物12346.196 5 [M + H]+,分子量345,失去1分子HCOOH、NH3产生碎片300.154 8、329.202 5,分子式C15H27N3O6,结合Metlin数据库推测为缬氨酸-亮氨酸-天冬氨酸。
化合物13336.191 4 [M + CH3OH + H]+,分子量303, 失去1分子HCOOH、NH3产生碎片290.067 8、319.043 9,分子式C16H21N3O3,结合Metlin数据库推测为缬氨酸-色氨酸。
化合物14346.196 8 [M + H]+,分子量345,失去1分子HCOOH、NH3产生碎片300.082 7、329.074 7,分子式C15H27N3O6,结合Metlin数据库推测为缬氨酸-天冬氨酸-亮氨酸。
化合物15330.237 7 [M + H]+,分子量329,失去1分子HCOOH、NH3产生碎片284.049 5、313.055 7,分子式C16H31N3O4,结合Metlin数据库推测为缬氨酸-亮氨酸-缬氨酸。
化合物16332.216 9 [M + H]+,分子量331,失去1分子HCOOH、NH3产生碎片286.066 2、315.042 1,分子式C15H29N3O5,结合Metlin数据库推测为亮氨酸-丝氨酸-异亮氨酸。
化合物17344.252 9 [M + H]+,分子量343,失去1分子HCOOH、NH3产生碎片298.052 0、327.059 5,分子式C17H33N3O4,结合Metlin数据库推测为缬氨酸-异亮氨酸-亮氨酸。
化合物18336.190 6 [M + H]+,分子量335,失去1分子HCOOH、NH3产生碎片290.055 3、319.162 7,分子式C17H25N3O4,结合Metlin数据库推测为甘氨酸-苯丙氨酸-异亮氨酸。
化合物19358.268 7 [M + H]+,分子量357,失去1分子HCOOH、NH3产生碎片312.097 6、341.187 1,分子式C18H35N3O4,结合Metlin数据库推测为异亮氨酸-亮氨酸-亮氨酸。
化合物20426.237 5 [M + H]+,分子量425,失去1分子HCOOH、NH3产生碎片380.055 2、409.049 3,分子式C24H31N3O4,结合Metlin数据库推测为异亮氨酸-苯丙氨酸-苯丙氨酸。
2.1.2 萜类化合物
化合物21149.058 2 [M + H-H2O]+,分子量166,失去1分子HCOOH产生碎片103.101 2,分子式C9H12O4,结合HMDB数据库推测为京尼平酸。
化合物22247.131 3 [M + H-H2O]+,分子量为264,失去1分子HCOOH产生碎片201.087 1,分子式为C15H20O4,结合Metlin数据库推测为脱落酸。
化合物23221.188 3 [M + H]+,分子量220, 失去1分子H2O (18)产生碎片203.103 7, 分子式C15H24O,结合Metlin数据库推测为石竹素。
化合物24497.246 9 [M + Na]+,分子量474,失去1分子HCOOH产生碎片451.082 5,分子式C27H38O7,结合HMDB数据库推测为赤芝酸l。
2.1.3 黄酮类化合物
黄酮苷类化合物易脱去糖基形成黄酮苷元,黄酮苷元和对应的黄酮类化合物裂解规律一样,即黄酮结构中的C环的C1与C2位和C3与C4位已发生RDA裂解反应,产生A环和B环2个碎片离子。
化合物25611.160 5 [M + H]+,分子量610,失去1分子鼠李糖基(146)产生碎片465.238 2,继续失去1分子葡萄糖基产生碎片303.151 3,分子式C27H30O16,结合文献[34]推测为芦丁。
化合物26433.111 9 [M + H]+,分子量432,失去1分子C4H8O4(120)产生碎片313.061 1,继续失去1分子醛基产生碎片283.058 8,分子式C21H20O10,结合文献[35]推测为异牡荆素。
化合物27465.101 9 [M + H]+,分子量464,失去1分子葡萄糖基产生碎片303.054 2,分子式C21H20O12,结合Metlin数据库推测为异懈皮苷。
化合物28595.1648 [M + H]+,分子量为594,失去1分子脱氧己糖-己糖基(308)产生碎片287.055 4,分子式为C27H30O15,结合Metlin数据库推测为野黄芩素-7-新橘皮糖苷。
化合物29287.053 4 [M + H]+,分子量286,失去1分子CO(28)产生碎片259.043 6,分子式C15H10O6,结合文献[32,34]推测为山奈酚。
化合物30449.106 8 [M + H]+,分子量448,失去1分子半乳糖基产生碎片287.055 2,分子式C21H20O11,结合Metlin数据库推测为山柰酚-3--d-半乳糖甙。
化合物31271.058 6 [M + H]+,分子量270,失去2分子CO产生碎片215.081 2,分子式C15H10O5,结合文献[36]推测为高良姜素。
化合物32491.117 2 [M + H]+,分子量490, 失去1分子乙酰基葡萄糖苷(204)产生碎片287.071 6, 分子式C23H22O12,结合Metlin数据库推测为矢车菊素-3-(6-乙酰葡糖苷)。
化合物33479.114 3 [M + H]+,分子量478,失去1分子葡萄糖苷产生碎片317.009 9,分子式C22H22O12,结合Metlin数据库推测为矮牵牛素葡萄糖苷。
化合物34303.048 7 [M + H]+,分子量302,C环1、3位RDA裂解产生碎片153.034 7, 分子式C15H10O7,结合文献[37]推测为槲皮素。
化合物35401.122 1 [M + H-H2O]+,分子量418,失去1分子葡萄糖苷产生碎片239.139 7,分子式C21H22O9,结合文献[38]推测为新甘草苷。
2.1.4 脂肪醇类化合物
化合物36200.199 4 [M + CAN + H]+,分子量158,失去1分子H2O产生碎片182.086 3,分子式C10H22O,结合HMDB数据库推测为1-癸醇。
化合物37228.230 9 [M + CAN + H]+,分子量186,失去1分子H2O产生碎片210.072 3,分子式C12H26O,结合HMDB数据库推测为十二醇。
2.1.5 脂肪酸和有机酸类化合物
化合物38305.235 6 [M + H]+,分子量304,失去1分子HCOOH产生碎片259.082 1,分子式C16H32O5,结合Metlin数据库推测为紫胶桐酸。
化合物39211.167 6 [M + H]+,分子量210, 失去1分子HCOOH产生碎片165.086 0, 分子式C13H22O2,结合Metlin数据库推测为7-十三炔酸。
化合物40305.245 7 [M + H]+,分子量304,失去1分子HCOOH产生碎片259.023 6,分子式C20H32O2,结合Metlin数据库推测为5,11,14, 17-二十碳四烯酸。
化合物41293.209 8 [M + H]+,分子量292,失去1分子HCOOH产生碎片247.226 8,分子式C18H28O3,结合Metlin数据库推测为12,13-环氧-9,11,15-十八碳三烯酸。
化合物42311.220 1 [M + H]+,分子量310, 失去1分子HCOOH产生碎片265.219 3, 分子式C18H30O4,结合Metlin数据库推测为9-氧代-11- (3-戊基-2-环氧乙烷基)-10()-十一烯酸。
化合物43383.278 6 [M + H-2H2O]+, 分子量418, 失去1分子HCOOH产生碎片337.231 5,分子式C22H42O7,结合HMDB数据库推测为棕榈酰葡萄糖苷酸。
化合物44295.225 7 [M + H-H2O]+,分子量312,失去1分子HCOOH产生碎片249.087 0,分子式C18H32O4,结合Metlin数据库推测为13-过氧羟基-9,11-十八碳二烯酸。
化合物45376.102 1 [M + CAN + Na]+,分子量312, 失去1分子HCOOH产生碎片330.061 8,分子式C14H16O8,结合HMDB数据库推测为3,4,5-三羟基-6-[(2-苯乙酰基)氧基]氧烷-2-羧酸。
化合物46537.2116 [M + 2Na-H]+,分子量492,失去1分子HCOOH产生碎片491.280 0,分子式C26H36O9,结合HMDB数据库推测为4-羟基视黄酸葡糖苷酸。
化合物47309.204 7 [M + H-H2O]+,分子量326,失去1分子HCOOH产生碎片263.238 0,分子式C18H30O5,结合Metlin数据库推测为2,3-丁炔-8-异构前列腺素。
化合物48339.251 9 [M + H-H2O]+,分子量356,失去1分子HCOOH产生碎片293.0989,分子式C20H36O5,结合HMDB数据库推测为13,14-二氢前列腺素。
2.1.6 生物碱类和其他类化合物
化合物49273.120 1 [2M + K]+,分子量117, 失去2分子HCOOH产生碎片181.072 3, 分子式C5H11NO2,结合HMDB数据库推测为5-氨基颉草酸。
化合物50441.118 2 [M + CH3OH + H]+,分子量408, 失去1分子环己胺盐(99)产生碎片342.077 5, 再失去1分子葡萄糖苷酸(194)产生碎片148.072 6, 分子式为C20H28N2O7,结合HMDB数据库推测为3-吲哚基--d-葡糖苷酸环己胺盐。
化合物51374.143 8 [M + H-2H2O]+, 分子量409,失去1分子葡萄糖苷酸(194)产生碎片180.057 6,分子式C16H27NO11,结合HMDB数据库推测为软骨d-葡萄糖醛酸。
化合物52206.043 2 [M + H]+,分子量205,失去1分子HCOOH产生碎片160.054 4,分子式C10H7NO4,结合Metlin数据库推测为4,8-二羟基喹啉-2-甲酸。
化合物53309.086 5 [M + H]+,分子量为308, 失去1分子羟基(17)产生碎片292.083 0, 再失去1分子NH3产生碎片275.085 6, 分子式C17H12N2O4,结合Metlin数据库推测为酒渣碱。
化合物54316.284 0 [M + H]+,分子量315,失去1分子羟基产生碎片299.285 5,再失去1分子NH3产生碎片282.271 4,分子式C18H37NO3,结合Metlin数据库推测为6-羟基鞘氨醇。
化合物55462.339 9 [M + H]+,分子量为461,失去1分子半乳糖苷产生碎片300.383 8, 分子式C24H47NO7,结合Metlin数据库推测为神经鞘氨醇半乳糖苷。
化合物56302.304 4 [M + H]+,分子量301, 失去1分子羟基产生碎片285.061 0, 再失去1分子NH3产生碎片268.043 4, 分子式C18H39NO2, 结合Metlin数据库推测为d-赤式-C18-二氢-d-神经鞘氨醇。
化合物57708.489 4 [M + H-H2O]+,分子量725,失去1分子H2O产生碎片690.423 7, 分子式C43H67NO8,结合HMDB数据库推测为螺环内酯。
化合物58490.363 3 [M + H-H2O]+,分子量507,失去1分子H2O产生碎片472.278 0,分子式C26H54NO6P,结合HMDB数据库推测为溶血磷脂。
化合物59338.341 0 [M + H]+,分子量337,失去1分子C19H37(265)产生碎片73.375 6, 再脱去CH2产生碎片59.364 0,分子式C26H54NO6P, 结合文献[39]推测为芥酸酰胺。
化合物60328.138 7 [M + CAN + H]+,分子量286,失去1分子H2O产生碎片310.269 9, 分子式C13H18O7,结合文献[40]推测为水杨甙。
化合物61504.170 2 [M + CAN + H]+,分子量462,失去1分子H2O产生碎片486.106 5, 分子式C17H28O13,结合HMDB数据库推测为海藻酸丙二醇酯。
化合物62463.122 2 [M + K]+,分子量424,失去1分子H2O产生碎片445.129 4,分子式C20H24O10,结合HMDB数据库推测为芸香素。
化合物63417.117 4 [M + H]+,分子量416,失去1分子H2O产生碎片399.110 3,分子式C21H20O9,结合Metlin数据库推测为13-二氢阿霉酮。
化合物64235.167 5 [M + H]+,分子量234,失去1分子H2O产生碎片217.154 4,分子式C15H22O2,结合Metlin数据库推测为日齐醇。
化合物65309.204 4 [M + H]+,分子量308,失去1分子H2O产生碎片291.187 3,分子式C18H28O4,结合Metlin数据库推测为Soraphen O。
化合物66263.237 3 [M + H]+,分子量262, 失去1分子C3H6O (58)产生碎片205.220 8, 分子式C18H30O,结合文献[41]推测为法尼基丙酮。
提取物中相对含量较高的成分有野黄芩素-7-新橘皮糖苷(21.59%)、3-吲哚基--d-葡糖苷酸环己胺盐(12.36%)、螺环内脂E (10.25%)、芦丁(6.19%)、海藻酸丙二醇酯(3.46%)、山柰酚-3--d-半乳糖甙(3.41%)和4,8-二羟基喹啉-2-甲酸(3.00%)等。
黄酮类和生物碱类成分是蚕豆花水提取物中相对含量最高的2类成分, 分别达到36.53%和34.33%,黄酮类和生物碱类是蚕豆花水提取物的主要物质基础,对蚕豆花水的功效发挥具有重要作用。生物碱类成分有17种, 3-吲哚基--d-葡糖苷酸环己胺盐、螺环内脂E、4,8-二羟基喹啉-2-甲酸、酒渣碱、6-羟基鞘氨醇和软骨素d-葡萄糖醛酸相对含量较高,分别为12.36%、10.25%、3.00%、2.91%、1.08%和1.05%;黄酮类成分有16种,包括有2种花青素[矢车菊素- 3-(6-乙酰葡糖苷)和芍药素-3--葡萄糖苷],野黄芩素-7-新橘皮糖苷、芦丁、山柰酚-3--d-半乳糖甙和异牡荆素相对含量较高,分别为21.59%、6.19%、3.41%和2.21%。
本研究还检测到12种氨基酸和18种肽类成分,总相对含量分别达3.67%和4.05%,主要包括色氨酸、缬氨酸、异亮氨酸、亮氨酸、谷氨酸、天冬氨酸、丝氨酸、脯氨酸、甘氨酸、苯丙氨酸、赖氨酸、丙氨酸、苏氨酸和瓜氨酸等氨基酸成分。11种萜类成分,相对含量均小于1%,其中3种单萜类成分:京尼平酸、芳樟醇氧化物d 3-芹菜糖基(1-6)葡萄糖甙和L-紫苏醇;5种倍半萜类成分:脱落酸、5--甲基-melledonal、二氢猕猴桃内酯、石竹素和-姜黄烯; 1种二萜类成分:水芹烯二聚物; 2种三萜类成分:赤芝酸l和安息香胶酸。9种脂肪酸成分, 12, 13-环氧-9,11,15Z-十八碳三烯酸、棕榈酰葡萄糖苷酸、9-氧代-11-(3-戊基-2-环氧乙烷基)-10()-十一烯酸和紫胶桐酸相对含量较高, 分别为2.77%、1.87%、1.55%和1.16%。9种有机酸和3种脂肪醇成分,相对含量均小于1%。
2.2 抗氧化活性分析
从图2可见,蚕豆花水提取物对DPPH和ABTS+自由基的清除能力均高于维生素C,其IC50值分别为26.5和25.0g/mL,表明蚕豆花水提取物具有较强的DPPH和ABTS+自由基清除能力。
3 结论和讨论
黄酮类化合物属植物次生代谢产物,是广泛存在于植物中具有功效活性的一类化合物,黄酮类化合物普遍具有良好的抗氧化、抑菌作用,能够防治血管疾病、调节动物激素水平和提高机体免疫力。蚕豆花水提取物中野黄芩素-7-新橘皮糖苷和山柰酚-3--d-半乳糖甙都以糖苷的形式存在,其中野黄芩素能通过抑制EGFR/ERK1/2通路的激活来抑制结肠癌发生发展[42],同时具有抗炎镇痛[43]、活血化瘀和祛风除湿等功效;山柰酚具有良好的抗癌活性,能抑制肺癌、肝癌、结肠癌和卵巢癌等多种恶性肿瘤的发生发展,主要通过促使癌细胞内活性氧生成,诱导癌细胞发生线粒体途径凋亡来起到抗癌作用[44],同时具有抗炎、抗氧化、抗菌、抗病毒等多种功效。芦丁具有抗氧化、抗炎、抗肿瘤、抗病毒、预防和治疗心脑血管疾病等作用[45];异牡荆素具有降血糖、抗菌、调节记忆、抑制-葡萄糖苷酶、降血压和抗氧化等作用。
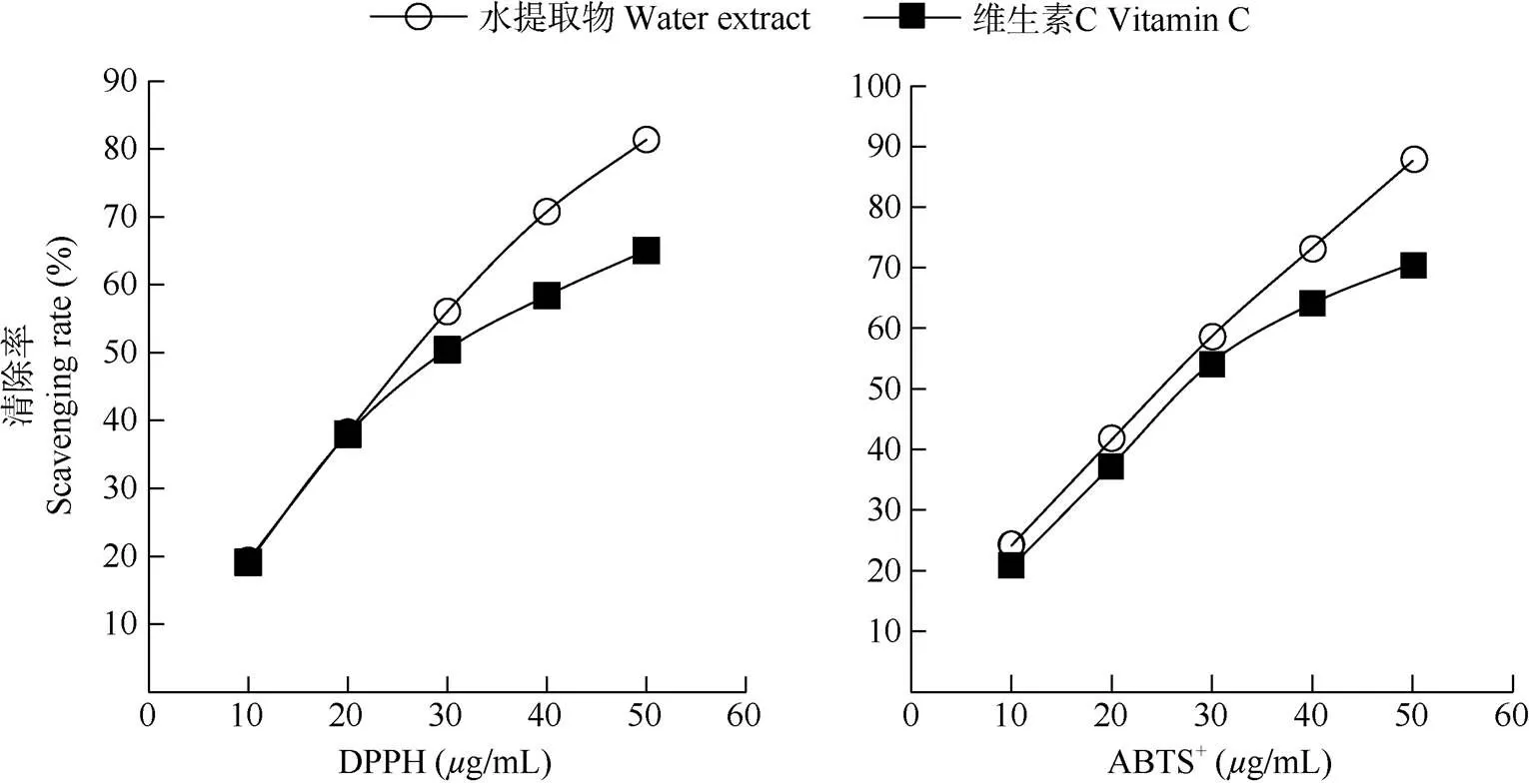
图2 蚕豆花水提取物DPPH和ABTS+自由基清除能力
生物碱类化合物种类较多,具有多种药理活性。蚕豆花水提取物中酒渣碱具有抗HIV、抗菌和预防癌症等作用[46];6-羟基鞘氨醇可以抑制结肠癌细胞的生长[47];软骨素d-葡萄糖醛酸中葡醛酸是抗坏血酸的前体,葡醛酸参与糖代谢,其与冰乙酸内酯化形成葡醛内酯,葡醛内酯具有减肥、增强能量、抗衰老等功效,常用于功能性饮料、化妆品和食品等领域[48]。
本研究结果表明,蚕豆花水提取物还含有多种氨基酸类和萜类成分,具有较高的功效作用和营养价值。蚕豆花水提取物含有7种人类必需氨基酸: 色氨酸、缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸、赖氨酸和苏氨酸,氨基酸种类丰富,营养价值高。萜类化合物中京尼平酸具有抗氧化、抗应激等药理作用;芳樟醇氧化物是一种多香韵的香料,具有强烈的甜香、木香和花香[49];二氢猕猴桃内酯是类胡萝卜素裂解产物之一[50],具有木香和麝香气味[51]; 石竹素具有细胞修复和再生功能[52];-姜黄烯为姜黄类药物的主要活性成分[53];赤芝酸l是药用真菌赤芝的主要成分之一[54]。
本研究利用UPLC-ESI-QTOF质谱联用技术从蚕豆花水提取物中鉴定出178种化学成分,相对含量大于0.01%的成分有107种,其中16种黄酮类和17种生物碱类成分, 相对含量分别为36.53%和34.33%,是蚕豆花发挥功效的主要物质基础。蚕豆花水提取物具有较强的抗氧化能力,其清除DPPH和ABTS+自由基的IC50分别为26.5和25.0g/mL, 表明蚕豆花提取物具有丰富的药效成分和高抗氧化活性,在医药、保健品、功能食品和化妆品等领域具有良好的应用前景。
[1] WANG K H, WANG X J, MIAO Y M, et al. Breeding and cultivation of high-quality and fresh large-grain broad bean Tong-Can-Xian 8 [J]. Jiangsu J Agric Sci, 2013, 41(11): 113–115. doi: 10.3969/j.issn.1002- 1302.2013.11.043.
汪凯华, 王学军, 缪亚梅, 等. 优质鲜食大粒蚕豆通蚕鲜8号的选育和栽培要点 [J]. 江苏农业科学, 2013, 41(11): 113–115. doi: 10. 3969/j.issn.1002-1302.2013.11.043.
[2] LÜ C Y, LIAO F L, CHEN H W, et al. Identification and evaluation of yield traits of 41germplasm resources from African areas and Hubei, China [J]. J S Agric, 2018, 49(12): 2356–2363. doi: 10. 3969/j.issn.2095-1191.2018.12.02.
吕春雨, 廖芳丽, 陈宏伟, 等. 41份非洲地区和我国湖北蚕豆种质资源产量性状的鉴定与评价 [J]. 南方农业学报, 2018, 49(12): 2356– 2363. doi: 10.3969/j.issn.2095-1191.2018.12.02.
[3] XIA M Z, XIONG F Q. Effects of change in source-sink ratio on the anscission of broad bean flower and pod [J]. Plant Physiol Commun, 1986, 22(1): 18–21. doi: 10.13592/j.cnki.ppj.1986.01.005.
夏明忠, 熊仿秋. 改变源-库比率对蚕豆花荚脱落的影响[J]. 植物生理学通讯, 1986, 22(1): 18–21. doi: 10.13592/j.cnki.ppj.1986.01. 005.
[4] KINJO J, HATAKEYAMA M, UDAYAMA M, et al. HPLC profile analysis of oleanene-glucuronides in several edible beans [J]. Biosci Biotechnol Biochem, 1998, 62(3): 429–433. doi: 10.1271/bbb.62.429.
[5] HA T J, LEE B W, PARK K H, et al. Rapid characterisation and comparison of saponin profiles in the seeds of Koreanspecies using ultra performance liquid chromatography with photo- diode array detector and electrospray ionisation/mass spectrometry (UPLC-PDA-ESI/MS) analysis [J]. Food Chem, 2014, 146: 270–277. doi: 10.1016/j.foodchem.2013.09.051.
[6] ARISAWA M, TAKAKUWA T, HANDA K. Studies on unutilized resources: VI. The components of the flavonoids ingenus plants. (1). Flavonoids ofL. andAL. BR. (Leguminosae) [J]. Yakugaku Zasshi, 1971, 91(5): 587–589. doi: 10.1248/yakushi1947. 91.5_587.
[7] SPANOU C, VESKOUKIS A S, KERASIOTI T, et al. Flavonoid gly- colsides isolated from unique legume plant extracts as novel inhibitors of xanthine oxidase [J]. PLoS One, 2012, 7(3): e32214. doi: 10.1371/ journal.pone.0032214.
[8] SPANOU C, BOUROU G, DERVISHI A, et al. Antioxidant and chemopreventive properties of polyphenolic compounds derived from Greek legume plant extracts [J]. J Agric Food Chem, 2008, 56(16): 6967–6976. doi: 10.1021/jf800842p.
[9] MERGHEM R, JAY M, BRUN N, et al. Qualitative analysis and HPLC isolation and identification of procyanidins from[J]. Phytochem Anal, 2004, 15(2): 95–99. doi: 10.1002/pca.731.
[10] CATALANO G, FOSSEN T, ANDERSEN Ø M. Petunidin 3---rham- nopyranoside-5---glucopyranoside and other anthocyanins from flowers of[J]. J Agric Food Chem, 1998, 46(11): 4568– 4570. doi: 10.1021/jf980558e.
[11] SINHA S K, KUMAR M, KUMAR A, et al. Antioxidant activities of different tissue extract of Faba bean (L.) containing phenolic compounds [J]. Legume Res, 2013, 36(6): 496–504.
[12] YAN E, LIU J L, YUAN J F, et al. Study on extraction and antioxi- dation activity of procyanidins from broad bean shell [J]. Sci Technol Food Ind, 2009, 30(2): 65–67. doi: 10.13386/j.issn1002-0306.2009.02. 089.
阎娥, 刘建利, 原江锋, 等. 蚕豆壳中原花青素的提取及抗氧化性研究[J]. 食品工业科技, 2009, 30(2): 65–67. doi: 10.13386/j.issn 1002-0306.2009.02.089.
[13] SIAH S D, KONCZAK I, AGBOOLA S, et al.investigations of the potential health benefits of Australian-grown faba beans (L.): Chemopreventative capacity and inhibitory effects on the angio- tensin-converting enzyme,-glucosidase and lipase [J]. Br J Nutr, 2012, 108(S1): S123–S134. doi: 10.1017/S0007114512000803.
[14] XU X Y, LI A P, KANG Z M, et al. Research progress of chemical constituents and pharmacological activities ofgenus [J]. Chin Agric Sci Bull, 2015, 31(31): 74–80.
徐晓俞, 李爱萍, 康智明, 等. 野豌豆属植物化学成分及其药理活性研究进展[J]. 中国农学通报, 2015, 31(31): 74–80.
[15] GUO X Q, CAO J M, DAI Y W. The quality research about broadbean flower [J]. Chin J Ethnomed Ethnopharm, 2014, 23(23): 6–7.
郭向群, 曹建民, 代玉文. 蚕豆花药材的质量研究[J]. 中国民族民间医药, 2014, 23(23): 6–7.
[16] GUO X Q, CAO J M, DAI Y W.The simultaneous content determi- nation of quercetin and kamepferol in broadbean flower by HPLC [J]. Strait Pharm J, 2014, 26(11): 56–57. doi: 10.3969/j.issn.1006-3765. 2014.11.020.
郭向群, 曹建民, 代玉文. HPLC法同时测定蚕豆花中槲皮素和山奈酚的含量[J]. 海峡药学, 2014, 26(11): 56–57. doi: 10.3969/j.issn. 1006-3765.2014.11.020.
[17] XIA M Z.[J]. J Sichuan Agric Univ2001, 19(4): 348–351. doi: 10.3969/j.issn.1000-2650.2001.04.008.
夏明忠. 环境因素对蚕豆花荚形成和脱落的影响[J]. 四川农业大学学报, 2001, 19(4): 348–351. doi: 10.3969/j.issn.1000-2650.2001.04. 008.
[18] WANG Y Z, CUI K R, GONG K. Interrelation between development process of anther and ovule inL. [J]. Acta Bot Boreali-Occid Sin, 1986, 6(1): 36–42.
王耀芝, 崔凯荣, 宫葵. 蚕豆花药和胚珠发育进程的相互关系[J]. 西北植物学报, 1986, 6(1): 36–42.
[19] KRAMELL R, SCHMIDT J, HERRMANN G, et al.-(jasmonoyl) tyrosine-derived compounds from flowers of broad beans () [J]. J Nat Prod, 2005, 68(9): 1345–1349. doi: 10.1021/np0501482.
[20] ZHENG K B, LI A P, CAO Y Y, et al. Development of high perfor- mance liquid chromatography for determination of l-dopa fromflower [J]. Jiangsu J Agric Sci, 2012, 28(3): 688–690. doi: 10. 3969/j.issn.1000-4440.2012.03.046.
郑开斌, 李爱萍, 曹奕鸯, 等. 蚕豆花左旋多巴液相色谱检测方法的建立[J]. 江苏农业学报, 2012, 28(3): 688–690. doi: 10.3969/j.issn. 1000-4440.2012.03.046.
[21] LÜ X F, ZHOU X H, WANG Y, et al. Component analysis ofanthocyanin extract and its antioxidant activity and irritation[J].J Trop Subtrop Bot, 2021, 29(4): 374–381. doi: 10.11926/jtsb.4327.
吕晓帆, 周新红, 王莹, 等. 秋石斛花青素提取液成分分析及其体外抗氧化活性和刺激性研究[J]. 热带亚热带植物学报, 2021, 29(4): 374–381. doi: 10.11926/jtsb.4327.
[22] SUN S W, LIU M J, HE J, et al. Identification and determination of seven phenolic acids in Brazilian green propolis by UPLC-ESI-QTOF- MS and HPLC [J]. Molecules, 2019, 24(9): 1791. doi: 10.3390/molecu les24091791.
[23] DOS SANTOS A T L, CARNEIRO J N P, DA CRUZ R P, et al. UPLC- MS-ESI-QTOF analysis and antifungal activity of theArruda leaf and root hydroalcoholic extracts [J]. Antibiotics, 2019, 8(4): 240. doi: 10.3390/antibiotics8040240.
[24] DONG R H, YU Q, LIAO W, et al. Composition of bound polyphenols from carrot dietary fiber and itsandantioxidant activity [J]. Food Chem, 2021, 339: 127879. doi: 10.1016/j.foodchem.2020. 127879.
[25] XU C, CHEN W J, YU J H, et al.[J]., 2016, 37(5): 440–445. doi: 10.7538/zpxb. youxian.2016.0018.
徐晨, 陈维佳, 于江洪, 等. 基于液相色谱-质谱的代谢组学方法研究卷柏治疗高尿酸血症大鼠的作用机制[J]. 质谱学报, 2016, 37(5): 440–445. doi: 10.7538/zpxb.youxian.2016.0018.
[26] YE J, YANG M J, YANG X Y, et al. Analysis of chemical constituents invar.folium by UPLC-QTOF-MS [J]., 2019, 31(7): 1183-1191. doi: 10.16333/j.1001-6880. 2019.7.010.
叶嘉, 杨明建, 杨香瑜, 等. 太行山区酸枣叶化学成分的UPLC- QTOF-MS分析[J]. 天然产物研究与开发, 2019, 31(7): 1183–1191. doi: 10.16333/j.1001-6880.2019.7.010.
[27] BALTRUŠAITYTĖ V, VENSKUTONIS P R, ČEKSTERYTĖ V. Radical scavenging activity of different floral origin honey and beebread phenolic extracts [J]. Food Chem, 2007, 101(2): 502–514. doi: 10.1016/j. foodchem.2006.02.007.
[28] GUAN Y, WANG J F, LI W, et al. Changes in major nutritional components and antioxidant activity of fermented okara [J]. Food Sci, 2016, 37(21): 189–194. doi: 10.7506/spkx1002-6630-201621032.
管瑛, 汪瑨芃, 李文, 等. 豆渣固态发酵过程中主要营养成分及抗氧化特性变化[J]. 食品科学, 2016, 37(21): 189–194. doi: 10.7506/ spkx1002-6630-201621032.
[29] BADING-TAIKA B, AKINYEKE T, MAGANA A A, et al. Phyto- chemical characterization ofroot bark and its effects on dysfunctional metabolism and cognitive performance in high-fat-fed C57BL/6J mice [J]. JFB, 2018, 3: 111–123. doi: 10.31665/ JFB.2018.3154.
[30] BAO W, CAO C, LI S Q, et al. Metabonomic analysis of quercetin against the toxicity of acrylamide in rat urine [J]. Food Funct, 2017, 8(3): 1204–1214. doi: 10.1039/C6FO01553K.
[31] XU X Y, LI C X, ZHENG K B, et al. Chemical constituents of water extract fromflowers by UHPLC-ESI- Orbitrap MS [J]. J Trop Subtrop Bot, 2021, 29(1): 96–104. doi: 10. 11926/jtsb.4256.
徐晓俞, 李程勋, 郑开斌, 等. 杭白菊花水提物的UHPLC-ESI- Orbitrap质谱联用分析[J]. 热带亚热带植物学报, 2021, 29(1): 96– 104. doi: 10.11926/jtsb.4256.
[32] TAN Y. Multiomics integrative analysis for discovering the mechanism of dioscin lowering uric acid in hyperuricemia mice [D]. Tianjin: Tianjin University of Traditional Chinese Medicine, 2021. doi: 10. 27368/d.cnki.gtzyy.2021.000471.
谈谣. 多组学综合分析薯蓣皂苷对高尿酸血症小鼠的降尿酸机制[D]. 天津: 天津中医药大学, 2021. doi: 10.27368/d.cnki.gtzyy.2021. 000471.
[33] TANG M, GAO X, GENG T, et al. Identification of chemical consti- tuents in Qiwei Tongbi oral liquid by HPLC-Q-TOF-MS/MS [J]. Chin Trad Herb Drugs, 2021, 52(8): 2226–2236. doi: 10.7501/j.issn.0253. 2670.2021.08.005.
唐明, 高霞, 耿婷, 等. 基于HPLC-Q-TOF-MS/MS技术的七味通痹口服液化学成分分析[J]. 中草药, 2021, 52(8): 2226–2236. doi: 10.7501/j.issn.0253.2670.2021.08.005.
[34] ZHANG Y Y. Metabolomics study of non-volatile components in the processing of fu brick tea [D]. Changsha: Hunan Agricultural University, 2019. doi: 10.27136/d.cnki.ghunu.2019.000559.
张贻杨. 茯砖茶加工过程中非挥发性成分代谢组学研究[D]. 长沙: 湖南农业大学, 2019. doi: 10.27136/d.cnki.ghunu.2019.000559.
[35] XU C, LOU Y, LU Q J, et al. Metabolic research of vitexin in rats [J]. Chin J Mod Appl Pharm, 2018, 35(9): 1365–1369. doi: 10.13748/j. cnki.issn1007-7693.2018.09.021.
徐聪, 楼燕, 卢祺炯, 等. 牡荆素在大鼠体内的代谢研究[J]. 中国现代应用药学, 2018, 35(9): 1365–1369. doi: 10.13748/j.cnki. issn 1007-7693.2018.09.021.
[36] LUO J C. Analysis of diarylheptanoids inby UPLC/Q-TOF MS and study on anti-inflammatory activity of monomer [D]. Guangzhou: Guangdong Pharmaceutical University, 2010.
罗京超. 高良姜中二苯基庚烷的UPLC/Q-TOFMS分析及单体抗炎活性研究[D]. 广州: 广东药学院, 2010.
[37] YIN Z H, SUN C H, FANG H Z. Analysis and comparison on frag- mentation behavior of quercetin and morin by ESI-MS [J]. J Instrum Anal, 2017, 36(2): 205–211. doi: 10.3969/j.issn.1004-4957.2017.02. 009.
尹智慧, 孙长海, 方洪壮. 槲皮素与桑色素ESI-MS裂解行为的比较分析[J]. 分析测试学报, 2017, 36(2): 205–211. doi: 10.3969/j.issn. 1004-4957.2017.02.009.
[38] ZHAO Y M, LIU S X, ZHANG C X, et al. Analysis on chemical constituents from glycyrrhizae radix et rhizoma by HPLC-Q-TOF-MS [J]. Chin Trad Herb Drugs, 2016, 47(12): 2061–2068. doi: 10.7501/ j.issn.0253-2670.2016.12.007.
赵艳敏, 刘素香, 张晨曦, 等. 基于HPLC-Q-TOF-MS技术的甘草化学成分分析[J]. 中草药, 2016, 47(12): 2061–2068. doi: 10.7501/j. issn.0253-2670.2016.12.007.
[39] XU D C, LIU J, LI X J, et al. Study on absorbed components of Xiebai powder in rat blood [J]. China Pharm, 2022, 33(1): 38–45. doi: 10. 6039/j.issn.1001-0408.2022.01.07.
徐东川, 刘瑾, 李晓晶, 等. 泻白散大鼠体内入血成分研究[J]. 中国药房, 2022, 33(1): 38–45. doi: 10.6039/j.issn.1001-0408.2022.01.07.
[40] ZHAO X Y, FU X F, LI J, et al. Determination of salicin, a charac- teristic component of poplar tree gum by HPLC-LTQ-Orbitrap high resolution mass spectrometry [J]. J Instrum Anal, 2016, 35(3): 342–346. doi: 10.3969/j.issn.1004-4957.2016.03.015.
赵晓亚, 付晓芳, 李晶, 等. 高效液相色谱-线性离子阱-静电场轨道阱高分辨质谱测定杨树胶的指标性成分水杨苷[J]. 分析测试学报, 2016, 35(3): 342–346. doi: 10.3969/j.issn.1004-4957.2016.03.015.
[41] FANG G Z, ZHANG L F, ZHANG L, et al. Use of two-dimensional nuclear magnetic resonance technique for identifying the geometric conformation of farnesylacetone [J]. Chin Rem Clin, 2019, 19(9): 1397–1400. doi: 10.11655/zgywylc2019.09.002.
房桂珍, 张丽芳, 张莉, 等. 二维核磁共振技术确定法尼基丙酮的几何构型[J]. 中国药物与临床, 2019, 19(9): 1397–1400. doi: 10. 11655/zgywylc2019.09.002.
[42] LI Y Z, WANG J D, YUE C C, et al.[J]., 2021, 28(20): 12–16. doi: 10.3969/j.issn.1674-4721. 2021.20.005.
李远志, 王钧冬, 岳朝驰, 等. 野黄芩素在结肠癌发生发展中的作用机制研究[J]. 中国当代医药, 2021, 28(20): 12–16. doi: 10.3969/j. issn.1674-4721.2021.20.005.
[43] YANG Y, JIANG C H, JIN Q M, et al. Effect of scutellarein on acute pharyngitis in rats [J]. J China Pharm Univ, 2019, 50(5): 600–605. doi: 10.11665/j.issn.1000-5048.20190514.
杨阳, 蒋翠花, 金乔梅, 等. 野黄芩素对大鼠急性咽炎的治疗作用[J]. 中国药科大学学报, 2019, 50(5): 600–605. doi: 10.11665/j.issn. 1000-5048.20190514.
[44] ZHONG W L, XIONG Y, WANG X W, et al. Anti-tumor effect and mechanism of kaempferol: A review [J]. Chin J Exp Trad Med Formul, 2021, 27(20): 219–226. doi:
钟文良, 熊雨, 王贤文, 等. 山柰酚抗肿瘤效应与机制研究进展[J].中国实验方剂学杂志, 2021, 27(20): 219–226. doi:
[45] MAO Y J, FENG Y L, WANG M J, et al. Research progress on rutin derivatives [J]. China J Chin Mat Med, 2021, 46(18): 4654–4665. doi: 10.19540/j.cnki.cjcmm.20210429.602.
毛雅君, 冯亚莉, 王梦娇, 等. 芦丁衍生物的研究进展[J]. 中国中药杂志, 2021, 46(18): 4654–4665. doi: 10.19540/j.cnki.cjcmm.2021 0429.602.
[46] YAO L, XU L X, XUE J H, et al. Antibacterial activity and metabolits of an acremonium fungus [J]. J Trop Subtrop Bot, 2012, 20(2): 192– 196. doi: 10.3969/j.issn.1005-3395.2012.02.014.
姚磊, 徐良雄, 薛璟花, 等. 枝顶孢属真菌的抑菌活性及其代谢产物研究[J]. 热带亚热带植物学报, 2012, 20(2): 192–196. doi: 10. 3969/j.issn.1005-3395.2012.02.014.
[47] SONG S L, LI B X, HAN Y F. Inhibitory effect of sphingosine on human colon HT-29 cells [J]. Chin J Publ Health, 2004, 20(7): 775– 776. doi: 10.3321/j.issn:1001-0580.2004.07.003.
宋士利, 李百祥, 韩云峰. 鞘氨醇对人结肠癌细胞的抑制作用[J]. 中国公共卫生, 2004, 20(7): 775–776. doi: 10.3321/j.issn:1001-0580. 2004.07.003.
[48] LU R. Preparation and characterization of glucuronic acid and its lactone [D]. Xian: Shaanxi University of Science & Technology, 2018.
卢瑞. 葡萄糖醛酸及其内酯的制备与表征[D]. 西安: 陕西科技大学, 2018.
[49] GU Y C, QIAN L Q, LI B X, et al. Synthesis of linalool oxide [J]. Flav Frag Cosm, 2013(S1): 28–31. doi: 10.3969/j.issn.1000-4475.2013.z1. 009.
谷运璀, 钱莉群, 李步详, 等. 芳樟醇氧化物的合成[J]. 香料香精化妆品, 2013(S1): 28–31. doi: 10.3969/j.issn.1000-4475.2013.z1.009.
[50] LI S P, HUANG B X, LIU C Y, et al. Rapid determination of vitamin A in food by pyrolysis derivatization gas chromatography triple qua- drupole mass spectrometry [J]. J Food Saf Qual, 2021, 12(4): 1281– 1290. doi: 10.19812/j.cnki.jfsq11-5956/ts.2021.04.004.
李少鹏, 黄濒漩, 刘聪熠, 等. 热裂解衍生气相色谱-三重四极杆质谱法快速测定食品中维生素A [J]. 食品安全质量检测学报, 2021, 12 (4): 1281–1290. doi: 10.19812/j.cnki.jfsq11-5956/ts.2021.04.004.
[51] WANG Z Z, YANG Y H, ZHANG H X, et al. Volatile and aroma components of(Thunb.) Makino tea from five different origins [J]. Nat Prod Res Dev, 2020, 32(10): 1717–1729. doi: 10.16333/j.1001-6880.2020.10.013.
王忠泽, 杨宇涵, 张红霞, 等. 五个不同产地绞股蓝茶挥发物及香气成分研究[J]. 天然产物研究与开发, 2020, 32(10): 1717–1729. doi: 10.16333/j.1001-6880.2020.10.013.
[52] DENG S R, PAN Y Z. Research on main chemical constituents and pharmacological effects of cinnamon [J]. Mod J Integr Trad Chin West Med, 2018, 27(4): 448–451. doi: 10.3969/j.issn.1008-8849.2018.04.034.
邓淑蓉, 潘宇政. 肉桂主要化学成分及药理作用研究概况[J]. 现代中西医结合杂志, 2018, 27(4): 448–451. doi: 10.3969/j.issn.1008- 8849.2018.04.034.
[53] YANG H, BAI X F, YANG L Y, et al. A methodological study of the determination of-curcumene in Sri Lanka Turmeric [J]. J Yunnan Minzu Univ (Nat Sci), 2020, 29(3): 190–194. doi: 10.3969/j.issn.1672- 8513.2020.03.002.
杨瀚, 白雪飞, 杨丽英, 等. 斯里兰卡姜黄中-姜黄烯含量测定的方法学研究[J]. 云南民族大学学报(自然科学版), 2020, 29(3): 190– 194. doi: 10.3969/j.issn.1672-8513.2020.03.002.
[54] CHEN X Q, LI S P, ZHAO J. Ganoderma triterpenoids from aqueous extract of[J]. China J Chin Mat Med, 2017, 42 (10): 1908–1915. doi: 10.19540/j.cnki.cjcmm.20170412.001.
陈显强, 李绍平, 赵静. 赤芝水提取物中的三萜类成分[J]. 中国中药杂志, 2017, 42(10): 1908–1915. doi: 10.19540/j.cnki.cjcmm.2017 0412.001.
UPLC-ESI-QTOF Mass Spectrometry Analysis and Antioxidant Activity of Water Extract fromFlowers
LI Chengxun1, XU Xiaoyu1, LI Aiping1*, ZHENG Kaibin2*
(1. Crop Research Institute, Fujian Academy of Agricultural Sciences,Fuzhou 350013, China; 2. Fujian Academy of Agricultural Sciences,Fuzhou 350003, China)
In order to clarify the pharmacodynamic basis of water extractfromflowers, the chemical constituents were analyzed and identified by ultra performance liquid chromatography electrospray ion source quadrupole time of flight mass spectrometry (UPLC-ESI-QTOF-MS), and the antioxidant activity was determined. The results showed that 178 components were identified from the water extract, and the relative contents of 107 components were more than 0.01%. The components with higher relative content included scutellarein 7-neohesperidoside, indoxyl glucuronide, spirolide E, rutin, propylene glycol alginate, kaempferol 3--d- galactoside, xanthurenic acid, and so on. The main components of flower water extract were flavonoids and alkaloids, with 16 and 19 kinds, and their relative contents were 36.53% and 34.33%, respectively. The IC50of flower water extract for scavenging DPPH and ABTS+free radical was 26.5 and 25.0g/mL, respectively. Therefore, flavonoids and alkaloids were the main substance basis offlower, and the water extract had strong antioxidant activity, indicatingflowers had high application value.
flower; Water extract; Chemical constituent; Antioxidant
10.11926/jtsb.4596
2021-12-17
2022-05-06
福建省科技计划公益类专项(2021R1031004);福建省农业科学院科技创新团队建设项目(CXTD2021011-2);福建省“5511”协同创新工程(XTCXGC2021019)资助
This work was supported by the Special Project for Public Welfare for Research Institute in Fujian (Grant No. 2021R1031004), the Project for Scientific and Technological Innovation Team Construction of Fujian Academy of Agricultural Sciences (Grant No. CXTD2021011-2), and the Project for “5511” Collaborative Innovation in Fujian (Grant No.XTCXGC2021019).
李程勋(1991生),男,硕士,研究实习员,研究方向为作物遗传品质育种与农产品天然产物提取。E-mail: 1219513539@qq.com
. E-mail: apl909@163.com; k03163@163.com
