Cu-Mn-BTC MOF催化C3H6选择性还原NO的性能
2022-10-17苏亚欣徐国强温妮妮
刘 权 ,苏亚欣 *,徐国强,温妮妮,周 皞
(1.东华大学环境科学与工程学院,上海 201620; 2.常州工程技术学院智能制造学院,常州 213164)
石油化工、化石燃料燃烧、农药及化肥等生产活动是氮氧化物的主要来源,过量排放氮氧化物会造成一系列大气污染问题,对人类健康和生活环境带来严重危害。 NOx的脱除一直是世界各国研究者关注的焦点,1990年,Iwamoto M等[1]率先报道在富氧条件下利用烃类作为还原剂可以有效去除NO,自此引发了研究者的很大兴趣。由于HC-SCR能够实现污染气体中烃类和氮氧化物的同时去除,HC-SCR被认为是极具发展前景的烟气脱硝技术。近年来,研究人员对金属氧化物、贵金属、柱撑黏土、分子筛和水滑石等催化剂催化烃类还原NO进行了大量研究[2-9],但离实际工业运用存在差距。如贵金属类催化剂低温活性好,但存在N2选择性差等问题;金属氧化物类催化剂水热稳定性好,但活性温度高。因此开发新型高效的催化剂是目前HC-SCR主要的研究方向。C3H6-SCR相关催化剂见表1。
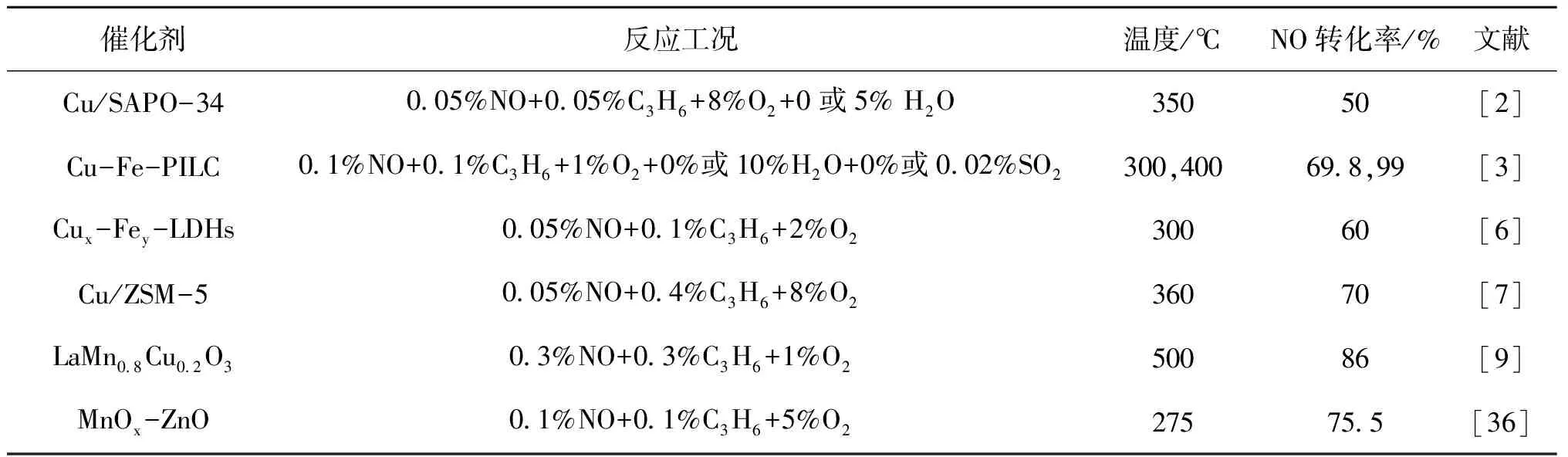
表1 C3H6-SCR相关催化剂
金属有机骨架(MOFs)是由金属离子与有机连接体配合形成的多孔晶体材料,具有比表面积大、孔隙率高、活性位点分散程度高以及结构可调等优点,目前已经被广泛用于气体吸收、污水处理和催化等多个领域[10-13]。为了增强单金属MOFs的相关性能,研究人员将第二金属离子掺入到骨架节点中以制备双金属MOFs。与单金属MOFs相比,具有可调节成分和结构的双金属 MOFs表现出更加优异的性能[14-15]。常见的双金属MOFs合成方法有一步合成法和合成后修饰法,一步合成法是通过在溶剂热合成过程中混合所有金属盐直接制备双金属MOFs,具有操作方便和可应用于工业生产等优点,因此引起了研究者的广泛关注[16]。
目前双金属MOFs在SCR催化领域引起了广泛关注。何汉兵等[17]利用一步合成法制备了Cu1/6-MOF-5催化剂用于CO-SCR脱硝测试,研究发现,Cu掺杂于MOF-5在160 ℃可以实现NO转化率89%,较MOF-5提高了57%。Zhang W等[18]报道了MIL-100(Fe-Mn)的NH3-SCR催化活性优于MIL-100(Fe)和MIL-100(Mn),在(260~300) ℃下表现出转化率超过90%,同时还表现了更好的热稳定性。此外,在 H2O 和 SO2存在下,MIL-100(Fe-Mn)催化剂NO转化率提高了7%。研究表明,第二金属的部分取代使双金属框架产生金属协同效应,同时能够调节材料的物化性质,进而产生较好的催化效果。双金属MOFs是很有潜力的低温SCR催化剂材料,但目前关于MOFs材料在HC-SCR方面的应用未有报道。
相关研究[3,6,7,9]表明,金属Cu有助于低温下还原NO,在中低温(<350 ℃ )表现出较好的催化活性。在已经报道的MOFs材料中,Cu-BTC是最适合应用于催化脱硝的材料之一。Cu-BTC是由二聚四羧酸铜单元组成的配合物([Cu3(BTC)2(H2O)3;BTC=benzene-1,3,5-tricarboxylate,苯-1,3,5-三羧酸盐]),具有较高的比表面积[(1 000~2 000) m2·g-1]和大量开放金属位点等特性,在低温下具有很强的催化性能[19-20]。Shu H等[21]采用溶剂热法合成Cu-BTC用于NH3-SCR,在270 ℃可以达到90%的NO转化率,显示出良好的低温催化效果。Yao Z等[22]利用合成后修饰法制备Mn@Cu3(BTC)2催化NH3还原NO,在(230~260) ℃可以实现接近100%的NO转化率。Mn的引入降低了纳米孔中水的占有率,从而提高了催化剂的脱硝活性。相关研究[22-24]证实,Mn和Cu离子之间的协同作用促进了NO在低温下的转化,有助于提高催化活性。
本文利用一步合成法制备xCu-Mn-BTC,测试其C3H6-SCR的脱硝反应活性,并采用SEM、XRD、BET、H2-TPR、XPS和Py-FTIR等表征方法对催化剂进行表征,分析Mn和Cu对催化C3H6还原NO效率的影响。
1 实验部分
1.1 催化剂制备
Cu-BTC制备:1.772 g硝酸铜(中国医药集团有限公司,分析纯)和0.85 g均苯三甲酸(上海皓鸿生物医药科技有限公司,98%)分别溶解于24 mL去离子水和24 mL无水乙醇,将上述两种溶液移至100 mL反应釜,120 ℃加热24 h,冷却至室温,无水乙醇和去离子水洗涤、离心, 100 ℃干燥12 h。
Mn-BTC制备:将1.23 g醋酸锰(中国医药集团有限公司,分析纯)和3.32 g均苯三甲酸分别溶解于50 mL去离子水和150 mL无水乙醇,将两种溶液混合,25 ℃搅拌15 h,无水乙醇洗涤、离心, 60 ℃干燥12 h。
xCu-Mn-BTC制备:取1.48 g硝酸铜和适量醋酸锰放入烧杯中[分别控制反应物中n(Cu)∶n(Mn)=1、2、4、6],加入30 mL水,1.29 g均苯三甲酸溶解于30 mL无水乙醇,混合移至100 mL水热反应釜中,120 ℃水热反应12 h。去离子水和无水乙醇洗涤,100 ℃干燥12 h。样品标记为xCu-Mn-BTC[x为催化剂中n(Cu)∶n(Mn),x=2.0、3.2、4.2、98]。
1.2 催化剂活性评价
催化剂C3H6-SCR反应活性评价在固定床石英管微型反应器上进行。将0.4 g(24~50)目催化剂置于内径8 mm石英管,两端放置适量石英棉。评估催化剂活性之前, 200 ℃下N2氛围预处理1 h。待测试仪器与催化剂温度降至室温后,进行催化剂活性测试,测试温度(100~350) ℃。常规活性测试气体由体积分数0.1%NO、0.1%C3H6和2%O2组成,N2为平衡气,气体总流量200 mL·min-1。测量催化剂抗水抗硫性能时,在上述气体中分别通入0.02%SO2和5%H2O。通过德国RBRE烟气分析仪、气相色谱仪(GC-4000A)分别测定NO/NO2和C3H6的含量。催化剂C3H6-SCR活性测试反应示意图见图1。
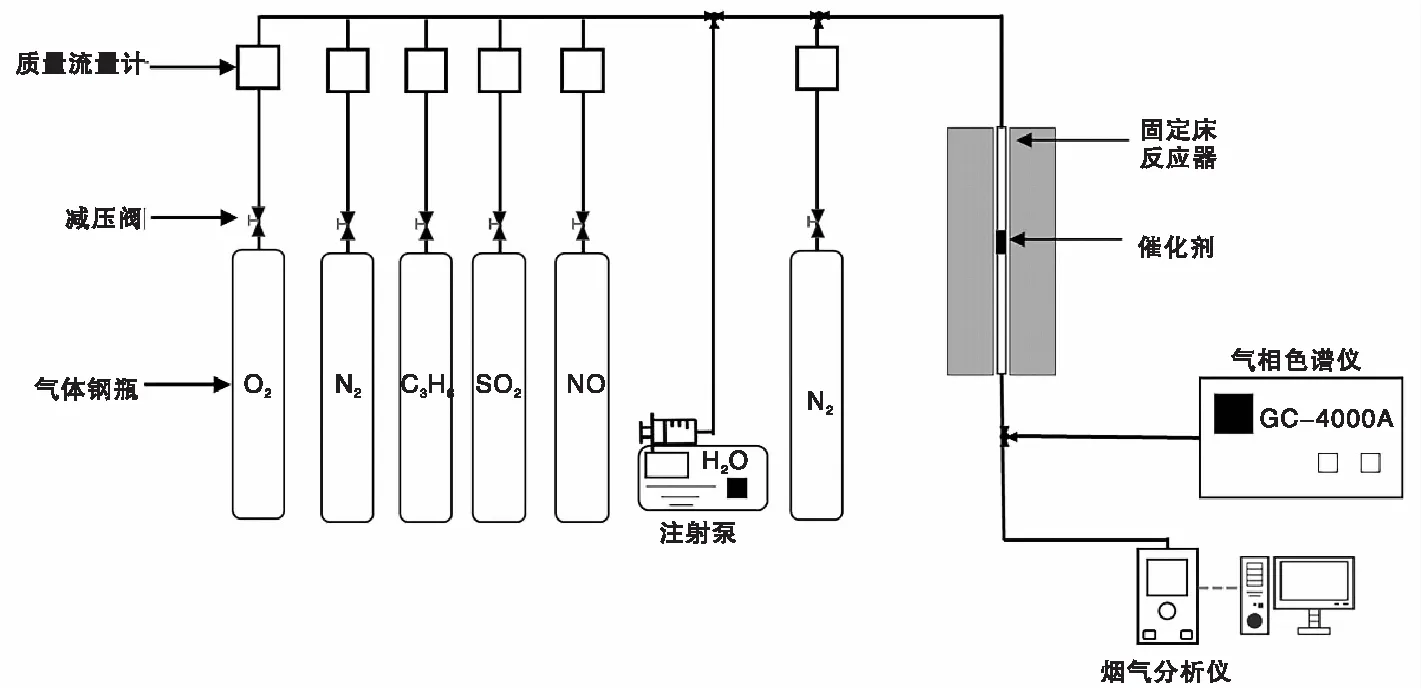
图1 催化剂C3H6-SCR活性测试反应示意图Figure 1 Reaction diagram of catalyst activity test in C3H6-SCR
1.3 催化剂表征
SEM采用日本Jeol公司 JSM-5600LV型扫描电镜进行测试,加速电压(0.5~30) kV,放大倍数18~3×105。
XRD采用日本理学公司DMax-RB型X射线衍射仪进行测试, 5°~80°,扫描速率 2°·min-1。
TGA采用热重分析仪(GA8000 )进行测试,N2氛围,测试温度(25~600) ℃,升温速率5 ℃·min-1。
N2吸附-脱附采用美国康塔公司 Autosorb-iQ型全自动气体吸附仪测量催化剂比表面积以及孔结构。
H2-TPR采用固定床反应器以及气相色谱仪GC-4000A进行测试。催化剂装填量为0.1 g,测试前在200 ℃氮气氛围下处理1 h,待仪器与催化剂冷却至室温,切换H2、N2质量流量计,分别控制 H2和N2流量为1 mL·min-1和19 mL·min-1,检测温度为(100~760) ℃,升温速率3 ℃·min-1,通过检测器TCD测量H2含量。
XPS采用美国赛默飞世尔公司Escalab 250Xi 型电子能谱仪器测试。
Py-IR采用美国PE公司 FT-IR Frontier型吡啶吸附红外光谱仪测定催化剂表面酸性位(L酸和B酸)含量,测试前在200 ℃氮气氛围下预处理1 h,在150 ℃和300 ℃下采集谱图。
式中,K为酸性位吸收系数,其中L酸取1.42,B酸取1.88;I为仪器测定L酸或B酸的峰面积,R、W分别为压片直径(cm)和压片重量(mg)。文中R取1.3 cm,W取19.6 mg。
2 结果与讨论
2.1 催化剂C3H6-SCR活性评价
不同催化剂NO转化率、C3H6转化率及N2选择性如图2所示。
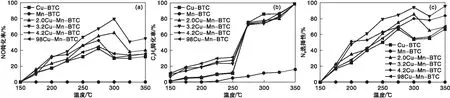
图2 不同催化剂NO转化率、C3H6转化率及N2选择性Figure 2 NO conversion,C3H6 conversion,and N2 selectivity of catalysts
由图2(a)可知,不同催化剂NO还原效率顺序为:3.2Cu-Mn-BTC>2.0Cu-Mn-BTC>4.2Cu-Mn-BTC>98Cu-Mn-BTC>Cu-BTC>Mn-BTC,表明在Cu-BTC框架中引入Mn显著提高了催化剂的脱硝活性。随着框架中Mn含量的增加,NO转化率先增后减,其中3.2Cu-Mn-BTC效率最高,Mn-BTC效率最低。3.2Cu-Mn-BTC在300 ℃效率达到最高80%,继续升温到350 ℃,NO转化率开始下降,结合TGA表征,这可能与骨架结构的崩塌、不饱和活性位点减少有关。此外,Mn-BTC在0~350 ℃没有活性。Li C等[25]研究了不同预处理温度对Cu-BTC催化NH3还原NO的影响,研究表明,温度会影响金属活性位点的产生,当温度超过300 ℃时,催化剂结构发生破坏,不饱和铜位点减少,催化剂表面产生CuO和Cu2O,导致NO转化率下降。
由图2(b) 可知,在(150~250) ℃时,xCu-Mn-BTC催化剂C3H6转化率增长缓慢;在(250~300) ℃时,xCu-Mn-BTC催化剂C3H6转化率迅速增大,此时与NO转化率变化基本一致,表明此时转化的C3H6参与还原NO反应。
由图2(c)可知,当反应温度低于300 ℃时,xCu-Mn-BTC的N2选择性逐渐增加,与Cu-BTC相比, N2选择性显著提高,其中 3.2Cu-Mn-BTC催化剂在300 ℃时显示出94%的N2选择性。当温度高于300℃时,N2选择性先降后增,这可能和催化剂骨架崩塌转化为氧化物有关。
2.2 SO2和H2O的影响
实际工业烟气和汽车尾气存在SO2和H2O,催化剂的抗水、抗硫性是重要的催化剂评价指标。275 ℃和300 ℃下SO2和H2O对3.2Cu-Mn-BTC催化剂活性的影响如图3所示。

图3 275 ℃和300 ℃下SO2和H2O对3.2Cu-Mn-BTC催化剂活性的影响Figure 3 Influence of SO2 and water vapor on 3.2Cu-Mn-BTC catalyst at 275 ℃ and 300 ℃
由图3(a)可知,当温度达275 ℃时,通入0.02% SO2后,NO转化率下降了15%,切断SO2后,NO脱硝效率回升但仍较之前下降了8%。当温度达300 ℃时,通入0.02% SO2后,NO转化率分别下降了17%,切断SO2后,NO转化率呈先升后降的趋势。由图3(b)可知,当温度达275 ℃时,通入5% H2O,3.2Cu-Mn-BTC的NO转化率下降了25%,切断H2O后,NO转化率恢复到初始水平。当温度达300 ℃时,通入5% H2O,NO转化率降低了24%,切断H2O后,NO转化率先增后减。
3.2Cu-Mn-BTC在275 ℃和300 ℃通入H2O后NO转化率开始下降,这可能是由于H2O与开放的金属位点结合,使反应活性位点减少,从而使脱硝效率下降[26]。切断H2O后,由于配位水的去除,活性位点暴露,NO转化率又恢复到原来水平,表明H2O造成催化剂失活是可逆的。切断SO2后,NO转化率有一定程度增加,但没有恢复到原先水平。Song F等[27]研究发现,一方面SO2与反应物NO存在竞争吸附占据活性位点,另一方面 SO2会破坏Cu-BTC部分晶体结构,导致NO转化率下降,而后者可能是NO转化率无法恢复到原先水平的原因。综上可知,SO2比H2O对催化剂活性影响更大。
2.3 SEM
不同催化剂的SEM照片如图4所示。由图4(a)可知,Cu-BTC是规则的正八面体结构,微粒尺寸约10 μm,表面较光滑,这与之前文献报道相符[25]。由图4(b)可知,Mn-BTC是由规则的纳米棒状物体叠加在一起,Mn-BTC纳米棒的平均长度约(1~2) μm,直径约100 nm。由图4(c)可知,Mn的引入使催化剂的表面微观结构发生了改变,粒径减小,由大小(0.2~1) μm的块状颗粒不规则堆叠而成,同时可以看出催化剂孔道分布均匀。

图4 不同催化剂的SEM照片Figure 4 SEM images of catalysts
2.4 XRD
不同催化剂的XRD图如图5所示。
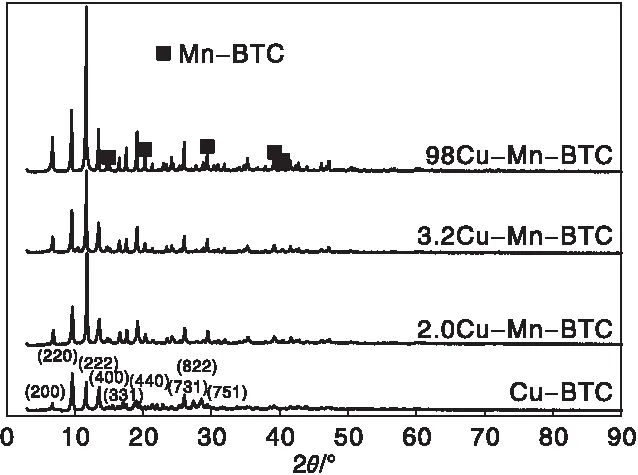
图5 不同催化剂的XRD图Figure 5 XRD patterns of catalysts
由图5可知,对于Cu-BTC、2.0Cu-Mn-BTC、3.2Cu-Mn-BTC和98Cu-Mn-BTC催化剂,观察到6种形状和位置相近的特征衍射峰,分别位于2θ=6.7°、9.5°、11.7°、13.5°、17.4°和19.3°,对应(200)、(220)、(222)、(400)、(331)和(440)晶面,与文献[28]关于Cu-BTC的报道相吻合。此外,2.0Cu-Mn-BTC、3.2Cu-Mn-BTC和98Cu-Mn-BTC在2θ=15.6°、20.9°、29.1°、38.2°和42.4°出现了新的衍射峰,归属于Mn-BTC的特征峰[29]。图中没有观察到金属氧化物特征峰,表明 Mn已成功进入到有机金属骨架中。
对比Cu-BTC,随着 Mn含量增加,3.2Cu-Mn-BTC和2.0Cu-Mn-BTC在2θ=28°和29.3°衍射峰缺失,表明产生了晶格缺陷,这可能是Mn的引入破坏了原有的Cu-BTC正八面体结构,这与SEM表征结果一致。此外,xCu-Mn-BTC催化剂的衍射峰变得更尖锐,表明结晶度变高。
2.5 TGA
3.2Cu-Mn-BTC催化剂的TGA谱图见图6。
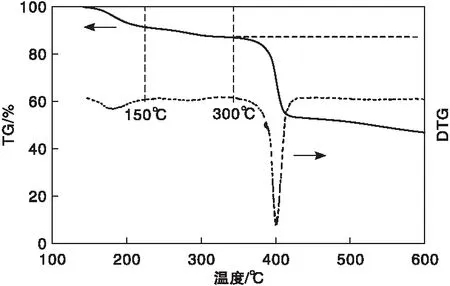
图6 3.2Cu-Mn-BTC催化剂的TGA谱图Figure 6 TGA patterns of 3.2Cu-Mn-BTC catalyst
由图6可知,在温度低于150 ℃时,失重约为9.3%,主要归因于吸附水分和乙醇分子的脱除。在(150~300) ℃,失重4.3%,催化剂质量下降缓慢,主要是由于3.2Cu-Mn-BTC晶体金属铜、锰失去配位水。(300~400) ℃是催化剂失重最快阶段,失重约33.98%,这是由于有机分子开始分解,骨架结构开始崩塌,不饱和金属位点减少,这与活性测试结果一致。
2.6 BET
根据IUPAC分类,Cu-BTC和xCu-Mn-BTC的吸附曲线属于Ⅰ类吸附等温线类型,表现出明显的微孔特性。xCu-Mn-BTC和Cu-BTC的N2吸附-脱附等温线和孔径分布如图7所示。由图7(a)可知,2.0Cu-Mn-BTC和3.2Cu-Mn-BTC的等温曲线出现很小的回滞环,回滞环属于H4型,在高相对压力区域有明显的吸附量,表明催化剂含有介孔。由图7(b)可知,xCu-Mn-BTC和Cu-BTC的孔径在(0~2) nm和(2~20) nm存在明显的单峰,表明催化剂孔径分布均匀,与SEM表征结果一致。
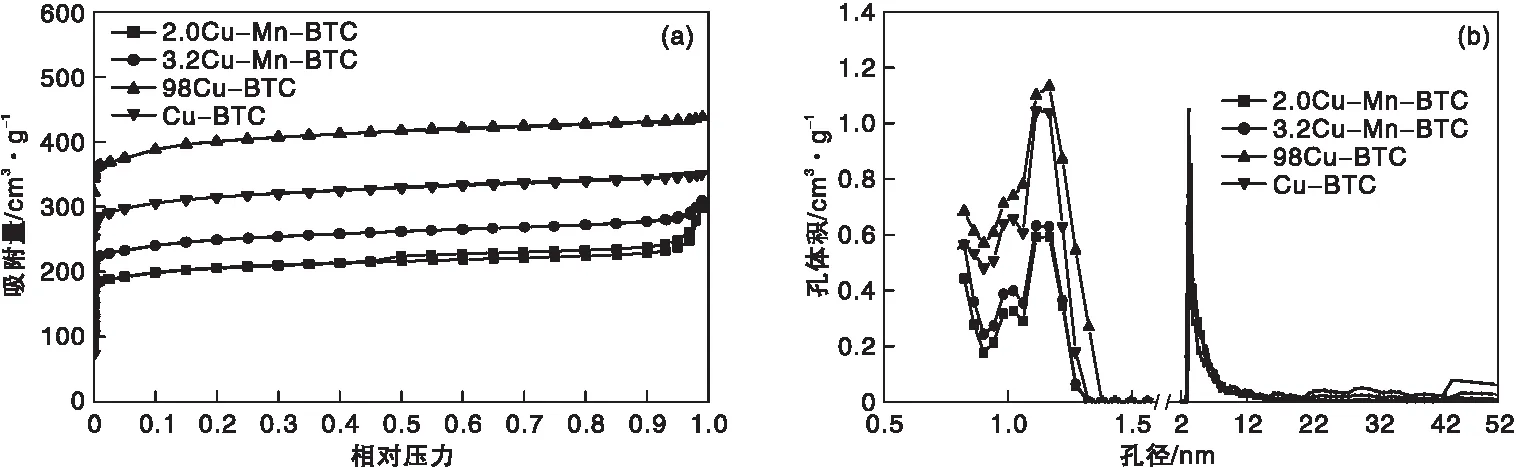
图7 不同催化剂的N2吸附-脱附等温线和孔径分布Figure 7 N2 adsorption-desorption isotherms and pore size distribution of catalysts
催化剂的物理性能如表2所示。由表2可知,BET比表面积顺序为:Cu-BTC>98Cu-Mn-BTC>4.2Cu-Mn-BTC>3.2Cu-Mn-BTC>2.0Cu-Mn-BTC,其中Cu-BTC比表面积达1 238 m2·g-1。此外,随着掺杂Mn含量的增加,催化剂比表面积减小,孔径增加。由SEM和XRD表征可知,xCu-Mn-BTC 晶体产生了结构缺陷,表明存在于Cu-BTC中的金属阳离子形成的正方形平面配位环境对于Mn不利,导致了 3D孔隙无法充分形成,催化剂比表面积降低[30]。结合活性测试结果,比表面积减小没有使催化剂活性降低,相反催化剂活性由于Mn的加入反而提高,一方面归因于孔径的增加,说明Mn的引入有利于气体在催化剂中的吸附和参与反应[31]。另一方面说明Mn和Cu活性位存在良好的协同催化作用,使NO转化率在比表面积下降的情况下仍然得以提高。
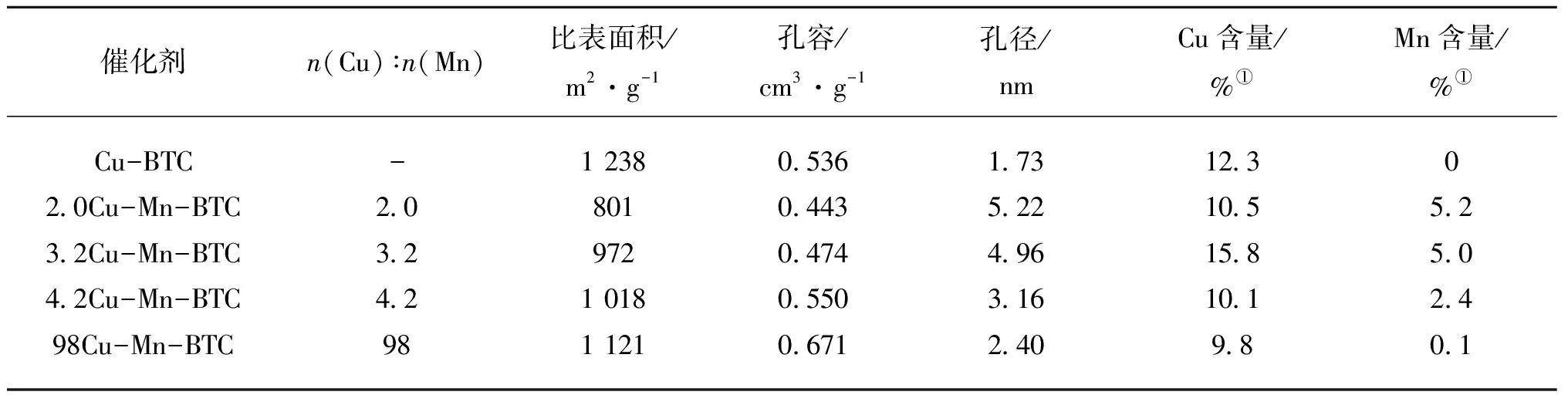
表2 不同催化剂的物理性能
2.7 H2-TPR
不同催化剂的H2-TPR谱图如图8所示。
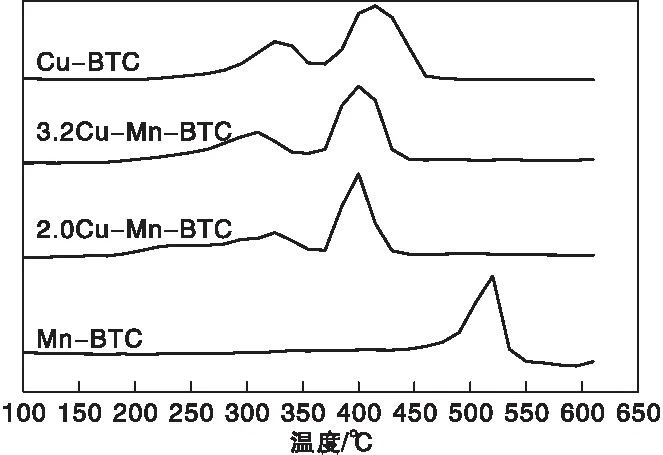
图8 不同催化剂的H2-TPR谱图Figure 8 H2-TPR profiles of catalysts
由图8可知,Cu-BTC在325 ℃和425 ℃出现还原峰,前者可以归属为Cu2+还原为Cu+,后者可以归属为Cu+还原为Cu0。3.2Cu-Mn-BTC在305 ℃和410 ℃出现还原峰,根据相关研究[18,32],xCu-Mn-BTC催化剂第一个还原峰可对应Mn4+还原为Mn3+、 Cu2+还原为Cu+的过程,第二个还原峰可对应Cu+还原为Cu的过程。另外,3.2Cu-Mn-BTC和2.0Cu-Mn-BTC催化剂还原峰位置较Cu-BTC向更低的温度移动,表明引入Mn后催化剂低温还原能力得到增强。耗氢量是评价还原能力的另一个重要指标,通过对4种催化剂在305 ℃附近还原峰定量分析,可得催化剂在305 ℃附近还原峰面积顺序:3.2Cu-Mn-BTC(129)>2.0Cu-BTC(125)>Cu-BTC(100)>Mn-BTC(0),这与催化剂的活性测试结果一致,其中3.2Cu-Mn-BTC还原峰面积最大,表明催化剂的还原能力较强,这可能是3.2Cu-Mn-BTC催化活性较好的原因之一。
2.8 XPS
Cu-BTC、2.0Cu-Mn-BTC和3.2Cu-Mn-BTC催化剂的XPS谱图如图9所示,3种催化剂的的XPS谱图拟合结果如表3所示。
图9(a)为3.2Cu-Mn-BTC、2.0Cu-Mn-BTC、Cu-BTC 的O 1s 谱图,主要分为两个峰值,在531.7 eV附近的峰属于化学吸附氧(Oα),在533.3 eV附近的峰属于化学基团(C=O、C-O)上的氧(Oβ)[21]。其中Oα的含量可以通过拟合结果Oα/(Oα+ Oβ)的面积比确定,通过计算可知,2Cu-Mn-BTC、2.0Cu-Mn-BTC、Cu-BTC的Oα/(Oα+ Oβ)分别为89.7%、85.8%和83%,表明Mn的引入可以增加吸附氧Oα含量。Zhan S等[33]研究表明,Oα具有更好的流动性,可以作为电子受体与NO反应,有利于将NO氧化成NO2,在氧化还原反应中起重要作用。 3.2Cu-Mn-BTC含有更多吸附氧,这可能是催化剂活性较好的原因之一。

图9 Cu-BTC、2.0Cu-Mn-BTC和3.2Cu-Mn-BTC催化剂的XPS谱图Figure 9 XPS spectra of Cu-BTC,2.0Cu-Mn-BTC and3.2Cu-Mn-BTC catalysts
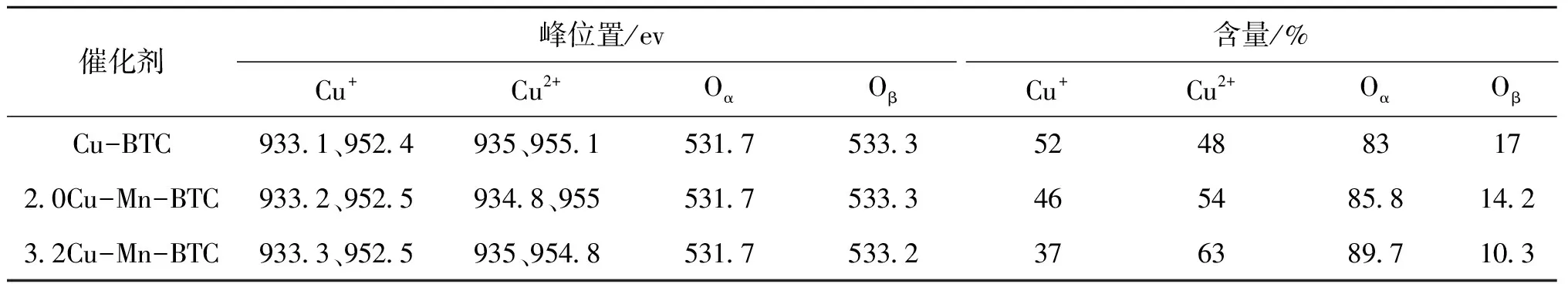
催化剂峰位置/ev含量/%Cu+Cu2+OαOβCu+Cu2+OαOβCu-BTC933.1、952.4935、955.1531.7533.3524883172.0Cu-Mn-BTC933.2、952.5934.8、955531.7533.3465485.814.23.2Cu-Mn-BTC933.3、952.5935、954.8531.7533.2376389.710.3
图9(b)为3.2Cu-Mn-BTC、2.0Cu-Mn-BTC和Cu-BTC 的Cu 2p谱图。Cu 2p光谱可以分成6个特征峰。其中3.2Cu-Mn-BTC在(939~944) eV中存在明显的卫星峰,还观察到935 eV处的Cu 2p3/2峰和954.8 eV处的Cu 2p1/2峰,表明催化剂表面含有Cu2+物种。此外,在933.3 eV和在952.5 eV观察到Cu+物种的特征峰,表明催化剂表面同时含有Cu2+和Cu+物种[32]。通过Cu2+和Cu+的峰面积确定Cu2+和Cu+的含量,计算发现3.2Cu-Mn-BTC、2.0Cu-Mn-BTC 和Cu-BTC表面上Cu2+/Cu2++Cu+的比值分别为0.63、0.54、0.48。较高Cu2+含量有利于将 C3H6部分氧化为CxHyOz,CxHyOz是催化反应进行的重要中间物质,Cu2+含量是影响氧化还原反应的重要因素[34]。
图9(c)为催化剂3.2Cu-Mn-BTC、2.0Cu-Mn-BTC 的Mn 2p谱图,在641.7 eV(Mn 2p1/2)和650 eV(Mn 2p3/2)处出现两个峰,归属于Mn3+物种。在643.8 eV(Mn 2p1/2)和641.7.6 eV (Mn 2p3/2)处出现两个峰,归属于Mn4+物种[35]。Zhao L等[36]研究发现,Mn物种的引入有助于NOx(ads)物质的形成,同时增加了活性位点,从而有助于C3H6-SCR活性的提高。较高的 Cu2+含量、Oα含量及Cu和Mn之间的协同作用可能是影响3.2Cu-Mn-BTC催化剂脱硝活性的重要因素。
2.9 Py-FTIR
MOFs材料上的大部分L酸性位点是通过热处理除去羟基和部分骨架接头而产生[37-38]。一般来说,1 450 cm-1附近的谱带归因于吡啶的振动,并用于分配L酸性位点,1 540 cm-1附近的谱带归因于吡啶的振动,并用于分配B酸性位点[39-40]。Leclerc H等[41]报道,在MOFs材料中,由于羧酸盐和环的振动,原来在(1 400~1 600) cm-1产生的谱带不可见,其吸收峰主要存在于(1 000~1 100) cm-1之间[42]。Kikhtyanin O等[43]研究表明Cu-BTC在活化后,不存在B酸性位点,因此本文主要研究催化剂的L酸性位点。150 ℃和300 ℃时不同催化剂的FT-IR谱图如图10所示。
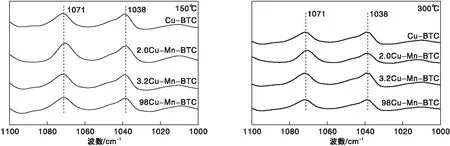
图10 不同催化剂的FT-IR谱图Figure 10 FT-IR spectra of catalysts
由图10可知,吡啶于150 ℃和300 ℃下,在1 071 cm-1和1 038 cm-1处均出现了吸收峰,两处吸收峰对应于L酸与吡啶形成的PyL+。Yuan D等[44]研究表明,L酸位点的强度与中间反应体硝酸盐的种类和数量有关,在氧气过量情况下,增加L酸位点将有利于NO 转化为 N2。Li J等[45]研究表明,L酸位点有助于活化C3H6和氧化NO。因此, L酸性位点是HC-SCR的活性点位,是影响催化剂性能的重要因素。150 ℃和300 ℃时不同催化剂的L酸含量如表4所示。

表4 不同催化剂的L酸含量
由表4 可知,引入Mn后,L酸总含量提高,其中3.2Cu-Mn-BTC的L含量最多,从而使脱硝活性最佳 。
3 结 论
(1) 采用一步合成法成功制备了xCu-Mn-BTC 催化剂,研究了其在富氧条件下的C3H6-SCR脱硝性能。结果表明,双金属xCu-Mn-BTC比单金属MOFs催化剂表现出更好的 C3H6-SCR 性能,其中3.2Cu-Mn-BTC在300 ℃时表现出转化率80%和N2选择性94%,体现了良好的脱硝性能。
(2) XRD、SEM、BET和N2吸附-脱附等表征分析证实Mn成功引入到Cu-BTC框架中,Mn的引入使催化剂比表面积和粒径变小,孔径增大;XPS、Py-IR和H2-TPR表征分析显示,Mn的引入提高了催化剂吸附氧Oα、Cu2+、 L酸量和氧化还原能力,这是其脱硝性能良好的原因。
(3) xCu-Mn-BTC表现出较窄的活性温度窗口,但证明了使用双金属MOFs作为低温C3H6-SCR新型催化剂的可行性,合成多金属MOFs并利用每种金属的优点来提高 C3H6-SCR催化性能可能是未来研究的方向。
