有氧运动康复训练对慢性腰痛患者临床症状、功能障碍的影响及作用机制探讨
2022-10-17卢晓燕曹斌闫旭岭
卢晓燕,曹斌,闫旭岭
(首都医科大学附属北京康复医院(北京工人疗养院),北京 100041)
研究显示,运动是慢性疼痛(chronic pain,CP)管理的核心组成部分,可有效缓解CP和改善功能。有氧运动康复训练(aerobic exercise training,AET)是CP运动计划的重要组成部分[1]。多项研究显示,AET对CP管理有效,但文献相对较少,而且部分研究对患者基线资料平衡控制不佳[2-3]。目前AET对CP缓解的机制尚未完全明确,可能与疼痛调节系统改变相关[4]。研究显示,内源性阿片(endogenous opioid,EO)的活性增加可能与患者接受AET后疼痛程度减轻有关,给予纳络酮阻断阿片类受体可消除AET带来的镇痛作用,表明EO参与了AET的镇痛机制[5]。本研究观察了AET对慢性腰痛患者疼痛强度和功能障碍的缓解效果及对EO的作用机制,现报告如下。
1 资料与方法
1.1 一般资料
选择2019年7月~2020年12月在本院就诊的慢性腰痛患者作为研究对象,纳入标准:①年龄20~60岁,腰痛时间>3个月,X线、CT、MRI等检查未发现腰椎器质性疾病;②入组前7 d内未应用过阿片类药物或非甾体类镇痛药;③患者有运动能力,愿意参加运动治疗,并签署知情同意书。排除标准:①严重肝肾功能障碍;②创伤后应激综合征、精神疾病、糖尿病、癫痫、酒精或药物依赖;③6个月内有重大生活应激(包括工作、婚姻等);④腰部肿瘤、结核、骨质疏松等疾病导致的疼痛或内脏器官病变所致放射性腰痛;⑤无法完成有氧运动者;⑥存在纳络酮禁忌证者。共纳入患者74例,采用随机数字表法分为对照组和观察组各37例。两组患者性别、年龄、体质量指数、病程、痛阈等基线资料差异均无统计学意义(P>0.05),见表1。
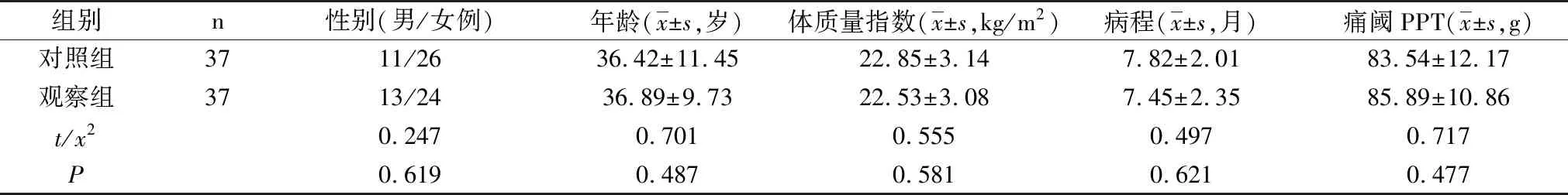
表1 两组患者一般资料比较
1.2 研究方法
对照组给予理疗,对所标记的腰痛点及其周围区域进行蜡疗干预,每次20 min,1次/周,持续8周。观察组在对照组的基础上给予8周有氧运动训练,每周训练3次,每次30 min,在理疗师指导下训练,8周时间可让机体生理适应有氧训练。通过心率储备百分比法计算目标运动心率=(220-年龄-静息心率)×60%+静息心率,运动强度设定为保留心率40%~60%,逐渐增加到85%,每周增加5%。采用心率检测仪检测受试者心率,并用自感劳累评分(Borg CR-10量表)对运动强度进行补充估计。训练方式包括跑步机、踏步和骑自行车运动。
1.3 观察指标
①干预前(随机分组后)、干预后(第8周末)采用电子测痛仪检测椎旁软组织痛阈,测量方法:患者先休息5 min,选疼痛区域椎旁软组织为测痛点,连续测定3次取平均值(给药前痛阈);给药前痛阈测定完成后,上臂三角肌肌肉注射注射纳洛酮0.8 mg,注射后10 min再次评定痛阈值(给药后痛阈),注射纳洛酮后共测定3次痛阈、取平均值;干预前、后测量时,纳洛酮分别给药1次。②干预前、后采用VAS评分评估患者的疼痛程度,采用ODI指数评估功能障碍程度。③干预前后观察患者的体脂百分比、最大摄氧量(maximal oxygen intake,VO2Max)、背伸肌耐力和坐姿伸展测试情况,体脂百分比采用XR-36型双能X线吸收仪检测全身瘦体重、体脂和骨矿物含量,体脂百分比(%)=体脂(kg)/[瘦体重(kg)+体脂(kg)+骨矿物含量(kg)]×100%,单位以%表示;最大摄氧量采用负荷递增至症状自限的运动方案进行心肺运动试验,记录VO2Max,单位为mL/kg/ min;背伸肌耐力采用Sorensen测试进行评估,评估时令患者俯卧于床边,上身保持水平,双手胸前交叉,保持该动作直至疲劳,单位以秒(s)表示;坐姿伸展测试是测试腰部和腿部柔韧性常用的测试,测试时患者脱鞋,双腿并拢坐于地板,双手平伸指向脚尖,尽量弯曲腰部和臀部,测量手指尖超出脚足的距离,以cm表示。
1.4 统计学方法

2 结果
2.1 VAS评分和ODI指数
干预后两组患者VAS评分和ODI指数均显著低于干预前(P<0.05),且观察组干预后VAS评分和ODI指数均显著低于对照组(P<0.05)。见表2。
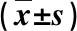
表2 两组患者干预前后的VAS评分和ODI指数比较
2.2 痛阈
干预后两组患者纳洛酮给药前、给药后的痛阈均较干预前显著升高(P<0.05),对照组给药后的痛阈与给药前无显著差异(P>0.05),观察组给药后痛阈较给药前显著降低(P<0.05);观察组干预后给药前、给药后的痛阈均显著高于对照组(P<0.05)。见表3。

表3 两组患者干预前后痛阈比较
2.3 其他指标
对照组患者干预后的体脂百分比和VO2Max与干预前差异无统计学意义(P>0.05),观察组干预后的体脂百分比与干预前相比均显著降低(P<0.05),且显著低于同期对照组(P<0.05);观察组VO2Max、背伸肌耐力、坐姿伸展测试与干预前相比均显著升高(P<0.05),且均显著高于同期对照组(P<0.05)。见表4。
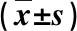
表4 两组患者干预前后其他指标比较
3 讨论
AET对疼痛的缓解作用已得到研究证实,可增强内源性疼痛抑制能力,主要反映在诱发疼痛的反应性降低,即增加EO镇痛方面[6]。本研究结果表明,经8周AET干预后,患者的VAS评分和ODI指数均显著改善,证实了AET治疗慢性腰痛的有效性。研究显示,有氧运动可提高实验动物EO镇痛效果,EO镇痛效果与运动量相关,定期有氧运动可促进EO功能持续增加[7]。另一项基础研究显示,在完成5周有氧运动训练方案后5 d,实验动物EO脑水平和镇痛水平增加[8]。本研究结果提示,持续有氧运动可能导致慢性腰痛患者EO功能的持续增加,有利于改善患者疼痛缓解和功能障碍。
本研究还评估了AET对疼痛反应性即痛阈的影响。既往研究显示,AET可提高痛阈,减轻刺激诱导的疼痛反应[9]。对猴子和人类的研究表明,注射吗啡产生明显的镇痛作用,这种镇痛作用可通过给予纳洛酮进行有效拮抗[10]。纳洛酮是阿片类受体拮抗剂,通过血脑屏障的速度是吗啡的12倍,首先与边缘系统阿片类受体结合,其亲和力大于吗啡和脑啡肽,是外源和内源性阿片类物质的专一拮抗剂[11]。研究显示,纳洛酮在人体血浆半衰期为90 min,作用持续时间为45~90 min,小剂量和常规剂量应用无明显不良反应,临床应用安全[12]。本研究采用纳洛酮阻断内源性阿片类物质的作用后,显示观察组痛阈降低,结果提示,8周的AET训练持续性EO镇痛效应可能是其对慢性腰痛作用的重要机制。既往研究显示,纳洛酮在高频神经电刺激镇痛方面有显著效果,且对镇痛效果的阻断作用与纳洛酮使用剂量显著相关[13]。本研究中,观察组诱导的痛阈升高并未完全被纳洛酮阻断,推测AET对慢性腰痛患者的作用可能包括纳洛酮不敏感成分,也有可能与纳洛酮剂量相关,尚需要进一步研究探讨。
体脂百分比是体现肥胖程度的重要指标,有规律的有氧运动可改善机体的肌肉体积和重量[14]。VO2Max是评价心肺功能和有氧耐力的金标准,可很好评价人体有氧运动能力的高低[15]。本研究显示,观察组患者干预后体脂百分比显著低于对照组,VO2Max显著高于对照组,结果提示,经过AET干预后的观察组患者有氧运动能力显著提高,这种升高与痛阈变化一致。此外,观察组干预后背伸肌耐力及坐姿伸展测试高于对照组,结果提示,AET干预有利于恢复和重建腰椎力学结构的平衡,增强脊柱稳定性腰部活动柔韧性,有利于疼痛恢复。
综上所述,本研究结果显示,理疗基础上增加有监督的AET可显著减少慢性腰痛的疼痛和功能障碍,其疼痛抑制作用可能部分与EO相关,本研究同时观察到AET对背部肌肉和柔韧性的有利影响,提示AET的疼痛抑制作用可能是多种作用机制综合的结果,其详细机制尚需要进一步研究探讨。
