互花米草凋落物分解微生物的群落组成和多样性对模拟增温和增氮的响应
2022-10-15庞金玲王银华王欢欢王丽霞王佳宁张慧敏郭宏宇
庞金玲,王银华,王欢欢,王丽霞,王佳宁,张慧敏,郭宏宇
(1.天津师范大学生命科学学院,天津 300387;2.天津师范大学天津市动植物抗性重点实验室,天津 300387)
工业革命以来,随着化石燃料的大规模开发和使用,全球变暖及其带来的气候变化日益显著,对陆地、海洋、湿地等各类生态系统均产生了严重影响.氮元素是生物地球化学循环中的重要元素,由于人为因素的影响,近年来通过沉降和施肥形式进入生态系统的氮素不断增加[1].目前我国已成为全球大气氮沉降的重点区域[2],其中,京津地区氮沉降通量达到2.0~4.5 g/(m2·a),是当前中国氮沉降通量最高的地区之一[3],贯穿京津地区的海河水系氮输入量达到13.3 g/(m2·a),氮污染比较严重[4].滨海湿地是海洋与陆地的过渡地带,具有维持海陆生态资源平衡、调节物质循环以及调控全球气候变化的生态功能[5].植物凋落物的分解是滨海湿地物质循环的重要过程,对滨海湿地生态系统的平衡和稳定具有重要作用[6].土壤微生物是凋落物分解过程中的主要驱动力[7],深入了解植物凋落物分解过程中微生物群落特征对环境条件改变的响应具有重要意义.
互花米草(Spartina alterniflora)原产于北美洲大西洋沿岸,1979年被引入我国并用于海岸防护[8].由于互花米草繁殖能力较强,引入我国后其分布区迅速扩大,目前我国沿海湿地中互花米草入侵面积已达约50 000 hm2,在天津滨海湿地中入侵面积已达约570 hm2[9],对滨海湿地生态系统造成诸多不良影响[10-11].
为进一步了解全球气候变化背景下,我国滨海湿地中互花米草凋落物分解微生物群落的特征,本研究应用传统分离培养与分子生物学相结合的方法,对天津滨海湿地互花米草凋落物分解微生物群落在不同增温与增氮条件下的响应进行探究,旨在为在全球气候变化背景下更好地保护滨海湿地提供理论依据.
1 材料与方法
1.1 实验材料
2019年10月,以天津滨海湿地中互花米草入侵的典型芦苇湿地为研究区,采用环刀采样器采集18份原状湿地土壤(0~20 cm),分装于18个栽培盆中,带回至天津师范大学种植园.同时,在同一湿地收集当年的互花米草叶片凋落物带回实验室,将其剪成1 cm×4 cm的小段,充分混匀后,在室内风干至恒重,称取5 g凋落物样品装入孔径为1 mm的尼龙网袋中,共制成18份凋落物样品.
1.2 实验设置
模拟增温设置为未增温(AT)和增温(WT)2种处理.将AT处理的栽培盆置于一个保持通风的透明温室中,室内温度与环境温度保持一致,实验中该温室内平均温度为11.2℃;将WT处理的栽培盆置于一个利用温室效应进行增温的透明温室内,实验中该温室内平均温度为13.5℃.氮输入设置为3个水平:13 g/(m2·a)(N13,背景氮输入水平)、20 g/(m2·a)(N20,模拟未来较低氮输入增加水平)、40 g/(m2·a)(N40,模拟未来较高氮输入增加水平).增温和增氮交互实验中共设置6个处理组合,每个组合设3个重复.
将装有互花米草叶片凋落物样品的尼龙网袋摆放在每个栽培盆土壤表面中央,使尼龙网袋与土壤紧密接触.为了保持栽培盆中湿地土壤的水分条件,将栽培盆放置于大小适宜的水盆中,水深约为3 cm.每月将适量尿素均匀施加在各栽培盆土壤表面以维持增氮处理水平.2019年11月1日开始进行以上实验处理,2020年6月30日采集各实验处理中的互花米草叶片凋落物样品及土壤样品,保存于-20℃条件下以备后续分析.
1.3 实验方法
1.3.1 土壤理化性质分析
参照文献[12]中的方法,测定土壤中水的质量分数(SWC)、盐度(S)、pH值、有机质含量(SOM)、总氮(TN)含量、硝态氮(NO3-)含量、铵态氮(NH4+)含量、亚硝态氮(NO2-)含量、总磷(TP)含量和有效磷(AP)含量.
1.3.2 互花米草凋落物分解细菌和真菌的分离与鉴定
利用pH值为7.0~7.2的牛肉膏蛋白胨培养基分离细菌,在37℃条件下培养3~4 d;利用pH值为7.0~7.4的孟加拉红培养基分离真菌,在28℃条件下培养3~5 d.通过预实验确定适当的稀释倍数,对稀释后的菌液进行涂布,使平板上的菌落数量在30~300个之间.放入恒温培养箱进行培养,培养完成后对不同形态的菌落进行计数,并用平板划线法进行纯化.根据纯化后的菌落形态特征进行初步分类,应用分子生物学方法进行进一步分类鉴定.参照文献[12]中的方法,对分离得到的细菌和真菌进行分子生物学鉴定,将其鉴定至属分类学水平.
1.4 数据处理
计算不同增氮处理中可培养细菌和真菌对增温处理的响应比(response ratio,RR),公式为:

式中:EG和CG分别为实验组和对照组中相关变量的平均值.RR为正值表示正效应,为负值表示负效应,绝对值大小表示作用强度.
计算可培养细菌和真菌群落的Shannon-Wiener多样性指数(H)和Simpson多样性指数(D).利用SPSS 20.0软件进行方差分析和Tukey HSD多重比较分析;利用PAST 3软件进行非度量多维尺度(NMDS)分析;利用Canoco 5软件进行冗余分析(RDA);利用Origin 2019软件作图.
2 结果与分析
2.1 互花米草凋落物可培养细菌和真菌的数量及响应比差异
不同增温和增氮条件下,互花米草凋落物可培养细菌和真菌的数量及其对增温的响应比如图1所示.

图1 细菌和真菌数量及其对增温的响应比Fig.1 Quantities of bacteria and its response ratio to warming
由图1(a)和图1(b)可以看出,相同氮输入水平条件下,增温处理使细菌数量显著下降,真菌数量显著上升(P<0.05).相同温度条件下,细菌和真菌数量均随着氮输入水平的增加先升高再降低(P<0.05).由图1(c)和图1(d)可以看出,在不同氮输入水平条件下,细菌数量对增温的响应比均为负值,随着氮输入水平的增加,增温对细菌数量的影响呈先增大再减小的趋势;真菌数量对增温的响应比则均为正值,随着氮输入水平的增加,增温对真菌数量的影响呈先减小再增大的趋势.
2.2 互花米草凋落物可培养细菌和真菌的群落组成差异
本研究从互花米草凋落物中分离得到可培养细菌和真菌各16个属,如图2所示.不同处理组中细菌的群落组成如图2(a)所示:小单胞菌属(Micromonospora)、溶杆菌属(Lysobacter)、不动杆菌属(Acinetobacter)、芽孢杆菌属(Bacillus)、微杆菌属(Microbacterium)在所有处理组中均有分布,其中,芽孢杆菌属、不动杆菌属和溶杆菌属在各处理组中均占较高比例;枝芽孢杆菌属(Virgibacillus)仅出现在未增温处理组中;链球菌属(Streptococcus)、放线菌属(Actinomycetes)、动性球菌属(Planococcus)、类芽孢菌属(Paenibacillus)、考克氏菌属(Kocuria)以及鞘氨醇杆菌属(Sphingobium)仅出现在增温处理组中.不同处理组中真菌的群落组成如图2(b)所示:链格孢属(Alternaria)、曲霉属(Aspergillus)、镰刀菌属(Fusarium)、短梗霉属(Aureobasidiu)在所有处理组中均有分布;根霉属(Rhizopus)仅出现在未增温处理组中;红孢菌属(Catenulispora)、小不整球壳属(Plectosphaerella)以及玛丽亚霉属(Mariannaea)仅出现在增温处理组中.

图2 细菌和真菌的群落组成Fig.2 Community composition of bacteria and fungi
对细菌和真菌群落的组成进行非度量多维尺度分析,结果如图3所示.由图3可以看出,细菌群落和真菌群落在不同实验处理条件下分别有明显的聚集趋势,而细菌和真菌群落的组成在不同实验处理条件下均有较大的差异,细菌和真菌群落的Stress值分别为0.032和0.097,均小于0.1,表明互花米草凋落物可培养细菌和真菌群落的组成均受到增温和增氮处理的影响.
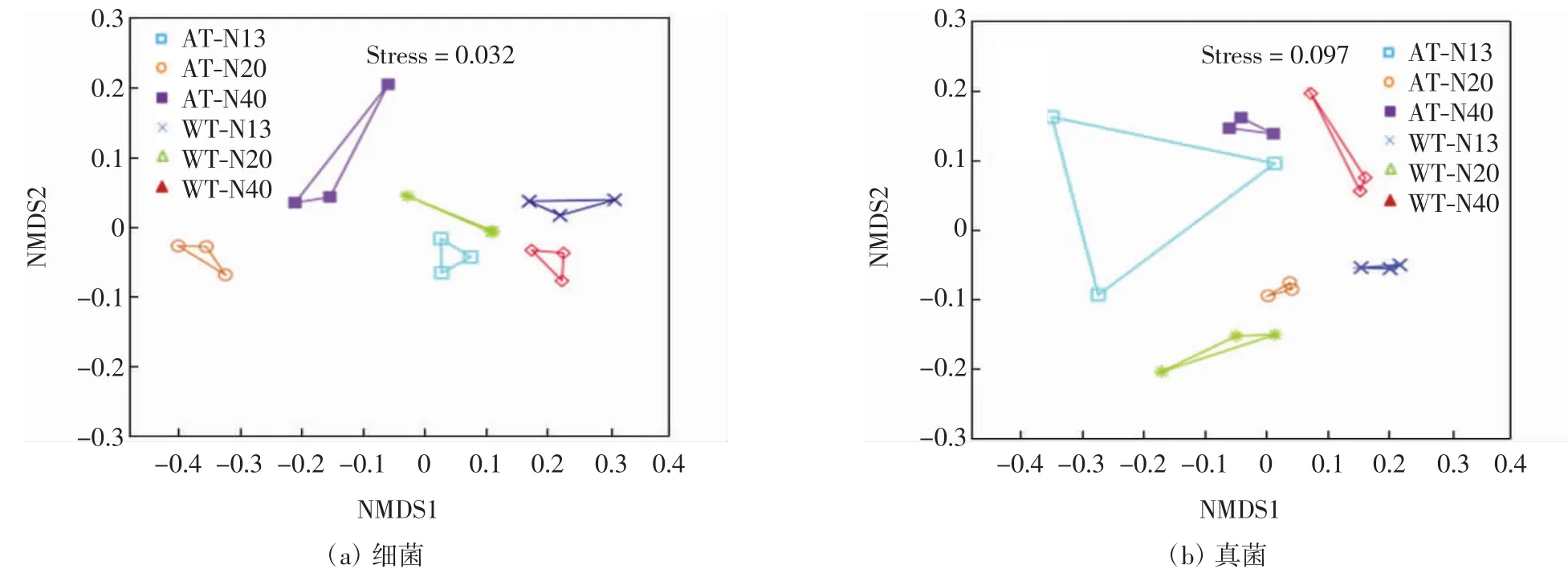
图3 细菌和真菌群落组成的非度量多维尺度分析(NMDS,基于Bray-Curtis相异性指数)Fig.3 Nonmetric multidimensional scaling analysis(NMDS,Bray-Curtis based dissimilarity)of bacteria and fungi community composition
2.3 互花米草凋落物可培养细菌和真菌的群落多样性及响应比差异
不同处理条件下互花米草凋落物可培养细菌和真菌群落的Shannon-Wiener多样性指数(H)分别如图4(a)和图4(b)所示.在相同氮输入水平条件下,增温处理使细菌和真菌群落的H指数均显著降低(P<0.05);相同温度处理条件下,细菌和真菌群落的H指数随氮输入水平增加均先升高再降低(P<0.05).细菌和真菌群落的H指数对增温的响应比分别如图4(c)和图4(d)所示.在不同氮输入水平条件下,细菌群落和真菌群落H指数对增温的响应比均为负值;随氮输入水平的增加,增温对细菌群落H指数的降低作用呈逐渐减弱趋势,而对真菌群落H指数的降低作用呈逐渐增强趋势.
不同处理条件下,互花米草凋落物可培养细菌和真菌群落的Simpson多样性指数(D)分别如图5(a)和图5(b)所示,在相同氮输入水平下,增温处理使细菌和真菌群落的D指数均显著降低(P<0.05);相同温度条件下,细菌和真菌群落的D指数随氮输入水平增加均先升高再降低(P<0.05).不同处理条件下,互花米草凋落物可培养细菌和真菌群落的D指数对增温的响应比如图5(c)和图5(d)所示.
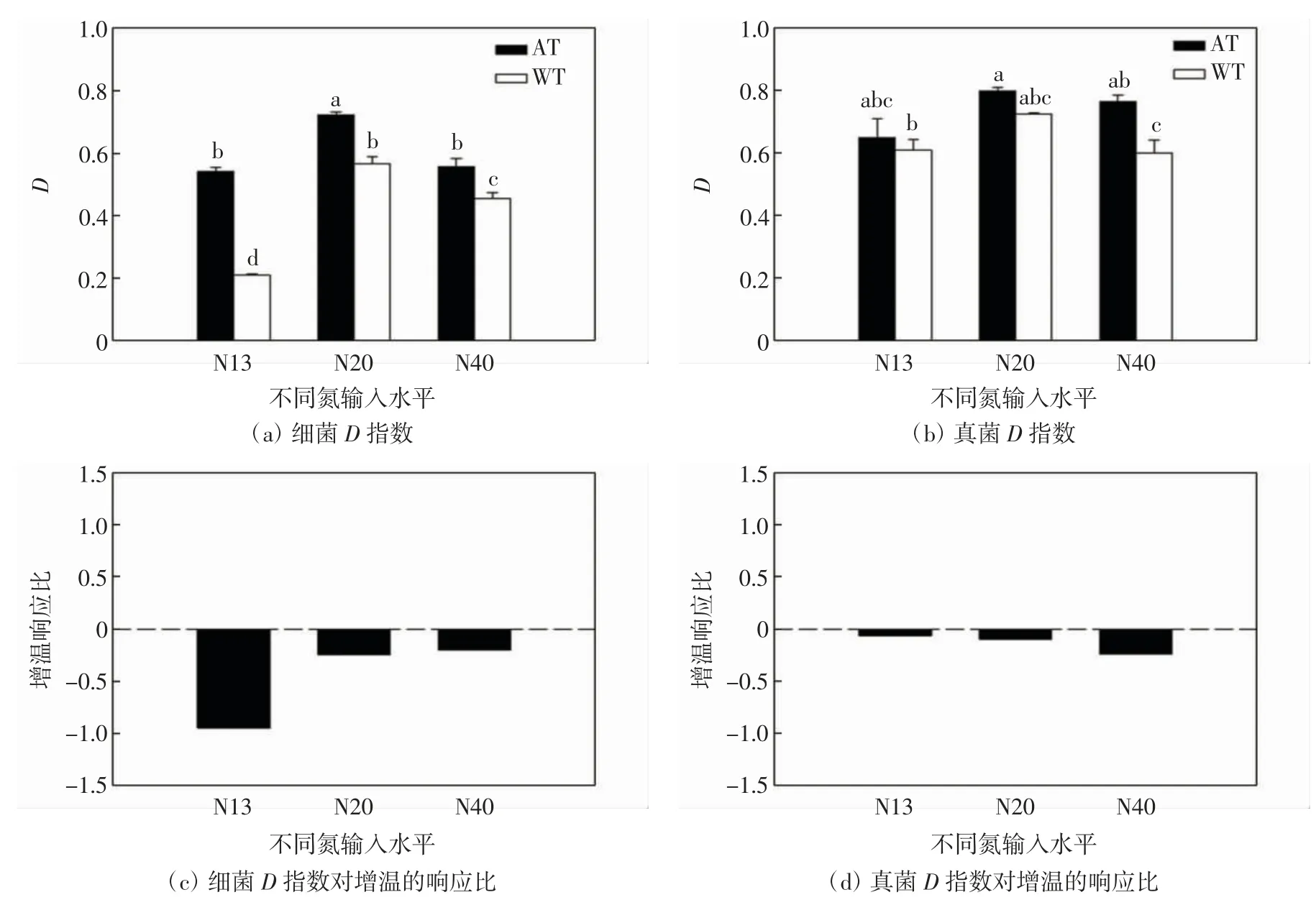
图5 细菌和真菌群落的D指数及增温响应比Fig.5 Community D index and response ratio to warming of bacterial and fungal communities
由图5(c)和图5(d)可以看出,在不同氮输入水平条件下,细菌群落和真菌群落的D指数对增温的响应比均为负值;随氮输入水平增加,增温对细菌群落D指数的降低作用呈逐渐减弱的趋势,而对真菌群落D指数的降低作用呈逐渐增强趋势.
2.4 互花米草凋落物可培养细菌和真菌群落组成与土壤理化性质间的相关关系
细菌和真菌群落组成与土壤理化性质(具体见文献[12])间相关关系的冗余分析如图6所示,各土壤因子对群落组成的解释度如表1所示.

图6 细菌和真菌群落组成与土壤理化性质间相关关系的冗余分析Fig.6 Redundancy analysis of the relationships between the bacterial and fungal community compositions and the main soil properties
土壤因子对细菌群落组成的总解释度为75.95%(图6(a)),其中,微杆菌属(Microbacterium)、芽孢杆菌属(Bacillus)与土壤有效磷含量呈显著正相关关系(P<0.05);土壤有效磷含量、亚硝态氮含量和硝态氮含量对细菌群落组成有显著影响(表1).土壤因子对真菌群落组成的总解释度为58.73%(图6(b)),其中,毛霉属(Mucor)、蓝状菌属(Talaromyces)与土壤铵态氮含量、硝态氮含量、亚硝态氮含量、有效磷含量呈显著正相关关系(P<0.05);土壤铵态氮含量、亚硝态氮含量、有效磷含量和硝态氮含量对真菌群落组成有显著影响(表1).

表1 冗余分析中各土壤因子对细菌和真菌群落组成变异的解释度Tab.1 Explaining percentage of the soil factors for the variation of the bacterial and fungal community composition in the redundancy analysis
3 讨论与结论
3.1 互花米草凋落物分解微生物数量对增温和增氮的响应
本研究对天津滨海湿地互花米草凋落物分解微生物的群落特征及其对增温和增氮的响应特点进行了调查分析.研究发现,增温处理使互花米草凋落物可培养细菌的数量显著降低(P<0.05),可能是由于细菌对温度变化较为敏感,增温对其生长产生了负面影响,从而使其数量降低,这与杨玉莲[13]、宋影等[14]的研究结果一致;增温处理使互花米草凋落物可培养真菌的数量显著增加(P<0.05),可能是因为真菌的营养体为丝状体,对温度变化的耐受能力较强[15],且增温可提高真菌的活性,在一定程度上增强了真菌的生长优势,从而使其数量增加,这与Zhang等[16]、胡明慧等[17]的研究结果一致.
随着氮输入水平的增加,互花米草凋落物可培养细菌和真菌的数量均先升高再降低,这表明氮输入水平较低时可促进细菌和真菌数量增加,而过高时则会抑制细菌和真菌数量增加.对于细菌,可能是因为适度的氮输入可提高土壤中底物的有效性,从而促进细菌生长,而过量的氮输入将加速土壤酸化,减少土壤中细菌的可利用资源,从而对细菌生长产生抑制作用[18],这与符鲜等[19]的研究结果一致.对于真菌,可能是因为适量的氮输入可提高土壤肥力,增多真菌可利用资源,从而促进真菌数量增加,而过量的氮输入则将导致土壤环境恶化,如抑制木质素降解酶活性,使木质素与酚类物质、纤维素等聚合为难以被真菌所利用的有机物质,从而抑制真菌的生长[20],这与周世兴等[21]的研究结果一致.
本研究发现,互花米草凋落物细菌数量对增温处理为负响应,且随氮输入增加呈先增强再减弱的趋势,这表明氮输入水平可影响增温对细菌数量的作用.而互花米草凋落物真菌数量对增温处理为正响应,且随氮输入增加呈先减弱再增强的趋势,这表明氮输入水平也可影响增温对真菌数量的作用.这些结果表明增氮和增温处理对互花米草凋落物细菌和真菌数量的影响存在交互作用,这与方差分析及Tukey HSD多重比较分析的结果(P<0.05)一致.
总的来看,本研究中增温使微生物群落的细菌与真菌数量平衡向偏于真菌的方向移动;细菌和真菌数量对增氮的响应模式相似,即适量氮输入会增加微生物总量,过量氮输入则会显著降低其总量.
3.2 互花米草凋落物分解微生物群落多样性对增温和增氮的响应
增温处理使互花米草凋落物可培养细菌和真菌的Shannon-Wiener与Simpson多样性指数均显著降低.对于细菌,可能是由于温度升高导致部分细菌类别的相对丰度降低甚至死亡,即增温对细菌群落多样性产生了负面影响,这与章妮等[22]、杨有芳等[23]的研究结果一致.对于真菌,可能是由于增温使某些可耐受较高温度的真菌类别(如小不整球壳属、红孢菌属、玛丽亚霉属等)在群落组成中更占优势,从而导致真菌群落多样性降低,这与龙致炜[24]、姚世庭等[25]的研究结果一致.
随着氮输入水平增加,互花米草凋落物可培养细菌和真菌群落的多样性指数均先升高后降低.对于细菌,可能是因为适量的氮输入可促进细菌的生长和繁殖,从而提高细菌群落的多样性;过量的氮输入则会造成土壤酸化,过量积累的氮素也会引起毒害作用,从而抑制细菌的生长和活性,导致细菌群落多样性降低[26].这与Sun等[27]、李宗明等[28]的研究结果一致.对于真菌,可能是由于适量施氮可以提高土壤中的养分含量,促进了真菌的生长和繁殖,从而使其群落的多样性增加;而过量施氮则会引起土壤有机物组成的改变,导致真菌可利用有机物比例的减少,从而使真菌群落多样性降低[29],这与Eberwein等[30]、Yan等[31]的研究结果一致.
本研究发现,互花米草凋落物可培养细菌的Shannon-Wiener和Simpson多样性指数对增温处理均为负响应,且随氮输入增加呈减弱的趋势,这表明氮输入水平可影响增温对细菌群落多样性的作用.互花米草凋落物可培养真菌的Shannon-Wiener和Simpson多样性指数对增温处理也均为负响应,且随氮输入增加呈增强的趋势,这表明氮输入水平也可影响增温对真菌群落多样性的作用.这些结果表明增氮和增温处理对互花米草凋落物细菌和真菌群落多样性的影响存在交互作用,这与方差分析及Tukey HSD多重比较分析的结果(P<0.05)一致.
总的来看,本研究中互花米草凋落物分解细菌和真菌的群落多样性对增温和增氮的响应模式一致,即增温会显著降低细菌和真菌的群落多样性;适量氮输入会使二者的群落多样性增加;过量氮输入则会降低群落多样性.
3.3 互花米草凋落物分解微生物群落组成与土壤因子间的相关关系
由冗余分析可知,本研究中对细菌群落组成起主导作用的土壤因子为土壤有效磷含量、亚硝态氮含量和硝态氮含量;对真菌群落组成起主导作用的土壤因子为土壤铵态氮含量、亚硝态氮含量、有效磷含量和硝态氮含量.Lei等[32]、王静等[33]的研究指出,土壤有效磷含量可显著影响细菌和真菌的群落组成;霍玉珠等[34]的研究表明,土壤亚硝态氮含量可显著影响细菌和真菌的群落组成;张佳楠[35]的研究表明,土壤微生物群落结构与硝态氮含量显著相关;He等[36]的研究表明,铵态氮是真菌的主要氮源之一,对土壤真菌群落结构有重要影响.本研究结果与以上研究结果一致,表明氮输入的急剧增加会使得土壤中各种形态的氮含量也随之增加,显著改变互花米草凋落物分解微生物的群落组成,从而影响其功能类群构成.
综上所述,全球变暖和氮输入增加将对滨海湿地互花米草凋落物分解微生物群落的组成和多样性产生重要影响.总体上,气候变暖将使细菌数量和多样性降低,使真菌数量升高,多样性降低.另一方面,一定程度的氮输入增加可能会在短期内改善湿地土壤养分条件,有利于湿地凋落物分解微生物生长繁殖和多样性的提高,但过量氮输入将导致湿地土壤养分条件恶化,从而对凋落物分解微生物群落造成不利影响,这些影响将进而导致滨海湿地微生物驱动的物质循环模式发生改变.
