基于Keap-1/Nrf2信号通路探究异甘草酸镁改善非酒精性脂肪性肝病大鼠糖脂代谢紊乱的作用机制
2022-10-14赵文明赵飞宋志玉左兴盛
赵文明,赵飞,宋志玉,左兴盛
(河南省人民医院药学部,河南 郑州 450000)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是临床常见的慢性肝脏疾病,以发病隐匿、病程发展缓慢为主要特征,可直接导致失代偿期肝硬化、肝细胞癌,并参与代谢综合征、心脑血管疾病发病进程[1]。随着生活方式及膳食结构的改变,我国NAFLD患病人数大幅度增加,患病率已超过20%,且趋向年轻化,其防治工作已成为我国公共卫生事业的重大难题[2]。目前,对于NAFLD的临床治疗尚处于探索阶段,多以维生素E、熊去氧胆酸抑制过氧化,但效果缓慢且尚未得到大量样本验证。异甘草酸镁是中药单体甘草酸的异构体镁盐,作为一种保肝剂,常被用于治疗慢性病毒性肝炎及化疗、手术所致肝损伤[3]。然而,目前关于其对NAFLD的治疗作用研究尚少,且缺乏对应的机制研究。本研究通过建立NAFLD大鼠模型,观察异甘草酸镁对NAFLD糖脂代谢的影响,并探讨其可能机制。
1 材料与方法
1.1 实验动物
Wistar大鼠46只,SPF级,雄性,6周龄,体质量(160±15)g,购于上海南方模式生物科技股份有限公司,生产许可证号:SCXK(沪)2017-0010。大鼠实验前适应性饲养1周,饲养于SPF级动物房,伦理委员会批准号:HNSRMYY20210058。
1.2 药物、主要试剂、仪器
异甘草酸镁注射液(规格:10 mL,50 mg,生产批号H20051942,正大天晴药业集团股份有限公司);核因子E2相关因子2(nuclear factor-E2 related factor 2,Nrf2)抑制剂ML385(批号:846557-71-9,美国Sigma公司);空腹胰岛素(fasting serum insulin,FINS,生产批号:FT-PD8326S,上海梵态生物科技有限公司);三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(hHDL-C)、低密度脂蛋白胆固醇(lLDL-C)、丙氨酸氨基转移酶(ALT)、谷草转氨酶(AST)、丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒(生产批号分别为SBJ-R0195、SBJ-R0142、SBJR0126、SBJ-R0128、SBJ-R0116、SBJ-R0806、SBJR0704、SBJ-R0154,南京森贝伽生物科技有限公司);兔抗大鼠Nrf2、Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein-1,Keap1)一抗(生产批号:ab62352、ab119403,美国Abcam公司);辣根过氧化物酶标记的二抗(生产批号:A21010,武汉艾美捷科技有限公司)。
AU480全自动生化分析仪(美国Beckman Coulter公司);E100显微镜(德国Nikon公司);ACCU-CHEK ACTIVE罗氏血糖仪(德国Roche Diagnostics GmbH公司);1658001 Mini-PROTEAN小型蛋白垂直电泳槽、ChemiDoc XRS化学发光成像分析系统(美国Bio-Rad公司)。
1.3 模型的建立
大鼠适应性基础饲料喂养1周后参照文献[4]建立NAFLD模型,高脂高糖饲料喂养,分别于第4、6、8周末随机数字法处死造模大鼠2只,HE染色观察肝组织病理,若肝细胞肿胀明显且细胞脂肪变性比例超过1/3,则判定建模成功。
1.4 分组与给药
36只大鼠建立NAFLD模型,除去验证大鼠,剩余30只成功建模,随机数字法分为NAFLD组、异甘草酸镁组、联合组,每组10只;另取10只大鼠基础饲料喂养,设为正常对照组。联合组大鼠腹腔注射异甘草酸镁注射液(100 mg/kg,溶于5 mL生理盐水)[5],2 h后腹腔注射ML385(30 mg/kg溶于5 mL DMSO)[6];异甘草酸镁组大鼠腹腔注射异甘草酸镁注射液(100 mg/kg),2 h后腹腔注射5 mL DMSO;正常对照组、NAFLD组大鼠腹腔注射等量生理盐水,2 h后腹腔注射5 mL DMSO,每日1次,干预4周。除正常对照组外,其余3组仍以高脂高糖饲料喂养。
1.5 组织取材
末次干预后次晨,称取大鼠体质量,称重后腹腔注射戊巴比妥钠50 mg/kg深度麻醉,抽取空腹腹主动脉血,一份低温离心5 min(3 000 r/min,r=8 cm)取血清,用于检测血脂及肝功能指标,另一份4℃冷藏保存用于血糖指标检测,采血后脊椎脱臼处死大鼠,冰上开腹取其肝脏,称取肝湿质量,计算肝指数=(大鼠肝湿质量/大鼠体质量)×100%;切取同位置少量右侧肝组织,置于4%(φ)多聚甲醛固定24 h,常规脱水、透明、浸蜡、包埋,切4 μm厚度切片用于病理观察;另取部分肝组织投入液氮中保存,用于免疫印迹实验。
1.6 血糖检测[7]
取大鼠空腹腹主动脉血液,血糖仪检测空腹血糖(fasting plasma glucose,FPG);放射免疫法检测FINS;计算胰岛素抵抗指数(insulin resistance index,HOMA-IR)=(FPG×FINS)/22.5。
1.7 血脂及肝功能检测
取冷藏保存的腹主动脉血清,经全自动生化分析仪检测血清TG、TC、HDL-C、LDL-C、ALT、AST水平,按照试剂盒说明书检测。
1.8 血清氧化应激指标检测
取冷藏保存的腹主动脉血清,分别以TBA法、WST-8法检测血清MDA水平及SOD活性,根据试剂盒说明书要求操作进行,计算血清MDA浓度及SOD活性。
1.9 HE染色观察肝组织病理变化
取肝组织切片,脱蜡至水,蒸馏水冲洗,经苏木精液染色5 min,蒸馏水冲洗,1%盐酸酒精分化,碳酸氢钠溶液漂洗、伊红液浸染2 min,梯度乙醇脱水,二甲苯透明,中性树胶封固,置于显微镜下观察肝组织病理改变并拍照记录。
1.10 油红O染色观察肝组织脂质沉积
4%(φ)多聚甲醛固定10 min后蒸馏水充分冲洗;60%(φ)异丙醇浸泡180 s;导入油红O储液60 mL、蒸馏水40 mL 30 min;60%异丙醇分色,蒸馏水充分冲洗;苏木精对比染色120 s,蒸馏水充分冲洗;水性封片机固封,常温阴干后显微镜下观察。
1.11 免疫印迹法检测肝组织Nrf2、Keap1蛋白表达量
取液氮保存的肝组织,剪碎后移至研磨器研磨,PBS匀浆,加入预冷RIPA裂解液,注入离心管,4℃离心15 min(10 000 r/min,r=12 cm)取上清,BCA法定量蛋白。取50 μg蛋白样本,与5倍量上样缓冲液混匀,水浴沸腾5 min,离心取上清,电泳分离后湿法转膜,加入5%脱脂牛奶,室温封闭2 h,混合稀释体积比(1∶500)兔抗大鼠Nrf2、Keap1一抗,4℃冷藏过夜,洗膜后加入二抗,室温孵育2 h,发光液发光,暗室显色,成像分析仪扫描并分析各条带灰度值,以GAPDH为内参蛋白,分析Nrf2、Keap1蛋白相对表达水平。
1.12 统计学方法
采用SPSS 23.0软件,计量资料以表示,多样本资料比较采用单因素方差分析,两两样本采用LSD-t比较。P<0.05为差异有统计学意义。
2 结果
2.1 各组体质量、肝湿质量及肝指数比较
与正常对照组比较,NAFLD组大鼠体质量、肝湿质量、肝指数均升高(P<0.05);与NAFLD组比较,异甘草酸镁组大鼠体质量、肝湿质量、肝指数均降低(P<0.05);与异甘草酸镁组比较,联合组大鼠体质量、肝湿质量、肝指数均升高(P<0.05)。见表1。
表1 异甘草酸镁对NAFLD大鼠体质量、肝湿质量及肝指数的影响Table 1 Effects of magnesium isoglycyrrhizate on body mass,liver wet weight and liver index in NAFLD rats(±s,n=10)
与正常对照组比较:*P<0.05;与NAFLD组比较:#P<0.05;与异甘草酸镁组比较:@P<0.05。
组别正常对照组NAFLD组异甘草酸镁组联合组体质量/g 389.17±12.49 502.65±21.62*426.43±19.44#466.09±20.42@肝湿质量/g 11.46±1.37 21.48±1.65*14.56±1.77#17.02±1.60@肝指数/%2.73±0.30 4.15±0.46*3.30±0.38#3.76±0.40@
2.2 各组血糖指标比较
与正常对照组比较,NAFLD组大鼠FPG、FINS、HOMA-IR水平升高(P<0.05);与NAFLD组比较,异甘草酸镁组大鼠FPG、FINS、HOMA-IR水平降低(P<0.05);与异甘草酸镁组比较,联合组大鼠大鼠FPG、FINS、HOMA-IR水平升高(P<0.05)。见表2。
表2 异甘草酸镁对NAFLD大鼠血清FPG、FINS、HOMA-IR水平的影响Table 2 Effects of magnesium isoglycyrrhizinate on the levels of serum FPG,FINS and HOMA-IR in NAFLD rats(±s,n=10)
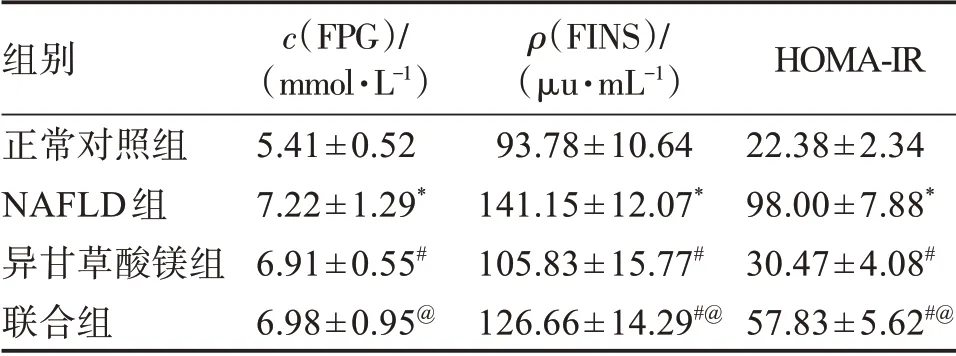
表2 异甘草酸镁对NAFLD大鼠血清FPG、FINS、HOMA-IR水平的影响Table 2 Effects of magnesium isoglycyrrhizinate on the levels of serum FPG,FINS and HOMA-IR in NAFLD rats(±s,n=10)
与正常对照组比较:*P<0.05;与NAFLD组比较:#P<0.05;与异甘草酸镁组比较:@P<0.05。
组别正常对照组NAFLD组异甘草酸镁组联合组c(FPG)/(mmol·L-1)5.41±0.52 7.22±1.29*6.91±0.55#6.98±0.95@ρ(FINS)/(μu·mL-1)93.78±10.64 141.15±12.07*105.83±15.77#126.66±14.29#@HOMA-IR 22.38±2.34 98.00±7.88*30.47±4.08#57.83±5.62#@
2.3 各组血脂指标比较
与正常对照组比较,NAFLD组大鼠TG、TC、HDL-C、LDL-C水平升高(P<0.05);与NAFLD组比较,异甘草酸镁组大鼠TG、TC、LDL-C水平降低(P<0.05);与异甘草酸镁组比较,联合组大鼠大鼠TG、TC、LDL-C水平升高(P<0.05)。NAFLD组、异甘草酸镁组、联合组HDL-C水平比较,差异无统计学意义(P>0.05)。见表3。
表3 异甘草酸镁对NAFLD大鼠血清TG、TC、HDL-C、LDL-C水平的影响Table 3 Effects of magnesium isoglycyrrhizinate on the levels of serum TG,TC,HDL-C and LDL-C in NAFLD rats(±s,n=10) c/(mmol·L-1)
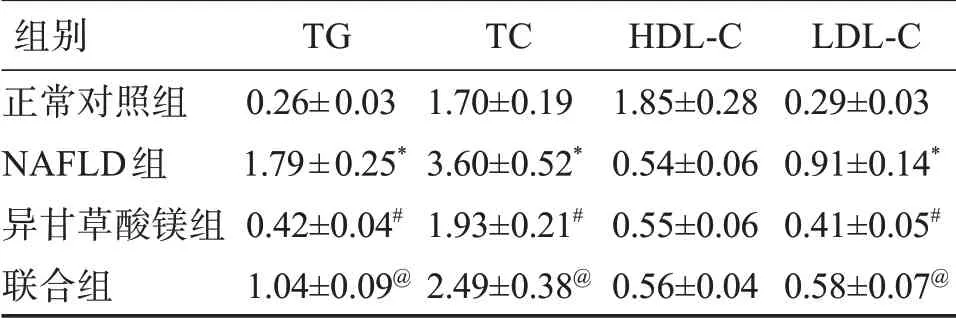
表3 异甘草酸镁对NAFLD大鼠血清TG、TC、HDL-C、LDL-C水平的影响Table 3 Effects of magnesium isoglycyrrhizinate on the levels of serum TG,TC,HDL-C and LDL-C in NAFLD rats(±s,n=10) c/(mmol·L-1)
与正常对照组比较:*P<0.05;与NAFLD组比较:#P<0.05;与异甘草酸镁组比较:@P<0.05。
组别正常对照组NAFLD组异甘草酸镁组联合组TG 0.26±0.03 1.79±0.25*0.42±0.04#1.04±0.09@TC 1.70±0.19 3.60±0.52*1.93±0.21#2.49±0.38@HDL-C 1.85±0.28 0.54±0.06 0.55±0.06 0.56±0.04 LDL-C 0.29±0.03 0.91±0.14*0.41±0.05#0.58±0.07@
2.4 各组肝功能指标比较
与正常对照组比较,NAFLD组大鼠AST、ALT水平升高(P<0.05);与NAFLD组比较,异甘草酸镁组大鼠AST、ALT水平降低(P<0.05);与异甘草酸镁组比较,联合组大鼠大鼠AST、ALT水平升高(P<0.05)。见表4。
表4 异甘草酸镁对NAFLD大鼠血清AST、ALT水平的影响Table 4 Effects of magnesium isoglycyrrhizinate on the levels ofserum AST and ALT in NAFLD rats(±s,n=10)ρ/(u·L-1)

表4 异甘草酸镁对NAFLD大鼠血清AST、ALT水平的影响Table 4 Effects of magnesium isoglycyrrhizinate on the levels ofserum AST and ALT in NAFLD rats(±s,n=10)ρ/(u·L-1)
与正常对照组比较:*P<0.05;与NAFLD组比较:#P<0.05与异甘草酸镁组比较:@P<0.05。;
组别正常对照组NAFLD组异甘草酸镁组联合组AST 136.87±14.35 182.41±18.09*142.66±14.95#165.35±19.14@ALT 45.81±6.15 89.43±12.07*51.43±5.74#67.08±8.70@
2.5 各组血清氧化应激指标比较
与正常对照组比较,NAFLD组大鼠血清MDA水平升高,SOD活性降低(P<0.05);与NAFLD组比较,异甘草酸镁组大鼠血清MDA水平降低,SOD活性升高(P<0.05);与异甘草酸镁组比较,联合组大鼠血清MDA水平升高,SOD活性降低(P<0.05)。见表5。
表5 异甘草酸镁对NAFLD大鼠血清MDA水平、SOD活性的影响Table 5 Effects of magnesium isoglycyrrhizinate on the levels of serum MDA level and SOD activity in NAFLD rats(±s,n=10)
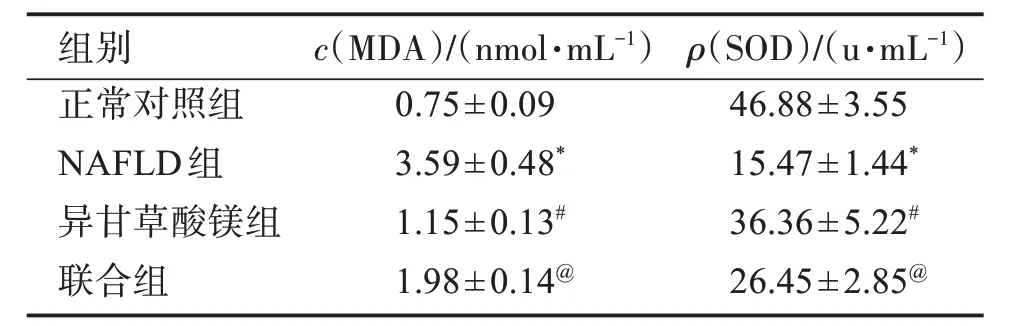
表5 异甘草酸镁对NAFLD大鼠血清MDA水平、SOD活性的影响Table 5 Effects of magnesium isoglycyrrhizinate on the levels of serum MDA level and SOD activity in NAFLD rats(±s,n=10)
与正常对照组比较:*P<0.05;与NAFLD组比较:#P<0.05;与异甘草酸镁组比较:@P<0.05。
组别正常对照组NAFLD组异甘草酸镁组联合组0.75±0.09 3.59±0.48*1.15±0.13#1.98±0.14@46.88±3.55 15.47±1.44*36.36±5.22#26.45±2.85@c(MDA)/(nmol·mL-1)ρ(SOD)/(u·mL-1)
2.6 肝组织病理变化
HE染色显示,正常对照组肝组织肝小叶结构、细胞形态均正常,未见细胞脂肪变性;NAFLD组肝小叶结构破坏严重,边界不清,细胞体积增大且脂肪变性严重,可见大量脂肪空泡及炎症细胞浸润;异甘草酸镁组、联合组肝组织肝小叶结构破坏不明显,细胞体积趋于正常,脂肪变性程度减轻,脂肪空泡及炎症细胞减少,异甘草酸镁组较联合组病理改善更佳。NAFLD组、异甘草酸镁组、联合组肝组织病理学变化评分分别为(3.05±0.41)分、(1.69±0.25)分、(2.21±0.39)分,与NAFLD组比较,异甘草酸镁组大鼠肝组织病理学变化评分降低(P<0.05);与异甘草酸镁组比较,联合组大鼠肝组织病理学变化评分升高(P<0.05)。
油红O染色显示,正常对照组肝组织几乎未观察到脂滴聚集,NAFLD组可观察到橘红色脂滴呈现弥漫性分布及大泡性脂肪变,异甘草酸镁组、联合组橘红色脂滴显著减少,异甘草酸镁组少于联合组。见图1、图2。
2.7 肝组织Nrf2、Keap1蛋白表达量
与正常对照组比较,NAFLD组肝组织Nrf2蛋白表达量升高,Keap1蛋白表达量降低(P<0.05);与NAFLD组比较,异甘草酸镁组肝组织Nrf2蛋白表达量降低,Keap1蛋白表达量升高(P<0.05);与异甘草酸镁组比较,联合组肝组织Nrf2蛋白表达量升高,Keap1蛋白表达量降低(P<0.05)。见表6、图3。
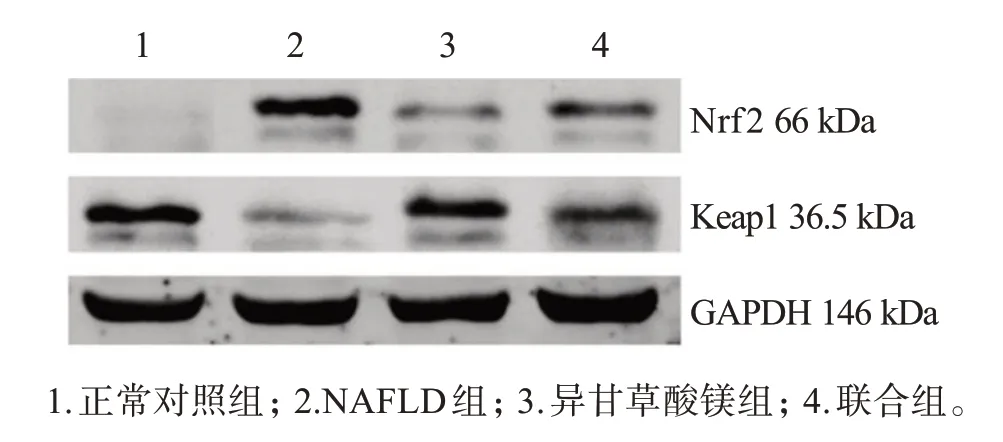
图3 肝组织Nrf2、Keap1蛋白表达Figure 3 Expressions of Nrf2 and Keap1 proteins in liver tissue
表6 异甘草酸镁对NAFLD大鼠肝组织Nrf2、Keap1蛋白表达量的影响Table 6 Effects of magnesium isoglycyrrhizinate on the expressions of Nrf2 and Keap1 proteins in liver tissue of NAFLD rats (±s,n=10)
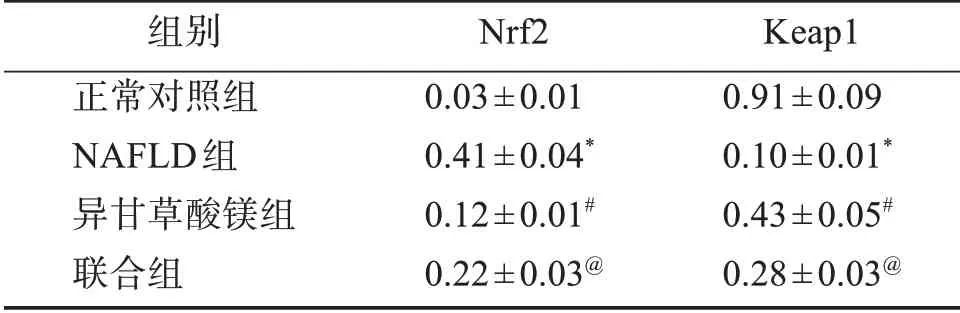
表6 异甘草酸镁对NAFLD大鼠肝组织Nrf2、Keap1蛋白表达量的影响Table 6 Effects of magnesium isoglycyrrhizinate on the expressions of Nrf2 and Keap1 proteins in liver tissue of NAFLD rats (±s,n=10)
与正常对照组比较:*P<0.05;与NAFLD组比较:#P<0.05;与异甘草酸镁组比较:@P<0.05。
组别正常对照组NAFLD组异甘草酸镁组联合组Nrf2 0.03±0.01 0.41±0.04*0.12±0.01#0.22±0.03@Keap1 0.91±0.09 0.10±0.01*0.43±0.05#0.28±0.03@
3 讨论
NAFLD是以非酒精及外部因素导致肝细胞脂肪过度沉积为特征的临床综合征,起初表现为单纯性脂肪肝,肝小叶内肝细胞大泡性脂肪变性,后可扩大至75%以上肝细胞变性,后出现细胞炎症,引发腺泡点灶状坏死,蔓延至门管区造成周围桥接纤维化,最终肝小叶原结构严重破坏,出现广泛性纤维化,从而导致肝硬化[8]。肥胖、2型糖尿病、高脂血症、慢性肾病及高血压等是NAFLD的高危因素,其发病机制复杂,多认为是肝细胞脂质积累、氧化应激损伤、过量炎症反应、胰岛素抵抗等因素相互关联所致,其中胰岛素抵抗及氧化应激被认为是其主要机制[9]。胰岛素敏感性降低促使肝细胞摄入大量游离脂肪酸,脂肪过载变性引发低度炎症反应,变性肝细胞线粒体发生脂质过氧化,肝细胞膜被破坏,氧化产物聚集,进一步加剧氧化应激,加剧肝细胞胰岛素抵抗,形成恶性循环,促进炎症反应及肝纤维化的发生[10]。因此,抑制过量氧化应激是治疗NAFLD的关键。
中医将NAFLD归属于“肝癖”、“积聚”、“肝胀”等症范畴,病位在于肝、脾、肾,其主要病机为嗜食肥甘、脾失健运、肾失气化、津液聚而生痰,湿热中阻、蕴结于肝、脉络壅滞,久病成瘀、瘀血痰浊相结、发为肝癖,故化痰祛瘀、补益肝脾是其治疗之道[11]。中药甘草为豆科植物甘草、胀果甘草及光果甘草干燥根与根茎,具有补脾、保肝、清热的功效,异甘草酸镁是以其为主要原料合成的第4代甘草酸制剂,具有良好的亲脂性,可与肝细胞膜受体蛋白及固醇类激素结合,抑制膜脂质过氧化,降低细胞膜通透性,从而改善肝功能[12-13]。Li等[14]研究认为,异甘草酸镁可抑制肝脏HepaRG细胞脂质过度积累,减轻氧化应激损伤,保护线粒体完整性,改善肝细胞代谢紊乱,发挥其降低肝脂毒性的功效,提示异甘草酸镁对肝细胞脂肪变性具有改善作用,或可成为脂肪性肝病潜在治疗药物。本研究结果显示,与NAFLD组比较,异甘草酸镁组血清FPG、FINS、HOMA-IR、TG、TC、LDL-C、AST、ALT水平均降低,SOD活性升高,提示异甘草酸镁可改善血糖、血脂代谢紊乱,抑制氧化应激,改善NAFLD大鼠肝功能。
Nrf2/ARE信号通路是机体重要的氧化应激调节通路,参与神经、血管及多种器官组织病变过程,其中Nrf2是细胞抗氧化关键介导因子,Keap1是其抑制蛋白[15]。在稳态下,Nrf2与Keap1结合形成复合体隔离于细胞质中,参与构成肌动蛋白架构,Nrf2活性被抑制并被泛素化降解,在氧化应激状态下,Nrf2自复合物中解离移至胞核,激活核内ARE复合物启动子,诱导下游相关还原酶转录,降低氧自由基浓度,从而发挥其抑制肝细胞氧化应激损伤的功效[16-17]。Saeedi等[18]认为,激活Nrf2/ARE通路可调节肝脏对氧化损伤易感性,从而治疗由对乙酰氨基酚及乙醇诱发的急性肝损伤,提示Nrf2或可成为肝脏疾病的治疗新靶点。本研究结果显示,与正常对照组比较,NAFLD组肝组织Nrf2蛋白表达量升高,Keap1蛋白表达量降低,经异甘草酸镁干预后肝组织Nrf2蛋白表达量降低,Keap1蛋白表达量升高,且联合应用Nrf2/ARE通路抑制剂ML385可减弱异甘草酸镁对NAFLD的治疗作用,提示Nrf2/ARE通路活性在NAFLD中有所降低,异甘草酸镁能通过激活该通路治疗NAFLD大鼠。
综上所述,异甘草酸镁可改善NAFLD大鼠糖脂代谢紊乱,抑制氧化应激并改善肝功能,其作用机制可能与激活Nrf2/ARE信号通路有关。
