离子液体功能化磁性纳米颗粒的制备及其茶多酚吸附性能研究
2022-10-14贾广成杨金漆高海莹陈鹏飞陈祥贵何绍志
罗 琴, 贾广成, 杨金漆, 高海莹, 陈鹏飞, 陈祥贵, 何绍志
(1. 西华大学食品与生物工程学院,四川 成都 610039; 2. 新疆维吾尔自治区计量测试研究院,新疆 乌鲁木齐 830011;3. 四川省食品检验研究院,四川 成都 611731)
0 引 言
茶多酚(TP)是茶叶中最重要且含量最高的生物活性成分,其不仅是一种新型的天然抗氧化剂,还具有明显的抗肿瘤、抗辐射、降低血糖、血脂和胆固醇、预防心血管疾病和提高机体免疫力等药理功能[1-2],因而广泛用于保健和医疗领域。目前获取茶多酚的主要途径仍是从茶叶中直接提取,工业上一般采用溶剂提取法和金属离子沉淀法[3],但前者生产周期长、产品纯度低、操作安全风险高;而后者虽然产品纯度可高达95%,但得率较低、且金属离子后处理负担较大。近年来,愈来愈多的新方法和技术被应用于茶多酚的提取,其中离子液体作为一种“绿色可设计”溶剂[4-5]而受到研究者们的关注,万常等[6]采用 BMIMBr 取代传统有机溶剂,并以微波辅助的方式显著提高了普洱茶茶多酚的提取率,然而离子液体的蒸气压较低且粘稠性高,导致其难以回收。Zhang等[7]将咪唑类离子液体键合在球形SiO2材料表面制备了一种固定化离子液体并成功用于茶多酚的吸附分离,尽管其实现了离子液体的固液分离,但该法需要进行装柱,操作复杂耗时。鉴于茶多酚在大健康产业中的良好应用前景和亟待解决的分离提取现状,有必要探索新型的茶多酚提取分离方法。
作为固相萃取的一种新模式,磁性固相萃取以功能化磁性纳米材料作为萃取剂的一种分散固相萃取技术。在萃取过程中,磁性纳米萃取剂无需装柱,而是直接分散至样品溶液或悬浮液中以与目标物质发生作用。在萃取过程后,利用外加磁场即可实现吸附有目标物质的萃取剂与样品分离,操作方便快捷[8]。因此,基于上述磁性固相萃取技术的优点和离子液体在茶多酚萃取中的应用潜力,本研究拟选用磁性四氧化三铁纳米颗粒作为磁性内核,咪唑类离子液体作为功能化的表面修饰成分制备一种新型磁性萃取剂并对其结构性能进行表征,在此基础上,将其用于茶多酚的吸附萃取,采用单因素实验对静态吸附条件进行优化,并进一步对该吸附过程的热动学进行研究以明晰其吸附机理,期望本研究可为建立新型的茶多酚分离方法提供一定的参考。
1 实验部分
1.1 材料与仪器
纳米四氧化三铁 (≤30nm)、十六烷基三甲基溴化铵(CTAB, 99%)、硅酸四乙脂(TEOS, 98%)、γ-氯丙基三甲氧基硅烷、1-甲基咪唑 (99%)、L-脯氨酸(99%) (阿拉丁),盐酸、无水乙醇、氨水、乙腈 (科龙化工)、茶多酚 (98%, 源叶生物)。
Spectrum two型傅里叶变换红外光谱仪 (Perkin Elmer);Merlin compact-61-78型扫描电子显微镜(ZEISS);Versalab型振动样品磁强计(Quantum Design);Bruker D8型X-射线衍射仪 (Bruker);ZEN-3600型纳米粒径电位分析仪 (Malvern)。
1.2 离子液体功能化磁性纳米颗粒的制备
1.2.1 磁性介孔二氧化硅纳米颗粒的制备
参照Chen[9]等的方法首先制备了SiO2修饰的Fe3O4纳米颗粒(Fe3O4@SiO2), 将1 g Fe3O4@SiO2超声分散到乙醇/水(400 mL/140 mL)溶液中,再加入0.1 g CTAB和20 mL TEOS,80 ℃搅拌反应12 h后,磁分离并用乙醇洗涤,将洗涤后的产物分散到100 mL乙醇中,加入0.6 g硝酸铵, 80 ℃回流反应24 h后,磁分离并用乙醇洗涤,50 ℃真空干燥得到磁性介孔二氧化硅纳米颗粒(Fe3O4@SiO2@SiO2)。
1.2.2 离子液体功能化磁性纳米颗粒的制备
参考Zhang[7]等的方法,首先将偶联剂γ-氯丙基三甲氧基硅烷(0.1 mol)与1-甲基咪唑(0.12 mol)进行取代反应,将得到的产物溶解于乙醇中,采用强碱性阴离子树脂进行离子交换,待流出液的pH值大于10后,将流出液逐滴滴入装有脯氨酸(0.06 mol)的圆底烧瓶中,待脯氨酸完全溶解后,常温搅拌反应8 h。减压蒸馏回收乙醇。用20 mL乙腈溶解产物,剧烈搅拌后,放置在0 ℃下冷却,析出过量脯氨酸。快速过滤除去过量的脯氨酸固体,回收溶剂后得淡黄色粘稠液体。产物置于50 ℃真空干燥箱干燥12 h。
准确称取1.0 g Fe3O4@SiO2@SiO2,超声分散在50 mL乙腈中,将离子液体溶于10 mL乙腈中,在N2氛围下,逐滴加入上述混合液中,78 ℃下回流反应10 h,磁分离并依次用蒸馏水、乙醇进行洗涤,50 ℃真空干燥后得到离子液功能化磁性纳米颗粒(Fe3O4@SiO2@SiO2@IL)。
1.3 茶多酚吸附实验
1.3.1 茶多酚静态吸附实验
称量一定质量的Fe3O4@SiO2@SiO2@IL,加入具有一定体积、pH和初始浓度的TP溶液,放入恒温振荡箱(200 r/min)内,在恒定温度下进行吸附实验,在一定时间后,取上清液稀释至合适浓度,用紫外-可见分光光度法测溶液在273 nm处的吸光度,然后根据标准曲线(y= 18.189x+ 0.001 3,r2=0.999 1)方程计算,得到吸附后溶液中残留的茶多酚浓度,计算得到溶液中剩余茶多酚浓度后,进而根据下式计算得到吸附剂的吸附量:

式中:V——被吸附溶液体积, mL;
C0——溶液吸附前浓度,mg/mL;
C1——吸附后剩余的浓度,mg/mL;
m——吸附剂用量,g;
qe——吸附剂吸附量,mg/g。
1.3.2 茶多酚吸附动力学实验
准确称量Fe3O4@SiO2@SiO2@IL 40 mg于具塞试管中,分别加入浓度为1 mg/mL、2 mg/mL、3 mg/mL TP溶液10 mL,在30 ℃恒温震荡摇床(200 r/min)下进行吸附,间隔一定的时间测溶液中未吸附茶多酚的浓度,计算出单位吸附量并确定动力学曲线。进而分别采用准一级动力学方程(式(2))和准二级动力学方程(式(3))对该吸附过程进行动力学拟合[10]。

式中:k1、k2——一、二级吸附速率常数,min–1;
t——吸附时间,min;
qe——吸附平衡时对TP的吸附量,mg/g;
qt——时间为t时TP的吸附量,mg/g。
1.3.3 茶多酚吸附热力学实验
精确称量磁性纳米吸附材料于具塞试管,将其分为三组。分别加入10 mL初始浓度不同的茶多酚溶液(0.5,1.0,1.5,2.0,2.5,3.0 mg/mL),接着分别在25 ℃、35 ℃和45 ℃条件下,恒温吸附直至达到平衡,测量吸附后溶液中剩余TP的浓度。应用Langmuir(式(4))和Freundlich(式(5))等温方程对该吸附过程进行热力学拟合[10]。

式中:qe——吸附达到平衡时对TP的吸附量,mg/g;
Ce——吸附达到平衡时剩余TP的浓度,mg/L;
n——吸附过程经验常数;
qm——吸附达到平衡时的最大吸附量,mg/g;
Kf——Freundlich等温平衡常数。
2 结果与讨论
2.1 离子液体功能化磁性纳米颗粒的表征
采 用SEM-EDS对Fe3O4@SiO2@SiO2@IL的形貌结构进行表征,如图1所示,EDS结果中出现的N元素说明了离子液体成功接枝在磁性纳米颗粒的表面,且各元素的质量百分占比为:C 10.28%,N 0.63%,O 29.34%,Si 32.08%,Fe 27.68%。制备的离子液体功能化磁性纳米颗粒主要呈椭球形,平均粒径在90 nm左右。可以看到,由于接枝了离子液体,纳米颗粒的表面较为粗糙且凹凸不平(见图1)。

图1 Fe3O4@SiO2@SiO2@IL的SEM-EDS结果
采用X-射线衍射仪(XRD)和傅里叶变换红外光谱仪(FT-IR)对所制备的磁性纳米颗粒的结构进行表征。XRD结果见图2,Fe3O4@SiO2@SiO2@IL与Fe3O4磁性纳米颗粒的图谱均可以观察到6个明显 的 特 征 衍射峰,分 别 位 于2θ = 30.1°(220),35.5°(311),43.1°(400),53.4°(522),57.0°(511)和62.6°(440),与粉末衍射标准联合委员会(JCPDS)粉末衍射标准卡(JCPDS No. 85-1 436)上Fe3O4的特征峰值非常接近[9],说明在离子液体功能化的过程中并未改变Fe3O4磁性纳米颗粒的晶型,仅仅是由于表面接枝了非磁性物质使得对应特征吸收峰处的衍射强度有所降低。

图2 Fe3O4纳米颗粒和Fe3O4@SiO2@SiO2@IL的XRD图谱
从FT-IR结果中可以看出,在Fe3O4@SiO2@SiO2(见图3中a)表面接枝了离子液体后出现了一系列新的特征吸收峰(见图3中b),其中2 922 cm–1和2 853 cm–1为甲基 C-H 的不对称和对称伸缩振动峰;1 728 cm–1为羧酸羰基C=O的特征峰;1 570 cm–1为咪唑环 C=N的伸缩振动峰,可以作为离子液体甲基咪唑阳离子片段的特征峰[7]。

图3 Fe3O4@SiO2@SiO2和Fe3O4@SiO2@SiO2@IL的 红外光谱图
采用振动样品磁强计对Fe3O4纳米颗粒、Fe3O4@SiO2@SiO2和Fe3O4@SiO2@SiO2@IL的 磁性性能进行表征,其在300 K 下的磁滞回线如图4所示。从图中可以看出,所有磁性纳米颗粒的磁滞回线均呈S形,质量比剩余磁化强度和矫顽力均极小,显示出典型的超顺磁特性[11]。Fe3O4纳米颗粒、Fe3O4@SiO2@SiO2和Fe3O4@SiO2@SiO2@IL的 饱和磁化强度分别为68.98 emu/g、51.13 emu/g和49.68 emu/g。不难发现,经过修饰后的磁性纳米颗粒由于含有一定量的非磁性物质,导致其单位质量的饱和磁化强度有所降低,这也说明了磁性纳米颗粒的制备是成功的。

图4 Fe3O4纳米颗粒、Fe3O4@SiO2@SiO2和Fe3O4@SiO2@SiO2@IL在300 K下的磁滞回线
2.2 离子液体功能化磁性纳米颗粒对茶多酚的吸附性能研究
2.2.1 吸附条件优化
通过单因素实验对吸附过程中的主要影响因素(包括:吸附时间、茶多酚初始浓度、固液比、pH、吸附温度(在热力学部分进行讨论))进行了优化,结果如图5所示。随着吸附时间(图5(a))的逐渐增加,吸附量呈上升趋势,且在吸附的初始阶段,由于活性结合位点较多,吸附速率较快,之后开始变得缓慢,最终在30 min后达到吸附饱和。由图5(b)可以发现,随着样品溶液初始浓度的增加,吸附剂的饱和吸附量也逐渐增加,在达到3 mg/mL时,吸附量达到饱和。这可能是由于在茶多酚浓度较低时,浓度差是吸附传质过程中的主要推动力,浓度差增大促进了吸附,而在浓度达到3 mg/mL时,吸附剂表面活性位点数量起主要作用,吸附剂的总量未发生变化,因而达到了平衡。

图5 吸附时间、茶多酚初始浓度、固液比及pH对茶多酚吸附量的影响
随着吸附剂用量的增多,其活性位点逐渐增多,因此吸附量逐渐增大(图5(c)),而随着吸附剂用量的继续增加,颗粒间可能会发生干扰沉降作用,导致吸附剂发生沉降团聚而使得吸附位点减少,导致了吸附量的显著下降。从图5(d)可以发现,溶液pH的变化对吸附过程的影响较小,说明静电作用并不是吸附过程的主要驱动力,Zeta电位的测试结果(见图6)也证明了这一结果,在实验的pH范围内,磁性纳米颗粒的表面电位较低,难以发生较强的静电作用。

图6 Fe3O4@SiO2@SiO2@IL在不同pH条件的Zeta电位值
根据单因素实验优化的最佳吸附条件为:吸附时间30 min、茶多酚溶液初始浓度为3 mg/mL、吸附固液比40∶10 mg/mL、pH 6.5,吸附温度 45 ℃。在此条件下对茶多酚的最大吸附量为213.99 mg/g。作为对比,测定了此条件下Fe3O4@SiO2@SiO2对茶多酚的吸附量为75.21 mg/g,明显发现在进行表面离子液体功能化后,磁性纳米颗粒的吸附萃取能力明显提高,这可能是由于表面的离子液体能够通过疏水作用、氢键作用等作用力与茶多酚发生结合[7]。
2.2.2 吸附动力学研究
吸附动力学是重要的吸附特性,它可以用来描述吸附过程中吸附速率与时间的关系,不仅为其他的吸附实验提供吸附所需的平衡时间,而且能够对吸附的过程进行预测。由实验结果得到的动力学曲线如图7所示。

图7 Fe3O4@SiO2@SiO2对茶多酚的吸附动力学曲线
可以看出,不同浓度下的三条动力学曲线大致趋势一样,在前30 min以内,吸附量随着时间的延长而不断增加,之后吸附量基本稳定,达到了吸附平衡。以此为基本条件,应用最经典的两个动力学模型,对于吸附过程进行拟合,拟合参数如表1所示。可知在三个不同的温度条件下,准二级动力方程离合的相关系数r2均大于采用准一级动力学方程离合的相关系数。由准二级动力学方程算得到的最大理论吸附量qe,cal也与实验得到的最大吸附量更为接近,这都说明所制备的磁性纳米颗粒吸附茶多酚的过程更符合准二级动力学方程的假设,可以更好地对吸附过程进行预测。

表1 准一级和准二级动力学模型的相关参数
2.2.3 吸附热力学研究
吸附等温线是表示溶液中吸附质的平衡浓度(Ce,mg/L)对应的吸附量(qe,mg/g)的关系曲线(见图8),由图可知,吸附平衡后随着平衡浓度继续增大,平衡时的吸附量变化减少,且随着温度的升高,平衡吸附量呈增大的趋势,表明在所测试温度范围内,升温有利于吸附过程。

图8 不同温度下(25 ℃,35 ℃和45 ℃)的吸附等温线
在此基础上,分别用 Freundlich 和 Langmuir模型对吸附过程进行数据拟合,结果如表2所示,所制备吸附剂在三个温度下对茶多酚的吸附与Freundlich吸附等温方程拟合的相关系数r2均大于与 Langmuir吸附等温方程拟合的相关系数,说明该吸附过程更符合 Freundlich吸附等温模型,即说明吸附过程是由多个活性位点控制,且1/n的值均小于1,证明吸附过程比较容易进行[12]。
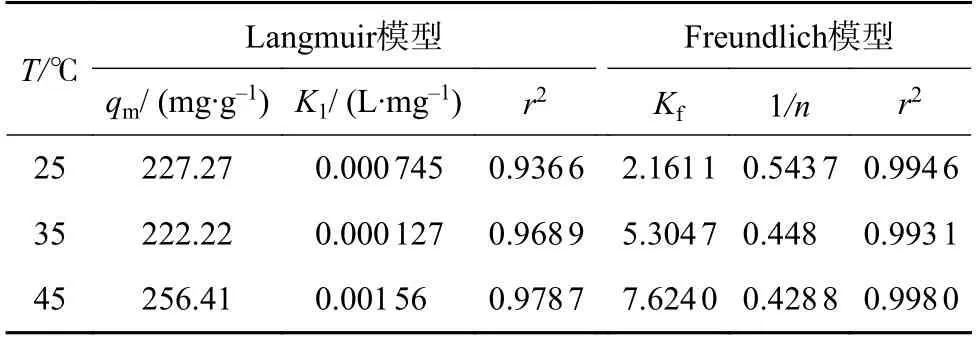
表2 Langmuir和Freundlich模型拟合后的相关参数
3 结束语
本研究以咪唑类脯氨酸离子液体作为修饰成分对磁性介孔二氧化硅纳米颗粒进行表面改性而制备了一种新型的磁性吸附剂,并通过扫描电子显微镜,傅里叶变换红外光谱仪,X-射线衍射仪和振动样品磁强计对其结构性能进行了表征。在此基础上,对其茶多酚的吸附性能进行了研究,根据单因素实验优化的最佳吸附条件为:吸附时间30 min、茶多酚溶液初始浓度为3 mg/mL、吸附固液比40∶10 mg/mL、pH 6.5,吸附温度 45 ℃,此时的吸附量为213.99 mg/g。吸附动力学和热力学研究结果表明该吸附过程更符合准二级动力学方程和Freundlich吸附等温模型。相较于传统的吸附分离过程,将所制备的新型磁性吸附剂用于茶多酚的吸附分离,不仅可以通过外加磁场实现固液分离,操作方便快捷,而且对茶多酚的吸附量远高于现有报道[13-14]。本研究结果可以为建立新型的茶多酚分离方法提供一定的参考。
