电流密度对镍电极电催化析氢性能的影响
2022-10-14邢乐红王宜鑫石鑫婷孟凡旭李闯刘胜熠
邢乐红,王宜鑫,石鑫婷,孟凡旭,李闯,刘胜熠
(牡丹江师范学院化学化工学院,黑龙江牡丹江 157012)
“十四五”规划提出推动能源结构、产业结构转型升级,推动绿色低碳经济体系建设,加快实现碳达峰和碳中和。氢能作为二次能源具有能量高、来源广、绿色环保等优点,可以有效缓解当下能源、环境问题,受到研究者们广泛关注[1-2]。在酸性或碱性介质中金属的析氢反应是电化学领域研究最多的反应之一[3],然而,由于析氢过电位的存在使电解制氢过程产生大量能耗。铂族贵金属具有较低的析氢过电位,是比较理想的电极材料,但铂族金属价格昂贵、丰度较低增大了电解制氢成本与难度。因此,研究低成本、具有较低析氢过电位的电极材料对提高电解制氢效益是非常有意义的。过渡金属镍外层存在未成对的d电子,在析氢反应中容易与氢原子1s轨道进行配对并吸附在金属镍表面反应生成氢气[4]。金属镍由于其成本低、在碱性介质中具有高稳定性与电催化活性常常被用做电解制氢催化剂[5-6]。研究发现,在电沉积过程中电流密度对电极性能有很大影响。适宜的电流密度能改变镀层的沉积速率与结晶大小,有利于形成致密均匀的镀层,从而提高电极的析氢性能。本文使用直接电沉积技术,通过改变电流密度制备镍电极,通过SEM分析与电化学方法对电极性能进行测试,研究了不同电流密度对电极微观形貌和析氢性能的影响。
1 实验部分
1.1 材料合成
以可溶性镍板为阳极,紫铜片为阴极。前处理流程为打磨、超声(丙酮)清洗、20 % NaOH溶液以及10 %酸活化,每次处理后均用去离子冲洗至中性。
镀液组成为10 g/L NiCl2、30 g/L NH4Cl、350 g/L Ni(NH2SO3)2·4H2O,工艺条件为pH 3.8,温度35℃,沉积时间30 min,反应全程进行磁力搅拌。
1.2 电极物理分析
用美国FEI公司热场发射QUANTA FEG 400型扫描电子显微镜观察镍镀层微观形貌。
1.3 电化学性能测试
使用美国PARSTAT 4000型电化学工作站测试镍镀层在1 mol/L NaOH溶液中的极化(LSV)曲线、塔菲尔(Tafel)曲线、交流阻抗(EIS)曲线以及计时电位(CP)曲线。电极测试面积为0.785 cm2,辅助电极为10.0 mm×10.0 mm×0.1 mm铂片电极,参比电极为饱和甘汞(SCE)电极,扫描速度为5 mV·s-1。计时电位曲线测试的电流密度为-100 mA·cm-2,时间12 h。交流阻抗测试频率范围为10-2~105Hz,振幅为5 mV。
2 结果与讨论
2.1 沉积电流密度对镀层微观形貌影响
控制电沉积其他条件不变,研究改变电流密度对镍电极微观形貌的影响,图1为不同电流密度获得的镍电极SEM图。

图1 不同电流密度下制备的镍电极微观形貌Fig.1 Microscopic morphology of nickel electrodes prepared under different current densities
由图1可以看出,当电流密度为2.6 A·dm-2时,镀层由各种大小不一的晶粒组成,镀层较薄,电流效率低。电流密度提升至3.0 A·dm-2时,镀层光滑平整、结晶细致,质量较高。电流密度提高到3.4 A·dm-2时,镀层表面出现凸起“鼓胞”与裂纹现象。这可能是因为在电沉积制备过程中,当电流密度过低时,阴极极化作用弱,镀层生成晶核速度较慢,晶粒的生长速率远大于生成速率,导致镀层较薄且晶粒粗大。随着电流密度增加,阴极极化作用增强,镀层成核速度加快,晶粒生成速率提高,电结晶得到细化,镀层更致密。当电流密度继续增大,阴极极化作用过强,阴极表面析氢反应加剧。一方面导致镀层与基底结合力变弱,出现“鼓胞”与裂纹现象,镀层质量较差;另一方面电流密度过大,金属镍沉积速率较快,阴极部分Ni2+得不到及时补充,镀层受浓差极化影响较大,导致结晶粗大。
2.2 沉积电流密度对镀层析氢性能影响
2.2.1 极化曲线分析
图2为5种镍电极在1 mol/L NaOH溶液测试得到的LSV曲线。由图2可知,电流密度对镀层催化析氢活性影响较大,随着电流密度的增加,镍电极在相同电位下析氢电流密度呈先升高再降低的趋势。这可能是由于电流密度增大,Ni2+扩散速率也加大,减少了Ni2+运动到阴极的时间,加快了沉积速率,有利于形成比较理想的镀层结晶,同时电流密度过高也会导致大量气体析出,导致镀层结构不稳定进而影响析氢活性。当沉积电流密度为3.0 A·dm-2时获得的镍电极析氢性能最佳,在该电流密度下电沉积效率最高,晶粒成核速率较快,晶粒细化使镀层比表面积增大,这有利于增大电极与电解液之间的有效催化面积,从而提高电催化活性。
2.2.2 塔菲尔曲线分析
图3为5种镍电极在1 mol/L NaOH溶液测试得到的Tafel曲线。塔菲尔公式如公式(1)所示,其中η为析氢过电位,j0是交换电流密度,b为Tafel斜率[7]。b值是体现析氢反应动力学过程的一个重要参数,能反映出析氢过电位与电流密度的关系,b值越小,相同电流密度下所需的过电位越小。表1为5种镍电极析氢反应的电催化参数,这些数据表明镍电极析氢反应动力学过程受Volmer反应步骤控制。当电流密度为3.0 A·dm-2时,获得的镍电极结晶更加细致,具有更大的比表面积以及更多的活性位点,有利于电极表面吸附氢的形成,加快了析氢反应进程[8]。由表1可知,3.0 A·dm-2时获得的镍电极具有最大的交换电流密度与最小的析氢过电位,析氢催化性能最佳,这与LSV曲线分析结果相同。这些数据均表明适中的沉积电流密度能够细化镀层结晶,对催化剂性能的提高有一定的促进作用。电流密度为3.0 A·dm-2时制备的镍电极在碱性溶液里与其他文献中镍电极相比表现出更好的催化活性(如表2)[9-11]。
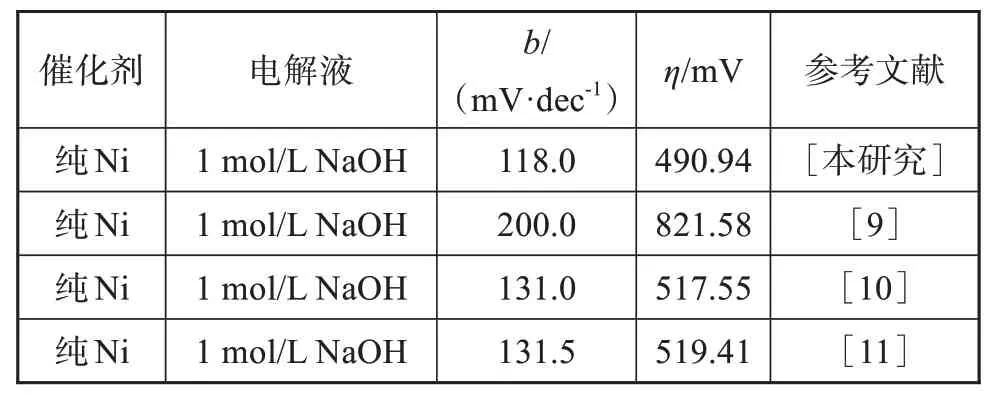
表2 本研究与各种镍电极析氢电催化剂在碱性条件下的催化性能Tab.2 Catalytic performance of the present study with various nickel electrode hydrogen precipitation electrocatalysts under alkaline conditions


图3 镍电极在1 mol/L NaOH溶液中的塔菲尔曲线Fig.3 Tafel curves of nickel electrode in 1 mol/L NaOH solution
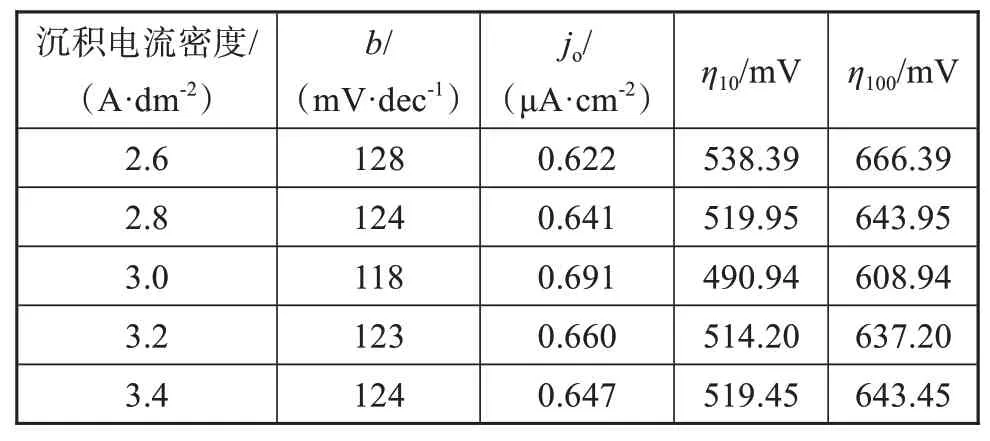
表1 镍电极在1 mol/L NaOH溶液中析氢反应的电催化参数Tab.1 Electrocatalytic parameters of hydrogen evolution reaction of nickel electrodes in 1 mol/L NaOH solution
2.2.3交流阻抗分析
图4为5种镍电极在阴极过电位250 mV下测得的EIS曲线,采用ZSimDemo软件对测试出的EIS曲线使用图4插图所示等效电路图进行拟合,拟合结果如表3所示。其中,CPE为常相位角元件[12],Rs为溶液电阻,Rct为电荷转移电阻。Rct值越小,对析氢反应动力学过程越有利。由表3可知,电流密度为3.0 A·dm-2时获得的镍电极Rct值明显小于其他电极,这说明3.0 A·dm-2时获得的镍电极电子转移速率最快,有利于加快H原子在电极吸脱附进程,具有更高的电催化活性。
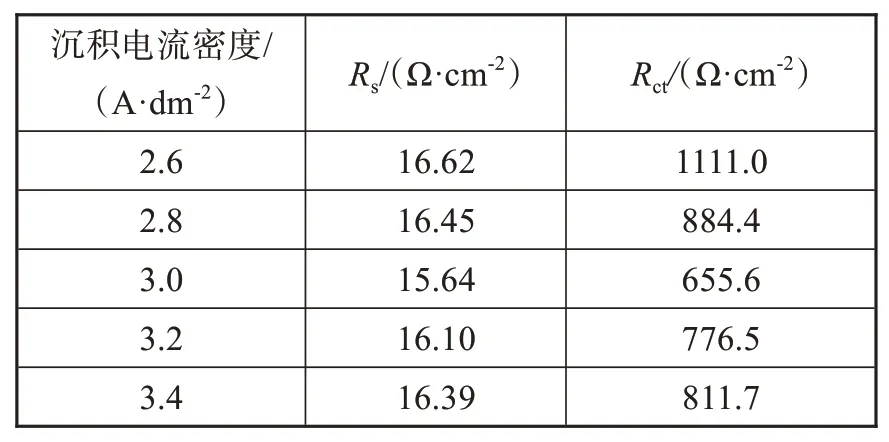
表3 5种镍电极在1 mol/L NaOH溶液中的交流阻抗拟合参数Tab.3 AC impedance fitting parameters of five nickel electrodes in 1 mol/L NaOH solution
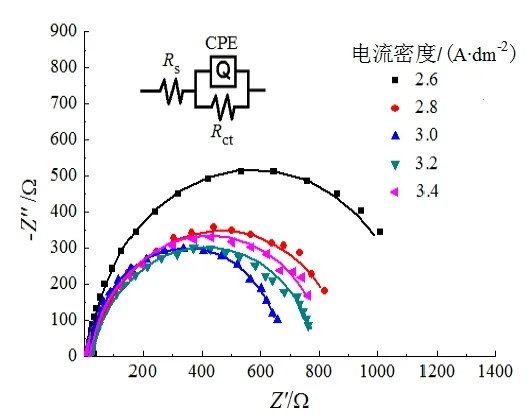
图4 5种镍电极在1 mol/L NaOH溶液中的交流阻抗曲线Fig.4 AC impedance curves of five nickel electrodes in 1 mol/L NaOH solution
2.2.4 稳定性分析
稳定性是评价电极性能一个重要依据[13],如图5为电流密度为3.0 A·dm-2时获得的镍电极计时电位曲线。在12 h的稳定性测试中,电极电位仅出现轻微波动,证明该电极在析氢反应中具有高稳定性与耐久性。插图为12 h计时电位测试前后的LSV曲线,可以看出电极反应前后的LSV曲线十分接近,在0.01 A·dm-2阴极极化下,反应后电极析氢过电位仅增大16 mV,增大幅度小于4%,说明镍镀层具有较好的稳定性。
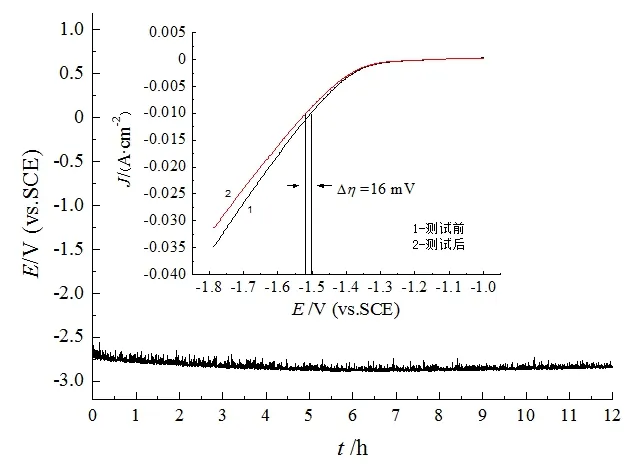
图5 镍电极在1 mol/L NaOH溶液中12 h计时电位曲线Fig.5 Chronopotentiometric curves of nickel electrode in 1 mol/L NaOH solution after 12 h
3 结论
当电流密度为3.0 A·dm-2时,电流效率最高,镀层致密均匀、结晶细致,结合力较好,并且具有较大比表面积与析氢活性位点,加快了吸附氢原子在电极表面形成,在1 mol/L NaOH溶液中表现出最好的电催化析氢活性与较好的析氢稳定性。
