镍阳极中S元素对电化学溶解性能的影响
2022-10-14卢建波解雁冰韩漫漫夏日辉王春霞
卢建波,解雁冰,韩漫漫,夏日辉,王春霞
(1.金川集团股份有限公司镍冶炼厂,甘肃金昌 737100;2.南昌航空大学材料科学与工程学院,江西 南昌 330063)
电镀专用镍阳极材料及其溶解行为对电镀件的质量及电镀过程的维护具有至关重要的影响。现阶段,在我国电镀镍工艺中,仍以电解镍板作为主要的阳极材料。但电解镍板存在溶解时产生麻点腐蚀,有很多残渣,而且随着使用时间的延长,会自行脱落,且存在导电性不良、极易钝化等诸多问题[1]。Dibari G A[2]在详细比较硫和其他组分对镍阳极电化学活性的影响后提出硫是最有实用价值的添加剂,国外很早便开始有活性镍阳极材料的研究和应用[3-5]。为发展我国的电镀工艺,国内一些单位也试制生产含硫活性镍。1986年含硫活性镍在武进阳极材料厂试制成功,根据检测报告和对产品的抽查结果显示产品的性能接近或达到国际镍矿有限公司(INCO)的1984年样品水平[6]。翟秀静等[7]研究了含硫活性镍的制备及活性,重点考察了镍生产过程中电流密度、电解液温度及阳极板形状、覆盖材料对活性镍制备的影响。杨少华等[8]介绍了以新工艺制取含硫活性镍冠的试生产情况。侯小川等[9]确定了采用硫化镍可溶阳极电解制备含硫活性镍扣的工艺和最佳技术参数,在此条件下制备出的含硫镍扣,外表光亮、形状规则、电化学活性较强、化学成分也符合电解镍的要求。
由于含硫镍的高活性,近年来国内对含硫镍的需求越来越多。目前国内生产含硫镍材料的方法包括气相沉积法与电解法,而气相沉积法是在气体状态下使镍硫元素通过分解沉积从而形成含硫镍材料,该法存在着生产过程复杂、耗能高、产品质量不稳定等缺点。金川集团对此开展了系统地研究,采用电解法制备含硫镍,在镀液中引入含硫添加剂,生产出含硫量为0.03%的金川含硫电镀专用镍角。本文将金川集团股份有限公司镍冶炼厂生产的金川含硫电镀专用镍角(以下简称含硫镍角)与金川电镀专用镍角(以下简称纯镍角)做比较,用阳极极化曲线、电位-时间曲线等方法测试其阳极溶解的电化学行为,用扫描电子显微镜(SEM)观察镍阳极溶解的微观形貌,研究镍阳极中S元素添加对电化学溶解性能的影响。
1 实验
1.1 材料
阳极材料采用纯镍角和含硫镍角,规格均为25 mm×25 mm×10 mm。其化学成分如表1所示,外观如图1所示。两种镍阳极材料纯度非常高,均达到99.95%以上,符合GB/T6516-2010[10]。

图1 阳极材料宏观形貌Fig.1 Macromorphology of anode materials
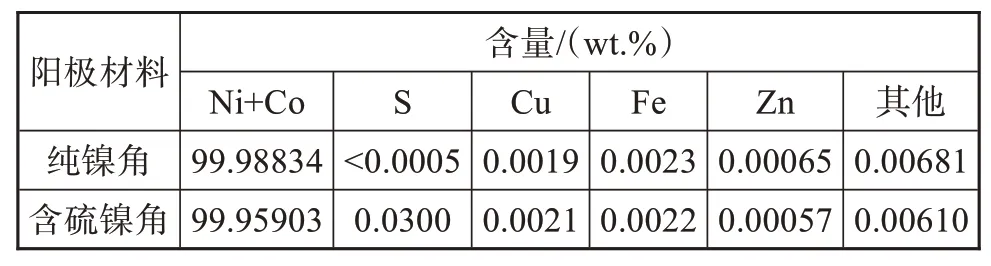
表1 纯镍角和含硫镍角的化学成分Tab.1 Chemical composition of pure nickel square and sulfur-containing nickel square
1.2 工艺流程
(阴极黄铜片)除油(除油粉)→去离子水洗→活化(稀硫酸)→去离子水洗→电镀溶解30 d(硫酸镍250 g/L、氯化镍30 g/L、硼酸30 g/L、十二烷基硫酸钠0.1 g/L,pH为4.0,温度55℃,阴极电流密度1.5 A/dm2)[11]。
1.3 性能测试
采用RST5200型电化学工作站测试镍阳极在55℃镀液中的阳极极化曲线、塔菲尔曲线和电位-时间曲线,扫描速度为10 mV/s。溶液选用瓦特镀镍液,采用三电极体系,其中工作电极是纯镍角和含硫镍角(面积为1 cm×1 cm),参比电极为饱和甘汞电极,辅助电极为铜电极(面积为1 cm×1 cm)。用600#、1000#、1200#砂纸将工作电极试样逐级打磨,用抛光液抛光成镜面。随后用含无水乙醇、丙酮的脱脂棉分别擦拭,浸入20%的稀硫酸进行活化5 min。
采用荷兰FEI公司生产的Nova Nano SEM450型场发射扫描电子显微镜(SEM)表征镍阳极溶解形貌。
采用电镀中试生产线(槽体40 L)连续生产30 d,计量镍阳极的残渣率,残渣率的计算公式为:
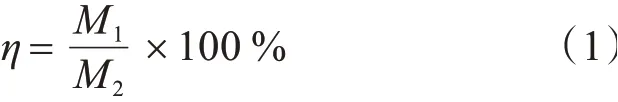
式中:η为残渣率;M1为残渣的质量,M2为阳极溶解的质量。残渣的质量采用机械剥离的方法使得镍表面溶解后的疏松层掉落,经过水洗、烘干后测得镍的平均质量作为镍渣的质量,测量结果采用多次实验之后的平均值。
2 结果和讨论
2.1 阳极极化曲线和E-t曲线
图2为两种镍阳极在镀镍液中的阳极极化曲线。由图2可以看出,在电位较负的情况下,两种镍阳极的电极行为差异较小,但当电极电位从约-0.18 V向正方向移动时,两种材料的电极行为截然不同,纯镍角阳极极化度高于含硫镍角。增加同样电流密度,纯镍角的电位值变化更大,很快发生钝化,电极电位约为0 V时就完全钝化,致钝电流密度仅为0.4 A/dm2,而含硫镍角在较高的电流密度范围内一直保持着正常溶解状态,说明含硫镍角能保持高速率的阳极溶解。

图2 两种镍电极的阳极极化曲线Fig.2 Anodic polarization curves of two types of nickel electrodes
图3是不同电流密度下,两种材料的E-t曲线。可以看出,含硫镍角的溶解电位比纯镍角负,在低电流密度(0.4 A/dm2、0.5 A/dm2)下,两者的电位差约0.15 V;在高电流密度(1.0 A/dm2、6.0 A/dm2)下,两者的电位差约0.25 V。含硫镍角在较负的电位下可以迅速溶解,镍阳极中的S元素具有较强的去极化作用,从而降低镍阳极的溶解电位,加速含硫镍角溶解,提高镍阳极的溶解活性。
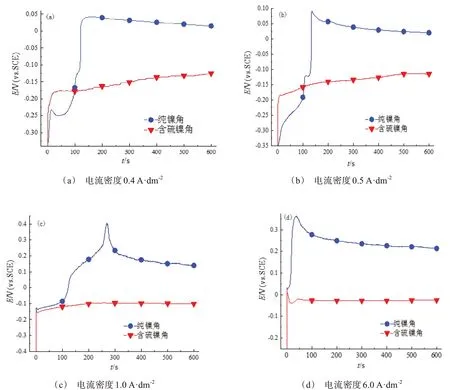
图3 电位-时间曲线Fig.3 Potential-time curves
镍是最容易钝化的金属之一,在酸性瓦特镀镍溶液中,纯镍阳极存在着显著的钝化倾向。在高的阳极极化下,OH-离子有可能在阳极上放电生成氧气,氧气的析出促使Ni3+离子生成,三价的镍离子不稳定,会继续发生如下反应:
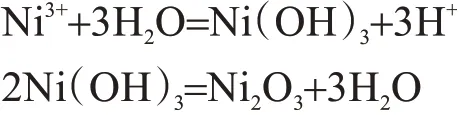
棕褐色的Ni2O3覆盖在镍阳极上,使阳极的有效工作面减少,真实电流密度相应增大,阳极电位升高,从而又加速上述反应进行,使阳极钝化越来越严重[12]。纯镍中添加0.02 %~0.03 %的硫可以提高其电化学溶解活性,陈文亮[1]给出相关假定分析,假定硫在镍中以NiS或Ni3S2形式均匀的分布,镍发生钝化产生的Ni3+离子会与活性镍中的NiS或Ni3S2反应,将产生的Ni3+转化为Ni2+,从而使钝化膜Ni2O3溶解或不生成。在金属腐蚀溶解中,阳极表面生成的钝化膜等高电阻产物增大了体系电阻,电极反应受阻,增大极化,而含硫镍角中的S元素抑制了钝化膜的生成,具有去极化作用;同时,由于含硫镍角体系电阻较小,相同电流下含硫镍角镍阳极在较负的电位下就可以溶解,降低了槽电压。
2.2 塔菲尔曲线
通过塔菲尔测试可以确定两种镍阳极在镀液中发生稳态极化时的动力学信息,即在不通电流的情况下镍阳极在镀液中发生自溶解的动力学信息,图4为纯镍角和含硫镍角在镀镍溶液中的塔菲尔曲线。腐蚀电位Ecorr反应材料发生电化学腐蚀的倾向,Ecorr越大,腐蚀倾向越小;腐蚀电流密度Jcorr反应材料腐蚀速率的大小,Jcorr越小,表明材料的腐蚀程度越小[13],表2所列为纯镍角和含硫镍角自腐蚀电位Ecorr和自腐蚀电流密度Jcorr。
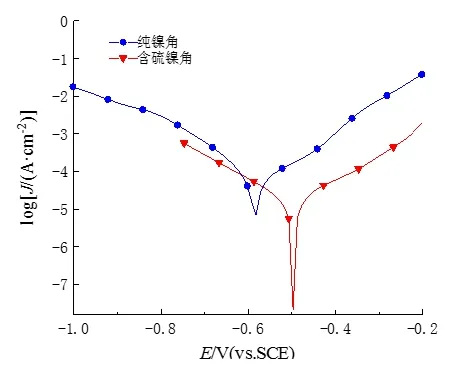
图4 两种镍电极在瓦特液中的塔菲尔曲线Fig.4 Tafel curves of two nickel electrodes in Watt solution
从表2可以看出,两者的自腐蚀电位由高到低分别为含硫镍角>纯镍角,自腐蚀电流密度由高到低分别为纯镍角>含硫镍角。纯镍角的自腐蚀电流密度最大、自腐蚀电位最负,其在镀液中比含硫镍角更容易发生自溶解。在使用过程中长时间停镀时,纯镍角阳极浸没在镀液中更容易发生自溶解,溶液镍离子浓度富集,造成镀液成分不稳定,增加了镀液维护和调整的困难。

表2 纯镍角与含硫镍角塔菲尔拟合结果Tab.2 Tafel fitting results of pure nickel square and sulfur-containing nickel square
2.3 溶解形貌分析
两种镍阳极溶解过后的宏观形貌如图5所示,纯镍角宏观表面没有大量的孔洞,溶解是呈周边棱角向基体中心的方向进行的,电化学溶解不均匀,溶解后表面松软;而含硫镍角的溶解较为均匀,溶解后的含硫镍角仍然很结实,含硫镍角的溶解呈逐层溶解的趋势,但大量的镍角发生分层现象,可能是采用含硫添加剂使镍角应力增大。

图5 两种镍阳极的溶解宏观形貌Fig.5 Macroscopic dissolution morphology of two types of nickel anodes
图6为纯镍角在不同放大倍数下观察到的微观溶解形貌图,可以看出纯镍角电解后,其表面较松散,不致密,如同“手撕面包”呈片状脱落;图7为含硫镍角在不同放大倍数下观察到的微观溶解形貌图,可以看出含硫镍角在阳极溶解过程中整体上溶解表面较为光滑、均匀,某些局部区域溶解出现疏松。

图6 纯镍角电化学溶解后表面微观形貌Fig.6 Surface micromorphology of pure nickel square after electrochemical dissolution

图7 含硫镍角电化学溶解后表面微观形貌Fig.7 Surface micromorphology of sulfur-containing nickel square after electrochemical dissolution
镍阳极的溶解过程是一个“活化-钝化-再活化”的交替过程[14],在阳极活性溶解区,阳极溶解电流随着电极电位正移而增大,阳极表面处于活化状态;当电极电位达到致钝电位时,镍阳极表面生成了一层阻碍电极反应进行的钝化膜,金属阳极表面由活化状态变为钝化状态;在溶解过程中,三价镍氧化物钝化膜还会与瓦特液中的氯离子发生作用,钝化膜首先变松,然后溶解,此时电流密度由于工作表面的增大而下降,阳极开始呈现活化状态。Moula M G等[15]在文献中也提出这一观点,图8是测试的羰基镍样品阳极溶解过程中电位与时间的关系图,文献指出,电位振荡是点蚀现象的典型表现,溶解的机制涉及到钝化层的破坏与形成这两个相互竞争的过程。随着溶解时间的增加,电压出现上升和下降的波动,上升为钝化,下降为溶解过程。由于镍电极表面生成的钝化膜增大了体系的电阻值,减少了阳极的有效工作面,使真实电流密度相应增大,阳极电位升高,当电压下降时镍电极又发生溶解,如此往复的现象就是阳极循环钝化现象。在这样的交替循环下,溶解就会不均匀导致部分区域钝化,而其它区域正常溶解,形成孔洞,随着溶解时间增加,孔洞内部发生横向溶解,对未溶解区域产生机械剥离,这种溶解方式导致纯镍角在溶解过程中生成海绵状物质覆盖在表面呈架空状态,在电镀达到一定时间后这层物质由于被架空而自行脱落成为碎镍残渣[16]。
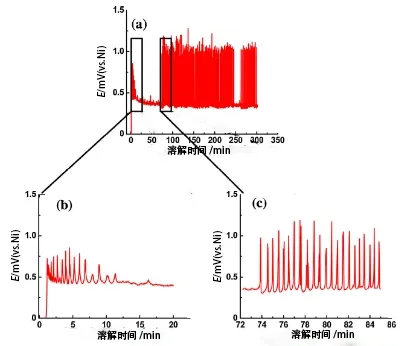
图8 镍阳极的溶解机制Fig.8 Dissolution mechanism of nickel anode
含硫镍角中的S元素抑制了钝化膜的生成,由图2可知,含硫镍角在较大的电流密度下也不易钝化,有很高的溶解活性,同时图3也证明了含硫镍角的电压稳定性好,不易出现“电压抖动”现象,含硫镍角在一定范围内一直处于活化溶解状态,随着溶解时间的增加,其溶解均匀,不会产生如纯镍角一样的海绵状结构,减少了由于“活化-钝化-再活化”溶解方式产生的残渣量。
2.4 溶解的残渣量分析
利用电镀中试线,配制两槽40 L瓦特镍镀液,55℃连续电镀30 d(720 h通电量为49766400 C)。溶解30 d后将钛篮中的残渣清理烘干后进行称重比较,如表3所列,产生的残渣如图9所示。
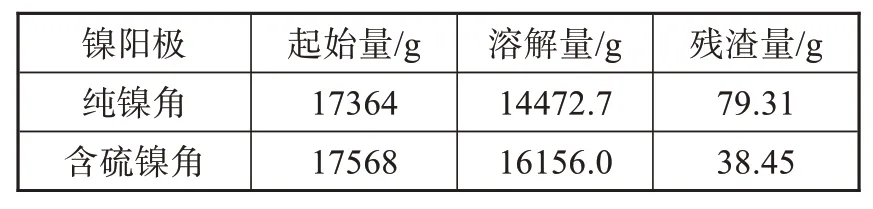
表3 两种镍阳极的残渣量情况Tab.3 The amount of residue situation of two nickel anodes

图9 两种镍阳极的残渣图Fig.9 Residue diagrams of two nickel anodes
由表3可知,在钛篮中镍阳极装载量相差不大的情况下,含硫镍角比纯镍角多溶解1500 g左右,而产生较少的残渣量,具有较高的溶解活性。由图9可知,含硫镍角溶解过后形成的镍渣是呈炭黑色的硫化镍[1],并且残渣比较细腻,大小也比较均匀规整;而纯镍角的镍渣则较粗。硫化镍残渣还可以与镀液中的铜离子生成硫化铜沉淀,减少铜的污染[1]。两种镍阳极的残渣率根据公式(1)进行计算,结果如图10所示,纯镍角和含硫镍角连续产生的残渣率分别为0.548%、0.238%。
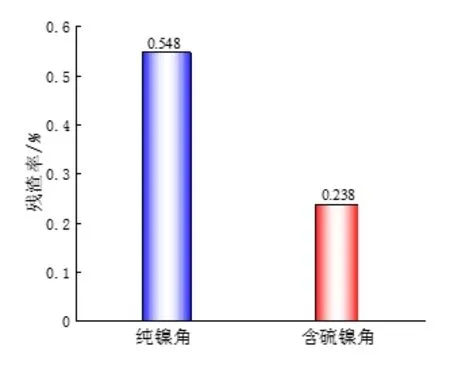
图10 两种镍阳极的残渣率Fig.10 Residue rate of two nickel anodes
纯镍阳极的溶解是在钝化膜下面进行的,以孔洞形式出现,成架空状态而最终脱落成为镍渣。含硫镍角在电镀后的宏观和微观形貌表明,含硫镍角作为电镀的阳极溶解非常均匀,溶解直接从表面开始进行,表面没有产生钝化膜,使其产生的镍渣较少。在同样电镀时间下,施加相同电流密度时,纯镍角钝化产生的钝化膜使阳极的有效工作面减少,真实电流密度相应增大,产生较多的镍渣。在镀镍工艺中,对镍阳极性能的要求是具有良好的导电性能,生成的泥渣尽量少[17],过多残渣的积累会使导电不良。含硫镍角产生的残渣比纯镍少,电镀性能更为优异。
3 结论
(1)镍阳极中的S元素具有较强的去极化作用,降低镍阳极的溶解电位,加速含镍角溶解,提高镍阳极的溶解活性。
(2)含硫镍角不易产生化学溶解,减少了电镀液中镍离子富集。
(3)含硫镍角的溶解较为均匀,溶解后的含硫镍角仍然很结实,产出的残渣量比纯镍少。
