基于高内涵筛选技术的吴茱萸次碱肝毒性研究
2022-10-14路青瑜杨付梅孙黔云
郭 丽,路青瑜,李 娇,杨付梅,孙黔云
(贵州省中国科学院天然产物化学重点实验室,贵州医科大学省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550014)
吴茱萸为芸香科植物吴茱萸Euodiarutaecarpa(Juss.) Benth.、石虎Euodiaruteacarpa(Juss.) Benth var.Officinalis (Dode) Huang或疏毛吴茱萸Euodiaruteacarpa(Juss.) Benth.var.bodinier (Dode) Huang的干燥近成熟的果实。其性味辛热、苦,有小毒,归肝、胃、脾、肾经,能散寒止痛,降逆止呕,助阳止泻,用于头痛、腹痛、脚气、腹泻等,为温中止痛的上品[1]。《本草纲目》中有提及吴茱萸的毒性:“有小毒,动脾火,病目者忌之”[2]。
作为贵州大宗药材吴茱萸,吴茱萸次碱(ruteacarpine,RUT)是其主要成分,药理学研究表明,RUT具有抗高血压、抗癌、抗炎症反应、抗抑郁、保护胃黏膜等多种药理作用[3]。近年来随着吴茱萸及其制剂在临床上的使用率越来越高,因服用吴茱萸不当产生的毒性时有发生,曾出现1例报道因服用吴茱萸过量致死,在死者的血液中检测到吴茱萸生物碱[4]。有文献研究显示[5],吴茱萸的水提、醇提、挥发油3个组分都表现出了一定的肝毒性。RUT是吴茱萸的主要成分之一,有文献报道称其在高浓度下能使肝细胞培养上清中的AST、ALP和LDH水平升高,表现出明显的肝毒性[6],但其具体的肝毒性机制尚不清晰。课题组的前期筛选结果也表明,RUT对HepG2有明显的毒性。本研究基于高内涵筛选技术开展了RUT对HepG2细胞的毒性作用及机制研究,以期为进一步认识RUT的毒性机制和临床安全用药提供参考依据。
1 材料与方法
1.1 试剂胎牛血清来源于南美;RUT(PS000914)购于成都普思生物科技有限公司;DMEM培养基(8121371)购自美国Gibco公司;荧光染料Hoechst 33342(C1022)、Mitotracker Red CMXRos(C1049B)、DAPI(C1002)、活性氧检测试剂盒(S0033S-1)、NF-κB激活-核转运检测试剂盒(SN368)、钙离子荧光探针Fluo-4 AM(S1060)购于江苏碧云天生物技术研究所;DIR细胞膜染料(DD0408)购于江苏宇恒生物科技有限公司;p38(8690s)、ERK 1/2(4695s)、p-ERK 1/2(4370s)、JNK(9252s)、p-JNK(9255s)、c-Fos(2250s)、c-Jun(9165s)、p-NF-κB p65(3033s)单克隆抗体(一抗)、Alexa Flour 488荧光标记山羊抗兔IgG、Alexa Flour 488荧光标记山羊抗鼠IgG抗体(二抗)购于美国CST公司;Alexa Flour 488荧光标记p-p38(sc-166182)、p-STAT3(sc-8059)和Alexa Flour 647荧光标记STAT3(sc-8019)抗体购于美国Santa Cruz Biotechnology公司;Annexin V-FITC试剂盒(556547)购于上海优宁维公司;阿霉素(D8740-25 mg)购于北京索莱宝生物科技有限公司;二甲基亚砜,美国Sigma公司。
1.2 仪器高内涵筛选仪型号为CellInsight Cx5(美国赛默飞公司);TS2-S-SM倒置相差显微镜(日本Nikon公司);NovoCyte 2040R流式细胞仪(美国ACEA公司);连续波长酶标仪Gen5(美国基因公司);赛默飞CO2培养箱(美国Thermo公司);Milli-Q Integral 超纯水系统(美国Milipore公司)。
1.3 细胞培养与实验分组HepG2细胞来源于中国典型培养物保藏中心,生长于胎牛血清浓度为10%的DMEM高糖培养基中,培养在含有5% CO2,温度为37 ℃的培养箱中。待HepG2细胞生长至80%~90%时,用0.25%的不含EDTA的胰酶将细胞消化下来,离心后用DMEM完全培养基调整细胞密度至1×108个·L-1,每孔100 μL细胞接种于Ⅱ型胶原包被的96孔板中,使得每孔的细胞数为1×104个[7]。RUT终浓度为5、10、25、50、100 μmol·L-1,阿霉素为阳性对照,终浓度为1.25、0.625 μmol·L-1,对照组为0.1% DMSO,每组设置2个复孔。
1.4 MTT法检测HepG2细胞的活力将处于对数期的HepG2细胞悬液接种于96孔细胞培养板中,每孔100 μL(1.0×104个/孔)。置37 ℃、5%的CO2细胞培养箱中培养24 h,给药处理,每组设置3个复孔,分别继续培养24、48 h后,每孔加入20 μL MTT后于37 ℃、5%的CO2细胞培养箱中孵育4 h后,然后再加入50 μL的三联液充分溶解沉淀,过夜孵育后,使用酶标仪于570 nm波长处检测其OD值。HepG2细胞的生长抑制率/%=[(实验组OD570 nm-对照组OD570 nm)/对照组OD570 nm]×100%。
1.5 细胞ROS水平检测给药处理6、12、24、48 h后,分别向每孔中加入50 μL已预热至37 ℃的Hoechst 33342染料,然后再加入50 μL已预热至37 ℃ DCFH-DA染料,使得各染料的终浓度分别为5、10 μmol·L-1。染料加入后于37 ℃避光孵育30 min,弃上清液,每孔用200 μL PBS洗3次,最后加入50 μL完全培养基溶液。使用高内涵筛选仪采集图像,每组双复孔,每孔采集12个视野,第一通道于388 nm/461 nm检测Hoechst 33342染色,第二通道于488 nm/525 nm检测DCFH-DA染色,Thermo ScientificTMHCS StudioTM分析系统进行结果分析。
1.6 细胞线粒体膜电位检测给药处理3、6、12、24、48 h后,向每孔中加入50 μL已预热至37 ℃的Hoechst 33342染料,然后再加入50 μL已预热至37 ℃ Mito-Tracker Red CMXRos染料,使得各染料的终浓度分别为5、0.2 μmol·L-1。染料加入后于37 ℃避光孵育40 min,弃上清液,每孔用200 μL PBS洗3次,最后加入50 μL完全培养基溶液。使用高内涵筛选仪采集图像,每组双复孔,每孔采集12个视野,第一通道于388 nm/461 nm检测Hoechst 33342染色,第二通道于551 nm/576 nm检测CMXRos染色,Thermo ScientificTMHCS StudioTM分析系统进行结果分析。
1.7 细胞内钙离子浓度检测给药处理3、6、12、24、48 h后,向每孔中加入50 μL已预热至37 ℃的Hoechst 33342染料,然后再加入50 μL已预热至37 ℃ Flou-4 AM染料,使得各染料的终浓度分别为5、10 μmol·L-1。染料加入后于37 ℃避光孵育40 min,弃上清液,每孔用200 μL PBS洗3次,最后加入50 μL完全培养基溶液。使用高内涵筛选仪采集图像,每组双复孔,每孔采集12个视野,第一通道于388 nm/461 nm检测Hoechst 33342染色,第二通道于488 nm/525 nm检测Flou-4 AM染色,Thermo ScientificTMHCS StudioTM分析系统进行结果分析。
1.8 细胞膜完整性检测给药处理3、6、12、24、48 h后,用预热至37 ℃的完全培养基配制含有细胞核染料Hoechst 33342和DIR混合的活细胞染料,使得各染料的终浓度分别为5、500 μmol·L-1。染料加入后于37 ℃避光孵育40 min,弃上清液,每孔用200 μL PBS洗3次,最后加入50 μL完全培养基溶液。使用高内涵筛选仪采集图像,每组双复孔,每孔采集12个视野,第一通道于388 nm/461 nm检测Hoechst 33342染色,第二通道于742 nm/767 nm检测DIR染色,Thermo ScientificTMHCS StudioTM分析系统进行结果分析。
每年军坡节,祭祀活动体现出情感的历史积淀与文化传承,潜在地影响着社会中每个人的行为方式,节日中的历史认同是重要的历史教育及爱国教育的德育资源。
1.9 MAPK、NF-κB、JAKs-STATs 信号通路活化水平检测细胞给药处理3、24 h后,用PBS洗涤细胞后,加入固定液固定15 min,洗涤液洗细胞3次,加入免疫荧光染色封闭液,室温振荡封闭1 h,吸弃封闭液,分别加入相应的抗体,p38(1 ∶200)、ERK 1/2(1 ∶800)、p-ERK 1/2(1 ∶400)、JNK(1 ∶200)、NF-κB p65(1 ∶400)、p-NF-κB p65(1 ∶400)、c-Jun(1 ∶200)、c-Fos(1 ∶3 200)和p-JNK(1 ∶200),4 ℃孵育过夜;吸弃一抗,洗涤液洗3次,加入相应的二抗Alexa Flour 488山羊抗兔IgG(1 ∶500)与Alexa Flour 488山羊抗鼠IgG(1 ∶500),室温避光孵育1 h,DAPI染色20 min,洗涤3次,最后加入50 μL PBS,采用高内涵分析仪进行检测,每组双复孔,每孔采集12个视野,第一通道于388 nm/461 nm检测Hoechst 33342染色,第二通道于488 nm/525 nm检测Alexa Flour 488,Thermo ScientificTMHCS StudioTM分析系统进行结果分析。直标抗体p-p38(1 ∶50)、STAT3(1 ∶50)、p-STAT3(1 ∶50)直接室温避光孵育3 h后,加入DAPI染色20 min,洗涤3次,最后加入50 μL PBS。使用高内涵筛选仪采集图像,每组双复孔,每孔采集12个视野,第一通道于388 nm/461 nm检测Hoechst 33342染色,第二通道于488 nm/525 nm检测p-p38、p-STAT3,STAT3的通道波长设置为650 nm/647 nm,Thermo ScientificTMHCS StudioTM分析系统进行结果分析。
1.10 细胞凋亡情况的检测将HepG2细胞接种到24孔细胞培养板中,于37 ℃、5% CO2、100%湿度中培养,给药处理48 h后,将24孔细胞培养板中培养基吸弃,用PBS洗涤1遍,胰酶消化7 min后加入培养基震荡5 min,然后将细胞转移到96孔V形板中,离心使细胞沉淀,吸弃上清,加入结合缓冲液将细胞洗涤一遍,离心吸净缓冲液,加入20 μL(含1 ∶50的抗FITC Annexin V抗体和1 ∶20 PI)结合缓冲液,于37 ℃震荡孵育30 min,加入200 μL结合缓冲液洗涤细胞,离心吸弃上清,然后加入200 μL结合缓冲液重悬后用流式细胞仪检测。
1.11 统计学分析采用软件SPASS 18.0进行单因素方差分析,组间多重比较采用LSD法。
2 结果
2.1 RUT对HepG2细胞活力的影响RUT暴露于HepG2细胞,分别作用24、48 h后,与对照组相比,25、50、100 μmol·L-1均能使HepG2细胞活力显著降低(P<0.01),且具有剂量依赖性,而阳性药物阿霉素组在所设浓度下细胞活力均有下降,差异具有显著性(P<0.01)(Fig 1)。
2.2 RUT对HepG2细胞数目、核面积和DNA量的影响RUT分别作用于HepG2细胞24、48 h后,与对照组相比,100 μmol·L-1的RUT使HepG2细胞数目明显减少(P<0.01),5、10、25、50 μmol·L-1的RUT对HepG2细胞数目无明显影响,RUT对DNA量和核面积无明显变化(Fig 2)。

Fig 1 Effect of RUT on cell viability of HepG2 by MTT n=3)A:The cells were cultured with RUT for 24 h.B:The cells were cultured with RUT for 48 h.*P<0.05,**P<0.01 vs control.

Fig 2 Effect of RUT on HepG2 cell number (A),DNA density (B),nuclear area (C) n=3)Nuc:nuclear **P<0.01;#P<0.05,##P<0.01 vs control.
2.3 RUT对HepG2细胞氧化应激的影响100 μmol·L-1的RUT暴露于细胞6 h后就出现ROS水平显著升高(P<0.01,Fig 3A);24、48 h时,ROS的含量变化程度随浓度的增大依次增加,表明RUT能快速诱导HepG2细胞ROS水平的上升,导致氧化应激损伤(P<0.01,Fig 3C,D)。
2.4 RUT对HepG2细胞线粒体膜电位、钙离子内流和细胞膜完整性的影响RUT作用于HepG2细胞6 h后,与对照组相比,RUT 50、100 μmol·L-1使HepG2细胞钙离子明显升高(P<0.01,P<0.05,Fig 4A),而相同浓度的RUT在6 h时间点会使得HepG2细胞细胞膜完整性被破坏(P<0.01,P<0.05,Fig 4B),50、100 μmol·L-1RUT 组线粒体膜电位水平明显降低(P<0.01,Fig 4C)。
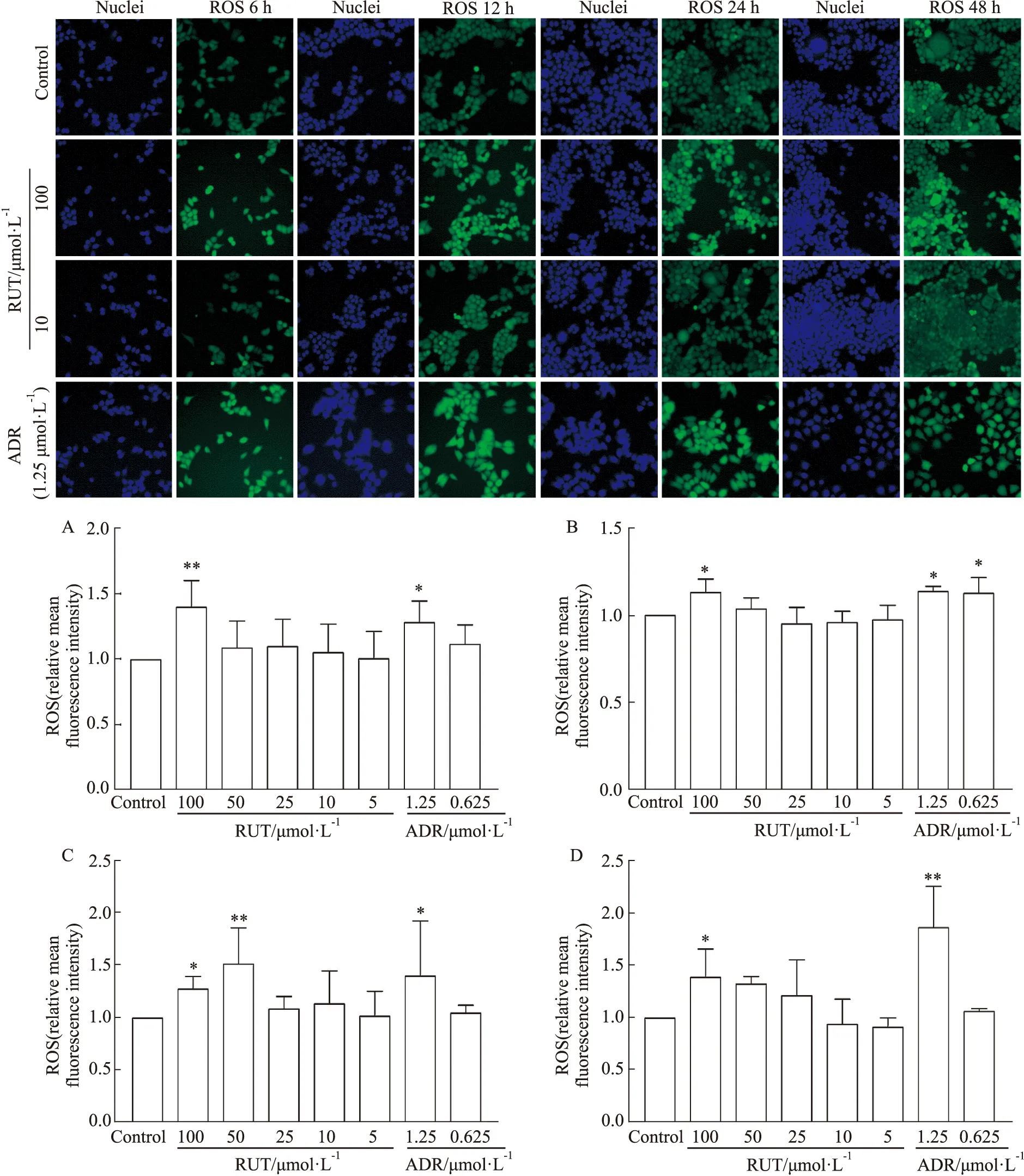
Fig 3 Effect of RUT on ROS of HepG2 cells by high-content analysis n=3)A:The cells were cultured with RUT for 6 h with different concentrations.B:The cells were cultured with RUT for 12 h with different concentrations.C:The cells were cultured with RUT for 24 h with different concentrations.D:The cells were cultured with RUT for 48 h with different concentrations.*P<0.05,**P<0.01 vs control.

Fig 4 Effect of RUT on calcium ion internal flow,cell membrane integrity and mitochondrial film potential of HepG2 by high-content analysis n=3)A and B:The cells were cultured with RUT for 6 h with different concentrations.C:The cells were cultured with RUT for 48 h with different concentrations.*P<0.05,**P<0.01 vs control.
2.5 RUT对MAPK信号通路活化的影响RUT作用HepG2细胞24 h后,与对照组相比,100 μmol·L-1RUT组和1.25 μmol·L-1ADR组p-ERK1/2、p-JNK、p-STAT3和p-p38的蛋白荧光强度明显增强(P<0.01,P<0.05,Fig 6),50 μmol·L-1RUT组的p-ERK1/2、p-JNK、p-STAT3和p-p38表达有上调(P<0.01,P<0.05,Fig 8),而不同浓度RUT组总蛋白未见明显变化。
2.6 RUT对AP-1信号通路的影响50、100 μmol·L-1RUT作用HepG2细胞3 h后,与对照组相比,AP-1相关蛋白c-Jun、c-Fos表达明显上调(P<0.01),25 μmol·L-1RUT组c-Fos表达上调(P<0.05),其余浓度下c-Jun、c-Fos蛋白的表达未见明显上调(Fig 9,10)。
2.7 RUT对NF-κB信号通路活化的影响HepG2细胞暴露于100 μmol·L-1RUT作用3 h后,磷酸化NF-κB p65水平明显升高(P<0.01,Fig 11C),细胞核内荧光强度/细胞质荧光强度(nuc/cyt fluorescence intensity)比值与对照组相比未见明显差异(Fig 11B)。
2.8 RUT对HepG2细胞凋亡的影响不同浓度的RUT处理HepG2细胞48 h,随着浓度的增加,发生早期凋亡的细胞比例逐渐增加,100 μmol·L-1RUT组细胞凋亡率明显升高(P<0.01,Fig 12),在10、25、50 μmol·L-13个浓度下均引起细胞凋亡(P<0.05,Fig 12)。
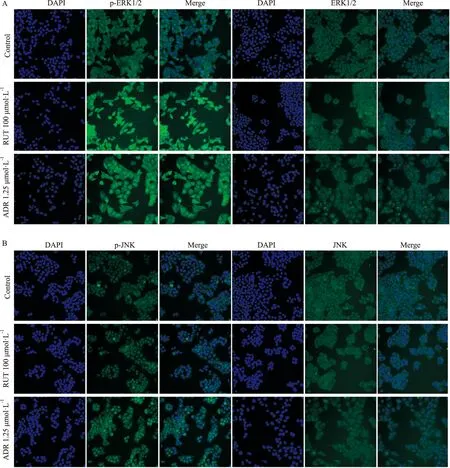
Fig 5 Effect of RUT on levels of p-Erk/Erk (A) and p-JNK/JNK (B) of HepG2 cells by high-content screening assay(×200)

Fig 6 Effect of RUT on levels of p-Erk/Erk (A) and p-JNK/JNK (B) of HepG2 cells for 24 h by high-content screening *P<0.05,**P<0.01 vs control.

Fig 7 Effect of RUT on levels of p-STAT3/STAT3 (A) and p-p38/p38 (B) of HepG2 cells by high-content screening assay(×200)

Fig 8 Effect of RUT on levels of p-STAT3/STAT3 (A) and p-p38/p38 (B) of HepG2 cells for 24 h by high-content screening n=3)*P<0.05,**P<0.01;##P<0.01 vs control.

Fig 9 Effect of RUT on levels of c-Jun and c-Fos of HepG2 by high-content screening assay(×200)

Fig 10 Effect of RUT on levels of c-Jun and c-Fos of HepG2 for 3h by high-content screening n=3)**P<0.01;#P<0.05,##P<0.01 vs control.
3 讨论
在临床用药历程中,中药肝毒性损伤(drug-induced liver injury,DILI)和肾毒性一样,是一种临床上常见的药物不良反应,它的毒性在药物性靶器官毒性中排第二位,仅仅次于心脏毒性[8]。肝脏作为药物解毒的一个重要靶器官,承受着药物产生的毒性,随着中药在临床上的广泛应用,以及近年来中药毒理学研究的不断深入,使用中药导致的肝损伤问题报道越来越多,这一点引起了人们的高度重视,中药导致肝损伤问题已经成为了在中药使用过程中不得不注意的问题。药物的肝毒性研究在药物发现早期评价阶段起着至关重要的作用,而高内涵筛选技术是近年来在药物活性筛选和早期安全性评价领域得到了广泛应用的研究技术,通过利用荧光显微镜成像自动化和图片集成分析,可以达到药物早期毒性监测与监控,这也是新药研发必不可少的一部分[9]。我们在前期筛选中发现RUT对HepG2细胞表现出明显的毒性,考虑到吴茱萸药材和含有吴茱萸的制剂在临床上的广泛应用,以及近年来吴茱萸安全性事件的报道时有发生,因此,本研究采用高内涵技术,开展了RUT对HepG2细胞毒性的作用和机制研究,以期为吴茱萸及吴茱萸制剂的临床应用和安全性提供参考依据和数据支撑。
本研究发现[10],RUT暴露于HepG2细胞后,其细胞活力和细胞数目减少,细胞膜完整性被破坏,细胞出现凋亡,呈现初步的毒性反应。研究结果显示,由细胞内的氧化自由基、过氧化氢和其下游的氧化物等产生的ROS,调控着许多生理和病理过程,是常见的细胞凋亡通路影响因素。进一步对Ca2+内流、线粒体膜电位和ROS的追踪,显示Ca2+发生了明显的内流,线粒体膜电位紊乱,其ROS水平显著上调,炎症相关蛋白出现磷酸化,这表明在一定条件下,RUT对HepG2细胞表现出一定的毒性,而其机制可能与RUT引起的氧化应激和炎症反应导致的细胞损伤有关。有研究显示通过抑制ROS引起的线粒体氧化应激,可使得细胞凋亡率明显下降[11],当细胞在受到有毒的物质刺激时,其内的ROS含量会突然升高,从而诱发了细胞的氧化应激,使得相关通路开放,凋亡因子被激活,细胞DNA被损坏,最终引起细胞凋亡[12]。线粒体膜电位作为细胞凋亡早期的一个重要指标,在特定信号的刺激下会发生紊乱,线粒体通透性改变,细胞质中产生的一些与凋亡相关的因子会影响到线粒体的正常功能[13-14]。

Fig 11 Effect of RUT on levels of translocation of NF-κB p65 and p-NF-κB p65 of HepG2 for 3 h by high-content screening n=3)*P<0.05,**P<0.01 vs control.
本研究发现,MAPK、NF-κB和JAKs-STATs信号通路被激活,它们是细胞内炎症密切相关的3条信号通路,并且它们之间有着复杂的交互作用。丝裂原活化激酶信号通路MAPK是涉及多种炎症反应的一条重要的信号通路,它在细胞内压力、紫外线和生长因子等的刺激下被激活而发挥相应的作用,通过调节细胞的过度增殖、生长分化、细胞的凋亡和细胞的自噬过程来调控细胞的生长,MAPK主要由JNK、p38和ERK这3条信号通路构成[15]。MAPK信号通路的激活可以促进转录因子如NF-κB和AP-1的活化并加重炎症反应,AP-1被激活后,组成AP-1的两个亚基c-Jun和c-Fos蛋白表达量会明显增多,并会转化成有活性的磷酸化形式,在靶基因启动子或增强子区域相应结合位点上发挥重要的转录作用[16]。NF-κB是体内重要的转录因子,通常以p50和p65组成异源二聚体的形式存在于细胞内,NF-κB p65活化后能够使得多种黏附分子、炎症细胞因子、趋化因子的活化,在免疫调节和炎症相关反应以及细胞生长等方面起重要作用[17]。STAT3是JAKs-STATs信号通路的一个重要组成部分,可以通过调节线粒体相关的蛋白来介导细胞凋亡,在细胞各种各样的活动中扮演着重要的作用[18]。在本研究中,100 μmol·L-1RUT可明显增加ERK1/2、JNK和p38的磷酸化水平,AP-1相关蛋白c-Jun和c-Fos的表达均有明显上升,提示RUT可能通过激活MAPK信号通路,使得AP-1的转录活性上调,从而引发后续的炎症级联反应。与对照组相比,HepG2细胞暴露于100 μmol·L-1RUT后,磷酸化NF-κB p65水平明显上升,但是其核转位强度不明显,其原因可能与检测的时间点和p-NF-κB p65的入核过程被抑制有关。在本研究中,100 μmol·L-1RUT可增强STAT3的磷酸化水平,表明JAKs-STATs信号通路被激活。这3个信号通路在引起RUT对HepG2细胞损伤中的相互调控关系仍需进一步的深入研究。
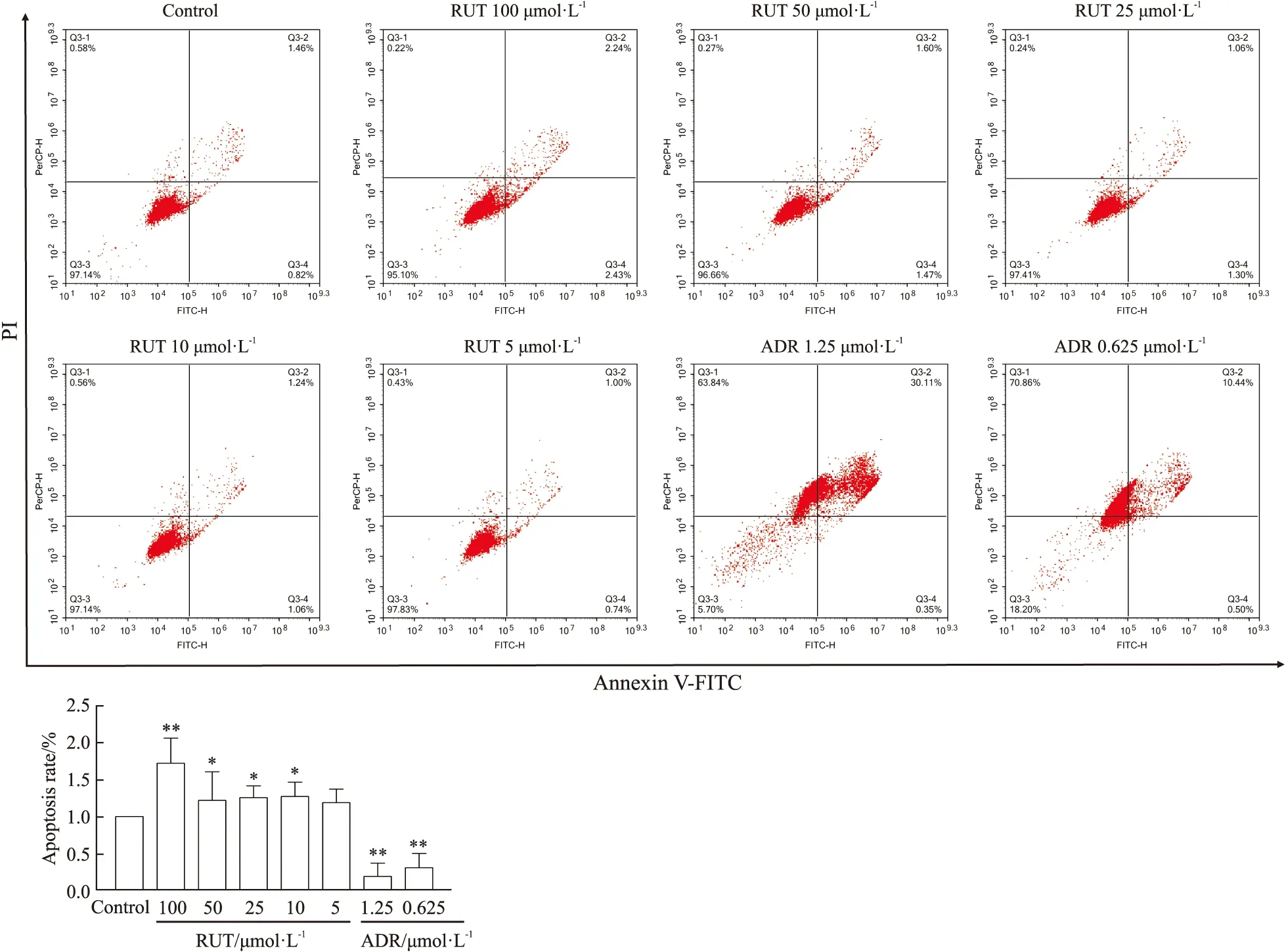
Fig 12 Effects of different concentrations of RUT for 48 h on early n=3)*P<0.05,**P<0.01 vs control.
本研究结果表明,HepG2细胞暴露于RUT后,会引起细胞内ROS升高、钙内流强度增强,线粒体膜电位紊乱、而其细胞膜完整性被打破,造成细胞氧化应激损伤,引发炎症MAPK、NF-κB和JAKs-STATs信号通路的炎症级联反应,进而导致HepG2细胞的损伤和凋亡。
(本论文研究是在贵州省中国科学院天然产物化学重点实验室药理与生物活性研究中心孙黔云课题组完成。)
