新型组蛋白去乙酰化酶抑制剂ZN-470A抑制乳腺癌的增殖、迁移的机制研究
2022-10-14王丽荣亓洪昭刘翠云朱素杰胡运洁周志侠孙振青单佩佩
王丽荣,于 杰,亓洪昭,刘翠云,朱素杰,胡运洁,周志侠,孙振青,单佩佩
(1.青岛大学转化医学研究院,山东 青岛 266021;2.青岛市中心医院,山东 青岛 266042;3.潍坊医学院附属医院心外科,山东 潍坊 261031;4.青岛大学附属医院胃肠外科,山东 青岛 266000)
据2020年数据统计,乳腺癌成为全球第一大癌症,其发病率和死亡率逐年攀升,对女性的健康造成很大的危害[1-2]。目前用于治疗乳腺癌的手段主要有:手术、放射疗法、化学疗法、内分泌治疗、免疫治疗以及靶向治疗[3]。其中,靶向治疗是一种特异性靶向肿瘤特定分子的治疗手段。因其具备肿瘤细胞的高针对性、较好的抗肿瘤效果,对正常组织的伤害更小的优点现在被广泛研究并应用于临床[4]。目前肿瘤分子靶向药物主要包括单克隆抗体和小分子化合物,一些已经由FDA批准用于肿瘤的临床治疗[5]。尽管如此,由于乳腺癌的高度异质性和复杂的发病机制,目前可用于乳腺癌的靶向药物依然极大的发展空间。近年来研究表明[6-7],在乳腺癌的发生发展过程中,伴随着明显的表观遗传学变化。表观遗传修饰在肿瘤的形成和肿瘤细胞的进一步恶化发挥重要的作用。组蛋白去乙酰化酶是一种催化染色体上组蛋白去乙酰化的表观遗传修饰酶,参与真核生物的基因表达调控。染色体上组蛋白的去乙酰化不利于DNA与组蛋白八聚体解离,核小体结构紧密从而抑制转录[8]。肿瘤组织中组蛋白去乙酰化酶表达的异常升高则会导致抑制肿瘤相关的基因表达受到抑制。已有研究显示乳腺癌细胞中组蛋白去乙酰化酶(HDAC)表达异常升高并可以作为治疗的分子靶标[9]。自2006年伏立诺他(Vorinostat)被FDA批准用于皮肤T细胞淋巴瘤的治疗起,近十年来对组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)的研究不断增多,其中一些已被批准用于肿瘤的临床治疗[10-12]。但目前针对实体瘤的HDACi抑癌效果并不理想,并且其抑癌机制仍然需要不断发掘完善。因此研发新型有效可用于临床治疗的HDACi并阐明其机制对于未来乳腺癌的治疗具有重要意义[13]。本研究以一组新的组蛋白去乙酰化酶抑制剂为研究对象,筛选出ZN-470A,发现该小分子药物在体内外对乳腺癌均具有较强的抑制作用。机制研究上,本课题将以抑制乳腺癌的生长和转移为出发点进行探究。我们的研究提示ZN-470A可以作为治疗乳腺癌的潜在候选药物。
1 材料与方法
1.1 主要材料
1.1.1细胞 人乳腺细胞MDA-MB-231、MCF-7;鼠乳腺癌细胞4T1。
1.1.2主要试剂 MTT(碧云天,ST316)、RPMI 1640培养基(Gibco,31800022)、DMEM培养基(Gibco,12100046)、胎牛血清(美仑,PWL001)、胰酶(Gibco,27250018)、Ac-H3(CST,9649S)、Ac-H4(CST,8647S)、β-actin(Santa Cruz,sc-47718)、细胞裂解液(Yeasen,20101ES60)、PVDF膜(Merck,IPVH00010);ECL化学发光液(Vazyme,E412-01)。
1.2 实验方法
1.2.1动物分组与处理 通过原位注射将肿瘤细胞接种至6~8周的小鼠乳腺脂肪垫内(4T1,1×105个),1周肿瘤形成后,将小鼠分成对照组和加药组,定期通过腹腔注射给药。加药组注射含有ZN-470A的PBS溶液(20 mg·kg-1),对照组注射含相同药物体积DMSO的PBS溶液。连续给药4周后,将小鼠处死,取出肿瘤、肺部及其他脏器进行后续的实验检测。
1.2.2组蛋白去乙酰化酶活性测定 利用HDAC活性测定试剂盒检测HDAC活性。在HDAC底物存在下,将HDAC酶(HeLa核提取物或MDA-MB231细胞裂解物)与SAHA或ZN-470A在37 ℃下孵育1 h。然后加入赖氨酸显色剂终止反应,37 ℃再孵育30 min。检测440~460 nm下吸光度值。3次重复独立实验。
1.2.3MTT 对数期生长的乳腺癌细胞消化,将细胞稀释成5×107·L-1,接种至96孔板中(100 μL/孔)。24 h待细胞贴壁后,将原培养液吸出,再加入梯度稀释含ZN-470A的培养液。37 ℃、5% CO2条件下孵育24 h。将培养液吸出,加入含5 g·L-1MTT的培养液,继续培养4 h。最后将培养液吸出,每孔加入150 mL的DMSO溶解沉淀,测定OD490 nm吸光度值,计算细胞抑制率。3次重复独立实验。
1.2.4克隆形成实验 取对数期生长的细胞,胰酶消化,重悬。接种至6孔板(500~1 000个细胞/孔)。细胞完全贴壁后,加入不同浓度的ZN-470A培养液,中途每2~3 d换液1次,并观察细胞状态,待克隆形成后终止培养。PBS洗涤1~2次,每孔加入1 mL的4%多聚甲醛固定30 min,PBS洗涤2~3次,每孔加入0.1%结晶紫染液1 mL,染色10~20 min,拍照。3次重复独立实验。
1.2.5Transwell实验 对数期细胞用胰蛋白酶消化,无血清培养基重悬。24孔板中放入Transwell小室,上室加入100 μL细胞悬液,5×104个细胞/孔(MDA-MB-231)或10×104个/孔(4T1)。下室加入500 μL完全培养基。上室与下室加入相同浓度的ZN-470A。细胞于37 ℃、5%的CO2条件下培养12 h,用4%多聚甲醛固定,0.1%结晶紫染色显微镜观察拍照。对照孔的抑制百分比表示为100%。3次重复独立实验。
1.2.6Western blot MDA-MB-231用一定浓度的ZN-470A处理24 h后,PBS洗涤2~3次,RIPA蛋白裂解液200 μL裂解细胞,加入5×蛋白上样缓冲液,100 ℃煮沸5 min使蛋白变性。蛋白样品用于SDS-PAGE电泳,转印至PVDF膜后,5%脱脂牛奶常温封闭60 min,一抗4 ℃孵育过夜,二抗常温孵育1 h。3次重复独立实验。
1.2.7免疫荧光 24孔板中放入细胞爬片,接种对数期生长的肿瘤细胞(5×103个/孔),待细胞完全贴壁后。吸弃原培养液,加入含一定浓度ZN-470A的培养液,37 ℃、5%的CO2条件下培养24 h。4%多聚甲醛室温固定15 min,0.1% Triton X-100通透5 min,2% BSA封闭1 h。细胞与Ac-H3、Ac-H4一抗(1 ∶2 000) 4 ℃孵育过夜。用PBS洗涤2~3次,细胞与相应荧光二抗(1 ∶1 000)常温孵育1 h。PBS洗涤2~3次,最后用含DAPI抗荧光淬灭封片剂封片,显微镜下观察拍照。3次重复独立实验。
1.2.8免疫组化 将切除的肿瘤,固定并包埋在石蜡中。切成6 μm厚度组织切片,依次进行脱蜡、复水、抗原修复。3 % H2O2常温避光孵育10 min,2% BSA封闭1 h,组织与Ac-H3、Ac-H4一抗(1 ∶1 000)4 ℃孵育过夜;PBS 洗涤2~3次,二抗(1 ∶1 000)常温孵育1 h,PBS 洗涤2~3次,DAB显色液常温10~15 min,PBS洗涤2~3次,苏木精染色2 min,自来水下冲洗,复水、透明、封片。3次重复独立实验。
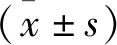
2 结果
2.1 ZN-470A抑制组蛋白去乙酰化酶的活性将HeLa细胞核提取物或MDA-MB231细胞裂解物与HDAC底物混合,其中阴性对照组不做处理;阳性对照组加入SAHA,终浓度为10 μmol·L-1;实验组加入相同浓度的ZN-470A。结果如Fig 1显示,与control组比较,组蛋白去乙酰化酶在药物作用下活性明显受到抑制,并且ZN-470A抑制效果优于阳性对照SAHA(P<0.01)。说明ZN-470A可有效抑制组蛋白去乙酰化酶的活性。

Fig 1 ZN-470A inhibited activity of histone SAHA:10 μmol·L-1;ZN-470A:10 μmol·L-1.**P<0.01 vs control
乳腺癌细胞MDA-MB-231经过不同浓度ZN-470A作用24 h后,提取细胞中的蛋白,通过Western blot检测各组样品中Ac-H3、Ac-H4表达情况。结果如Fig 2所示,以β-actin作为内参,ZN-470A药物作用后,细胞中Ac-H3、Ac-H4表达量明显上调,证明了在细胞中ZN-470A可抑制组蛋白去乙酰化酶的活性,从而使组蛋白H3、H4的乙酰化水平上调。

Fig 2 Effect of ZN-470A on histone acetylation in breastcancer cells MDA-MD-231**P<0.01 vs control
同样地,通过免疫荧光实验检测ZN-470A对细胞内部Ac-H3、Ac-H4表达的影响。结果如Fig 3所示,乳腺癌细胞MDA-MB-231在浓度为10 μmol·L-1的ZN-470A作用24 h后,与control组相比,Ac-H3、Ac-H4的荧光强度明显增加,表明ZN-470A作用后细胞内部组蛋白H3、H4的乙酰化水平上调,组蛋白去乙酰化酶活性有效被抑制。
2.2 ZN-470A抑制乳腺癌细胞的增殖、迁移和单细胞成瘤能力Fig 4结果显示,乳腺癌细胞MCF-7在10 μmol·L-1ZN-470A作用后细胞形态发生明显变化。与control相比,ZN-470A处理后的MCF-7细胞出现明显凋亡特征,细胞收缩变圆,细胞数量明显减少。说明ZN-470A可有效地抑制肿瘤细胞的生长,且促进肿瘤细胞的死亡。
Fig 5可见,不同浓度处理后的3株乳腺癌细胞的细胞生存率,ZN-470A对乳腺癌细胞4T1、MCF-7、MDA-MB-231均有明显的抑制作用,且呈现剂量依赖性,差异具有统计学意义(P<0.01)。且根据数据分析,两株三阴性乳腺癌细胞株4T1、MDA-MB-231对ZN-470A更加敏感。浓度为5 μmol·L-1时,4T1和MDA-MB-231的细胞数分别下降47%(P<0.01)及51.75%(P<0.01)。说明ZN-470A对三阴性乳腺癌的增殖呈现有效的抑制效果。

Fig 3 Effect of ZN-470A (10 μmol·L-1) on histoneacetylation in breast cancer cells MDA-MD-231

Fig 4 The morphological changes of breast cancercell MCF-7 after ZN-470A (10 μmol·L-1)treatment
肿瘤细胞的体外克隆形成反映出肿瘤细胞的单细胞成瘤能力,根据Fig 6的结果,ZN-470A对乳腺癌细胞4T1的克隆形成能力具有抑制作用,且呈现剂量依赖性。相同药物浓度下ZN-470A的克隆形成数少于阳性对照SAHA,克隆的大小也小于阳性对照SAHA。
通过Transwell检测两种三阴性乳腺癌细胞4T1、MDA-MB-231的迁移能力。如Fig 7的结果所示,与control相比,ZN-470A作用后细胞的迁移数量明显减少,证明ZN-470A显著降低了两种高度恶性乳腺癌细胞系的侵袭能力。
2.3 ZN-470A抑制小鼠乳腺癌的肺转移浓度为20 mg·kg-1的ZN-470A药物治疗28 d后,针对小鼠肿瘤组织的免疫组化结果显示(Fig 8),与Control组相比,ZN-470A治疗可提高肿瘤组织中组蛋白H3、H4的乙酰化水平。
ZN-470A治疗28 d后,取小鼠肺部进行H&E染色。Fig 9显示,与control组相比,ZN-470A治疗后肺部更光滑,相反地,未治疗的小鼠肺部出现肿瘤结节。ZN-470A可有效地抑制肿瘤在小鼠体内向肺部的转移。

Fig 5 ZN-470A inhibited proliferation of breast cancer n=4)*P<0.5,**P<0.01 vs control

Fig 6 ZN-470A inhibited formation of breast cancer cell clones

Fig 7 ZN-470A inhibited invasion of breast cancer cellsScale:0.1 μm

Fig 8 Effect of ZN-470A on histone acetylation in tumor tissuesZN-470A:20 mg·kg-1;Scale:50 μm
2.4 ZN-470作用后乳腺癌细胞中蛋白的表达变化不同浓度ZN-470A作用后,检测乳腺癌细胞MDA-MB-231细胞中几种相关蛋白的表达。Fig 10结果显示,TNFRSF17、AIF、FOSL2在ZN-470A作用后表达量减少。其中TNFRSF17为肿瘤坏死因子受体超家族中的一员,与肿瘤坏死因子配体相结合,参与细胞的活化、存活、增殖、坏死和凋亡等细胞程序;AIF属于凋亡诱导因子,参与线粒体途径细胞凋亡;FOSL2是一种转录因子,可与p-c-Jun形成异源二聚体AP-1转录因子复合物,参与多种基因的表达调控。

Fig 9 ZN-470A inhibited lung metastasis of breast cancerZN-470A:20 mg·kg-1;Scale:100 μm

Fig 10 Effect of ZN-470A on protein expression in breast cancer
3 讨论
目前治疗乳腺癌的方法包括局部治疗和全身治疗。治疗策略的选择需要考虑患者的肿瘤亚型、病理分期和其他疾病相关因素。对于非转移性乳腺癌,策略是手术切除。对于转移性乳腺癌,除手术治疗外,同时根据肿瘤亚型联合内分泌治疗或化疗[3]。然而,已经公布的许多化疗药物具有严重的副作用,并且乳腺癌患者对治疗的反应差异很大。最终,很大一部分患者对化疗产生耐药性[14]。近年来,靶向治疗表现出显著治疗效果,不良反应发生率最低,保证了患者良好的生活质量。近二十年来,肿瘤靶向药物发展迅速,在研究和临床应用方面取得多项突破。乳腺癌被认为是一种复杂的异质性肿瘤,靶向治疗显然在其中起着重要的治疗作用。研发药效更强,毒性更低的乳腺癌靶向药具有重要意义。
本研究从一组新型HDACi中筛选出具有治疗效果的ZN-470A,分别从细胞和动物水平上验证了该药对乳腺癌具有明显的抑制作用。ZN-470A是以目前已上市的组蛋白去乙酰化酶抑制剂SAHA为基础骨架,添加修饰基团合成的新型小分子化合物。在前期HDAC酶活检测时发现其抑制组蛋白去乙酰化酶的活性比SAHA高,继而细胞水平进一步验证了其对肿瘤细胞的抑制效果比SAHA更显著。修饰后的化合物可能通过增强药物与靶分子之间的结合能力而使药物的酶活抑制效果提高,修饰基团的引入亦可能使药物结合更多靶分子,从而增强药物的抗肿瘤效果。最后通过Western blot检测了药物处理前后一些增殖、凋亡相关蛋白表达的变化,结果发现TNFRSF17、AIF、FOSL2这3种蛋白表达有下调的趋势。TNFRSF17又称B细胞成熟抗原,是一种肿瘤坏死因子受体超家族成员。TNF 超家族成员(包括TNF、FAS、TRAIL及其受体),它们通过调节主要的信号通路,控制细胞的生存和分化,并在不同组织的生长、组织和稳态中发挥重要作用,在多种恶性肿瘤中被广泛研究[15]。AIF属于凋亡诱导因子,参与线粒体途径细胞凋亡[16]。FOSL2是一种转录因子,可与p-c-Jun形成异源二聚体AP-1转录因子复合物,参与多种基因的表达调控[17]。
综上所述,新型组蛋白去乙酰化酶抑制剂ZN-470A对乳腺癌的增殖、迁移具有明显的抑制作用,是一种治疗乳腺癌的潜在有效药物。通过对其机制的初步研究,提示该小分子化合物可调节肿瘤相关蛋白TNFRSF17、AIF、FOSL2的表达。未来针对其分子机制的更深入探索,研究其作用的相关通路,有利于进一步揭示ZN-470A的药理作用;同时,对HDACi抑制肿瘤的分子机制具有补充和完善的意义。
