口服JAK抑制剂治疗斑秃有效性和安全性的Meta分析Δ
2022-10-14杨勇杰张绮雯鲁憬莉乔高星刘克锋周奇杨楠康建张晓坚郑州大学第一附属医院药学部郑州450052河南省药品临床综合评价中心郑州450052兰州大学基础医学院循证医学中心兰州70099
杨勇杰,张绮雯,鲁憬莉,乔高星,刘克锋,周奇,杨楠,康建,张晓坚#(1.郑州大学第一附属医院药学部,郑州 450052;2.河南省药品临床综合评价中心,郑州 450052;.兰州大学基础医学院循证医学中心,兰州 70099)
斑秃(alopecia areata)是皮肤科常见且复杂的自身免疫性疾病,临床表现为突发的非瘢痕性斑状脱发,并可累及全身任何部位毛发[1]。轻症患者大部分可自愈,约半数患者反复发作,大约5%的患者可进展成全秃和普秃[2]。这种疾病会给患者的心理和生活带来严重困扰。流行病学研究显示,2009年我国斑秃的患病率为0.27%[3];国外研究显示,斑秃的终生患病率约为2%[4]。斑秃的病因尚不明确,目前公认的机制主要为患者生长期毛囊的免疫豁免受到破坏,T淋巴细胞被激活,大量炎症因子作用于毛囊,引起毛囊细胞损伤,并导致毛囊周期改变,使毛发生长提早进入休止期[5]。近年来,有研究发现,Janus激酶(Janus kinase,JAK)-信号转导及转录激活因子(signal transduction and activator of transcription,STAT)信号通路是斑秃发病的主要驱动因素[6]。该通路信号转导可影响毛囊周期,使毛发在生长期受到抑制[7]。
JAK抑制剂(Janus kinase inhibitors)是一类小分子化合物,可阻断JAK-STAT信号通路中的1种或多种细胞内酪氨酸激酶,包括JAK1、JAK2、JAK3和酪氨酸激酶2(tyrosine kinase 2,TYK2),从而阻断多种细胞因子和炎症途径,诱导免疫抑制[8]。JAK抑制剂可阻断T淋巴细胞介导的毛囊免疫反应,通过刺激毛囊干细胞增殖和诱导血管生成来促进毛发生长,这一过程发生在毛发的生长期[9]。现在已有许多关于JAK抑制剂治疗斑秃的临床研究,涉及的药物包括托法替尼(tofacitinib)、鲁索替尼(ruxolitinib)、巴瑞替尼(baricitinib),大多数采用口服的给药方式。这些临床研究主要为小样本病例报告或病例系列研究[9―10],但近期有多项随机对照试验(randomized controlled trial,RCT)完成并发布结果[11―14]。虽然这些RCT结果表明,口服JAK抑制剂对斑秃有良好的疗效,但其安全性仍不明确,加之目前尚无研究对这些新证据进行系统总结,因此,全面评价口服JAK抑制剂治疗斑秃的有效性和安全性显得尤为重要。本研究采用Meta分析的方法,对口服JAK抑制剂治疗斑秃的有效性和安全性进行系统评价,为该类药物在斑秃治疗中的应用提供循证医学依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 本研究纳入国内外公开发表的RCT,语种限定为中文和英文。
1.1.2 研究对象 本研究纳入确诊为斑秃的患者[脱发严重程度评分工具(the Severity Alopecia Tool,SALT)评分≥50分[15]];患者年龄、性别不限。
1.1.3 干预措施 试验组患者给予口服JAK抑制剂,疗程与剂量不限;对照组患者给予安慰剂。
1.1.4 结局指标 本研究的主要结局指标包括:第24、36周头发再生长情况和眉毛/睫毛再生长情况;本研究的次要结局指标包括:第24周SALT评分降低值(ΔSALT-24w)、第 36周 SALT评分降低值(ΔSALT-36w)、第24周焦虑抑郁情况、第36周焦虑抑郁情况、总不良反应发生率、痤疮发生率、尿道感染发生率、低密度脂蛋白升高发生率、上呼吸道感染发生率、头疼发生率、鼻咽炎发生率、磷酸肌酶升高发生率。
第24周头发再生长情况包括:第24周SALT评分≤10分(SALT10-24w)、≤20分(SALT20-24w)、≤50分(SALT50-24w)、≤75分(SALT75-24w)、≤90分(SALT90-24w)、≤100分(SALT100-24w)的患者比例;第36周头发再生长情况包括:第36周SALT评分≤10分(SALT10-36w)、≤20分(SALT20-36w)、≤50分(SALT50-36w)、≤75分(SALT75-36w)、≤90分(SALT90-36w)、≤100分(SALT100-36w)的患者比例。第24周眉毛/睫毛再生长情况包括:第24周眉毛(EB-24w)、睫毛(EL-24w)基本再生率;第36周眉毛/睫毛再生长情况包括:第36周眉毛(EB-36w)、睫毛(EL-36w)基本再生率。第24周焦虑抑郁情况包括:第24周医院焦虑抑郁量表-焦虑(Hospital Anxiety and Depression Scale-Anxiety,HADS-A)评分降低值(ΔHADS-A-24w)、医院焦虑抑郁量表-抑郁(Hospital Anxiety and Depres‐sion Scale-Depression,HADS-D)评分降低值(ΔHADSD-24w);第36周焦虑抑郁情况包括:第36周HADS-A评分降低值(ΔHADS-A-36w)、HADS-D评分降低值(ΔHADS-D-36w)。
1.1.5 排除标准 本研究的排除标准包括:(1)非中英文文献;(2)会议文章,或仅有摘要、无法获得全文的文献;(3)重复的研究及报道;(4)非口服给药的JAK抑制剂的研究。
1.2 文献检索策略
计算机检索PubMed、Embase、the Cochrane Library、Web of Science、中国知网、万方数据库和中国生物医学文献服务系统,搜集口服JAK抑制剂用于治疗斑秃的RCT,检索时限均为建库至2022年3月29日。检索采用主题词与自由词相结合的方式进行。同时,检索临床试验注册平台,并对纳入文献的参考文献进行手工检索,以补充获取相关资料。中文检索词包括:“JAK抑制剂”“酪氨酸激酶抑制剂”“巴瑞替尼”“托法替尼”“芦可替尼”“鲁索替尼”“斑秃”;英文检索词包括:“Janus kinase inhibitors”“JAK inhibitor”“tofacitinib”“baracitinib”“rux‐olitinib(CTP-543)”“ritlecitinib(PF-06700841)”“brepoci‐tinib(PF-06700841)”“alopecia areata”等。以PubMed为例,其具体检索策略见表1。

表1 PubMed检索策略
1.3 文献筛选和资料提取
依据纳入与排除标准,由2位评价者独立阅读所获文献的题目和摘要,排除明显不相关的文献后,进一步阅读全文以确定是否纳入,有不同意见时通过讨论或与第三方协商解决。对于纳入的研究,由2位研究者独立进行提取数据、交叉核对,如有分歧,则通过讨论或与第三方协商解决。资料提取内容包括:(1)纳入研究的基本信息(第一作者、发表年份、临床试验注册号、研究国家、随访时间、干预措施及样本量等);(2)研究对象的基线特征;(3)所关注的结局指标。
1.4 文献质量评价
由2位研究者独立评价纳入研究的偏倚风险,并交叉核对结果。采用Cochrane系统评价员手册5.1.0推荐的RCT偏倚风险评估工具对纳入的RCT进行质量评价,包括随机方法、分配隐藏、盲法实施、数据完整性、报告偏倚和其他偏倚,每个方面均分为高偏倚风险、低偏倚风险和不清楚[16]。
1.5 统计学方法
采用Cochrane协作网提供的RevMan 5.4软件进行统计分析。计数资料采用风险比(RR)、计量资料采用均数差(MD)为效应量,各效应量均提供其95%置信区间(CI)。采用χ2检验对纳入研究进行异质性检验(检验水准α=0.1),同时结合I2检验定量判断异质性大小,I2>50%表示研究间异质性较大。若各研究结果间无统计学异质性,采用固定效应模型进行Meta分析;若各研究结果间存在统计学异质性,则采用随机效应模型进行Meta分析。Meta分析的检验水准α=0.05。采用倒漏斗图进行发表偏倚分析。
2 结果
2.1 文献检索流程与结果
初检共获得相关文献831篇,补充检索获得1篇,文献去重后剩余530篇;经阅读题目及摘要初筛后纳入16篇;进一步阅读全文,排除非RCT、会议论文和无相关结局指标的文献后,最终纳入4篇文献,包含5项RCT[11―14](文献[14]涉及2项RCT),共计2 170例患者,其中试验组1 619例、对照组551例。纳入的研究均来自美国;2项RCT的随访时间为24周[11―12],3项RCT的随访时间为36周[13―14]。纳入研究的基本特征见表2。
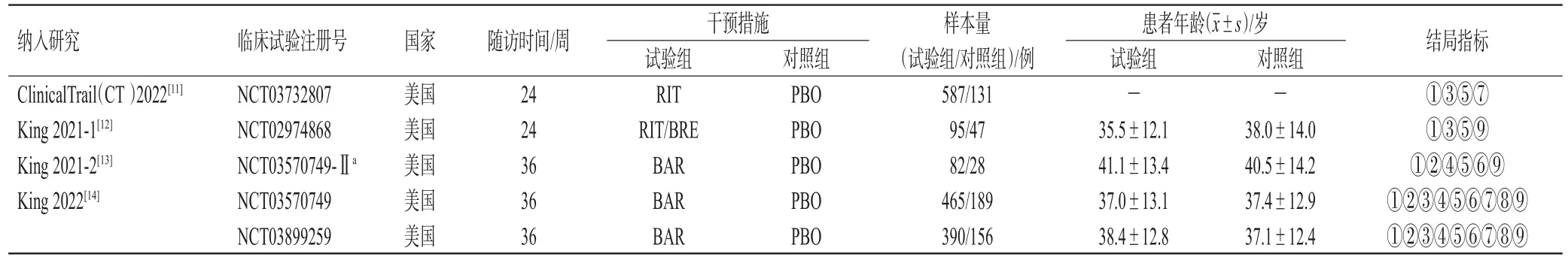
表2 纳入研究的基本特征
2.2 纳入研究的质量评价结果
纳入研究的质量评价结果详见图1和图2。1项RCT采用交互式响应系统进行随机分组[12],2项RCT采用计算机随机数字发生器进行随机分组[14],2项RCT未报告随机分组方法[11,13];4 项RCT 为双盲试验[12―14],1项为四盲试验[11];3项RCT采用中心随机法实现分配隐藏[12,14],2项未报道分配隐藏方案[11,13];所有研究的数据报告均完整,没有选择性报道结果,但均不清楚是否存在其他偏倚。
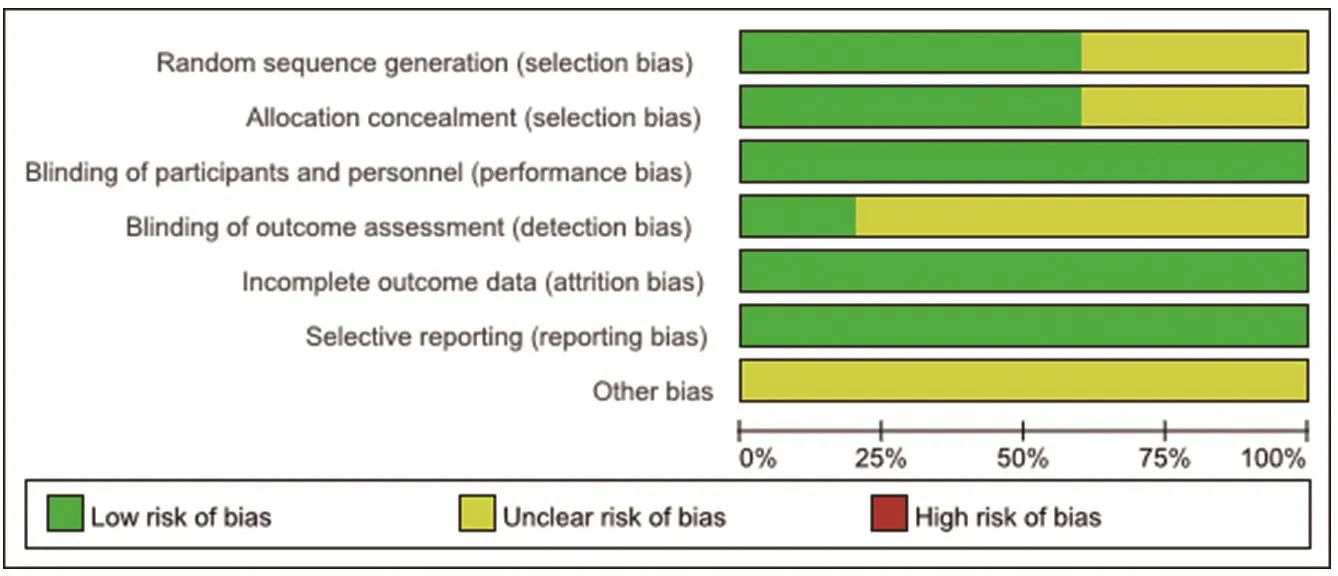
图1 纳入RCT的偏倚风险条形图

图2 纳入RCT的偏倚风险总图
2.3 Meta分析结果
2.3.1 主要结局指标 (1)第24周头发再生长情况:按照文献[17]以SALT20-24w的患者比例作为反映第24周头发再生长情况的主要指标,共纳入 4 项 RCT[11,13―14]。各研究间无统计学异质性(I2=34%,P=0.21),采用固定效应模型进行Meta分析,结果显示,试验组SALT20-24w的患者比例更高[RR=6.10,95%CI(3.86,9.63),P<0.000 01](图3A,图中部分研究对应多种药物或有剔除,故例数与表2不一致,下同)。其余反映第24周头发再生长情况的指标见表3,结果均表明试验组患者的各项指标均显著优于对照组(P<0.05)。
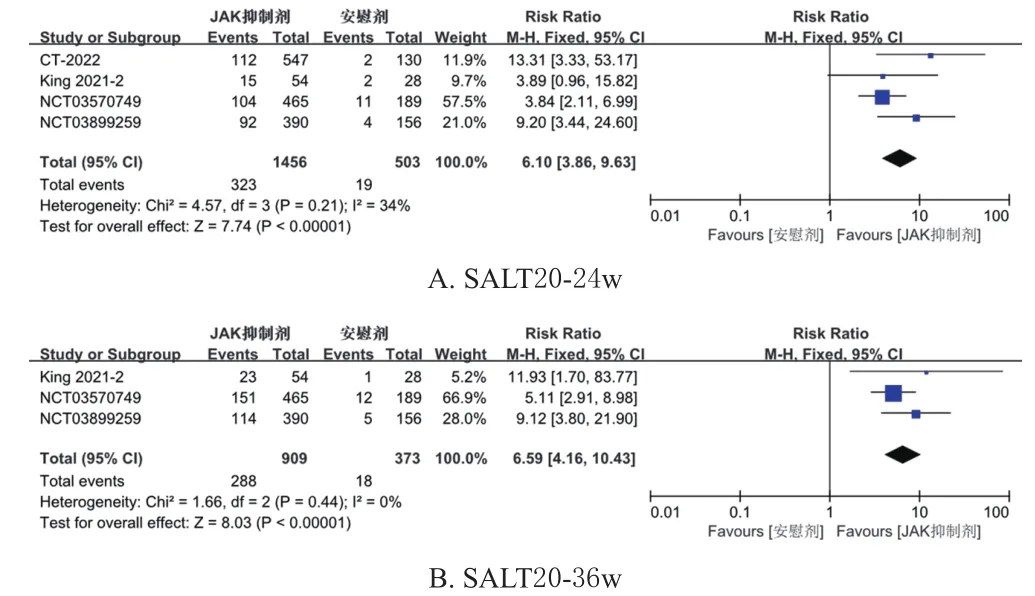
图3 2组SALT评分≤20分的患者比例的Meta分析森林图
(2)第36周头发再生长情况:按照文献[17]以SALT20-36w作为反映第36周头发再生长情况的主要指标,共纳入3项RCT[13―14]。各研究间无统计学异质性(I2=0,P=0.44),采用固定效应模型进行Meta分析,结果显示,试验组SALT20-36w的患者比例更高[RR=6.59,95%CI(4.16,10.43),P<0.000 01](图3B)。其余反映第36周头发再生长情况的指标见表3,结果均表明试验组患者的各项指标均显著优于对照组(P<0.05)。

表3 2组患者头发再生长情况的Meta分析结果
(3)第24周眉毛/睫毛再生长情况:该指标共纳入4项 RCT[11―12,14]。各项研究间均无统计学异质性(I2=0,P=0.59和I2=0,P=0.99),采用固定效应模型进行Meta分析,结果显示,试验组患者治疗的EB-24w基本再生率[RR=5.95,95%CI(3.65,9.68),P<0.000 01]和EL-24w 基本再生率[RR=4.83,95%CI(3.02,7.74),P<0.000 01]均显著高于对照组,详见表4。
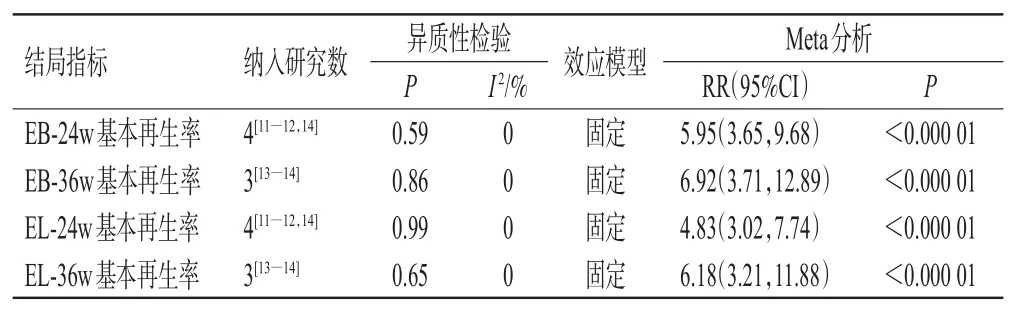
表4 两组患者眉毛与睫毛再生长情况的Meta分析结果
(4)第36周眉毛/睫毛再生长情况:该指标共纳入3项RCT[13―14]。各项研究间无统计学异质性(I2=0,P=0.86和I2=0,P=0.65),采用固定效应模型进行Meta分析,结果显示,试验组患者的EB-36w基本再生率[RR=6.92,95%CI(3.71,12.89),P<0.000 01]和 EL-36w 基本再生率[RR=6.18,95%CI(3.21,11.88),P<0.000 01]均显著高于对照组,详见表4。
2.3.2 次要结局指标 (1)SALT评分降低值:共5项RCT报道了ΔSALT-24w[11―14]。各研究间有统计学异质性(I2=67%,P=0.02),采用随机效应模型进行Meta分析,结果显示,试验组患者的ΔSALT-24w显著大于对照组[RR=25.53,95%CI(19.85,31.20),P<0.000 01](图4A)。共3项RCT报道了ΔSALT-36w[13―14]。各研究间无统计学异质性(I2=33%,P=0.22),采用固定效应模型进行Meta分析,结果显示,试验组患者的ΔSALT-36w显著大于对照组[RR=28.90,95%CI(24.95,32.85),P<0.000 01](图4B)。

图4 2两组患者SALT评分降低值的Meta分析森林图
(2)第24周焦虑抑郁情况:共3项RCT报告了第24周焦虑抑郁情况[11,14]。各研究间均无统计学异质性(I2=0,P=0.54和I2=0,P=0.84),采用固定效应模型进行Meta分析,结果显示,试验组患者的ΔHADS-A-24w和ΔHADS-D-36w 均显著大于对照组(P<0.05),详见表5。
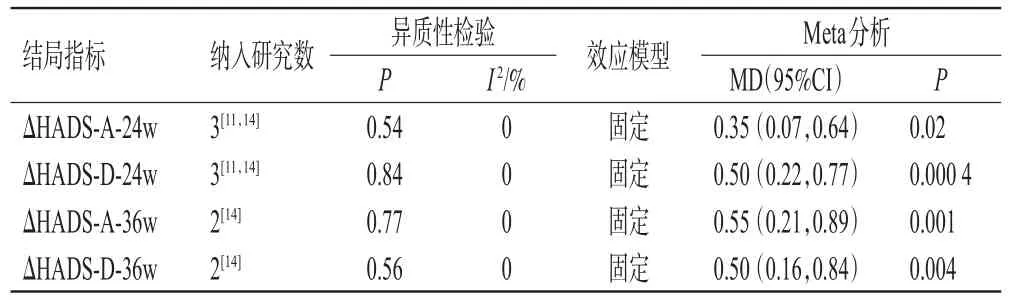
表5 2组患者焦虑抑郁情况的Meta分析结果
(3)第36周焦虑抑郁情况:共2项RCT报告了第36周焦虑抑郁情况[14]。各研究间均无统计学异质性(I2=0,P=0.77和I2=0,P=0.56),采用固定效应模型进行Meta分析,结果显示,试验组患者的ΔHADS-A-36w和ΔHADS-D-36w均显著大于对照组(P<0.05),详见表5。
(4)不良反应发生情况:共4项RCT报道了不良反应发生情况[12―14]。各研究间无统计学异质性(表6),采用固定效应模型的Meta分析结果显示,试验组患者的痤疮和低密度脂蛋白升高的发生率均显著高于对照组(P<0.05),而两组患者尿道感染、上呼吸道感染、头疼、鼻咽炎、磷酸肌酶升高的发生率及总不良反应发生率比较,差异均无统计学意义(P>0.05),详见表6。

表6 2组患者不良反应发生情况的Meta分析结果
2.4 发表偏倚分析
以主要结局指标SALT20-24w的患者比例进行发表偏倚分析,倒漏斗图见图5。由图可知,各研究散点在倒漏斗图内对称分布,提示本研究存在发表偏倚的可能性较小。
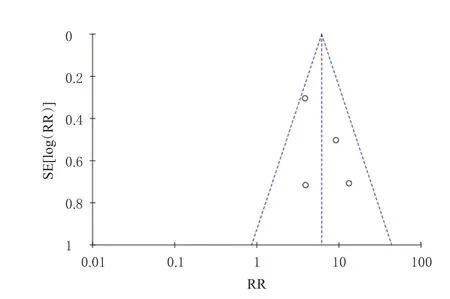
图5 SALT20-24w的患者比例的倒漏斗图分析
3 讨论
斑秃典型的临床表现为突然发生的斑状脱发,脱发斑边界清晰,多呈圆形或椭圆形且大小不一,主要见于头发,也可累及眉毛及睫毛等其他体毛,患者一般无明显自觉症状,大多在无意间发现。斑秃俗称“鬼剃头”,对患者的外在形象造成极大影响。斑秃的病情评估一般使用SALT。SALT是一种用于测量头皮脱发量的工具,通过测量头皮4个区域[顶部(占40%)、右侧(占18%)、左侧(占18%)和后部(占24%)]的脱发百分比来计算总得分。SALT总分为0~100分,0分表示没有脱发,100分表示完全没有头发。SALT评分降低值可用来反映头发的再生长情况。本研究结果显示,第24周和第36周时,试验组患者的ΔSALT-24w、ΔSALT-36w均显著大于对照组,可见试验组患者的头发再生情况明显好于对照组。这也与2组SALT20-24w和SALT20-36w患者比例的比较结果一致,即在第24周和第36周时,试验组中SALT评分≤20分的患者比例均更大。此外,试验组患者不仅头发再生情况更好,其第24周和第36周时的眉毛/睫毛基本再生率也均显著高于对照组。
由于外在形象的变化,斑秃患者在社会交往等方面会遇到较大的精神压力,例如睡眠、生活质量明显变差和广泛性焦虑症、抑郁情绪加重。研究表明,斑秃患者的抑郁症发病率为8.8%,发病风险远高于普通人群的1.3%~1.5%[18]。HADS是评估非精神病患者焦虑抑郁情况的常用工具,包括焦虑(HADS-A)和抑郁(HADSD)2个亚表,评分越高表明焦虑抑郁状况越严重[19]。本研究结果显示,第24周和第36周时,试验组患者的HADS-A和HADS-D降低值均显著大于对照组,说明试验组患者的焦虑抑郁情况有明显好转。由此可见,伴随着毛发的再生和患者外在形象的恢复,患者的心理问题得以改善。斑秃作为一种典型的身心疾病[20―21],患者心理精神因素的改善也对病情的改善有着积极意义。
本研究证实JAK抑制剂对于斑秃有良好的治疗作用,但由于患者需要长时间口服此类药物以维持毛发生长,故其安全性同样值得关注,本Meta分析发现,试验组患者的痤疮和低密度脂蛋白升高的发生率均显著高于安慰剂组。JAK抑制剂常见的不良反应包括痤疮、感染、头痛、咽峡炎、血脂代谢异常和磷酸肌酶升高,特别是痤疮、尿道感染和低密度脂蛋白升高的发生率显著增加。这些不良反应可能与JAK抑制剂的免疫抑制作用有关[22]。值得注意的是,这种免疫抑制也可能会削弱干扰素及自然杀伤细胞的肿瘤监视功能,故长期服用有可能会增加肿瘤的发生风险[22]。不过对于此类药物远期安全性的评估,仍需要开展更多大样本长随访的临床研究进行探索。
本研究尚存在一定的不足:(1)所纳入文献数量有限,且纳入研究样本量较小,检验效能可能不足;(2)纳入研究的文种限定为中英文,可能存在语言偏倚;(3)纳入研究存在异质性,包括药品种类和剂量不同、干预疗程有差异、随访周期不一致、研究环境不同等,导致结果可能会存在一定的偏倚,需谨慎解读;(4)所有纳入的研究全部来自于美国,且均处于临床试验阶段,大大限制了本研究结论的代表性。
综上所述,当前证据显示,口服JAK抑制剂可显著促进斑秃患者的毛发再生长并改善其焦虑抑郁情况,痤疮、低密度脂蛋白升高为其主要不良事件。受纳入研究数量和质量的限制,上述结论尚待更多高质量研究予以验证。
