结直肠癌化疗期间PEG-rhG-CSF对中性粒细胞增殖率及化疗不良反应的影响
2022-10-14王永领刘华强何江涛
王永领 刘华强 黄 潞 何江涛
广东省农垦中心医院肿瘤内科一区,广东湛江 524000
结直肠癌为消化道恶性肿瘤[1]。结直肠癌患者手术治疗后辅助化疗的实施对于延长患者生存期具有积极意义[2]。中性粒细胞绝对值降低是结直肠癌患者手术治疗后化疗常见的毒副反应,随着中性粒细胞绝对值降低,持续时间延长,会提高患者感染的风险[3]。研究显示,发热性中性粒细胞缺乏症的出现可能影响化疗的效果,增加患者严重并发症的发生风险[4]。有临床研究发现,聚乙二醇化重组人粒细胞刺激因子(polyethylene glycol recombinant human granulocyte colony-stimulating factor,PEG-rhG-CSF)可使机体高中性粒细胞绝对值提高,可取得较传统重组人粒细胞集落刺激因子(rhG-CSF)更好的效果[5]。但目前研究报道中,并无关于两种药物在结直肠癌化疗患者中应用效果的比较[6]。本研究选取2018年1月至2021年4月广东省农垦中心医院(我院)收治的接受化疗的结直肠癌患者80例为研究对象,探讨PEG-rhG-CSF预防结直肠癌患者化疗后出现中性粒细胞减少的效果,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月至2021年4月我院收治的接受化疗的结直肠癌患者80例为研究对象,以随机数表法分为对照组(n=40)与观察组(n=40)。对 照 组 男26例,女14例;年 龄45~72岁,平均(63.50±3.85)岁;肿瘤位置:结肠26例,直肠14例;TNM分期:Ⅱ期25例,Ⅲ期15例。观察 组 男24例,女16例,年 龄48~71岁,平 均(63.62±3.90)岁;肿瘤位置:结肠24例,直肠16例;TNM分期:Ⅱ期22例,Ⅲ期18例。两组患者一般资料比较,差异无统计学意义(P> 0.05),具有可比性。本研究经医院医学伦理委员会批准。
纳入标准:符合结直肠癌诊断标准[7],且经病理学检查确诊;TNM分期为Ⅱ~Ⅲ期;卡式评分(KPS)[8]达到70分及以上;预计生存时间超过6个月;化疗前中性粒细胞绝对值与白细胞总数符合正常值范围;具备化疗适应证;对研究内容知情同意。排除标准:入组前30 d内接受放疗;具备器官移植史的患者;妊娠或哺乳期妇女。
1.2 方法
全部患者均接受化疗,化疗方案为mFOLFOX6方案,2周为1个治疗周期,共开展2个周期治疗,具体方案:奥沙利铂(恒瑞制药,国药准字 H2000037)85 mg/m2,静脉滴注用药,2 h用药完成,d1;亚叶酸钙(恒瑞制药,国药准字 H32022391)200 mg/m2,静脉滴注用药,2 h用药完成,d1、d2;后采用5-氟尿嘧啶(海南卓泰制药,国药准字 H20113265)400 mg/m2静 脉 推 注,10~15 min内用药完成,d1,后以1200 mg/m2持续微泵推注22 h,d1、d2,每2周重复。对照组采用rhG-CSF(山东科兴生物制品有限公司,国药准字 S20010015)进行治疗,在化疗周期第5天,即化疗后48 h,采用5 μg/kg的rhG-CSF皮 下 注 射,1次/d,连续治疗14 d,或中性粒细胞绝对值≥5×109/L时停止用药。观察组采用PEG-rhG-CSF(石药集团有限公司,国药准字 S20110014)治疗,在化疗周期第5天,即化疗后48 h,采用100 μg/kg的PEG-rhG-CSF皮下注射。
1.3 观察指标
①两组Ⅲ度以上中性粒细胞减少率、中性粒细胞减少持续时间、发热性中性粒细胞缺乏症发生率、静脉抗菌药物应用率、中性粒细胞减少或发热性中性粒细胞缺乏症导致的再住院率;②全部患者均在 首 次 应 用PEG-rhG-CSF后的24、48、96 h对血液内中性粒细胞数进行检测,并对治疗开始后中性粒细胞增殖率进行计算;③两组化疗过程中的不良反应发生率,包括疲劳乏力、骨关节痛、头晕头痛。
1.4 统计学方法
使用SPSS 23.0统计学软件进行数据处理,计量资料用均数±标准差()表示,采用t检验,计数资料用[n(%)]表示,采用χ2检验,P< 0.05为差异有统计学意义。
2 结果
2.1 两组患者临床指标比较
观察组Ⅲ度以上中性粒细胞减少率、再住院率均低于对照组,差异有统计学意义(P< 0.05);两组中性粒细胞减少持续时间、发热性中性粒细胞缺乏症发生率、静脉抗菌药物应用率比较,差异无统计学意义(P> 0.05)。见表1。

表1 两组患者临床指标比较
2.2 两组患者中性粒细胞数与增殖率比较
观察组治疗24、48、96 h的中性粒细胞数高于对照组,治疗24、48、96 h的中性粒细胞增殖率高于对照组,差异有统计学意义(P< 0.05),见表2。
表2 两组患者中性粒细胞数与增殖率比较(±s)

表2 两组患者中性粒细胞数与增殖率比较(±s)
24 h 48 h 96 h F组内比较值(中性粒细胞数/增殖率)P组内比较值组别 n 中性粒细胞数(×109/L)中性粒细胞增殖率(%)中性粒细胞数(×109/L)中性粒细胞增殖率(%)中性粒细胞数(×109/L)中性粒细胞增殖率(%)(组内中性粒细胞数/增殖率)对照组40 1.36±0.12 113.65±26.20 1.98±0.26 192.75±62.35 3.42±0.91 205.15±37.82 18.546/22.362 0.001/0.001观察组40 1.72±0.20 275.26±60.32 7.35±2.31 326.54±82.50 10.32±3.26 328.64±50.24 25.315/43.625 0.001/0.001 t值 9.762 15.542 14.610 8.183 12.893 12.420 P值 0.001 0.001 0.001 0.001 0.001 0.001
2.3 两组患者不良反应发生率比较
两组不良反应总发生率比较,差异无统计学意义(P> 0.05),见表3。
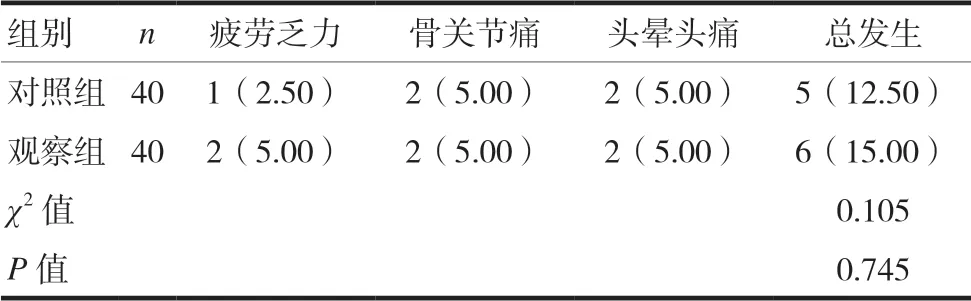
表3 两组患者不良反应发生率比较[n(%)]
3 讨论
PEG-rhG-CSF是基于rhG-CSF发展而来的长效剂型,其是在rhG-CSF的氨基酸序列N末端共价结合聚乙二醇,由此形成的一种蛋白质。其具有比rhG-CSF更长的半衰期,同时可取得更为稳定的血浆浓度[9]。由于PEG-rhG-CSF具备较大的分子量,因此可有效提升药物的生物稳定性,进入机体后,不容易发生酶解,可降低免疫原性和抗原性,出现中和性抗体的风险降低[10-13]。有研究显示,在PEG-rhG-CSF进入机体后12 d,患者体内的PEG-rhG-CSF血药浓度均低于2 ng/ml,通过早期预防性应用PEG-rhG-CSF,可使中性粒细胞减少的发生率降低,同时可使静脉抗菌药物的应用率降低75%,患者的再次住院率降低[14-15]。也有研究报道显示,在促使中性粒细胞增殖时,采用PEG-rhG-CSF单次应用,能够取得比重复应用rhG-CSF更好的效果,其可将同步放化疗引发的机体中性粒细胞缺乏症状改善时间缩短,由此将中性粒细胞缺乏引发的相关并发症减少[16-18]。
本研究结果显示,观察组治疗24、48、96 h的中性粒细胞数高于对照组,治疗24、48、96 h的中性粒细胞增殖率高于对照组,表明PEG-rhG-CSF可使结直肠癌化疗患者中性粒细胞增殖加快,使中性粒细胞水平提高。PEG-rhG-CSF在进入机体后,可和造血细胞的表面受体结合,从而使中性粒细胞增生速度加快,并使功能活化细胞增生受到抑制,受体结合机制和中性粒细胞功能的研究发现,PEG-rhG-CSF具备和rhG-CSF相同的作用机制。且本研究中,观察组Ⅲ度以上中性粒细胞减少率、中性粒细胞减少或发热性中性粒细胞缺乏症导致的再住院率均更低,提示PEG-rhG-CSF的应用可有效促进结直肠癌化疗患者机体中性粒细胞的增殖,预防结直肠癌患者化疗后出现中性粒细胞减少的效果优于rhG-CSF,可使患者的再住院率降低,但当出现Ⅲ度以上骨髓抑制时,并无法将其持续时间缩短[19]。有研究表明,PEG-rhG-CSF单次用药可使中性粒细胞减少情况改善,使患者可完成化疗周期治疗,特别是固定剂量给药的方式,可减轻患者痛苦,提升患者用药依从性[20-23]。本研究中,两组不良反应总发生率无明显差异,表明PEG-rhG-CSF用药具备较高的安全性[24]。
综上所述,PEG-rhG-CSF可有效促进结直肠癌患者化疗后中性粒细胞增殖,预防中性粒细胞减少的发生,使化疗毒副反应减轻。
