CK18基因的原核表达及蛋白纯化*
2022-10-14倪佳王伟徐莹莹陈相屹张欣孙达权
倪佳, 王伟,, 徐莹莹, 陈相屹, 张欣, 孙达权**
(1.贵阳市妇幼保健院 & 贵阳市儿童医院 儿童重症监护病房, 贵州 贵阳 550001; 2.贵州医科大学 基础医学院, 贵州 贵阳 550025; 3.宁波市第一医院 疝肝胆肛肠外科, 浙江 宁波 315000)
细胞角蛋白18(cytokeratin 18,CK18)基因位于12q13.13,可编码含有430个氨基酸残基的细胞骨架蛋白,其编码的蛋白可分为3个区域:中央区域为相对保守的α-螺旋杆状结构域,氨基端和羧基端均为高度可变的非螺旋结构域[1],各种翻译后修饰多发生于该蛋白的两端[2]。在细胞内,CK18通常与CK8按1 ∶1的比例结合而形成非共价异二聚体,并进一步组装成角蛋白丝,用于维持细胞形态,并在细胞增殖[3]、迁移[4]、侵袭[5]、上皮-间充质转换[6]、对抗外界应力[7]和调控细胞凋亡[8]中扮演着重要的角色。有研究表明,CK18不仅能够通过糖基化[9]、甲基化[10]等翻译后修饰调节角蛋白丝的溶解度和稳定性,还能被PKCε等蛋白激酶结合并磷酸化[11],从而调控角蛋白纤维重组,参与细胞多种生理调节和病理应答。为此,本研究欲通过克隆人CK18基因和获得CK18蛋白,为体外分析CK18蛋白与蛋白激酶PKCε之间的关系奠定前期基础,并为将来研究CK18蛋白对细胞突触和极性形成的影响奠定一定的基础。
1 材料与方法
1.1 材料
人肝癌细胞株SMMC-7721于2011年购自中国科学院上海细胞库,并长期保存于本实验室;RPMI-1640细胞培养液购自美国GIBCO公司,新生牛血清购自北京索莱宝,TRizol购自美国Invitrogen公司,高保真反转录试剂盒、DNA琼脂糖凝胶回收试剂盒、pMD18-T载体、T4 DNA ligase、限制性核酸内切酶购自大连宝生物公司,质粒小量提取试剂盒、感受态细菌DH5α和Rosetta(DE3)购自北京天根生物公司,谷胱甘肽硫转移酶(glutathione S-transferase,GST)亲和纯化树脂(Glutathione-Sepharose 4B)购自Pharmacia公司,GST标签抗体、CK18及其磷酸化抗体和PKCε抗体购自南京巴傲得公司,BCA定量试剂盒购自Pierce公司,原核表达的蛋白激酶PKCε由本实验室自制冻存。CK18引物合成及DNA测序由上海生工生物完成。
1.2 研究方法
1.2.1聚合酶链式反应(polymerase chain reaction,PCR)扩增及DNA片段TA克隆 将肝癌细胞系SMMC-7721培养于含10%新生牛血清的RPMI-1640培养液中,并置于37 ℃、5% CO2的环境中培养;待细胞融合至80%时,用TRizol法抽提细胞总RNA,利用反转录试剂盒将mRNAs反转录成cDNAs。根据GenBank中人CK18基因序列(NM_000224)设计PCR引物如下:上游引物5′-TGAATTCATGAGCTTCACCACTCGCTCCACCT-3′,下游引物5′-TCTCGAGTTAATGCCTCAGAACTTTGGTGTCAT-3′。以cDNAs为模板,加入引物及高保真DNA聚合酶,PCR扩增CK18基因蛋白编码区DNA片段。反应条件为:95 ℃预变性2 min、95 ℃变性15 s、56 ℃退火30 s、72 ℃延伸3 min、30个循环,72 ℃稳定10 min;然后加入Z-Taq DNA聚合酶,按上述反应程序继续反应4个循环。PCR产物经1%琼脂糖凝胶电泳,回收目的片段并进行TA克隆,用连接产物转化感受态细菌DH5α,并涂布于含氨苄青霉素的Luria-Bertani(LB)固体培养基平板上进行筛选培养。挑取阳性克隆并扩大培养,按质粒小量提取试剂盒说明抽提质粒。经EcoRⅠ/XhoⅠ双酶切鉴定及DNA测序鉴定,将序列正确的重组质粒命名为pMD18T-CK18GST。
1.2.2pGEX-CK18GST原核表达质粒的构建 分别对原核表达载体pGEX-4t-1及含有目的基因片段的pMD18-CK18GST进行EcoRⅠ/XhoⅠ双酶切,回收骨架载体片段和目的基因片段;将目的基因片段CK18GST与有相应切口的pGEX-4t-1在4 ℃下连接过夜,连接产物导入感受态细菌DH5α中,经筛选培养、挑取单克隆、抽提质粒和酶切鉴定,重组质粒命名为pGEX-CK18GST。
1.2.3原核诱导表达融合蛋白CK18及其鉴定 用重组原核表达质粒pGEX-CK18GST转化感受态细菌Rosetta(DE3),涂布于含氨苄青霉素的LB固体培养基上筛选培养,挑取单克隆并进行扩大培养,而后吸取1 mL菌液加入到200 mL LB培养基中。200 r/min、37 ℃下摇至菌液OD450 nm为0.4时,调节温度至23 ℃,加入10 mmo/L异丙基-β-D-硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)继续培养2 h,诱导目的蛋白表达。收集诱导前/后的菌液并制样,分别用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)、考马斯亮蓝染色及western blot检测融合蛋白(GST-CK18)在异丙基-β-D-硫代半乳糖苷(IPTG)诱导下的表达情况。
1.2.4融合蛋白GST-CK18的纯化及鉴定 诱导后的菌液在12 000 r/min、4 ℃离心10 min,收集离心沉淀的细菌,并用含1 mmol/L 苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)和1% Triton X-100的PBS重悬(按100 mL菌液沉淀,加5 mL PBS的比例重悬)。用均质仪破碎细菌,12 000 r/min、4 ℃离心10 min,取上清液和沉淀分别进行SDS-PAGE、考马斯亮蓝染色及Western blot,检测融合蛋白是否可溶。若为可溶性蛋白,直接用GST纯化柱纯化上清液;若为包涵体蛋白,先用PBS清洗沉淀3次,再用8 mol/L尿素(含1 mmol/L DTT)溶解包涵体,放入透析袋中,依次在6 mol/L尿素溶液(0.1 mmol/L DTT)、4 mol/L尿素溶液(0.1 mmol/L DTT)、2 mol/L尿素溶液(0.1 mmol/L DTT)和清水中4 ℃透析48 h,收集透析袋中的清液,用GST纯化柱纯化。GST纯化柱纯化蛋白(在4 ℃环境中操作):(1)平衡吸附柱,加入5倍柱体积的PBS平衡;(2)上样,取2倍柱体积的样品进行上样、重复过柱3次后弃去;(3)洗涤,以10倍柱体积的PBS洗去非特异性杂蛋白;(4)洗脱目的蛋白,加入2倍柱体积的10 mmol/L谷胱甘肽洗脱液、孵育10~15 min、重复过柱3次后收集、-80 ℃保存;(5)再生吸附柱,加入2倍柱体积0.1 mol/L Tris-Cl/0.5 mol/L NaCl溶液(pH 8.4)后、再加入2倍柱体积0.1 mol/L NaAc/0.5 mol/L NaCl溶液(pH 4.5)、重复上述两步操作4次;(6)平衡并保存吸附柱,以20倍柱体积PBS平衡吸附柱、再加入2倍柱体积的20%乙醇洗涤、用20%乙醇填充吸附柱、并于4 ℃存放。取洗脱液制样,进行SDS-PAGE、考马斯亮蓝染色及Western blot,检测蛋白纯化效果。
1.2.5SDS-PAGE、考马斯亮蓝染色及Western blot 样品经brandford法定量后制样,左右对称上样,进行SDS-PAGE。电泳结束后,切取一侧变性胶用于考马斯亮蓝染色,先经固定液固定30 min,再用考马斯亮蓝R-250染色液染色30 min,最后用漂洗液漂洗至条带清晰;另一侧变性胶则用于Western blot,将胶中蛋白电转印至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上,经5%脱脂牛奶封闭、TBST洗膜、一抗孵育、洗膜、二抗孵育、洗膜等操作后,用电化学发光液(electrochemiluminescence,ECL)在多功能成像系统中成像。
1.2.6体外CK18磷酸化位点分析 取2个1.5 mL的离心管,将纯化的CK18蛋白、65 ℃蛋白酶灭活的细胞内容物提取液、四种核苷三磷酸(NTPs),再在其中一个离心管中加入本实验室自制的蛋白激酶PKCε,混合均匀后放入37 ℃金属浴反应6 h。反应结束后加入5×变性胶上样缓冲液,金属浴煮沸5 min。SDS-PAGE电泳后,使用抗体pS33-CK18和pS52-CK18进行分析。
1.2.7细胞免疫荧光染色及激光扫描共聚焦显微分析 免洗盖玻片高压灭菌后放入细胞培养板24孔板,将过表达PKCε的肝癌细胞低密度铺板于盖玻片上;培养1周后,用PBS清洗细胞3次,并用4%多聚甲醛室温下固定30 min;然后,用1% TritonX-100室温下通透细胞膜15 min。并用5% BSA在37 ℃中封闭1 h;将盖玻片置于湿盒中,盖玻片上滴加按1 ∶100稀释的一抗50 μL,4 ℃孵育过夜;再滴加按1 ∶100稀释的荧光二抗,4 ℃孵育4 h;用含4,6-二脒基-2-苯基吲哚,二氢氯化物(DAPI)的抗荧光淬灭封片剂封片,并用无色指甲油固定盖玻片后在4 ℃暗盒中过夜。荧光染色片子用激光共聚焦扫描显微镜拍照记录。
2 结果
2.1 pGEX-CK18GST原核表达质粒的建立
高保真PCR扩增获得的CK18GSTDNA片段经TA克隆后获得含有目的基因的克隆质粒pMD18T-CK18GST(图1A)。用EcoRⅠ/XhoⅠ对pMD18-CK18GST进行双酶切,琼脂糖凝胶电泳结果显示pMD18-CK18GST被分为2个条带:1条分子量约2.6 kbp的pMD18-T载体骨架DNA和1条分子量约1.3 kbp的目的基因CK18GSTDNA片段(图1A)。DNA测序结果显示,该CK18GSTDNA片段正是CK18蛋白编码区DNA片段(图1B)。将该DNA片段通过EcoRⅠ/XhoⅠ酶切位点导入原核表达载体pGEX-4t-1中,构建了原核表达质粒pGEX-CK18GST(图1C),用EcoRⅠ/XhoⅠ对其进行双酶切鉴定,其两条DNA片段的长度与预计的大小一致(图1D),证明pGEX-CK18GST构建成功。
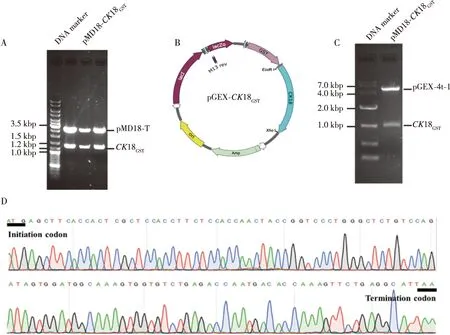
注:A为EcoR Ⅰ/Xho Ⅰ双酶切pMD18T-CK18GST克隆质粒,B为pGEX-CK18GST原核表达质粒图谱,C为EcoR Ⅰ/Xho Ⅰ双酶切原核表达质粒pGEX-CK18GST,D为CK18基因的DNA测序结果。图1 CK18基因克隆及其原核表达载体pGEX-CK18GST构建Fig.1 The construction of CK18 gene cloning and its prokaryotic expression vector pGEX-CK18GST
2.2 诱导目的蛋白GST-CK18原核表达及其蛋白纯化
原核表达质粒pGEX-CK18GST导入细菌Rosetta(DE3)后,用IPTG诱导目的融合蛋白GST-CK18表达。经SDS-PAGE电泳和考马斯亮蓝染色,其结果如图2所示,考马斯亮蓝染色可见分子量70 kDa之上有蛋白表达增加(泳道1~2),而Western blot结果也显示同一位置GST融合蛋白(GST-CK18)的表达量也随之升高(泳道1~2)。由于融合蛋白中GST标签是由239个氨基酸残基组成,目的蛋白CK18由430个氨基酸残基组成,故融合蛋白理论相对分子质量为76 kDa,目的条带的分子量大小与预期相符,证明融合蛋白GST-CK18在IPTG诱导下大量表达。对诱导后的菌体蛋白进行分析,发现GST-CK18同时出现于沉淀和溶液中(泳道3~4),证明部分GST-CK18具有可溶性。对上清液中的GST-CK18进行GST亲和层析,获得纯化的目的蛋白CK18(泳道5)。
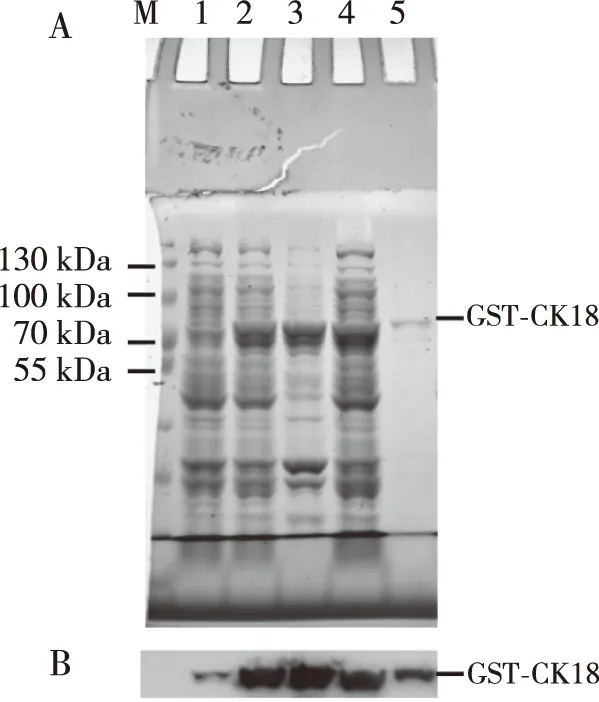
注:A为变性胶的考马斯亮蓝染色结果,B为对应的Western blot结果;M为Thermo Scientific PageRuler Pierce 26616,1为未诱导的细菌全蛋白,2为IPTG诱导后的细菌全蛋白,3为菌体破碎后的沉淀物,4为菌体破碎后的上清液,5为GST亲和纯化的目的蛋白。图2 融合蛋白GST-CK18的考马斯亮蓝染色及Western blot分析Fig.2 Coomassie blue staining and Western blot analysis of the fusion protein GST-CK18
2.3 CK18的Ser52磷酸化可引起细胞形态变化
将体外纯化的CK18蛋白与蛋白激酶PKCε在体外37 ℃共孵育,发现CK18的Ser52能够发生磷酸化修饰,而该蛋白的Ser33未发生磷酸化修饰(图3A)。为进一步观察PKCε对CK18的作用,对过表达外源PKCε的肝癌细胞进行Western blot分析,发现过表达PKCε的肝癌细胞内CK18的Ser52磷酸化水平进一步提高(图3B),提示PKCε能够调控细胞骨架蛋白CK18的Ser52磷酸化修饰。将表达外源PKCε的肝癌细胞铺板于盖玻片上培养后,用抗pS52-CK18抗体进行免疫荧光染色,结果显示当细胞内pS52-CK18与PKCε多处存在共定位,且细胞由原来的多边形变成具有许多突起的类似于树突状细胞,细胞形态明显发生改变(图3C)。
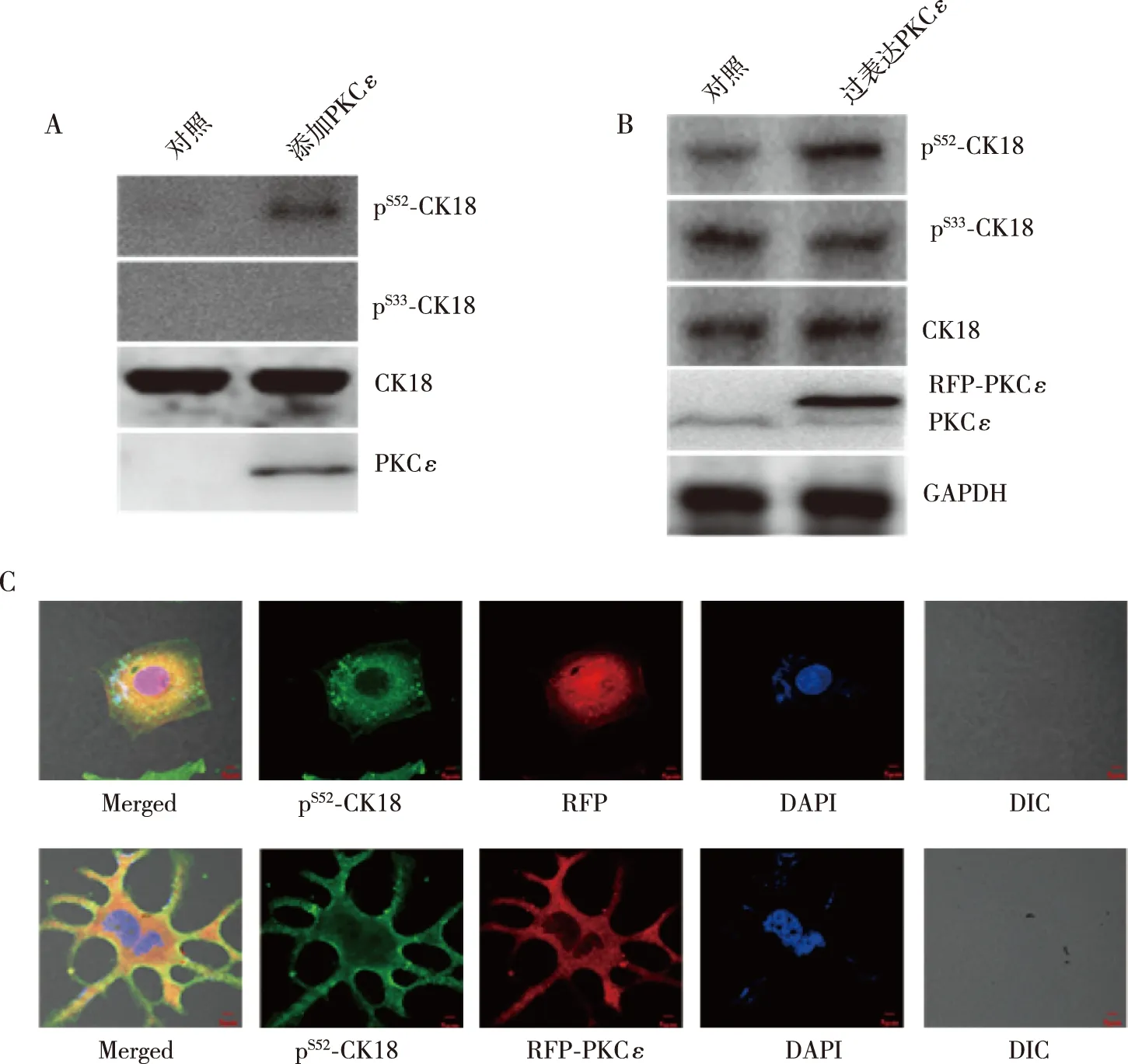
注:A为蛋白激酶PKCε可以在体外使CK18 Ser52磷酸化,B为细胞内过表达蛋白激酶PKCε促进细胞内CK18 Ser52磷酸化水平,C为细胞内CK18 Ser52与PKCε在细胞内共定位并引起细胞形态变化。图3 CK18 Ser52磷酸化引起细胞形态变化Fig.3 Changes in cell morphology caused by phosphorylation of CK18 Ser52
3 讨论
CK18属于Ⅰ型细胞角蛋白,是细胞中间丝蛋白和骨架蛋白的主要成分之一,主要参与调控细胞极性等多种生理,这些调控作用基本上都是通过对CK18蛋白翻译后修饰而实现的[12-14]。这种翻译后修饰具有多样性,包括最重要的磷酸化、O-连接的糖基化、乙酰化与甲基化、转酰胺基修饰等[15-17]。这些翻译后修饰中最常见和最多的是磷酸化修饰。CK18有多个磷酸化修饰位点(Ser7、Ser33、Ser34、Ser52、Ser53)[15-16]。有研究指出,CK18的Ser33常发生磷酸化修饰,当Ser33发生磷酸化修饰后,CK18就可以与14-3-3蛋白结合,使CK18的亚细胞定位发生变化,从而参与调控肝细胞的有丝分裂[18]。然而,Ser52才是CK18磷酸化的主要生理位点,研究显示肝细胞中CK18 Ser52高度磷酸化与乙肝病毒、丙肝病毒等感染有密切联系[19]。此外,还有研究显示在S期和G2/M期时CK18 Ser52的磷酸化水平可上升至G1期的3~4倍,并主要分布于母中心粒近端,而将该位点由丝氨酸突变为丙氨酸后会导致子母中心粒分离和微管成核,最终抑制细胞分裂。这些结果提示母中心粒Ser52磷酸化状态在维持母子中心粒之间的紧密结合和微管成核中起着关键作用[20]。
鉴于CK18翻译后磷酸化修饰对细胞的重要生理调控,本研究在之前的研究基础上[3],又在本研究中克隆了CK18基因的蛋白编码区,构建重组原核表达质粒pGEX-CK18GST,用原核表达的方式成功诱导重组蛋白CK18,用亲和层析的方法纯化了该蛋白,并发现蛋白激酶PKCε能够促进CK18 Ser52磷酸化水平,导致细胞内骨架发生重排,最终导致细胞表面突起形成和细胞形态改变。这些研究和纯化的CK18蛋白为接下来研究CK18其他位点的翻译后修饰和肝癌细胞表型之间的关系奠定了一定的基础。此外,本组还克隆和纯化了蛋白激酶ERK1/2和PKCε,为接下来系统研究ERK1/2、PKCε和CK18三者之间的关系以及它们之间对细胞形态重塑和细胞极性的影响做好了前期准备。
