芦根中2个新的苯丙素苷类化合物
2022-10-14赵伟伊苏艳芳常艳旭高秀梅
赵伟伊,苏艳芳*,秦 涛,常艳旭,高秀梅
芦根中2个新的苯丙素苷类化合物
赵伟伊1,苏艳芳1*,秦 涛1,常艳旭2,高秀梅2
1. 天津大学药物科学与技术学院,天津 300072 2. 天津中医药大学中医药研究院,天津 301617
研究芦根(芦苇的根茎)的化学成分。选用D101大孔吸附树脂、正相硅胶、Sephadex LH-20凝胶、ODS及反相HPLC等多种柱色谱方法进行分离纯化,并运用核磁共振波谱技术对化合物进行结构鉴定。通过电子圆二色谱(electrostatic circular dichroism,ECD)确定化合物的绝对构型。从芦根中分离得到了2个苯丙素苷类化合物,分别鉴定为(2)-3-(β葡萄糖基)-2-羟基-1-(4-羟基-3,5-二甲氧基苯基)-1-丙酮(1)、(2)-3-(β葡萄糖基)-2-羟基-1-(4-羟基-3,5-二甲氧基苯基)-1-丙酮(2)。化合物1、2均为新化合物,分别命名为芦根苷A和芦根苷B。
芦根;苯丙素苷;绝对构型;芦根苷A;芦根苷B
芦根是禾本科(Gramineae)植物芦苇Trin的新鲜或干燥根茎。芦苇分布广泛,产自全国各地,生于江河湖泽、池塘沟渠沿岸和低湿地[1]。芦根是一味常用的药食同源中药,其性寒、味甘,入肺、胃经,有清热生津、除烦、止呕、利尿之功效。临床上常用它来治疗感冒、支气管炎、肺脓肿等[2-3]。在国家卫生健康委员会发布的新型冠状病毒肺炎诊疗方案中,芦根是推荐治疗处方“宣肺败毒方”中的主要组成药材之一[4]。目前,有关芦根的化学成分研究集中于多糖,次生代谢产物的研究鲜有报道,本课题组前期对芦根的研究[5]表明其主要含有黄酮类、木脂素类等化学成分。芦根以鲜品捣汁或传统水煎剂形式用药,其所含极性较大的化学成分相对较多,为了进一步明确其物质基础,本实验从芦根含水乙醇提取物的正丁醇萃取部位分离鉴定,得到2个新的苯丙素苷类化合物(2)-3-(β葡萄糖基)-2-羟基-1-(4-羟基- 3,5-二甲氧基苯基)-1-丙酮[(2)-3-(βglucopyranosyloxy)-2-hydroxy-1-(4-hydroxy-3,5- dimethoxyphenyl)-1-propanone,1]、(2)-3-(β葡萄糖基)-2-羟基-1-(4-羟基-3,5-二甲氧基苯基)-1-丙酮 [(2)-3-(βglucopyranosyloxy)-2-hydroxy-1- (4-hydroxy-3,5-dimethoxyphenyl)-1-propanone,2],分别命名为芦根苷A和芦根苷B,结构见图1。
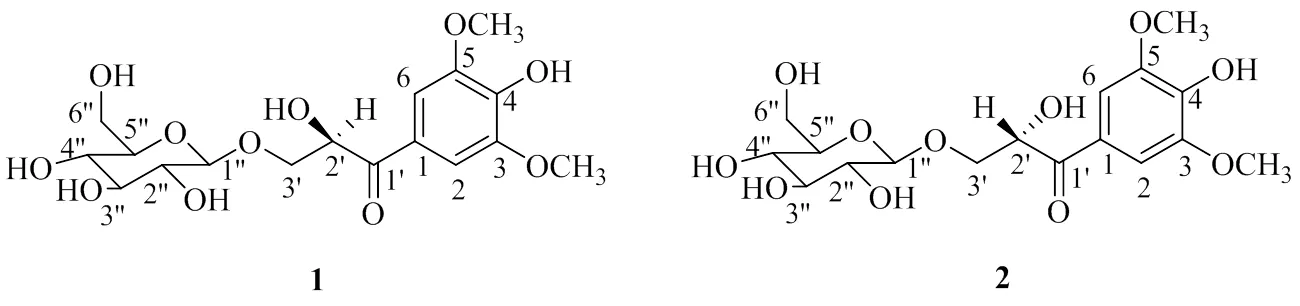
图1 化合物1和2的化学结构
1 仪器与材料
Autopol II型旋光仪(美国Rudolph公司);Bruker Tensor 27红外光谱仪(瑞士Bruker公司);Bruker Avance III核磁共振谱仪(600 MHz,瑞士Bruker公司);Cary 60紫外可见分光光度计(美国Agilent公司);Agilent TOF LC/MS质谱仪(美国Agilent公司);Bio-Logic SAS MOS-500圆二色光谱仪(法国Bio-Logic公司);Quiksep高效液相色谱仪(北京慧德易科技有限责任公司);ODS柱色谱硅胶(20~45 μm,日本Fuji Silysia公司);D101大孔吸附树脂(天津市海光化工有限公司);薄层色谱硅胶(GF254,10~40 µm)和柱色谱硅胶(100~200、200~300目,青岛海洋化工厂);Sephadex LH-20 葡聚糖凝胶(瑞典Amersham Pharmacia公司);ZORBAXSB-C18制备柱(250 mm×21.2 mm,7 μm)、ZorbaxSB-C18分析柱(250 mm×4.6 mm,5 μm),美国Agilent公司。
芦根于2018年4月采集于河北省保定市白洋淀,经天津中医药大学李天祥教授鉴定为芦苇Trin的干燥根茎。标本(201804001)保存于天津大学药物科学与技术学院天然药物化学实验室。
2 提取与分离
干燥的芦根(27.1 kg)用95%乙醇在室温下冷浸2周,然后用95%、60%乙醇加热回流提取2次,每次2 h。浓缩得到提取物4.1 kg,提取物分散在适量蒸馏水中,然后依次用石油醚、醋酸乙酯、正丁醇萃取,减压浓缩去除溶剂后得到石油醚萃取物(84.0 g)、醋酸乙酯萃取物(188.0 g)和正丁醇萃取物(571.0 g)。正丁醇萃取物用适量水溶解,经D101大孔吸附树脂柱,依次用水及30%、95%乙醇洗脱,最终得到了水洗脱部分(353.0 g)、30%乙醇洗脱部分(54.0 g)和95%乙醇洗脱部分(65.0 g)。30%乙醇洗脱部分采用硅胶柱色谱分离,二氯甲烷-甲醇(9∶1→6∶4)梯度洗脱,并根据TLC分析,得到了3个组分(F1~F3)。F2通过硅胶柱色谱,以醋酸乙酯-甲醇(95∶5)作为洗脱剂,得到2个组分(F2-1和F2-2)。F3经凝胶柱色谱分离得到了3个组分(F3-1,F3-2和F3-3)。F2-1通过常压ODS反相色谱柱分离,甲醇-水(10∶90~0∶100)洗脱得到了F2-1-1和F2-1-22部分。合并F2-1-2,F2-2和F3-1(3.3 g),再经过常压ODS反相色谱柱分离,甲醇-水(10∶90~0∶100)洗脱,得到6个组分(F4-1~F4-6)。F4-1经过反相HPLC分离(12%甲醇-水,4 mL/min),得到了化合物1(10 mg,R=66.3 min)和2(11 mg,R=74.2 min)。
3 结构鉴定
表1 化合物1和2的1H-NMR和13C-NMR数据 (600/150 MHz, CD3OD)
Table 1 1H-NMR and 13C-NMR data of compounds 1 and 2 (600/150 MHz, CD3OD)
碳位12δHδCδHδC 1 126.6 126.6 2, 67.35 (2H, s)107.87.35 (2H, s)107.7 3, 5 149.1 149.1 4 143.2 143.1 1' 199.0 198.8 2'5.32 (1H, t, J = 4.3 Hz)73.75.31 (1H, dd, J = 6.7, 3.2 Hz)74.1 3'a4.13 (1H, dd, J = 11.0, 5.0 Hz)73.64.22 (1H, dd, J = 10.8, 3.3 Hz)73.6 3'b3.95 (1H, dd, J = 11.0, 3.8 Hz)3.77 (1H, dd, J = 10.9, 4,2 Hz) 3,5-OCH33.91 (6H, s)56.93.91 (6H, s)56.9 1''4.30 (1H, d, J = 7.6 Hz)104.94.26 (1H, d, J = 7.6 Hz)104.8 2''3.17 (1H, dd, J = 8.9, 7.6 Hz)75.03.18~3.38 (4H, m)75.0 3''3.34 (1H, t, J = 8.6 Hz)77.977.8 4''3.24 (2H, m)71.571.4 5''78.078.0 6''a3.81 (1H, dd, J = 12.1, 1.3 Hz)62.63.83 (1H, dd, J = 11.9, 2.0 Hz)62.5 6''b3.61 (1H, dd, J = 11.9, 5.3 Hz)3.64 (1H, dd, J = 11.9, 5.6 Hz)
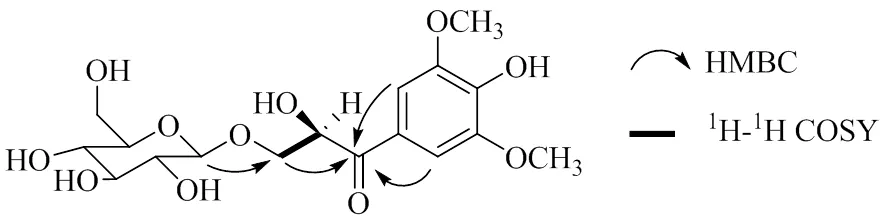
图2 化合物1的主要HMBC和1H-1H COSY信号

图3 化合物1和2的实测和计算ECD谱图
4 抗氧化活性测试
根据文献方法[7],采用DPPH自由基清除实验,对化合物1和2进行抗氧化活性测定并计算半数抑制浓度(median inhibition concentration,IC50)值,以维生素C为阳性对照。实验结果表明化合物1和2均表现出一定程度的抗氧化活性,与芦根的抗炎活性有一定相关性,其IC50值分别为(39.21±0.84)、(32.15±1.51)μmol/L [维生素C的IC50值为(8.71±0.66)μmol/L]。
5 讨论
化合物1和2的苷元为对映异构体,本课题组前期从芦根中以外消旋体的形式分离得到[5]。化合物1和2正相硅胶色谱行为一致,为不可分离的2个化合物;但在常规ODS柱色谱上,化合物1和2的保留时间不同。曾有一篇文献报道[8]了其中1个化合物的平面结构,其质谱、红外、核磁等数据均未见报道。本研究首次报道了化合物1和2的分离及结构鉴定,及其核磁、质谱、红外、旋光等数据。研究结果丰富了芦根的化学成分,为芦根进一步研究开发提供了科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物志编辑委员会. 中国植物志 [第9(2)册] [M]. 北京: 科学出版社, 2006: 27.
[2] 中国药典 [S]. 一部. 2020: 171.
[3] 孙淑玲. 中药芦根的药理作用及临床应用 [J]. 中西医结合心血管病电子杂志, 2016, 4(36): 165.
[4] General Office of National Health Commission of the People’s Republic of China; Office of National Administration of Traditional Chinese Medicine of the People’s Republic of China;. 新型冠状病毒肺炎诊疗方案(试行第九版) [J]. 中国医药, 2022, 17(4): 481-487.
[5] 秦涛, 高祉婧, 苏艳芳, 等. 芦根化学成分及其抗氧化和α-葡萄糖苷酶抑制活性 [J]. 中成药, 2022, 44(3): 798-806.
[6] Sobolev A P, Brosio E, Gianferri R,. Metabolic profile of lettuce leaves by high-field NMR spectra [J]., 2005, 43(8): 625-638.
[7] Fan S J, Zhang Y, Sun Q H,. Extract of okra lowers blood glucose and serum lipids in high-fat diet-induced obese C57BL/6 mice [J]., 2014, 25(7): 702-709.
[8] Nakasone Y, Kawakami H, Ishii K,. The changes in the phenolic glycosides from sugarcane juice during kokuto production in Okinawa [J]., 2005, 52: 5-7.
Two new phenylpropanoid glycosides from rhizoma of
ZHAO Wei-yi1, SU Yan-fang1, QIN Tao1, CHANG Yan-xu2, GAO Xiu-mei2
1. School of Pharmaceutical Science and Technology, Tianjin University, Tianjin 300072, China 2. Institute of Traditional Chinese Medicine, Tianjin University of traditional Chinese Medicine, Tianjin 301617, China
To study the chemical constituents of rhizoma of.The chemical constituents were isolated and purified by D101 macroporous adsorption resin, silica gel, Sephadex LH-20, ODS column chromatography and RP-HPLC. Their structures were elucidated on the basis of spectroscopic data and the absolute configuration were confirmed via electronic circular dichroism (ECD).Two phenylpropanoid glycosides were isolated and identified as (2)-3-(βglucopyranosyloxy)-2-hydroxy-1-(4-hydroxy-3,5-dimethoxyphenyl)-1-propanone (1) and (2)-3-(βglucopyra- nosyloxy)-2-hydroxy-1-(4-hydroxy-3,5-dimethoxyphenyl)-1-propanone (2).Compounds 1 and 2 are new compounds, named as phragcomside A and phragcomside B.
Trin; phenylpropanoid glycosides; absolute configuration; phragcomside A; phragcomside B
R284.1
A
0253 - 2670(2022)19 - 5955 - 04
10.7501/j.issn.0253-2670.2022.19.002
2022-07-18
天津市科技计划项目(20ZXGBSY00050)
赵伟伊(1998—),女,硕士研究生,研究方向为天然药物化学。E-mail: 2020213073@tju.edu.cn
苏艳芳,教授,主要从事天然药物化学研究。E-mail: suyanfang@tju.edu.cn
[责任编辑 王文倩]
