民族药刺梨根茎化学成分及其抗炎活性研究
2022-10-14李良群杨小生
梁 勇, 李良群, 王 丽, 周 浪, 杨小生*
( 1. 贵州医科大学省部共建药用植物功效与利用国家重点实验室, 贵阳 550002; 2. 贵州省中国科学院天然产物化学重点实验室, 贵阳 550014; 3. 贵州医科大学 药学院, 贵阳 550025 )
刺梨()是一种蔷薇科(Rosaceae)蔷薇属()多年生的落叶灌木植物,别名缫丝花、刺菠萝和文先果等(代甜甜等,2015),主要分布于我国西南地区,尤其以贵州省分布最为广泛。刺梨的功效最早记载于1690年,《黔书》“味甘而微酸,食之可以已闷,亦可消滞积”。作为贵州民族药材,先后收录于《贵州省中药材、民族药材质量标准》(1994版和2003版)中,具有消食健脾收敛止泻的功效,主要用于治疗积食腹胀、泄泻、止痛等。刺梨的根茎具有治疗急性细菌性痢疾和慢性胃溃疡等作用(陈建中等,2001;陈云志和刘安英,2007),它在贵州民间炎症疾病均有广泛应用。在贵州荔波地区,瑶族老百姓常用刺梨根茎煎汤服用治疗消化系统疾病和带下病症(余跃生等,2015;郑志强等,2016),以及治疗猪、牛、羊等多种畜禽的痢疾泄泻(罗茂川和白贤彩,2008)。刺梨根茎抗炎功效应用在多个民族均有记载,如苗族用刺梨根治急性肠炎(邱德文和杜江,2005)。土家族用于治胃痛、中暑、食积腹胀、痢疾、肠炎等疾病(朱国豪,2006)。布依用刺梨根入药,添加野荞头、鱼鳅串适量水煎服以治胃痛(陆科闵,1992)。仡佬人民以刺梨根入药,辅以石榴皮煎水服(日服 3 次)治上吐下泻(潘炉台等,2003)。
刺梨除了维生素C含量丰富之外,还含有丰富的多糖、黄酮、酚酸和三萜等活性成分(杨娟等,2006;张峻松等,2007)。现代药理研究表明,刺梨具有降血糖、抗菌、抗氧化和抗癌作用(汪磊,2019;梁梦琳等,2019)。目前,有关刺梨根茎化学成分文献报道不多,其化学成分的抗炎活性研究未见报道。基于刺梨根茎在贵州少数民族地区的实际应用确切疗效,为了进一步阐明该民族药的抗炎活性物质基础,本实验开展刺梨根茎化学成分及其抗炎活性研究。本实验结果不仅为民族药刺梨应用提供科学根据,也为其后续刺梨活性成分的进一步开发利用提供物质基础。
1 材料与方法
1.1 材料
药材:采自贵州省贵阳市白云区,经贵州中医药大学孙庆文教授鉴定为蔷薇科植物刺梨()的根茎,凭证标本存于贵州省中国科学院天然产物化学重点实验室功能中心(凭证标本号:CL201901)。
细胞株:小鼠单核巨噬细胞(RAW 264.7),购买于中乔新舟生物科技公司,在贵州省中国科学院天然产物化学重点实验室功能中心冻存。
1.2 仪器
Hewiett Pakard110质谱仪(美国惠普公司),BrukerAM-600MHz核磁共振测试仪(美国布鲁克公司),倒置荧光显微镜(Nikon公司),二氧化碳培养箱(ESCO公司),-80 ℃超低温冰箱(Thermo公司),多模式酶标仪(PerkinElmer公司)。
1.3 试剂
柱色谱硅胶(60~100目,200~300目,300~400目,青岛海洋化工厂),Sephadex LH-20(美国GE公司),二甲基亚砜(DMSO天津市致远化学试剂有限公司),PBS pH 7.4缓冲液、FBS胎牛血清、DMEM培养基(默克公司),胰蛋白酶EDTA(生物工业以色列拜特海姆有限公司),脂多糖(lipopolysaccharide,LPS)、噻唑蓝(methyl thiazolyl tetrazolium,MTT)(默克公司),地塞米松(dexamethasone)(默克公司),NO 检测试剂盒(碧云天生物技术公司)。
1.4 实验方法
1.4.1 提取与分离 新鲜刺梨根茎(40 kg)洗净、切碎后,先用80%乙醇浸泡3 d,再用80%的乙醇热回流提取3次,每次2 h,趁热过滤,合并提取液,减压浓缩至无醇味,转移到水浴锅(60 ℃)浓缩为浸膏,浸膏0.65 kg。
对浸膏进行硅胶柱层析分离,选用氯仿∶甲醇=(10∶1、5∶1、1∶1、0∶1)作洗脱剂,得到四个部分,分别为A部分11 g、B部分97 g、C部分69 g和D部分263 g。D部分采用氯仿甲醇=6∶1洗脱,得到D1和D2两个亚流分。D1部分使用氯仿∶甲醇=8∶1洗脱,减压浓缩甲醇重结晶得到化合物(40 mg);对D2部分采用Sephadex LH-20凝胶色谱柱甲醇洗脱和硅胶柱氯仿∶甲醇=6∶1~4∶1洗脱,获得化合物(200 mg)、化合物(25 mg)和化合物(18 mg)。C部分依次用氯仿∶甲醇=30∶1~20∶1~10∶1等度洗脱,得到C1、C2、C3三个亚流分。C1部分用氯仿∶甲醇=10∶1洗脱和甲醇重结晶得到化合物(65 mg)和(42 mg);C3部分用氯仿∶甲醇=30∶1~20∶1梯度洗脱,重结晶得到化合物(16 mg)。B部分用氯仿∶甲醇=20∶1~10∶1梯度洗脱,重结晶得到化合物(35 mg)、(26 mg)、(15 mg)、(23 mg)、(15 mg)。A部分依次用石油醚∶乙酸乙酯=40∶1~30∶1~20∶1等度洗脱,得到化合物(15 mg)、化合物(25 mg)和化合物(18 mg)。其中,化合物-的结构式见图1。
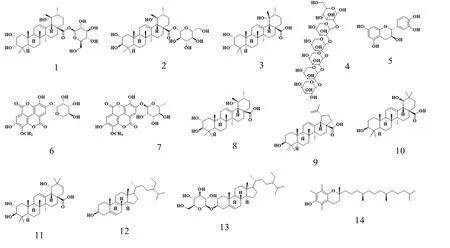
图 1 化合物1-14结构式Fig. 1 Chemical structures of compounds 1-14
1.4.2 单体化合物对RAW 264.7细胞活力的影响 采用MTT法(周晗等,2020)检测单体化合物对小鼠巨噬细胞RAW 264.7活力的影响,取对数生长期细胞,调整细胞浓度为每毫升2×10个,接种于96孔板中,每孔100 μL,在37 ℃、5%CO培养箱中培养至细胞贴壁,加入不同浓度药液作为给药组,继续培养24 h,每孔加入20 μL的MTT(5 mg·mL),4 h后吸取上清液,每孔加入150 μL DMSO,避光振荡10 min,在570 nm下检测其吸光度值。
1.4.3 Griess法检测RAW 264.7细胞NO释放 采用LPS诱导的小鼠巨噬细胞RAW 264.7炎症模型评价单体化合物抗炎活性,利用Griess试剂显色法检测NO释放量(杨晓露等,2013)。取对数生长期细胞,调整细胞浓度为每毫升1×10个,接种于96孔板中,待细胞贴壁后,每孔加入不同浓度待测样品,LPS的终浓度为1 μg·mL,每个浓度设置3个复孔,继续培养24 h,取培养液上清,按NO试剂盒说明书操作,测定NO的释放量。用酶标仪在540 nm下测定吸光度值,实验数据由GraphPad Prism 7生物统计学软件计算药物对小鼠巨噬细胞RAW 264.7炎症因子NO释放的IC值。
2 结果与分析
2.1 结构鉴定
化合物白色粉末。ESI-MS: 673.3 [M+Na], 分子式为CHO。H NMR (600 MHz,CDOD): 5.35 (1H, d,=12.0 Hz, glc-1), 5.32 (1H, br s, H-12), 2.52 (1H, s, H-18), 2.65 (1H, m, H-3), 1.35 (3H, s, CH-27), 1.20 (3H, s, CH-29), 0.98 (3H, d, CH-25), 0.97 (3H, d, CH-23), 0.92 (3H, d,=9.0Hz, CH-30), 0.84 (3H, s, CH-23), 0.75 (3H, s, CH-24) ;C NMR (150 MHz, CDOD): 42.5 (C-1), 67.3 (C-2), 80.1 (C-3), 39.6 (C-4), 49.2 (C-5), 22.6 (C-6), 34.2 (C-7), 41.5 (C-8), 48.5 (C-9), 39.4 (C-10), 24.5 (C-11), 129.5 (C-12), 139.5 (C-13), 42.8 (C-14), 29.5 (C-15), 26.5 (C-16), 48.5 (C-17), 55.2 (C-18), 73.5 (C-19), 43.0 (C-20), 27.3 (C-21) , 38.5 (C-22), 29.3 (C-23), 16.6 (C-24), 17.2 (C-25), 19.3 (C-26), 24.8 (C-27), 178.5 (C-28), 27.2 (C-29), 17.7 (C-30), 95.6 (C-1′), 73.5 (C-2′), 78.6 (C-3′), 71.3 (C-4′), 78.5 (C-5′), 62.5 (C-6′)。以上数据与文献(Yuan et al., 2019)基本一致,故鉴定化合物为刺梨苷。
化合物白色粉末。ESI-MS: 673.5 [M+Na], 分子式为CHO。H NMR (600 MHz, CDOD): 5.35 (1H, d,=12.0 Hz, glc-1), 5.32 (1H, br s, H-12), 2.50 (1H, s, H-18), 1.32 (3H, s, CH-27), 1.28 (3H, s, CH-29), 1.15 (3H, s, CH-25), 1.05 (3H, s, CH-23), 0.92 (3H, d,=7.5 Hz, CH-30), 0.80 (3H, s, CH-26), 0.75 (3H, s, CH-24);C NMR (150 MHz, CDOD): 48.2 (C-1), 69.5 (C-2), 84.2 (C-3), 39.2 (C-4), 56.5 (C-5), 19.7 (C-6), 34.0 (C-7), 41.5 (C-8), 48.6 (C-9), 40.6 (C-10), 24.8 (C-11), 129.5 (C-12), 139.7 (C-13), 42.8 (C-14), 29.5 (C-15), 26.5 (C-16), 48.5 (C-17), 55.0 (C-18), 73.5 (C-19), 43.0 (C-20), 27.3 (C-21), 36.9 (C-22), 29.3 (C-23), 17.6 (C-24), 16.5 (C-25), 17.5 (C-26), 24.9 (C-27), 178.5 (C-28), 28.6 (C-29), 25.2 (C-30), 95.8 (C-1′), 73.6 (C-2′), 78.2 (C-3′), 71.3 (C-4′), 78.5 (C-5′), 62.3 (C-6′)。以上数据与文献(李晓强等,2008)基本一致,故鉴定化合物为野蔷薇苷。
化合物白色粉末。ESI-MS: 511.2 [M+Na],分子式为CHO。H NMR (600 MHz, CDOD): 5.30 (1H, br s, H-12), 3.91 (1H, br d,=18.0 Hz, H-3), 3.31 (1H, overlop, H-2), 2.50 (1H, s, H-18), 1.35 (3H, s, CH-27), 1.28 (3H, s, CH-29), 1.18 (3H, s, CH-25), 0.98 (3H, s, CH-23), 0.92 (3H, d,=10.5 Hz, CH-30), 0.85 (3H, s, CH-26), 0.75 (3H, s, CH-24);C NMR (150 MHz, CDOD): 42.3 (C-1), 67.2 (C-2), 80.2 (C-3), 41.2 (C-4), 49.3 (C-5), 24.5 (C-6), 34.0 (C-7), 39.3 (C-8), 48.2 (C-9), 39.5 (C-10), 27.2 (C-11), 129.3 (C-12), 140.0 (C-13), 42.8 (C-14), 29.5 (C-15), 26.5 (C-16), 48.5 (C-17), 55.0 (C-18), 73.5 (C-19), 43.0 (C-20), 19.2 (C-21), 36.9 (C-22), 39.0 (C-23), 29.3 (C-24), 17.5 (C-25), 16.6 (C-26), 27.0 (C-27), 182.5 (C-28), 24.9 (C-29), 16.9 (C-30)。以上数据与文献(刘学贵等,2013)基本一致,故鉴定化合物为蔷薇酸。
化合物黄色半固体。ESI-MS: 840.6 [M-H], 分子式为CHO。H NMR (600 MHz, CDOD): 4.45 (d, H-1a), 3.96 (dd, H-2a), 3.48 (m, H-3a), 3.83 (m, H-4a), 3.95 (m, H-5a), 3.15(d, H-6a), 5.08 (d, H-1b), 4.03 (dd, H-2b), 3.45 (m, H-3b), 3.85 (m, H-4b), 3.22 (d, H-5b), 4.63 (d, H-1c), 3.94 (m, H-2c), 3.46 (m, H-3c), 3.75 (m, H-4c), 3.25 (d, H-5c), 4.85 (br s, H-1d), 4.05 (dd, H-2d), 3.43 (m, H-3d), 3.73 (m, H-4d), 3.35 (d, H-5d), 4.83 (br s, H-1e), 4.05 (dd, H-2e), 3.46 (m, H-3e), 3.73 (m, H-4e), 3.30 (br s, H-5e), 4.50 (d, H-1f), 3.92 (dd, H-2f), 3.56 (m, H-3f), 3.60 (m, H-4f), 3.35 (d,H-5f);C NMR(150 MHz, CDOD): 99.5 (C-1a), 84.2 (C-2a), 69.8 (C-3a), 69.5 (C-4a), 76.5 (C-5a), 60.5 (C-6a), 94.2 (C-1b), 83.1 (C-2b), 76.3 (C-3b), 66.0 (C-4b), 62.5 (C-5b), 91.3 (C-1c), 83.1 (C-2c), 74.6 (C-3c), 64.9 (C-4c), 62.6 (C-5c), 98.5 (C-1d), 78.4 (C-2d), 73.8 (C-3d), 65.0 (C-4d), 62.6 (C-5d), 103.5 (C-1e), 78.1 (C-2e), 73.1 (C-3e), 72.0 (C-4e), 64.5 (C-5e), 105.5 (C-1f), 77.3 (C-2f), 71.2 (C-3f), 63.8 (C-4f), 63.5 (C-5f)。以上数据与文献(Ill et al., 2014)基本一致,故鉴定为化合物为-D-glucopyranosyl-(2a→1b)-2a---L-arabinopyranosyl-(2b→1c)-2b---L-arabinopyranosyl-(2c→1d)-2c---L-arabinopyranosyl- (2d→1e)-2d---L-arabinopyrano-syl-(2e→1f)-2e---L-arabinopyranoside。
化合物黄色粉末。ESI-MS: 289.2 [M-H], 分子式为CHO。H NMR (600 MHz, CDOD): 8.03 (4H, s, OH×4), 4.55 (1H, d,=10.5 Hz, H-2), 5.95 (1H, d,=2.25 Hz, H-6), 6.01 (1H, d,=2.25 Hz, H-8), 6.91 (1H, br s, H-2′), 6.75 (1H, br d,=12Hz, H-5′), 6.81 (1H, d,=12 Hz, H-6′), 4.05 (1H, br s, OH×3);C NMR (150 MHz, CDOD): 82.5 (C-2), 68.2 (C-3), 28.5 (C-4) , 157.3 (C-5), 95.6 (C-6), 157.2 (C-7), 95.2 (C-8), 157.0 (C-9), 99.8 (C-10), 132.0 (C-1′), 115.5 (C-2′), 145.4 (C-3′), 145.3 (C-4′), 115.3 (C-5′), 119.3 (C-6′)。以上数据与文献(杨秀伟等,2020)基本一致,故鉴定化合物为儿茶素。
化合物黄色针晶。ESI-MS: 919.5 [2M+Na], 分子式为CHO。H NMR (600 MHz, DMSO-): 7.55 (1H, s, H-5), 7.72 (1H, s, H-5′), 3.95 (3H, s, -OCH), 5.00 (1H, d,=14 Hz, H-1");C NMR(150 MHz, DMSO-): 113.2 (C-1), 141.5 (C-2), 140.1 (C-3), 152.4 (C-4), 111.3 (C-5), 111.3 (C-6), 158.7 (C-7), 114.1 (C-1′), 141.7 (C-2′), 135.5 (C-3′), 146.5 (C-4′), 107.3 (C-5′), 111.4 (C-6′), 158.5 (C-7′), 60.9 (C-OCH), 102.5 (C-1"), 72.5 (C-2"), 75.3 (C-3"), 69.2 (C-4"), 65.1 (C-5")。以上数据与文献(孔令义等,2009)基本一致,故鉴定化合物为3--methylellagic acid-4′---D-xylopyranoside。
化合物黄色针晶。ESI-MS: 461.2 [M-H], 分子式为CHO。H NMR (600 MHz, DMSO-): 7.48 (1H, s, H-5), 7.60 (1H, s, H-5′), 3.95 (3H, s, -OCH), 5.42 (1H, s, H-1");C NMR (150 MHz, DMSO-): 107.3 (C-1), 140.1 (C-2), 136.2 (C-3), 146.5 (C-4), 111.3 (C-5), 111.5 (C-6), 158.7 (C-7), 114.1 (C-1′), 141.7 (C-2′), 141.6 (C-3′), 152.6 (C-4′), 111.6 (C-5′), 113.0 (C-6′), 158.5 (C-7′), 60.9 (C-OCH), 100.3 (C-1"), 70.2 (C-2"), 70.5 (C-3"), 71.5 (C-4"), 69.8 (C-5"), 17.8 (C-6")。以上数据与文献(Guan et al., 2007)基本一致,故鉴定化合物为3--methylellagic acid-4′---L-rhamnopyranoside。
化合物白色粉末。ESI-MS: 511.3 [M+Na], 分子式为CHO。H NMR (600 MHz, CDOD): 5.20 (1H, br s, H-12), 4.38 (1H, m, H-2), 3.41 (1H, overlop, H-3), 2.48 (1H, s, H-18), 1.28 (3H, s, CH-27), 1.06 (3H, s, CH-29), 0.92 (3H, s, CH-25), 0.88 (3H, s, CH-23), 0.68 (3H, s, CH-26) ,0.82(3H, d,=10.5 Hz, CH-30), 0.65 (3H, s, CH-24);C NMR (150 MHz, CDOD): 47.5 (C-1), 67.2 (C-2), 82.5 (C-3), 38.9 (C-4), 55.2 (C-5), 18.4 (C-6), 32.4 (C-7), 40.0 (C-8), 46.8 (C-9), 38.7 (C-10), 23.5 (C-11), 127.0 (C-12), 138.9, (C-13), 41.5 (C-14), 28.3 (C-15), 25.6 (C-16), 47.3 (C-17), 53.5 (C-18), 71.8 (C-19), 41.6 (C-20), 26.1 (C-21), 37.5 (C-22), 29.2 (C-23), 16.5 (C-24), 16.4 (C-25), 18.4 (C-26), 24.2 (C-27), 179.2 (C-28), 26.7 (C-29), 17.4 (C-30)。以上数据与文献(杨秀伟和赵静,2003)基本一致,故鉴定化合物为委陵菜酸。
化合物白色粉末。ESI-MS: 479.4 [M+Na], 分子式为CHO。H NMR (600 MHz, CDCl): 4.65 (1H, br s, H-29a), 4.52 (1H, s, H-29b), 3.10 (1H, dd,=11.2Hz, H-3), 1.65 (3H, s, H-30), 0.95 (3H, s, H-23), 0.86 (3H, s, H-26), 0.78 (3H, s, H-25), 0.68 (3H, s, H-24);C NMR (150 MHz, CDCl): 38.5 (C-1), 27.2 (C-2), 79.3 (C-3), 38.5 (C-4), 55.2 (C-5), 17.9 (C-6), 34.5 (C-7), 40.5 (C-8), 50.3 (C-9), 37.2 (C-10), 22.5 (C-11), 25.7 (C-12), 37.3 (C-13), 43.0 (C-14), 27.2 (C-15), 32.2 (C-16), 57.8 (C-17), 45.5 (C-18), 49.6 (C-19), 149.7 (C-20), 29.0 (C-21), 37.5 (C-22), 27.5 (C-23), 15.2 (C-24), 16.0 (C-25), 16.2 (C-26), 15.2 (C-27), 181.2 (C-28), 109.2 (C-29), 19.5 (C-30)。以上数据与文献(Simin et al., 2007)基本一致,故鉴定化合物为桦木酸。
化合物白色粉末。ESI-MS: 495.3 [M+Na], 分子式为CHO。H NMR (600 MHz, CDOD): 5.33 (1H, br s, H-12), 3.15 (1H, overlop, H-3), 3.10(1H, s, H-18), 1.28 (3H, s, CH-27), 1.06 (3H, s, CH-29), 0.92 (3H, s, CH-25), 1.02 (3H, s, CH-23), 0.98 (3H, s, CH-30), 0.78 (3H, s, CH-26), 0.82 (3H, s, CH-24);C NMR (150 MHz, CDOD): 38.5 (C-1), 26.8 (C-2), 78.6 (C-3), 38.5 (C-4), 55.5 (C-5), 18.4 (C-6), 32.8 (C-7), 39.5 (C-8), 47.6 (C-9), 37.2 (C-10), 23.9 (C-11), 123.5 (C-12), 143.5 (C-13), 41.5 (C-14), 28.3 (C-15), 27.5 (C-16), 45.5 (C-17), 44.2 (C-18), 81.3 (C-19), 34.9 (C-20), 28.5 (C-21), 32.8 (C-22), 27.6 (C-23), 15.1 (C-24), 14.5 (C-25), 16.6 (C-26), 24.2 (C-27), 181.2 (C-28), 27.5 (C-29), 24(C-30)。以上数据与文献(Xiao et al., 2011)基本一致,故鉴定化合物为spinosic acid。
化合物白色粉末。ESI-MS: 511.1 [M+Na], 分子式为CHO。H NMR (600 MHz, CDOD): 5.30 (1H, br s, H-12), 3.95 (1H, br d,=16.5 Hz, H-3), 3.63 (1H, m, H-2), 2.48 (1H, s, H-18), 1.28 (3H, s, CH-27), 1.15 (3H, s, CH-29), 1.01 (3H, s, CH-25), 0.96 (3H, s, CH-23), 0.92 (3H, d,=10.5 Hz, CH-30), 0.78 (3H, s, CH-26), 0.76 (3H, s, CH-24);C NMR (150 MHz, CDOD): 47.5 (C-1), 69.5 (C-2), 84.2 (C-3), 40.5 (C-4), 56.5 (C-5), 19.3 (C-6), 33.8 (C-7), 40.5 (C-8), 48.1 (C-9), 39.0 (C-10), 23.9 (C-11), 124.5 (C-12), 140.1 (C-13), 42.5 (C-14), 29.2 (C-15), 29.4 (C-16), 46.1 (C-17), 45.3 (C-18), 82.4 (C-19), 34.0 (C-20), 29.2 (C-21), 36. (C-22), 28.7 (C-23), 17.6 (C-24), 16.8 (C-25), 17.4 (C-26), 24.9 (C-27), 182.4 (C-28), 28.5 (C-29), 24.6(C-30)。以上数据与文献(张永红等,2005)基本一致,故鉴定化合物为arjunic acid。
化合物白色针晶。ESI-MS: 437.5 [M+Na], 分子式为CHO。H NMR (600 MHz, CDCl): 5.15 (1H, s, 6-H), 6.81 (1H, d,=12.0 Hz, H-3), 0.85 (7H, d,=6.9 Hz, H-2, H-26, H-9), 0.75 (1H, d,=6.4 Hz, H-27);C NMR (150 MHz, CDCl): 37.4 (C-1), 29.8 (C-2), 71.5 (C-3), 42.2 (C-4), 141.1 (C-5), 121.7 (C-6), 31.3 (C-7), 32.5 (C-8), 50.3 (C-9), 36.5 (C-10), 21.3 (C-11), 39.5 (C-12), 42.5 (C-13), 56.6 (C-14), 24.4 (C-15), 28.5 (C-16), 56.2 (C-17), 12.1 (C-18), 19.5 (C-19), 36.3 (C-20), 18.5 (C-21), 34.1 (C-22), 26.2 (C-23), 46.0 (C-24), 29.2 (C-25), 19.6 (C-26), 19.1 (C-27), 23.2 (C-28), 11.8 (C-29)。以上数据与文献(黄绿等,2020)基本一致,故鉴定化合物为-谷甾醇。
化合物白色粉末。ESI-MS: 599.7 [M+Na], 分子式为CHO。H NMR (600 MHz, DMSO-): 5.35 (1H, br s, H-6), 4.56 (1H ,d,=15 Hz ,H-1′);C NMR (150 MHz, DMSO-): 37.6 (C-1), 30.3 (C-2), 78.3 (C-3), 39.2 (C-4), 141.1 (C-5), 122.2 (C-6), 32.3 (C-7), 32.1 (C-8), 50.3 (C-9), 36.5 (C-10), 21.3 (C-11), 39.5 (C-12), 42.6 (C-13), 56.5 (C-14), 24.6 (C-17), 12.3 (C-18), 19.2 (C-19), 36.5 (C-20), 19.0 (C-21), 34.3 (C-22), 26.3 (C-23), 46.3 (C-24), 29.5 (C-25), 19.6 (C-26), 19.6 (C-27), 23.5 (C-28), 12.3 (C-29), 102.5 (C-1′), 75.3 (C-2′), 78.6 (C-3′), 71.8 (C-4′), 78.2 (C-5′), 62.5(C-6′)。以上数据与文献(詹庆丰和夏增华,2005)基本一致,故化合物鉴定为-胡萝卜苷。
化合物油状液体。ESI-MS: 429.3 [M-H], 分子式为CHO。H NMR (600 MHz, CDCl): 2.58 (2H, t,=10.2 Hz, H-4), 2.12 (3H, s, H-7a), 2.06 (6H, s, H-5a, H-8a), 1.73 (2H, m, H-3), 1.25 (3H, s, H-2a), 0.86 (3H, d,=10.2 Hz, H-12′a), 0.86 (3H, d,=10.2Hz, H-13′), 0.83 (3H, d,=9.6 Hz, H-4′a), 0.82 (3H, d,=9.6 Hz, H-8′a);C NMR (150 MHz, CDCl):145.6 (C-9), 144.5 (C-6), 122.5 (C-8), 121.2 (C-7), 118.5 (C-5), 117.3 (C-10), 74.5 (C-2), 39.6 (C-1′), 39.4(C-11′), 37.5(C-3′), 37.4(C-5′), 37.4(C-7′), 37.3(C-9′), 32.6(C-4′), 32.6(C-8′), 31.5(C-3), 27.9 (C-12′), 24.5 (C-10′), 24.4 (C-6′), 23.8 (C-2a), 22.5 (C-12′a), 22.6 (C-13′), 21.2 (C-2′), 20.5 (C-4), 19.7 (C-4′a), 19.6 (C-8′a), 12.3 (C-7a), 11.5 (C-8a), 11.2 (C-5a)。以上数据与文献(Kyeong et al., 2013)基本一致,故化合物鉴定为-tocopherol。
化合物油状液体。ESI-MS: 389.4 [M+Na], 分子式为CH。H NMR (600 MHz, CDCl): 1.25 (54H, m, H-2~25), 0.88 (6H, t,=8.4Hz, H-1, 26);C NMR (150 MHz, CDCl): 14.1 (C-1, 6), 22.7 (C-2, 25), 29.5 (C-5, 22), 29.5 (C-6~C-21), 31.9 (C-3, 4)。以上数据与文献(叶凤梅等,2015)基本一致,故化合物鉴定为正二十六烷。
2.2 单体化合物对RAW 264.7细胞活力影响
由图2可知,与空白对照组相比,化合物≤50 μmol·L时,细胞活力均大于90%。实验结果表明当单体化合物浓度≤50 μmol·L时,对小鼠巨噬细胞RAW 264.7细胞无明显毒性,因此,我们选用药物的最高浓度为50 μmol·L进行后续实验。
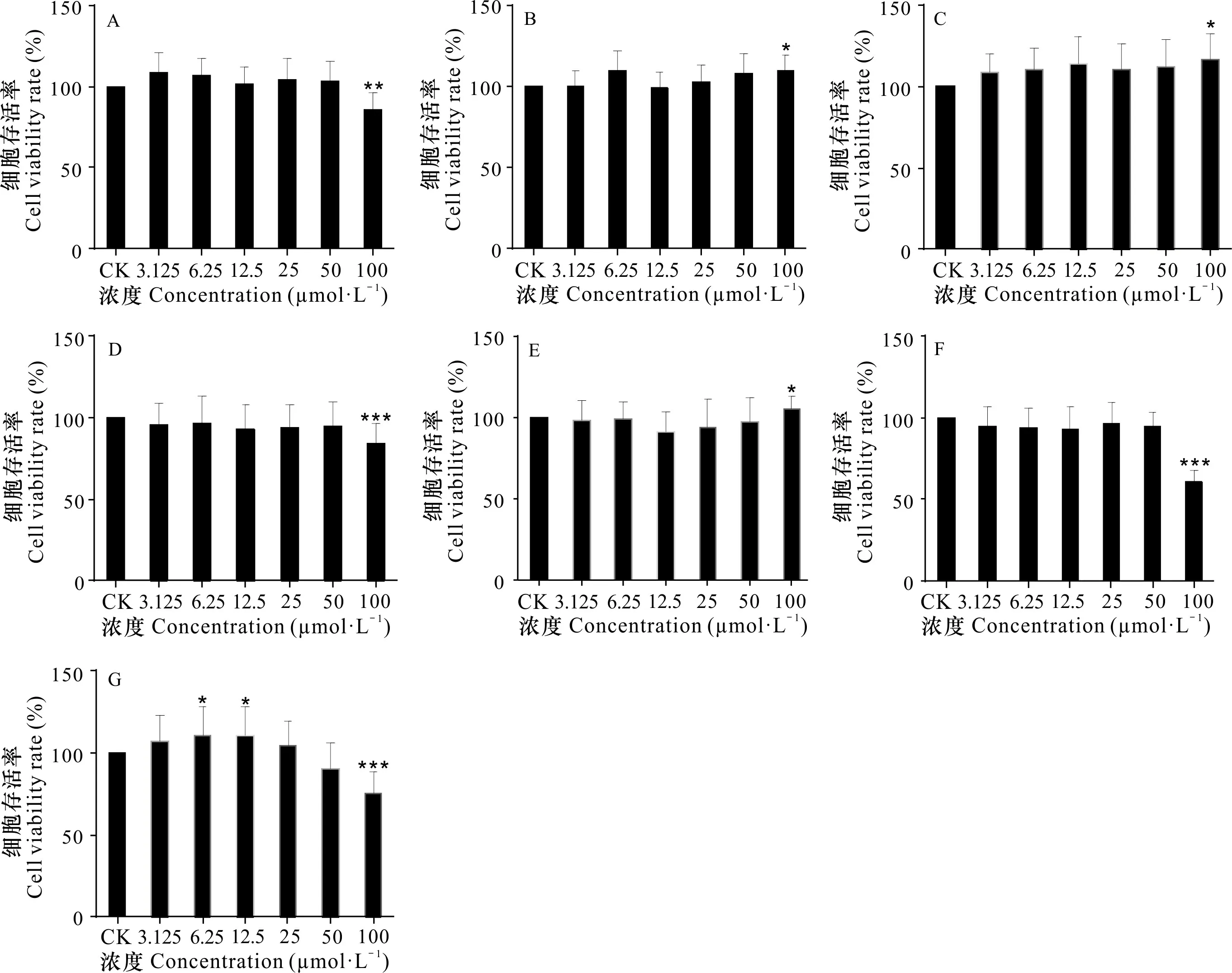
A-G表示化合物1-7。下同。与空白组相比,*P<0.05, **P<0.01,***P<0.001。A-G indicate compounds 1-7. The same below. Compared with the blank group, *P<0.05, **P<0.01, ***P<0.001. 图 2 各化合物对RAW 264.7细胞活力的影响Fig. 2 Effects of compounds on cell viabilities of RAW 264.7
2.3 单体化合物对RAW 264.7细胞NO释放的影响
本实验利用LPS诱导的巨噬细胞构建体外炎症模型,采用Griess法检测细胞上清中NO的释放量。实验需确保药物浓度对细胞无明显毒性情况下进行,否则会造成假阳性的结果,当RAW 264.7细胞受到LPS刺激后,会出现“炎症小瀑布”,大量释放炎症因子NO。由图3可知,LPS刺激后NO释放显著高于空白组(<0.001),表明造模成功。与LPS组相比,化合物-在浓度3.125、6.25、12.5、25、50 μmol·L和地塞米松在浓度0.39、1.56、6.25、25、100 μmol·L条件下均可降低NO释放量,且呈剂量依赖关系。通过计算化合物-和地塞米松在相应浓度下的IC值可知,其对应的IC值分别为25.07、24.56、17.65、9.87、16.67、40.83、34.98、22.46 μmol·L,由此可说明化合物、、有较好的体外抗炎活性,略优于地塞米松,化合物、、、表现出一定抗炎活性。
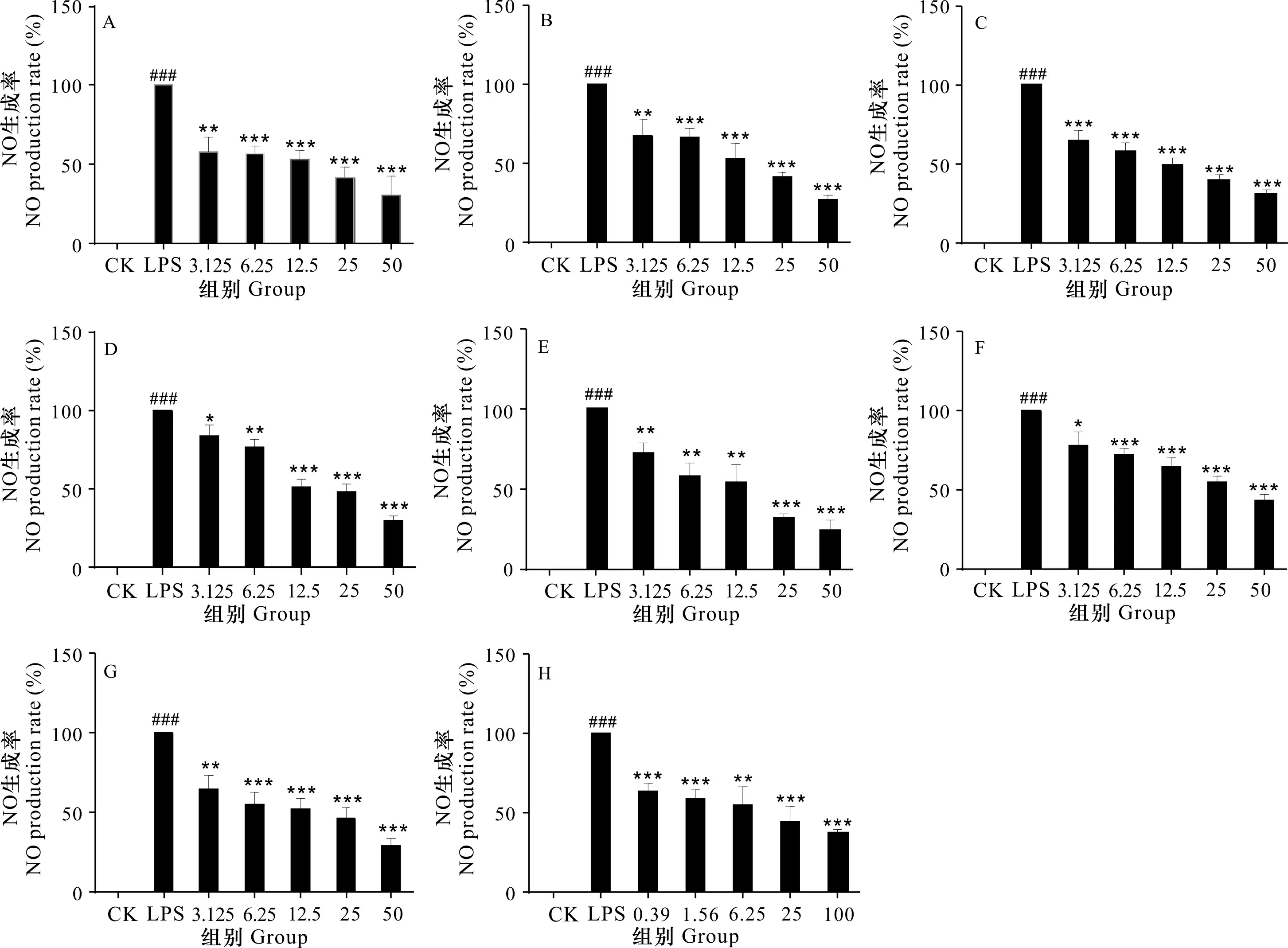
H表示地塞米松,LPS终浓度为1 μg·mL-1。与空白组相比,###P<0.001; 与模型组相比,*P<0.05, **P<0.01, ***P<0.001。H indicates dexamethasone, and the final concentration of LPS is 1 μg·mL-1. Compared with the blank group, ###P<0.001; Compared with the model group, *P<0.05, **P<0.01, ***P<0.001.图 3 单体化合物对RAW 264.7细胞NO释放影响Fig. 3 Effects of monomeric compounds on NO production in RAW 264.7 cells
3 讨论与结论
本研究从刺梨根茎部位分离鉴定15个化合物,包括五环三萜类(7个)、鞣花酸类(2个)、甾醇类(2个)、黄酮类(1个)、寡糖(1个)、多酚(1个)和脂肪烃(1个)。其中,化合物、、为首次从刺梨中分离得到。在刺梨根茎化学成分中,刺梨苷和野蔷薇苷(化合物、)的含量最高,2个三萜化合物在新鲜药材中含量达0.075%。
民族药在预防和治疗炎症性疾病中发挥着重要作用,具有多成分、多靶点、多通路的协同调控作用。民族药刺梨在贵州省资源最为丰富且在民间有着广泛应用历史。从化合物、、的抗炎活性可以看出,刺梨三萜苷元抗炎活性优于三萜皂苷,进一步证实刺梨五环三萜28位游离羧酸活性较好,该发现与文献报道一致(薛永,2018)。化合物-对小鼠巨噬细胞NO释放均有比较明显的抑制作用,且呈剂量依赖关系。其中,化合物、、有较好的体外抗炎活性,略优于地塞米松,化合物、、、表现出一定抗炎活性。证实了刺梨与蔷薇科属植物金樱子有相似的抗炎作用,而其机理有待于进一步深入。刺梨三萜作为刺梨根茎主要活性成分,并在增强免疫力、延缓衰老、抗动脉粥样硬化、健胃消食等方面均具有较好的活性。刺梨根茎的鞣花酸类化合物、的IC值分别为40.83、34.98 μmol·L,抗炎效果相对于刺梨三萜较差,其抗炎机制可能是下调炎症相关因子的基因表达,抑制促炎细胞因子和炎性介质的分泌,从而发挥抗炎作用。鞣花酸类化合物是一种天然的多酚类物质,能滋养肌肤(高新鹏和张立华,2020),因此该物质在化妆品的研发中值得重视。本研究显示出三萜类、鞣花酸类、黄酮类和寡糖类化合物是刺梨根茎发挥抗炎作用的主要有效成分,同时验证了刺梨根茎在贵州少数民族区域的民间抗炎功效。因此,对刺梨化学成分及其药理活性进一步研究,为刺梨开发成为抗肠道炎症及兽药奠定基础。
感谢中国科学院天然产物化学重点实验室核磁室提供的数据,同时感谢课题组研究助理对实验的指导,由衷感谢他们对本次实验的帮助。
