水中新型有机污染糖精的氧化降解及动力学分析
2022-10-13金雨鸿李青松宋亚丽黄奕鸣马晓雁
项 硕,金雨鸿,李青松,宋亚丽,黄奕鸣,马晓雁
(1.浙江科技学院 建筑工程学院,浙江 杭州 310023;2.浙江工业大学 环境学院,浙江 杭州 310014;3.浙江工业大学 土木工程学院,浙江 杭州 310014;4.厦门理工学院 水资源环境研究所,福建 厦门 361005)
糖精(Saccharin,SAC)是一种最早使用的人工甜味剂(artificial sweeteners,ASs),作为蔗糖的替代品广泛应用于食品、药品和饲料等领域中。近年来,其应用的安全性遭到质疑,有报道发现SAC影响肠胃吸收功能[1],且在生物毒性上存在着潜在的风险[2],需严格控制其用量。SAC在人体中无法代谢,可经由污水排放、畜牧使用和工业排放等途径进入水体。SAC具有一定的持久性,且对水生植物表现出低危害性和潜在风险,是一种环境新型污染物[3]。SAC在排入污水处理厂后,以生物处理为主的污水处理工艺无法实现完全去除,随排放进入受纳水环境或其他环境区域[4]。Mailler等[5]在对污水厂活性炭吸附SAC的调查中发现,SAC降解率偏低,仅有33%~54%。因此,近年来SAC在地下水和地表水中均普遍检出[6]。美国多地市政污水排放下游的受纳水体检出SAC浓度高至5 µg/L[7];瑞士处理后废水中SAC浓度范围为0.27~3.20 µg/L[8];中国天津市某污水排污口中下游检测到SAC的浓度高达91 µg/L,附近湿沉降SAC的浓度高达1.3 µg/L[9]。水源中SAC可穿透常规饮用水处理工艺[6],进入饮水系统,对饮用水水质安全产生影响。有研究表明,SAC几乎不会在氯化处理过程中转化[10]。为有效应对水源中的高有机物及微量有机污染问题,国内水厂逐步进行深度处理工艺改造。预氧化是最常见的深度处理技术之一,其中臭氧氧化是应用最广泛的工艺。Scheurer等[10]采用5.0 mg/L的臭氧浓度氧化SAC,结果发现SAC在60 min时仅有20%的降解,认为臭氧对SAC的氧化效果较差。Li等[11]利用UV/H2O2提高了SAC的去除效率,30 min后SAC降解率为47.6%。同样是在UV辐射下,过硫酸盐对SAC的60 min降解率可达85.39%[12]。Lin等[13]研究了阳极种类对电芬顿法去除SAC的影响,发现3种阳极均可在30 min内将SAC完全降解,矿化效率为55.8%~96.2%。关于水中SAC的去除报道较少,且已有的研究仅从单种工艺的角度出发,缺乏不同工艺的对比研究。因此,本文系统地比较了预氯化、UV、H2O2、臭氧及UV/H2O2联用工艺降解SAC的效果,重点探讨了UV/H2O2联用工艺高效降解SAC的动力学模型,并对工艺参数及影响因素进行了分析,以期为人工代糖类污染物的控制提供相应的技术参数,为饮用水安全保障提供基础数据。
1 材料与方法
1.1 实验材料与设备
SAC(纯度>98%)购自梯希爱(上海)化成工业发展有限公司,硫代硫酸钠、乙酸铵、抗坏血酸、磷酸二氢钾、三水合磷酸二氢钾和过氧化氢(纯度>30%)等分析纯试剂购自上海安谱实验科技股份有限公司等公司,甲醇和乙腈(色谱纯)均购自德国CNW有限公司,甲酸(色谱纯)、次氯酸钠溶液(有效氯6%~14%)、叔丁醇(分析纯)和草酸钛钾(分析纯,纯度98%)均购自阿拉丁试剂(上海)有限公司。
试验所用仪器设备包括臭氧发生器(COM-AD,鞍山安思罗斯环保有限公司,辽宁)、高效液相色谱仪(LC-20A,Shimadzu,日本)、配液相色谱柱(ODS-3,Shimadzu,日本)、紫外检测器、液相色谱-飞行时间质谱仪(6210 LC-TOF,Agilent,美国)、TOC自动分析仪(TOC-VCPN,Shimadzu,日本)、纯水机(IPHW1-90T,北京优普时代科技有限公司,北京)、pH计(SX751,上海三信仪表厂,上海)、电热恒温水浴锅(XMTE-8112,上海博迅实业有限公司,上海)、笔式余氯计(CL200,上海三信仪表厂,上海)。
1.2 SAC降解试验
采用纯水配制SAC储备液(1g/L),储存于棕色蓝口瓶中于4 ℃密封遮光保存待用,其它试剂均现配现用。试验时,通过磷酸缓冲液调节反应初始pH值至设定值,使用水浴锅控制反应温度至设定值。将SAC储备液经纯水稀释投入2 L反应器中,置于磁力水浴搅拌器,以确保充分混合。分别投加定量的氧化剂次氯酸钠,或H2O2进行氧化反应;臭氧以氧气作为进气源,通过臭氧发生器产生,经由微孔曝气头投加并扩散,与溶液充分接触反应;UV/H2O2氧化模拟过程为投加定量 H2O2后进行UV辐照。在对反应溶液氧化程度的检测阶段,在特定的反应间隔取样,通过0.22 µm膜过滤后立即加入过量抗坏血酸淬灭剩余氧化剂,进样HPLC检测SAC剩余浓度。
1.3 SAC检测方法及其降解产物鉴定
SAC定量检测采用HPLC法,紫外检测器波长220 nm,流动相为0.02 mol/L乙酸铵和甲醇(90∶10),流速为1.0 mL/min,进样量为20 µL。
采用液质联用LCMS负电离模式鉴定SAC降解产物,C18柱,柱温箱恒温30 ℃,流动相由纯水制0.01%甲酸(A)和乙腈(B)组成,流速为0.25 mL/min。梯度洗脱过程为:(0 min,99%A),(15 min,1%A),(17 min,99%A),(18 min,99%A)。载气流量为8 L/min,雾化器压力为0.24 MPa,干燥加热器为200 ℃,六级杆透镜电压峰值为50 V,毛细管电压为4 200 V。
2 结果与讨论
2.1 常用氧化工艺对SAC的降解
饮用水处理常用氧化工艺如预氯化、UV、H2O2、臭氧及UV/H2O2等对SAC及以总有机碳(total organic carbon,TOC)为指标的降解效果,如图1所示。其中,参数设置为:CSAC=20 mg/L,CH2O2=20.4 mg/L, UV光强JUV=1.46 mW/cm2,CO3=3.50 mg/min,CNaClO=84.0 mg/L,T=20 ℃,pH值为(7±0.2)。
由图1(a)可知,氧化能力较弱的UV和H2O2对SAC几乎没有降解能力,反应接触60 min后降解率分别低于10.0%和8.0%。预氯化对SAC的降解能力低,降解率最高为21.2%。臭氧对SAC具有较好的降解效果,在臭氧量充足的情况下,反应30 min后SAC降解率为77.6%,反应60 min降解率可达99.0%,与Scheurer等[10]的报道相差较大,主要是因为本文臭氧通量相对于臭氧溶液投加,氧化剂量更高。UV/H2O2联用对SAC降解效果最优,反应30及60 min的降解率分别为89.1%和99.0%以上,且降解速率快。几种氧化工艺对SAC的降解效果优劣依次为UV/H2O2>臭氧 ≫次氯酸钠>UV≈H2O2。
由图1(b)可知,臭氧和UV/H2O2氧化系统中,SAC随反应时间不断减少,臭氧对SAC的降解效率略小于UV/H2O2,但由TOC反映出的矿化速率差别较大。反应30 min后,UV/H2O2系统的降解率比臭氧系统高11.5%,矿化效果较臭氧高21.0%。2种氧化技术对SAC降解效果及速率的差异主要是因反应原理不同。羟基自由基(·OH)是UV/H2O2系统中主要的活性基团[14],是目前氧化能力最高的活性物种之一[15]。臭氧可直接与污染物反应,也可产生·OH,·OH产生量与系统酸碱度等因素有关。
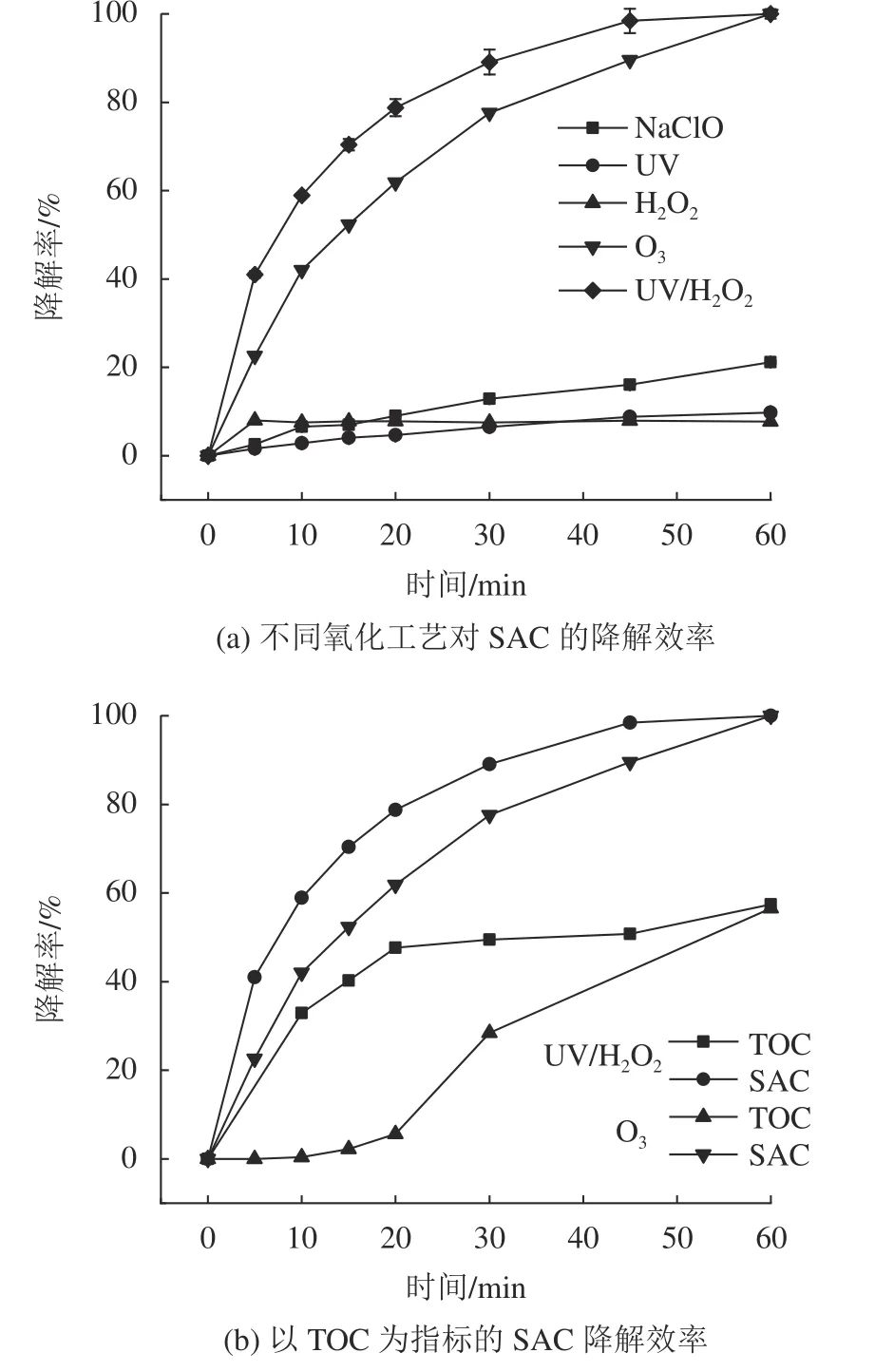
图1 不同工艺降解及矿化SAC的降解效果Fig. 1 Effects of different oxidation technologies on SAC and TOC degradation
2.2 臭氧及UV/H2O2降解SAC机理
臭氧及UV/H2O2体系降解SAC的机理,体系中·OH的作用经由叔丁醇(tert-butyl alcohol,TBA)抑制试验[16-17]进一步论证,得到叔丁醇对UV/H2O2及臭氧氧化降解SAC的降解率影响如图2所示。其中,参数设置为:CSAC=20 mg/L,CH2O2=20.4 mg/L,JUV=1.46 mW/cm2,CO3=7.10 mg/min,CTBA=20 mmol/L,T=20 ℃, pH值为 (7±0.2)。
如图2所示:臭氧通量增加到7.10 mg/min时,SAC降解效果与UV/H2O2相当,60 min时SAC几乎被完全降解。在投加了相同量叔丁醇的抑制试验中,反应60 min后,UV/H2O2和臭氧氧化对SAC的降解率从99.0%分别降到86.0%和 31.8%。叔丁醇的投加对2个反应体系降解SAC有明显的抑制作用,且对臭氧氧化的抑制作用更明显。UV/H2O2体系中·OH是主要作用因子[14],可能叔丁醇的投加量相对不足,抑制作用弱。在叔丁醇投加量同样不足的情况下,臭氧氧化SAC过程中降解率降幅明显,说明臭氧体系产生的·OH比UV/H2O2体系少[18]。
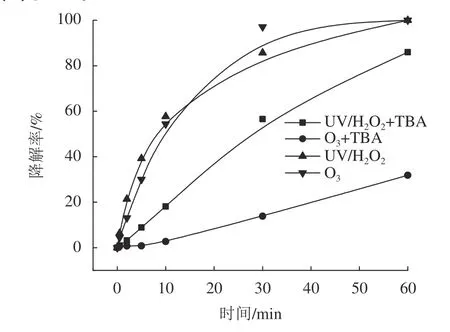
图2 叔丁醇对UV/H2O2及臭氧氧化降解SAC的降解率的影响Fig. 2 Effect of TBA on the SAC degradation efficiency by UV/H2O2 and ozonation
UV/H2O2降解SAC的主要活性物质为·OH[19],SAC的降解路径与·OH的作用机理直接相关,有研究证实·OH降解含苯环类的有机物时主要反应路径是苯环的羟基化[20],侧链对苯环存在供电子的诱导效应和共轭效应,使得苯环上电子云密度增加,有利于·OH攻击苯环从而形成络合物,而后形成羟基化产物[21]。Davididou等[22]指出·OH 与SAC中的苯环结合发生羟基化反应,促进C—N键断裂,形成羧基和氨基。此外还有UV的直接光解作用,可能主要通过裂解N—S键降解SAC[23],文献检索结合产物分析,UV/H2O2体系降解SAC的可能路径如图3(a)和(b)所示。
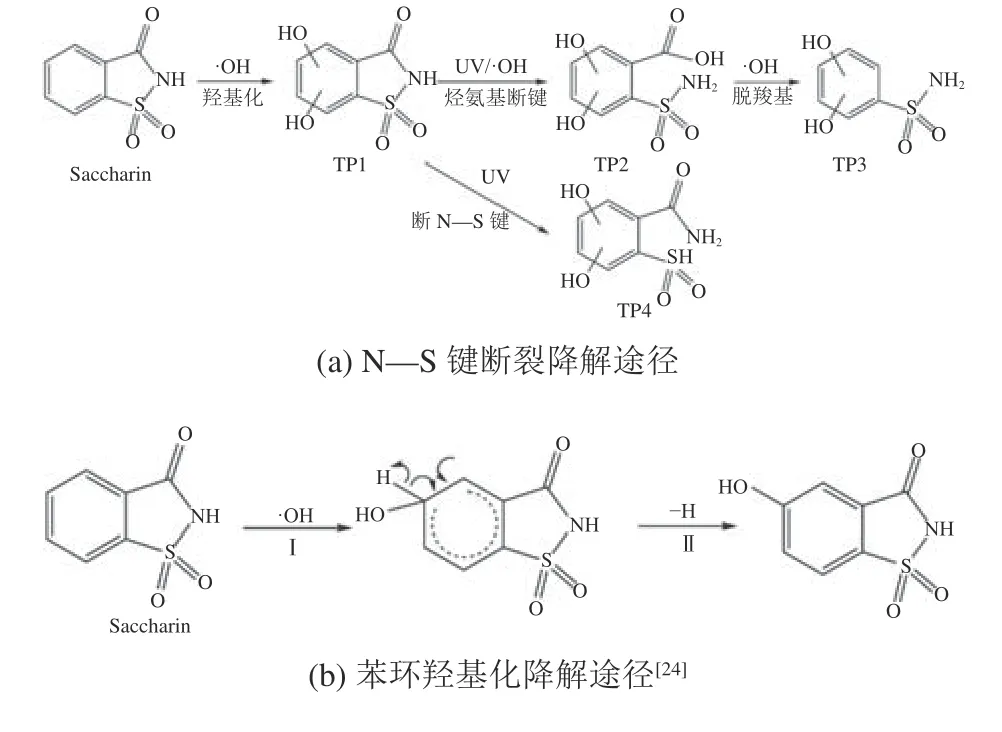
图3 SAC降解路径及机理推断图Fig. 3 Hypothetical SAC degradation pathway and mechanism
高级氧化是饮用水深度处理的方向之一,可实现有机物的彻底降解。下面探讨UV/H2O2降解SAC的操作及环境因子的影响。一级动力学反应是反应化学降解速率与反应有关的物质的浓度的关系的动力学方程,见式(1)
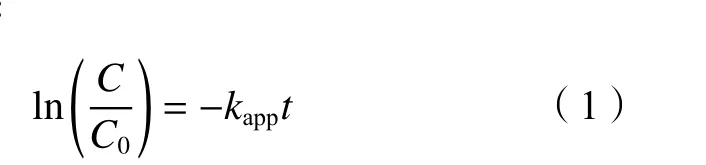
2.3 UV/H2O2降解SAC影响因素
式中:C为被降解tmin时的SAC浓度;C0为初始的SAC浓度;kapp为拟一级反应动力学速率常数,可以直接反映化学反应的快慢;t为反应时间。根据图1(a)中UV/H2O2降解SAC的实验数据拟合,得到R2=0.997 2,因此SAC的降解符合拟一级反应动力学。
2.3.1 H2O2投加量对SAC降解的影响
氧化剂H2O2的浓度直接影响·OH的浓度,不同H2O2的投加量对UV/H2O2氧化降解SAC的降解率和降解速率的影响如图4所示。其中参数设置为:CSAC=20 mg/L,JUV=1.46 mW/cm2,T= 20 ℃,pH值为(7±0.2)。

图4 H2O2初始浓度对降解SAC的降解率和降解速率的影响Fig. 4 Effect of initial H2O2 concentration on SAC degradation efficiency and rate
如图4所示:随着H2O2投加量在5.1~20.4 mg/L范围增加,SAC的降解率升高,降解速率加快。H2O2浓度达到20.4 mg/L后,H2O2浓度继续升高对SAC降解率的影响不再明显,且降解速率减慢,主要原因为H2O2浓度的增加促使UV活化H2O2产生更多的·OH[25],但过量的H2O2同时是·OH的淬灭剂,导致·OH产量减少[26],H2O2的投加量存在最佳浓度。
2.3.2 UV光强对SAC降解的影响
不同 UV光强对UV/H2O2氧化降解SAC的降解率影响如图5所示。其中参数设置为:CSAC=20 mg/L,CH2O2=20.4 mg/L,T=20 ℃, pH值为(7±0.2)。
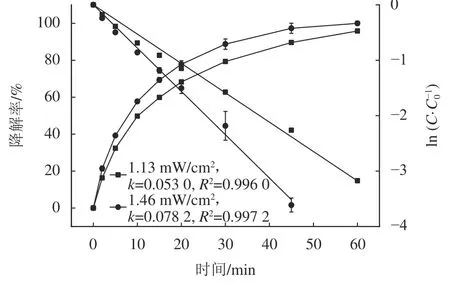
图5 UV光强对降解SAC的降解率影响Fig. 5 Effect of UV light intensity on SAC degradation efficiency
从图5可知:UV光强分别为1.13和1.46 mW/cm2条件下,反应20 min时,SAC降解率由68.3%提高至77.8%;反应60 min后,SAC降解率由95.8%提高至99.9%,降解速率常数0.053 0 min-1升高为0.078 2 min-1。UV光强的增加促进了反应体系的光量子数增多[27],加快·OH的产生,进而提高降解速率。
2.3.3 初始SAC浓度对SAC降解的影响
不同SAC初始浓度对UV/H2O2氧化降解SAC的降解率和降解速率的影响如图6所示。其中参数设置为:CH2O2=20.4 mg/L,JUV=1.46 mW/cm2,T=20 ℃, pH值为(7±0.2)。
由图6可知:SAC初始浓度升高,降解率和降解速率均逐渐降低。初始浓度为20、50和100 mg/L的SAC溶液,降解速率常数分别为0.078 2、0.023 1和0.010 5 min-1。在其他条件相同的情况下,SAC的浓度越高,降解生成更多中间产物,与SAC竞争·OH,使SAC降解速率下降[28]。

图6 SAC初始浓度对降解SAC的降解率和降解速率的影响Fig. 6 Effect of SAC initial concentration on SAC degradation efficiency and rate
2.3.4 溶液酸碱性对SAC降解的影响
UV/H2O2体系中,UV激发H2O2产生·OH,·OH降解SAC的过程的降解率受溶液酸碱性(pH值)的影响如图7所示。其中参数设置为:CSAC=20 mg/L,CH2O2=20.4 mg/L,JUV=1.46 mW/cm2,T=20 ℃。
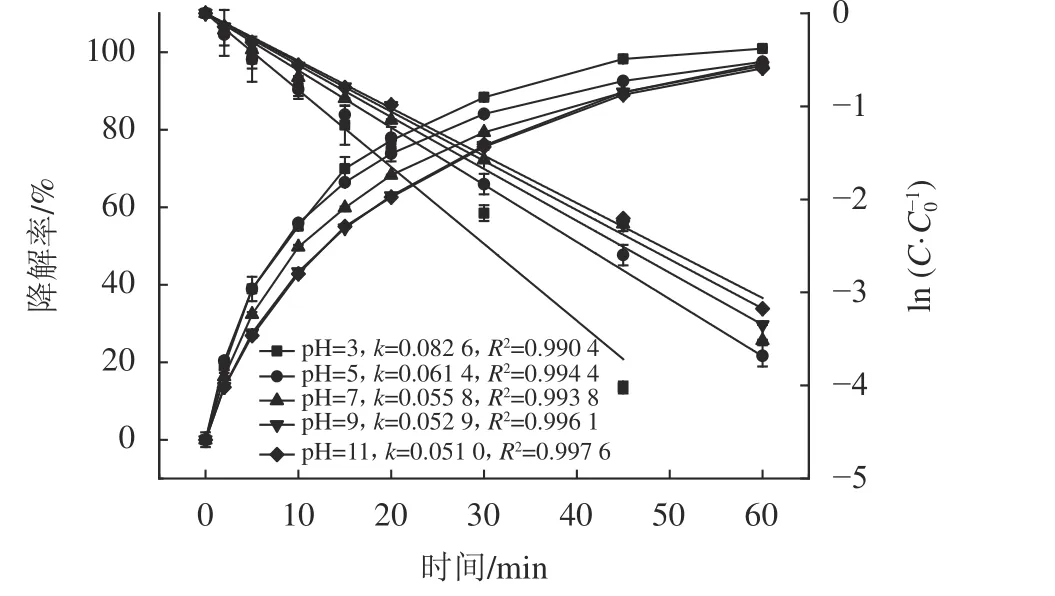
图7 pH值对降解SAC的降解率影响Fig. 7 Effect of pH values on SAC degradation efficiency
由图7可知,在不同的pH值条件下,UV/H2O2系统中SAC的降解反应遵循了拟一级反应动力学。酸碱性对UV/H2O2系统降解SAC影响较小,当pH值从3增加到11时,SAC的降解率和降解速率常数都随着pH值的增大而减小。H2O2在酸性和中性条件下更稳定,是因为H2O2电离受到抑制,分解较慢[29]。
2.3.5 水温对SAC降解的影响
不同水温对UV/H2O2氧化降解SAC的降解率和降解速率的影响如图8所示。其中参数设置为:CSAC=20 mg/L,CH2O2=20.4 mg/L,JUV=1.46 mW/cm2,pH值为(7±0.2)。

图8 水温对降解SAC的降解率和降解速率的影响Fig. 8 Effect of temperature on SAC degradation efficiency and rate
由图8可知,水温的升高有利于SAC的去除。随温度从10 ℃升至30 ℃,SAC降解率达到90.0%的接触时间从60 min降至30 min,降解速率常数随温度的提升而加快,从0.040 3 min-1增加至0.085 1 min-1。
化学反应速率常数对温度的依赖关系可根据阿伦尼乌斯公式得出,见式(2):

式中:T为反应温度;k为温度T时的反应速率常数;A为指前因子;Ea为活化能;R为理想气体通用常数,取R=8.314 J/(mol·K)。通过对lnk和1/T作图,可以求解出lnA=13.73,Ea=26.59 kJ/mol。温度对SAC降解的影响符合化学反应的阿伦尼乌斯定律中提高反应温度能降低反应活化能,从而促进反应速率提升。
2.3.6 共存阴离子对SAC降解的影响


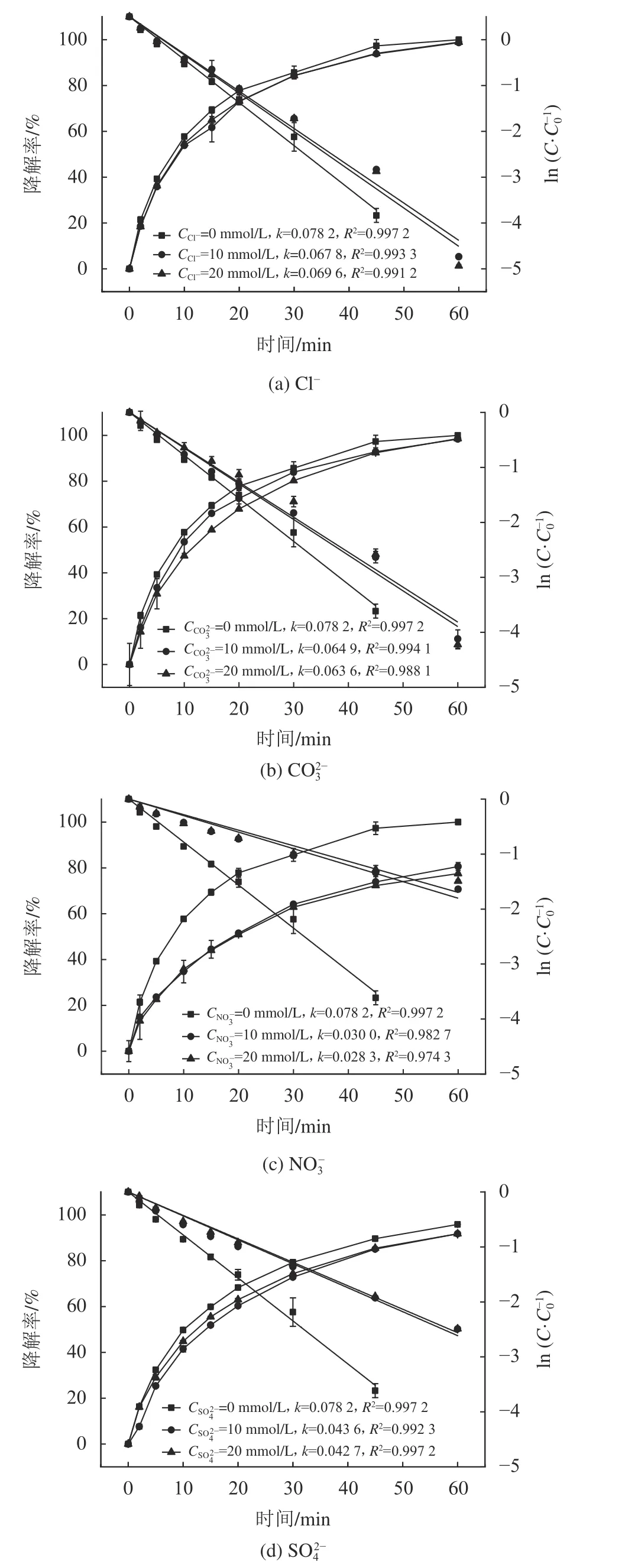
图9 4种阴离子对降解SAC的降解率的影响Fig. 9 Effect of four anions on SAC degradation efficiency

3 结 论
1)UV辐照、氯和UV/H2O2等氧化剂降解SAC的能力相对较弱,臭氧可有效降解SAC,但氧化剂用量大。UV/H2O2工艺表现出比臭氧更强的SAC降解能力,矿化程度更高,降解速率更快。
2)UV/H2O2工艺对SAC的降解过程符合一级动力学模型。H2O2投量、UV光强、SAC初始浓度、溶液pH值和水温均可对SAC的降解产生影响。初始H2O2的浓度越高,降解速率常数越大,但随着浓度的升高,对降解速率的影响越小,最佳投量约为20.4 mg/L;UV光强的增加能促进降解反应;初始SAC浓度、溶液pH值和水温与降解速率常数成负相关。水中常见共存阴离子可对UV/H2O2降解SAC产生影响,抑制作用顺序为 NO-3>SO24->CO23->Cl-。
3)由于现有检测方法的限制,SAC在UV/H2O2工艺处理后的中间产物种类的鉴别还存在一定的局限性,SAC的降解机理仍待进一步明确。UV/H2O2难以在生产中应用,水源水中SAC的高效、低碳去除仍需进一步探索。
