榴莲蜜实时荧光定量PCR内参基因的克隆与筛选
2022-10-12郭清云胡福初吴凤芝王祥和范鸿雁冯学杰
郭清云,胡福初,吴凤芝,王祥和,范鸿雁,冯学杰,陈 哲
(海南省农业科学院热带果树研究所/海南省热带果树生物学重点实验室/农业部海口热带果树科学观测实验站,海口,571100)
实时荧光定量PCR(RT-qPCR)是鉴定基因功能和分析分子机制的主要工具。然而,在基因转录水平研究中,模板cDNA 的质量和数量、RNA质量、cDNA合成效率、引物特异性和内参基因稳定性等因素都会影响RT-qPCR分析结果的准确性[1],其中以内参基因稳定性的影响最大。利用内参基因对目的基因表达量进行校准,是确保定量结果准确可信必不可少环节[2]。值得注意的是,由于试验品种、组织、发育时期及处理条件等因素不同,最佳的内参基因也会有所不同[3-5]。李露双等[6]研究发现,在屏边空竹不同组织器官(根、秆和叶)以及笋芽发育成笋的变化过程中,表达最稳定的基因均不相同。李永平等[7]在筛选黄秋葵内参基因时发现,6个候选内参基因在不同组织、各发育阶段及不同胁迫(低温、高温和干旱)下均有表达,但表达稳定性不尽相同。因此,有必要依据实验要求选择最适的内参基因。
榴莲蜜Artocarpusinteger(Thunb.)Merr.,属桑科木菠萝属热带特色果树,我国主要在南方种植[8],目前海南省实现了规模化种植。榴莲蜜果肉柔软芬芳,营养丰富,素有“水果皇后”之美誉[9]。国内外关于榴莲蜜的研究尚处于起步阶段,主要集中于引种试种[8]、品种选育[10]、快繁技术[11]、栽培管理[9,12]、果实品质和风味[13]、以及功能性成分[14]等基础性研究上,随着国内外对榴莲蜜研究的不断关注,基因表达相关等分子生物学研究会逐渐成为重点内容。至今鲜见关于菠萝蜜属植物内参基因评价的研究。汪永保等[15]研究了5个内参基因在菠萝蜜各个组织不同发育阶段的表达情况,分别在果实、嫩叶和花序中找到表达最稳定的内参组合。筛选榴莲蜜内参基因对丰富其内参基因及解析相关基因功能研究具有重要意义。我们根据获得的榴莲蜜转录组数据(未发表),筛选并克隆获得Actin1等5个传统内参基因,以“多异1号”榴莲蜜不同组织及不同发育时期果苞为材料,利用4种主流软件(GeNorm、NormFinder、BestKeeper和RefFinder)评价5个内参基因稳定性,并验证内参基因的稳定性,旨在筛选适用于榴莲蜜不同组织和不同发育时期果苞稳定表达的内参基因,为进一步研究榴莲蜜基因表达调控分子机制提供参考。
1 材料与方法
1.1 材料
“多异1号”榴莲蜜种植于海南省农业科学院永发果树科研创新基地榴莲蜜种质资源圃内,东经109°5′~110°15′,北纬19°23′~20°01′。选择树龄相同、长势相当的3株树,每株树分别采集花序、嫩叶和茎组织,以及3个发育阶段果实,即幼果(花后40 d)、小果(花后80 d)和大果(花后120 d)果肉,样品采集后于-80 ℃保存备用。
1.2 方法
1.2.1 总RNA提取和cDNA合成 采用植物RNA提取试剂盒(北京华越洋生物科技有限公司产)提取样品总RNA,用核酸蛋白仪检测总RNA纯度,1%琼脂糖凝胶电泳检测RNA降解程度。参照MonAmpTM2×Taq Mix(+Dye)试剂盒(莫纳生物科技有限公司产)说明书,每个样品取总RNA 600 ng进行逆转录试验,合成cDNA第一链。
1.2.2 引物设计 选取拟南芥常用的5个内参基因,即Actin,AT3G46520;GAPDH,AT1G13440;α-TUB,AT5G19770;β-TUB,AT5G23860;UBQ,AT1G55060,利用本地BLAST在榴莲蜜转录组数据中筛选比对出候选榴莲蜜内参基因序列10个,分别命名为Actin1、Actin2、GAPDH1、GAPDH2、α-TUB1、α-TUB2、β-TUB1、β-TUB2、UBQ1和UBQ2。利用Oligo 7软件分别设计各个内参基因的克隆引物(见表1),以合成的cDNA第一链为模板,采用Phanta Max Supper-Fidelity DNA Polymerase高保真酶(南京诺唯赞生物科技股份有限公司产)进行常规PCR扩增,产物经纯化、回收后连接至pTOPO-Blunt平末端克隆载体,转化DH5α感受态细胞(上海唯地生物技术有限公司产),经筛选阳性克隆后送天一辉远生物科技有限公司(广州)测序。参照RT-qPCR 引物设计原则,根据克隆获得内参基因序列,利用Oligo 7软件设计qPCR反应引物(见表2),并委托天一辉远生物科技有限公司(广州)合成。

表1 榴莲蜜内参基因的克隆引物
1.2.3 半定量PCR 使用MonAmpTM2×Taq Mix(+Dye),于PCR仪(型号BIO-RAD T100tm)进行反应。配制20 μL反应体系,其中,MonAmpTM2×Taq Mix(+Dye)10 μL,cDNA 0.5 μL,上下游引物各0.5 μL(10 μmol/L),ddH2O 8.5 μL。反应程序为94 ℃ 3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,32个循环;72 ℃ 5 min;保存于4 ℃。取PCR产物5 μL进行凝胶电泳检查。
1.2.4 RT-qPCR分析及引物扩增效率 配制10 μL反应体系:2 ×Phanta Mix Master Mix 5 μL,cDNA 1 μL(稀释2倍),上下游引物各0.5 μL(10 μmol/L),ddH2O 3 μL,每个反应设置3次重复。在荧光定量PCR仪(型号LightCycler 480 Ⅱ)上设置反应程序:95 ℃ 5 min;95 ℃ 15 s,56 ℃ 15 s,72 ℃ 35 s,40个循环;之后进行65~97 ℃熔解曲线分析。每个样品设置3个重复,取等量样品的cDNA模板混合,然后按1∶10梯度稀释为6个浓度后进行RT-qPCR反应。根据Ct值建立线性回归方程,最后求得扩增效率E(E=10-1/K-1,K为斜率)。
1.2.5 数据处理与分析 利用geNorm[16]、NormFinder[17]和BestKeeper[18]评价5个内参基因的表达稳定性,最后通过RefFinder[19]在线工具(https://heartcure.com.au/reffinder/)综合评价内参基因的稳定性。
2 结果与分析
2.1 总RNA提取
由图1可知,提取的总RNA条带清晰,28s RNA的亮度约为18s RNA亮度的2倍,所有待测样品RNA浓度70~870 ng/μL,A260/A280值在1.8~2.0之间,A260/A230均大于2.0。说明提取的RNA无明显降解,且纯度较高。

注:M为DL2000 DNA Maker,1~3为花序,4~6为嫩叶,7~9为茎,10~12为幼果,13~15为小果,16~18为大果。
2.2 内参基因RT-qPCR引物评价
从10个内参同源基因(Actin1、Actin2、α-TUB1、α-TUB2、β-TUB1、β-TUB2、GAPDH1、GAPDH2、UBQ1和UBQ2)中成功克隆出5个内参基因,分别为Actin1、α-TUB1、β-TUB1、β-TUB2和GAPDH1。测序验证表明,克隆的5个内参基因片段均与榴莲蜜转录组序列高度同源,5对引物的扩增效率介于94.1%~119.0%,R2值介于0.993 0~0.998 9。以榴莲蜜花序cDNA为模板,对克隆出的内参基因进行半定量PCR扩增。电泳结果显示,产物只有单一的条带,且条带大小与目标片段一致,长度138~186 bp(见图2和表2)。另外5个内参基因引物的RT-qPCR 熔解曲线均为单一信号峰(见图3和图4)。表明本研究所用的定量引物的特异性良好。
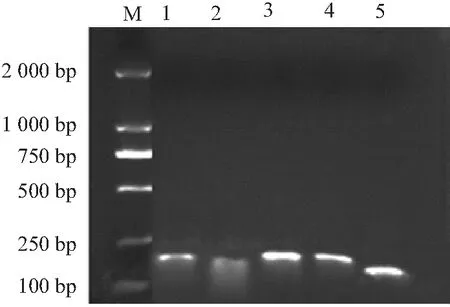
注:M为DL2000 DNA Maker,1~5分别为GAPDH1、α-TUB1、β-TUB2、Actin1、β-TUB1。

表2 榴莲蜜定量引物信息、扩增效率及相关系数

图3 榴莲蜜4个内参基因的熔解曲线

图4 榴莲蜜1个内参基因的熔解曲线
2.3 内参基因转录水平分析
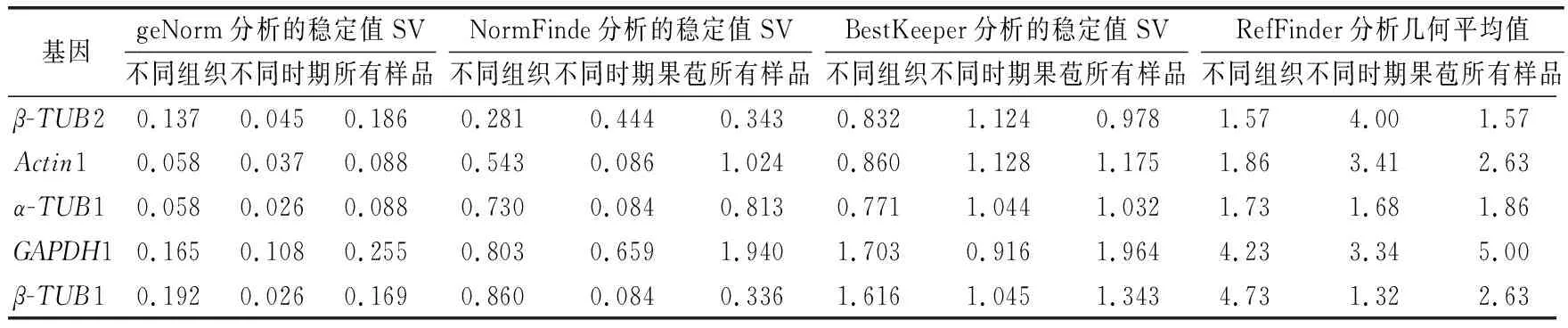
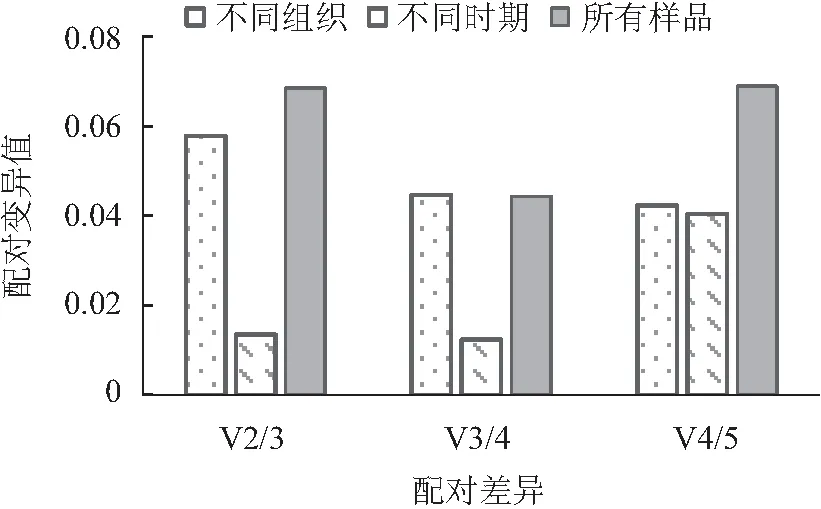
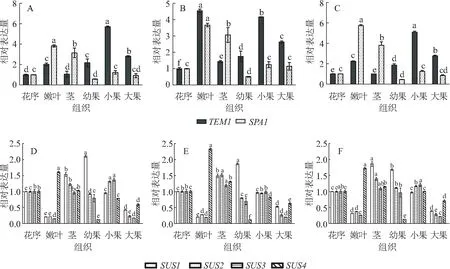
由表3可知,5个内参基因在不同组织中的平均Ct值在23.64~27.92之间,波动范围较大。同一组织中5个内参基因的Ct值存在显著性差异,说明所选择的内参基因在不同组织中表达水平不同。Ct值与基因的表达丰度成反比,因此,GAPDH1的Ct值21.00~26.54,较低,表达量最高;而Actin1的Ct值26.16~29.8,较高,其表达量最低,显著低于其他内参基因。5个内参基因的变异系数从低到高依次为β-TUB2<α-TUB1 表3 榴莲蜜不同组织内参基因表达情况 由表4可知,运用geNorm分析,所有样品中Actin1和α-TUB1的表达最稳定,GAPDH1的稳定性最差。不同组织(花序、茎和嫩叶)中,同样也是Actin1和α-TUB1的表达最稳定,而β-TUB1的稳定性最差。由于Actin1在所有组织中的表达量均最低,说明Actin1作为内参基因不可行。在果苞发育的不同时期,α-TUB1和β-TUB1的表达最稳定,GAPDH1的稳定性最差。由图5可看出,在不同组织、果苞发育不同时期中,V2/V3、V3/V4 和V4/V5值均低于默认值0.15,表明选用2个内参基因即可使试验结果准确可靠,无需引入其他内参基因。 表4 不同软件分析的榴莲蜜内参基因表达稳定性和RefFinder进行综合比较 图5 基于geNorm的内参基因稳定性分析及配对差异分析 运用NormFinde软件分析,所有样品中,β-TUB1和β-TUB2的稳定性较好,GAPDH1的稳定性最差;不同组织中,β-TUB2的稳定性最好,β-TUB1的稳定最差;在果苞不同发育时期,α-TUB1和β-TUB1的稳定性较好,GAPDH1的稳定性最差。 运用BestKeeper软件分析,α-TUB1和β-TUB2在所有样品及不同组织中稳定性均较好,GAPDH1的稳定性最差。然而,果苞发育不同时期中GAPDH1稳定性最好。 由于geNorm、NormFinde和BestKeeper分析得出的基因稳定性不同,所以采用RefFinder对这3种软件结果进行综合排名看出,在不同组织中,β-TUB2和α-TUB1排前,稳定性较好;在果苞不同发育时期,β-TUB1和α-TUB1的稳定性较好;所有样品中,β-TUB2和α-TUB1的稳定性较好。 综合来看,α-TUB1在榴莲蜜不同组织中均较稳定,在榴莲蜜果苞发育过程中,可选择β-TUB1和α-TUB1作共同内参基因。 以稳定性较好的α-TUB1、α-TUB1+β-TUB1及α-TUB1+β-TUB2分别作为内参基因,分析成花基因(TEM1和SPA1)以及蔗糖合成酶基因(SUS1、SUS2、SUS3和SUS4)分别在不同样本中的表达情况。由图5可知,2个成花基因和4个SUS基因各自在不同内参基因标定下的表达趋势基本一致。以α-TUB1和α-TUB1+β-TUB2作内参基因,TEM1在嫩叶和茎中的相对表达量最低,在果苞发育阶段最高,而SPA1的表达模式正好与之相反。这与TEM1及SPA1分别在开花时间调控位点的作用基本吻合。在α-TUB1+β-TUB1标定下,嫩叶中TEM1的相对表达量显著上调,而果苞发育阶段中TEM1的相对表达量变化规律与以α-TUB1以及α-TUB1+β-TUB2标定下的相似,这种差异与RifFinder综合评价结果相符,说明α-TUB1+β-TUB1更适合在果苞阶段作为内参基因。SUS1、SUS2和SUS3表达量均在嫩叶中显著下调。与其余3个SUS不同,SUS4在嫩叶中的表达量较高。另外,随着果苞发育成熟,SUS4的表达量逐渐降低,而SUS1、SUS2和SUS3呈先增加后降低的趋势。这说明4个SUS基因的表达部位与表达时间存在差异。 注:A和D以α-TUB1为内参基因,B和E以α-TUB1+β-TUB1为内参基因,C和F以α-TUB1+β-TUB2为内参基因。不同小写字母表示显著差异(p<0.05)。 因此α-TUB1和α-TUB1+β-TUB2可作为榴莲蜜不同组织中的内参基因进行功能基因表达研究;而仅对果苞功能基因进行表达研究时,可选择α-TUB1、α-TUB1+β-TUB1或α-TUB1+β-TUB2作为内参基因。 本研究克隆获得榴莲蜜Actin1、α-TUB1、β-TUB1、β-TUB2和GAPDH1基因,分析了这5个候选内参基因在榴莲蜜不同组织中的表达稳定性,结合4个软件的分析结果及内参基因稳定性验证,发现β-TUB2和α-TUB1是所有测试样本中及不同组织中(花序、茎和嫩叶)表达最稳定的基因,β-TUB1和α-TUB1在榴莲蜜果苞发育过程中表达最稳定。这为开展榴莲蜜基因表达分析提供了参考和依据。 基因表达是鉴定基因功能和分析分子机制的重要手段。RT-qPCR是一种精确、稳定、灵敏的基因表达检测技术。合适的内参基因是RT-qPCR准确分析基因表达模式的重要前提。不同品种、同品种不同组织及不同胁迫作用下同组织,适合的内参基因会有所不同。3个不同类型桃品种中,ACTIN是“Hakuho”(果肉溶质型))品种最稳定的内参基因,UBC是“Fantasia”和“NJC108”(果肉不溶质型)品种最稳定的内参基因,而EF-1α是“霞脆”(硬肉型)品种最稳定的内参基因[20]。Actin是火龙果不同组织和果实发育阶段表达最稳定的基因[21]。莲雾果肉和果皮中表达稳定的分别是ACT-7和α-TUB基因[22]。高温和盐胁迫处理的砀山酥梨叶片中表达稳定的是UBQ,而低温胁迫处理的叶片中表达稳定的是TUB和WDP[23]。本研究也发现,榴莲蜜组织类型及果苞发育阶段显著影响5个候选内参基因的转录水平。其中,α-TUB1在花序中的转录水平最高,β-TUB1在花序和幼果中的转录水平较高,GAPDH1则在果苞中的转录水平较高。因此需针对特定物种、试验环境的需求开发并筛选出最适的内参基因[24-25]。多项研究表明,将转录组测序结果与定量分析相结合可以快速筛选到合适的内参基因[7,26-27]。杨丹等[19]发现,根据材料自身转录组基因序列设计的引物特异性更好。Santos等[28]研究发现,在拟南芥Arabidopsisthaliana中,大多数通过转录组数据筛选的自定义内参基因比传统内参基因表达更稳定。本研究通过榴莲蜜转录组数据,克隆获得榴莲蜜5个候选内参基因Actin1、α-TUB1、β-TUB1、β-TUB2和GAPDH1,并对其表达稳定性进行评价。 目前geNorm、NormFinder及BestKeeper软件是评估内参基因稳定性最常用的软件[29-31]。由于这3种软件的统计学原理和算法不同,最终的分析结果可能会存在差异。本研究发现,利用这3种软件分析得到的内参基因稳定性结果不完全一致,前人研究也有类似现象[22,32-33]。因此,为筛选最适的内参基因,提高结果可信度,利用RifFinder软件进行综合分析和排名。结果表明,在榴莲蜜花序、茎和嫩叶中,最稳定的内参基因为β-TUB2和α-TUB1,另外β-TUB1和α-TUB1在榴莲蜜果苞发育过程中最稳定。α-TUB和β-TUB作为细胞器骨架的基本组分,对维持生物体生命活动有重要作用[34]。有研究报道,β-TUB在琯溪蜜柚不同组织和果实发育不同时期表达最稳定[35],珙桐的根、茎、叶中稳定表达的是β-TUB[33]。这与本研究结果相似。但并非所有同源基因表达模式相似。本研究中,β-TUB1和β-TUB2为榴莲蜜的2个同源基因,在不同组织中β-TUB2的综合排名首位,表达最稳定,而β-TUB1的稳定性最差;果苞发育过程中,β-TUB1和β-TUB2的综合排名与之相反。这说明即使同一组织中,内参基因虽互为同源基因,但它们的表达稳定性也会有显著差异。 榴莲蜜作为一种新兴热带果树,国内外相关研究刚刚起步。糖信号和成花相关基因一直是研究热点,而榴莲蜜这一方面的研究鲜见报道。因此本研究选择了成花基因和蔗糖合成酶基因作为验证基因,初步分析其在不同组织中的表达模式,也可为今后相关分子机理研究打下基础。TEM1是开花抑制因子,能结合成花素FT启动子抑制其表达,而且还可以抑制GA合成酶基因GA3OX1和GA3OX2的表达,从而抑制 GA依赖的开花路径[36]。TEM1在花序和茎中的相对表达量最低,在果苞发育阶段最高,推测源于茎中及花序自身积累的TEM1表达量减少,有助于榴莲蜜开花。SPA1参与隐花色素对去黄化作用的调控,可激活下游成花起始转录调控子CO的表达,进而激活FT的表达,促进开花[37-38]。4个SUS在参与调控蔗糖分配过程中发挥不同功能,具有发育和组织特异性。SUS1、SUS2和SUS3在花序、茎、幼果及小果果苞中表达较高,SUS4在花序、嫩叶和茎中表达较高。由于蔗糖合成酶催化蔗糖转化为果糖和尿苷二磷酸葡萄糖是一个可逆反应,因此明确不同SUS的作用还需将其与不同组织和果苞发育过程中糖分积累变化规律结合分析。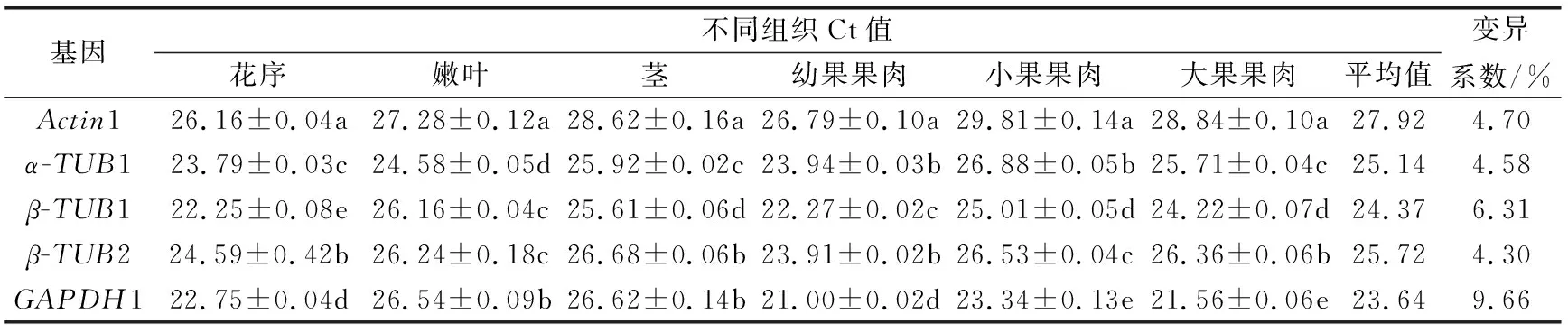
2.4 内参基因稳定性评价
2.5 内参基因稳定性验证
3 结论与讨论
