滇牡丹MYB家族成员鉴定及PdMYB2的功能验证
2022-10-12邹红竹韩璐璐吕纪杭贾莹华
邹红竹,韩璐璐,周 琳,吕纪杭,贾莹华,王 雁
(中国林业科学研究院林业研究所,国家林业和草原局林木培育重点实验室,北京 10009)
花色是牡丹(Paeonia suffruticosaAndr.)最重要的观赏性状,中国传统品种的牡丹花色多为白色、紫红色、粉色等颜色,黄色系的牡丹品种稀少。滇牡丹(Paeonia delavayiFranch.)是芍药科(Paeoniaceae)芍药属(Paeonia)牡丹组(Section Moutan DC.)肉质花盘亚组(Delavayanae)的落叶亚灌木。滇牡丹中的黄色花类群是十分重要的育种资源,法国和美国的育种专家用中国滇牡丹中的黄花类群开展远缘杂交,育出了当前流行的“金阁”、“金晃”、“海黄”等黄色花品种[1]。滇牡丹花色纯黄,但花朵较小,单瓣,花头下垂,在中原地区引种极难成功;中原牡丹与滇牡丹属于不同亚组,杂交有一定难度,目前杂交育出的黄色品种较少,且花头下垂[2]。迄今为止,传统的杂交育种手段未能高效地培育出人们理想中的色彩明亮纯正的黄色牡丹品种。了解滇牡丹黄色产生的分子机制对定向育种十分重要。
周琳等对滇牡丹黄色花的色素组成进行分析,认为主要为查尔酮苷/黄酮苷和黄酮醇苷的混合物,包括查尔酮苷类中的异杞柳苷及山奈酚苷、槲皮素苷、异鼠李素苷、金圣草黄素苷和芹菜素苷等[3]。类黄酮的生物合成始于1分子的4-香豆酰-辅酶A(coumaroyl-CoA)和3分子的丙二酰-辅酶A(malonyl-CoA)被查尔酮合成酶(chalcone synthase,CHS)催化形成四羟基查尔酮(2′,4′,6′,4-tetrahyroxychalcone,THC),为类黄酮合成提供了基本碳骨架。THC作为重要的中间产物在不同酶的催化下进入不同的代谢途径,生成不同的物质。THC在查尔酮2′葡糖基转移酶(chalcone 2′-glucosyltransferases,THC2’GT)的作用下生成在液泡中稳定存在的异杞柳苷(isosalipurposide,ISP,黄色),这也是黄色花牡丹中的重要显色物质。THC在查尔酮异构酶(chalcone isomerase,CHI)的作用下生成柚皮素(naringenin,黄色),是花青素、黄酮及黄酮醇生物合成的前体物质。柚皮素由黄烷酮3-羟基化酶(flavanone 3-hydroxylase,F3H)催化生成各类花青素苷的必要前体物质二氢山萘酚(dihydrokaempferol,DHK),再由黄酮醇合成酶(flavonol synthase,FLS)催化合成山奈酚(kaempferol,浅黄色)和槲皮素(quercetin,浅黄色)[4-9]。
通过对拟南芥(Arabidopsis thaliana(L.)Heynh.)、金鱼草(Antirrhinum majusL.)、玉米(Zea maysL.)、矮牵牛(Petunia hybrida(J.D. Hooker) Vilmorin)等模式植物类黄酮生物合成途径的深入研究发现,类黄酮合成途径的分子调控网络主要由结构基因(structural genes)和调节基因(regulatory genes)共同调控完成[10-12]。其中,MYB转录因子家族是植物中最大的转录因子家族[13]。MYB转录因子在N端都有一段保守的MYB结构域,是DNA的结合区(DNA-binding domain)。MYB转录因子的C端有一个转录激活区(transcription activation domain),通过折叠成双亲性的螺旋结构从而激活转录[14-15]。根据MYB转录因子N端R结构(R1、R2、R3)的个数,可以将MYB转录因子大致分为R1/R2-MYB、R2R3-MYB、R1R2R3-MYB三个亚类,其中R2R3-MYB是植物中数目最多的一类,它们主要参与细胞分化、激素应答、次生代谢、环境胁迫以及抵御病虫害,而且能够调控植物花青素的生物合成[16]。
调控类黄酮合成途径的MYB基因已从多种植物中分离出来,并对它们的功能进行了广泛研究。Kobayashi等从四倍体巨峰葡萄(Vitis labruscanaKyoho)中分离出MybA基因,通过调控UFGT基因参与葡萄花青素苷合成的调控[17]。Espley等从苹果(Malus×domesticaBorkh)中分离出MdMYB10基因,它在同源和异源系统中都能诱导花青素的积累,而且与MdbHLH3和MdbHLH33这2个bHLH蛋白共表达[18]。Chiou等发现,文心兰(Oncidiumspp.)OgMYB1可以激活黄色唇瓣中的OgCHI和OgDFR的转录而诱导花青素的形成[19]。Feng等在亚洲梨品种(Pyrus pyrifoliacv.‘Aoguan’)中分离到1个R2R3-MYB转录因子基因PyMYB10,证实在其成熟果实中,果皮中PyMYB10的转录量与花青素合成途径中的PyCHS、PyCHI、PyF3H等基因以及花青素的合成量呈正相关[20]。Yamagishi等从亚洲百合(Lilium‘Montreux’)中分离出2个R2R3-MYB转录因子LhMYB6和LhMYB12,对其花青素合成具有正调节作用,并决定了花青素在特定器官和组织中积累[21]。Tian等研究发现,红叶海棠(Malus‘Flame’)中的McMYB10通过对海棠中McF3'H的正调控在海棠红叶着色中起着重要作用[22]。Tuan等研究证明,桃(Prunus persicaL.)中的PpMYB10.1是红皮桃花青素积累的主要调节因子,并具有活化作用[23]。Shi等从茄子(Solanum melongenaL.)中分离出1个R2R3-MYB,命名为SmMYB75,过表达SmMYB75后发现,导致花青素积累量增加,愈伤组织颜色由青变紫[24]。MYB转录因子也并非都是激活子,也有一部分MYB转录因子起负调控作用。Colanero等从番茄(Solanum lycopersicumL.)中获得了1个R3-MYB蛋白的突变基因,当其过度表达时,这种蛋白通过负面干扰由内源性MBW复合物介导的花青素生物合成途径的激活,抑制了番茄幼苗和植株中的花青素生成[25]。Gates等从悬铃果属(Iochromaspp.)中发现1个新的R3-MYB转录因子等位基因与花色变异密切相关,命名为MYBL1,是一种MYB的转录抑制因子,该基因的高表达与花青素代谢途径上F3′5′H、DFR、ANS基因下调有关[26]。Deng等在香蕉(Musaspp.)中发现1个R2R3-MYB转录因子MaMYB4,可以跟CHS、ANS、DFR、bHLH的启动子结合,从而抑制它们的表达,使花青素的积累量变少[27]。
MYB转录因子在滇牡丹类黄酮生物合成途径中的作用未曾被报道过,本研究基于滇牡丹花瓣的转录组数据,对滇牡丹MYB家族进行了成员鉴定及分类。在分类得到的MYB转录因子中,依据系统进化树、同源序列比对、基因差异表达筛选到1个R2R3 MYB转录因子PdMYB2可能在类黄酮生物合成途径中发挥了重要作用。本研究利用亚细胞定位、实时荧光定量PCR、瞬时过表达、转基因烟草及液相色谱串联质谱等方法对其进行了功能验证,为进一步深入分析PdMYB2的功能和调控机制奠定了基础,并为牡丹花色分子育种提供了候选基因。
1 材料与方法
1.1 实验材料
本研究以滇牡丹纯黄色花为实验材料,所用材料均采集于云南省迪庆藏族自治州香格里拉县(29°58′7″ N,99°34′60″ E,海拔3400 m),根据牡丹生长发育年周期的划分,结合滇牡丹花蕾发育和花朵着色实际情况,采集花朵开放的4个进程:S1,硬蕾期(未着色紧实花朵);S2,透色期(轻微着色,花蕾蓬松);S3,初开期(花朵初开,花朵完全变黄);S4,盛开期(花朵盛开,花药完全外露)(图1)。采集时间为2019年5月,采集同一株滇牡丹上的4个时期的花朵,采集3株不同植株作为生物学重复,采集后将每朵花按花器官用锡箔纸包好,液氮速冻,保存于-80 ℃冰箱中。

图1 滇牡丹花朵开放的4个阶段Fig. 1 Four periods of blooming of Paeonia delavayi flowers
1.2 试验方法
1.2.1 滇牡丹MYB转录因子家族成员的鉴定和分析 根据滇牡丹花瓣转录组数据库(NCBI ID:PRJNA772706)的基因注释信息,分离出所有MYB Isoforms,使用NCBI开放阅读框工具ORFfinder获取所有基因的CDS区,运用EMBL-EBI在线工具Pfam(http://pfam.xfam.org/search/sequence)对全部MYB Isoforms的蛋白结构域进行检索,去除结构域完整度低于30%的序列,将剩余MYB转录因子根据相邻不完全重复区域数目对MYB转录因子进行分类,分为R1R2R3-MYB、R2R3-MYB、R1-MYB、4R-MYB及MYB-related,并使用MUSCLE(http://www.ebi.ac.uk/Tools/msa/muscl e/)在线网站对它们进行多序列比对。从拟南芥数据库在线网站TAIR(https://www.arabidopsis.org/index.jsp)下载拟南芥R2R3-MYB转录因子家族数据,运用Mega7.0软件,将滇牡丹R2R3-MYB与拟南芥R2R3-MYB进行系统发育分析。通过跟拟南芥MYB家族的聚类,预测滇牡丹中与类黄酮生物合成途径有关的MYB转录因子,并结合转录组差异表达热图,聚焦到可能参与类黄酮生物合成的PdMYB2转录因子上,对其进行进一步的分析和验证。
1.2.2 滇牡丹PdMYB2转录因子的克隆及序列分析 通过对前期构建的滇牡丹花瓣全长转录组数据库序列注释信息进行检索,获得滇牡丹PdMYB2(Isoform0011606)序列,使用NCBI开放阅读框工具ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)获取该基因的CDS区。使用Primer3web(https://primer3.ut.ee/)在线引物设计软件进行引物设计。克隆引物见表1。用艾德莱植物RNA快速提取试剂盒(货号:RN38)根据说明书提取RNA,用TaKaRa高保真酶(货号:R010A)克隆基因。利用生物信息学分析软件和工具对PdMYB2基因编码蛋白的理化性质和结构功能进行预测,为对PdMYB2基因的进一步研究和应用提供参考。利用ExPasy中的Prot-Param工具对PdMYB2基因编码蛋白的基本理化性质进行了分析。利用在线工具Swiss-model预测PdMYB2蛋白的三维结构。利用在线工具NetPhos(http://www.cbs.dtu.dk/services/NetPhos/)预测PdMYB2的磷酸化位点。
1.2.3 实时荧光定量PCR分析 对滇牡丹PdMYB2
基因在滇牡丹花瓣开放的S1~S4时期进行实时荧光定量PCR分析。在将PdMYB2转烟草后,对该转录因子基因在烟草的花、叶、茎中表达量进行实时荧光定量PCR分析。对转基因烟草NtCHS、NtCHI的表达量进行实时荧光定量PCR分析。实时荧光定量PCR的产物见表1。使用TaKaRa TB Green®PremixEx TaqTM(货号:RR420A)按照说明书实验,使用2-△△Ct计算表达量。滇牡丹内参基因为PsPP2A,烟草内参基因为NtCP。

表1 引物Table 1 Primers
1.2.4 亚细胞定位分析 将PdMYB2基因去除终止密码子后的编码区构建到PHB-GFP载体上,引物见表1。使用热击法将构建好的载体质粒转化到农杆菌GV3101菌株中。挑取鉴定为阳性的菌落,放入5 mL卡那霉素浓度为50 μg·mL-1、利福平浓度为20 μg·mL-1的LB液体培养基中,震荡培养12 h左右后,取其中1 mL新鲜菌液,加入100 mL卡那霉素浓度为50 μg·mL-1、利福平浓度为20 μg·mL-1的LB液体培养基中,继续震荡培养6~8 h,震荡培养6 h后开始0.5 h检测菌液OD600值,菌液OD600值为0.6~0.7时停止摇菌。将菌液分装至无酶无菌的50 mL离心管中,5000 rpm、10 min离心收菌。在超净工作台内倒掉上清液,尽量将上清液去除干净。用亚细胞定位侵染液重悬菌体,使侵染液的OD600值为0.75。在黑暗中静置悬菌液3 h,按1:1比例混合含有载体质粒的侵染液和空mCherry侵染液,使用1 mL无菌注射器注射4~6叶期的烟草叶片,注射完成后暗培养12 h后,转移至光下,进行12 h光照12 h黑暗交替培养2.5 d。2.5 d后将注射过的烟草叶片剪下,剪成0.5 mm × 0.5 mm大小,用0.1 μg·mL-1DAPI染色1~5 min后,用激光共聚焦扫描显微镜(卡尔蔡司光学(中国)有限公司,型号:Zeiss LSM510 Meta)观察烟草细胞的GFP和DAPI荧光表达情况。
1.2.5 叶盘法转烟草 将PdMYB2基因的CDS区构建到pCAMBIA1302载体上,引物见表1,使用热激法将构建好的PdMYB2-pCAMBIA1302载体质粒转化到EHA105农杆菌菌株感受态中。经过菌落PCR的鉴定,挑取鉴定为阳性的菌落,如1.2.4中方法培养菌液,当菌液OD600值为0.2~0.5时停止摇菌,将菌液分装至无酶无菌的50 mL离心管中,5000 rpm、10 min离心收菌。在超净工作台内倒掉上清液,尽量将上清液去除干净。使用1/2MS液体培养基重悬菌块,使重悬液OD600值在0.5~0.8之间侵染烟草。取生长健壮的烟草组培苗叶片,修剪掉叶脉和边缘后,剪成0.5 mm × 0.5 mm大小,将剪好的叶片一部分浸入侵染液,一部分浸入1/2MS液体培养中作为空白对照,不断晃动,使叶片与菌液充分接触。3~5 min后取出烟草叶片,在灭菌滤纸上吸干多余的菌液,烟草正面朝上,平铺于共培养分化培养基(MS + 0.5 mg·L-16-BA + 0.05 mg·L-1NAA + 100 μmol·L-1AS + 琼脂,调节pH = 5.8)中,封口膜封口,暗培养72 h。暗培养后,将叶片用无菌水清洗3次,再用含200 mg·L-1特美汀的无菌水清洗3次,转接于分化筛选培养基(MS +0.5 mg·L-16-BA + 0.05 mg·L-1NAA + 20 mg·L-1潮霉素B + 200 mg·L-1特美汀 + 琼脂,调节pH =5.8)上,封口膜封口,置于光照培养箱中16 h光照8 h黑暗培养。每2周更换1次培养基,待烟草小苗长至2 cm左右,即可切下小苗,转接于生根培养基(MS + 0.1 mg·L-1NAA + 20 μg·L-1潮霉素B + 200 mg·L-1特美汀 + 琼脂,调节pH = 5.8)上培养,继代2次后,能正常生根的即为阳性苗。小苗根生长至2 cm左右时,将小苗从组培瓶内移出,培养箱内缓苗2 d后即可将苗移至温室培养。
1.2.6 液相色谱分析花瓣中的色素变化 转基因烟草开花后,观测烟草花色表型的变化,并采集烟草花瓣部分,液氮速冻,存于-80 ℃冰箱中,使用液质联用分析系统(LC-MS/MS)的方法对花青素代谢物进行绝对定量检测。实验方法参照文献[28-31]。
将采集的烟草花瓣真空冷冻干燥,用研磨仪30 Hz研磨90 s,至样品变为粉末状,称取50 mg的花瓣粉末,溶解于50 μL的提取液中(提取液为含0.1%盐酸的50%甲醇水溶液)。溶解后,涡旋震荡5 min,超声清洗仪波处理5 min,高速离心机12000 rpm低温4 ℃离心3 min,吸取上清液后,重复操作1次。将2次获得的上清液合为一管,用0.22 μm孔径的微孔滤膜进行过滤,保存于进样瓶中,用于LC-MS/MS分析。
液相条件主要包括:(1)色谱柱:ACQUITY BEH C181.7 μm,2.1 mm × 100 mm;(2)流动相:A相为超纯水(加入0.1%的甲酸),B相为甲醇(加入0.1%的甲酸);(3)洗脱梯度:0.00 min B相比例为5%,6.00 min增至50%,12.00 min增至95%,保持 2 min,14 min降至5%,并平衡2 min;(4)流速0.35 mL·min-1;柱温40 ℃;进样量2 μL。
质谱条件主要包括:电喷雾离子源( ESI)温度550 ℃,正离子模式下质谱电压 5500 V,气帘气(CUR)35 psi。在Q-Trap 6500 + 中,每个离子对是根据优化的去簇电压(DP) 和碰撞能(CE)进行扫描检测。
将检测到的样本的积分峰面积代入标准曲线线性方程进行计算,最终得到实际样本中该物质的含量数据。计算公式为:样本中代谢物的含量(μg·g-1)=C×V×(1000000×m)-1(式中,C:样本中积分峰面积代入标准曲线得到的浓度值(ng·mL-1);V:提取时所用溶液的体积(μL);m:称取的样本质量(g))。
该实验交由武汉迈特维尔生物科技有限公司(https://www.metware.cn/)完成。
2 结果与分析
2.1 滇牡丹MYB基因家族成员的预测
本研究通过转录组注释,共获得93个MYB转录因子,删除重复序列后,在Pfam在线蛋白结构域分析网站上进行结构域检索,去除结构域完整度低于30%的序列后,最终共获得64个MYB基因家族成员。对这些家族成员进行不完全重复结构域数目统计,分为4个亚类,其中,R2R3-MYB成员有25个,R1R2R3-MYB有1个,4R-MYB有2个,MYB-related有36个。为研究它们之间的系统进化关系,使用MEGA7.0构建NJ树(Neighbor-Joining)。图2表明:在滇牡丹纯黄色花中,4种类型的MYB蛋白在进化树中划分较清楚,同一类型的MYB转录因子基本聚在相同的分支,这说明MYB转录因子家族在系统进化上具有保守性。

图2 滇牡丹 MYB 基因家族进化树分析Fig. 2 Neighbor-Joining tree of MYBs in P. delavayi
2.2 滇牡丹R2R3-MYB基因家族的系统发育分析及功能预测
R2R3-MYB转录因子是MYB家族在植物中数目最多的一类,不仅调控植物的次生代谢、细胞分化、激素应答等过程,而且能调控花青素的生物合成。对滇牡丹中所有R2R3-MYB转录因子进行碱基数量、氨基酸数量、R2及R3结构域在氨基酸序列中的位置、分子量、亲水性及等电点的统计(表2),以进行后续研究。

表2 R2R3 MYB理化性质统计Table 2 Statistics of physical and chemical properties of R2R3 MYB
为进一步研究滇牡丹R2R3-MYB转录因子的功能,从拟南芥TAIR网站下载拟南芥R2R3-MYB蛋白,将筛选出的25个滇牡丹R2R3-MYB与拟南芥R2R3-MYB转录因子构建系统发育树。拟南芥MYB转录因子家族大部分成员的功能都研究得比较清楚,系统发育树上同一分支的基因在功能上具有同源性和相似性,通过跟拟南芥MYB家族的聚类,可以预测滇牡丹中MYB转录因子的功能。在拟南芥中,S4、S5、S6、S7分支参与类黄酮的生物合成。图3a表明:PdMYB20、PdMYB29、PdMYB8、PdMYB7、PdMYB25与拟南芥第4亚家族的基因聚在一起,可能在类黄酮生物合成途径中行使转录抑制功能。PdMYB1、PdMYB2与拟南芥第5亚家族的AtMYB123聚在一支,研究表明AtMYB123参与原花青素的生物合成,推测PdMYB1、PdMYB2也可能在原花青素合成过程中行使一定的功能。拟南芥的第6亚家族主要参与花青素的生物合成,滇牡丹中没有MYB转录因子聚类到这个亚家族,这可能是由于滇牡丹花瓣纯黄,几乎不含有花青素的原因。PdMYB13、PdMYB26聚类到拟南芥第7亚家族,这一家族的功能是参与黄酮醇的生物合成。
根据转录组RPKM数据构建R2R3-MYB转录因子表达量热图,图3b表明:25个转录因子大体分为2个表达趋势,一部分随着花发育上调,一部分随着花发育下调。从图中可以看出,聚类在原花青素合成分支的PdMYB2转录因子的表达量远高于其它转录因子的表达量,对其进行实时荧光定量PCR的验证(图3c),RNA-seq和qRT-PCR数据具有非常密切的相关性,且表达趋势具有高度的一致性。

图3 滇牡丹R2R3-MYB功能预测和表达分析Fig. 3 Functional prediction and expression analysis of peony R2R3-MYB in P. delavayi
2.3 PdMYB2基因克隆及序列分析
使用全长引物克隆PdMYB2的全长CDS序列,获得PdMYB2序列600 bp(图4a),经测序,PdTHC2’GT具有从起始密码子ATG到终止密码子TAA的完整ORF,编码199个氨基酸,将PdMYB2登 录 到 NCBI,登 录 号 为:OM478634。选择当归(Angelica sinensis(Oliv.)Diels,AYA44248.1)、茶(Camellia sinensis(L.)O. Ktze.,ARB51599.1)、葡 萄(Vitis viniferaL.,NP_001268129.1)、黄灯笼辣椒(Capsicum chinenseJacq.,PHT97629.1)、拟 南 芥(A.thaliana,AAM67537.1)和 丹 参(Salvia miltiorrhizaBunge,ADG46002.1)的参与烟草花青素苷合成的转录激活因子R2R3-MYB蛋白与PdMYB2进行多重比对(图4f),在PdMYB2的N-末端发现了2个保守的DNA结合结构域,N-末端的R2和R3 DNA结合结构域是与在其他物种中鉴定的R2R3-MYB转录调节因子同源的主要区域。但与其他R2R3-MYB蛋白相比,PdMYB2中与bHLH结合并反应的特征序列显示出较低的同源性。还观察到C1和C2基序和C末端的锌指结构以及保守区的N1、N2和N3基序的同源性非常低。这些结果表明,不同植物中R2R3-MYB蛋白C末端的多样性。因此,在PdMYB2氨基酸序列中,DNA结合结构域比转录激活结构域更保守,这从分子角度解释了R2R3-MYB在各种植物中功能的相似性和独特性。使用BLAST和HHBlits对SWISS-MODEL模板库进行了模板搜索,发现PdMYB2与R2R3-MYB转录因子识别靶DNA(target DNA recognition by R2R3-type MYB transcription factor)蛋白模型同源性最高(57.66%)。因此,在模型的基础上,构建了PdMYB2蛋白的3D模型(图4b~e)。预测PdMYB2的氨基酸序列包含31个潜在的磷酸化位点,包括20个丝氨酸、6个苏氨酸和5个酪氨酸。
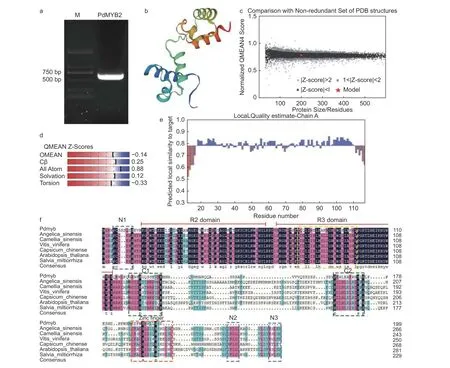
图4 PdMYB2基因克隆、同源性比对、蛋白质模拟结果及质量评价Fig. 4 PdMYB2 gene cloning, homology comparison of amino acid sequence,protein modelling results and quality estimation.
2.4 PdMYB2基因的亚细胞定位
利用荧光报告基因(GFP)对PdMYB2基因进行亚细胞定位。构建了35S:: PdMYB2-GFP重组载体,以35S::GFP和mCherry共同作为阴性对照,将其在农杆菌的介导下转化进本氏烟草叶片细胞中,使用激光共聚焦显微镜观察GFP的荧光。图5显示:35S::GFP的荧光在细胞核和细胞质中存在,PdMYB2基因的荧光在细胞核中有明显的荧光表达,在细胞质中有微弱的荧光表达。因此,推断PdMYB2基因在细胞核和细胞质中均有定位。

图5 PdMYB2在烟草中的亚细胞定位Fig. 5 Subcellular localization of PdMYB2 in Nicotiana benthamiana
2.5 PdMYB2基因在烟草中的过表达
2.5.1PdMYB2在烟草中的过表达 为进一步验证PdMYB2在类黄酮途径上的调控功能,将35S::PdMYB2-pCAMBIA1302载体通过叶盘法介导入烟草中。以Hygromycin B为抗性筛选标签,筛选出6个过表达PdMYB2的独立转基因烟草品系(line1~line6),岀瓶后移至温室中,在相同光照、水分、温度条件下培养。提取每个烟草品系(line1~line6)及野生型烟草(WT,Wild Type)的DNA,并以提取的DNA为模板,使用全长引物对PdMYB2基因进行克隆。琼脂糖凝胶电泳的结果显示:转化PdMYB2基因在各转基因株系中均可以检测到条带,而野生型烟草中未检测到该条带(图6a)。对6个烟草株系进行qRT-PCR的验证,结果表明:PdMYB2基因在不同组织中均有表达,表达量为茎>花>叶(图6b)。
对烟草开花后表型进行观测,过表达PdMYB2的烟草植株开花后,6个烟草株系的花色均比野生型的烟草花色为红色且显著变深(图6c)。对过表达PdMYB2基因的烟草花瓣中烟草自身的NtCHS、NtCHI基因的变化量进行实时荧光定量PCR分析,结果表明:过表达PdMYB2基因后,烟草花瓣中NtCHS和NtCHI基因表达量明显上调(图6d、e),且NtCHI的表达量上调水平高于NtCHS基因表达量,这说明在烟草中过表达PdMYB2基因确实影响了烟草类黄酮合成途径上基因的表达量。对过表达PdMYB2基因的烟草和野生型烟草进行花青素苷的定性定量分析,进一步验证表型的变化、类黄酮合成途径结构基因表达量的变化与类黄酮合成途径色素含量变化的一致性。对花青素苷含量进行绝对定量后,结果显示:与野生型相比,过表达PdMYB2基因株系中大多数花青素苷成分都有不同程度的上调,其中,矢车菊素苷、天竺葵素苷、芍药花素苷和矮牵牛素苷显示出显著的上调差异(图6f)。对单个色素成分及含量进行分析,矢车菊素-3-O-芸香糖苷(Cyanidin-3-O-rutinoside)、矢车菊素-3-O-葡萄糖苷(Cyanidin-3-O-glucoside)、天竺葵素-3-O-芸香糖苷(Pelargonidin-3-O-rutinoside)和飞燕草素-3-O-芸香糖苷-5-O-葡萄糖(Delphinidin-3-Orutinoside-5-O-glucoside)的含量极显著增加,导致了花色的显著差异(图6g)。

图6 过表达PdMYB2基因烟草株系的功能分析Fig. 6 Functional analysis of tobacco lines overexpressing PdMYB2
3 讨论
本研究的主要目的是了解滇牡丹类黄酮生物合成过程中的转录控制。本研究首次对滇牡丹中MYB转录因子家族成员进行鉴定,共鉴定到64个MYB基因家族成员,分别为R2R3-MYB成员25个,R1R2R3-MYB 1个,4R-MYB 2个,MYB-related 36个,其中,R2R3-MYB是植物中数目最多的一类,且能够调控植物类黄酮的生物合成[16]。拟南芥的MYB转录因子家族在植物中MYB转录因子家族功能研究较深入,笔者将滇牡丹的R2R3-MYB与拟南芥R2R3-MYB一起构建邻接树,由于MYB转录因子结构域的保守性,笔者认为处于相邻位置的滇牡丹R2R3-MYB转录因子与拟南芥R2R3-MYB转录因子具有更相似的结构,从而具有相似的功能。在拟南芥中,S4、S5、S6、S7亚家族是跟色素合成相关的亚家族[32]。在第4亚家族中,AtMYB3、AtMYB4、AtMYB32[33-34]、AtMYB8[35]、AtMYB6、AtMYB7[36]被证实可以作为转录激活因子和抑制因子。在第5亚家族中,AtMYB123(TT2)可以调控原花青素的积累[37],苦荞麦中分离的TT2基因也有相同功能[38]。在第6亚家族中,过表达AtMYB75、AtMYB90[33]可以导致花青素苷的积累。在第7亚家族中,AtMYB11、AtMYB12[33]被证实可以调控黄酮醇的产生,甚至AtMYB12可以直接调控番茄组织中黄酮醇的产生[39]。由此,聚类在S4亚家族的PdMYB20、PdMYB29、PdMYB8、PdMYB7、PdMYB25,聚类在S5亚家族的PdMYB1以及聚类在S7亚家族的PdMYB13、PdMYB26是后续研究的主要目标。
根据与拟南芥R2R3-MYB转录因子聚类结果及转录组表达量,笔者将PdMYB2基因从滇牡丹花瓣中分离出来。亚细胞定位显示,PdMYB2定位在细胞核和细胞质中。通常MYB转录因子大多在核中定位,PdMYB2在细胞质中的定位说明PdMYB2不完全进核,推测不但有转录因子功能,可能还有其他功能,比如与bHLH或WD40转录因子的互作,或者受诱导进核[40-42]。磷酸化是MYB蛋白重要的翻译后修饰。翻译后修饰建立了一种连接信号通路和反应的机制,根据信号,在适当的时间内调节蛋白质的表达和活性[43]。如磷酸化的RGPR-p117基因可以增强细胞中的调节钙蛋白mRNA表达,且RGPR-p117的表达模式为通过激素刺激后的蛋白激酶C信号传导介导后,在NRK52E细胞中从细胞质转运到细胞核[44]。本研究中,预测PdMYB2有31个磷酸化位点,包括20个丝氨酸、6个苏氨酸和5个酪氨酸,并且PdMYB2被证明定位在细胞核和细胞质中,这与RGPR-p117相似。因此,推测PdMYB2可以通过磷酸化位点的磷酸化和去磷酸化的共价修饰决定其生理活性,这表明PdMYB2可能参与了细胞器功能的调节。
为进一步探明PdMYB2在类黄酮合成过程中的作用,利用叶盘法将PdMYB2基因转化进烟草中进行稳定表达。在稳定过表达PdMYB2的转基因烟草花瓣中,NtCHI、NtCHS基因的表达量明显上调,且过表达PdMYB2后,NtCHI表达上调的幅度大于NtCHS,这可能是由于基因的级联效应造成的。
调控类黄酮合成途径的MYB基因已从多种植物中分离出来,不同的MYB转录因子可以引起不同种类的色素积累,其调控的酶基因也不相同。Kobayashi等从四倍体巨峰葡萄中分离出的MybA基因通过表达UFGT基因参与葡萄花青素苷合成的调控[17]。Espley等从苹果中分离出的MdMYB10基因在同源和异源系统中都能诱导花青素的积累,而且与MdbHLH3和MdbHLH33这2个bHLH蛋白共表达[18]。Chiou等研究发现,文心兰OgMYB1可以激活黄色唇瓣中的OgCHI和OgDFR的转录而诱导红色素的形成[19]。Tian等研究发现,海棠中的McMYB10通过对海棠中McF3'H的正调控在红叶着色中起着重要作用[22]。由于PdMYB2在滇牡丹花瓣发育过程中呈现了高表达量,而纯黄滇牡丹花瓣中没有肉眼可见的红色素产生,笔者推测PdMYB2并不直接调控CHI基因的表达,而是通过调控CHS来调控下游基因的表达。Gu等在牡丹中发现1个R2R3-MYB基因PsMYB12,研究表明,PsMYB12与bHLH和WD40蛋白在直接激活PsCHS表达来调控花瓣斑点的形成[45]。在滇牡丹中PdMYB2是否与bHLH、WD40互相作用以及是否直接与CHS作用,是后续研究的重点。
4 结论
本研究对滇牡丹中MYB转录因子家族的成员进行鉴定和分析。鉴定到1个R2R3-MYB转录因子PdMYB2,通过对PdMYB2基因进行序列分析和功能验证,结果显示PdMYB2基因定位在细胞质和细胞核中,在类黄酮生物合成过程中对类黄酮的积累量具有正调控作用,在烟草中过表达PdMYB2可以促进花青苷的积累。对转基因烟草株系的NtCHS、NtCHI进行实时荧光定量PCR的分析,PdMYB2可以提高NtCHS、NtCHI在花瓣中的表达量。
