水产品中苯甲酸快速检测单克隆抗体的制备
2022-10-12陈纯黄藤波林燕翠曹涛李广鹏甘慧
陈纯,黄藤波,林燕翠,曹涛*,李广鹏,甘慧
(1.深圳市亿腾检测科技有限公司,广东 深圳 518100;2.广东省检迅检测科技有限公司,广东 东莞 523843;3.深圳市深业航天食品与环境检测科技有限公司,广东 深圳 518100;4. 深圳市汇知科技有限公司,广东 深圳 518101)
水产品加工包括以鱼、虾、蟹、贝、藻类等可食用部分制成冷冻品、腌制品、干制品、罐头制品与熟食品等的食品加工业,是渔业生产的延续。广东省是我国南部水产品盛产的地区之一,其水产加工食品在全国首屈一指,而水产食品的储藏问题是一大难题。苯甲酸是食品工业中常用的一种防腐剂,对霉菌、酵母和细菌有较好的抑制作用[1]。长期食用苯甲酸超标的食品,可能导致肝脏积累性中毒,危害肝脏健康[2]。《食品安全国家标准 食品添加剂使用标准》(GB 2760-2014)中规定,苯甲酸及其钠盐(以苯甲酸计)在水产动物类罐头中不得使用[3]。水产动物类罐头中检出苯甲酸及其钠盐(以苯甲酸计)的原因,可能是生产企业为延长产品保质期,或者弥补产品生产过程卫生条件不佳而超范围使用[4]。
常用检测苯甲酸的方法有分光光度法、薄层色谱法、毛细管电泳法、动力学荧光法、电位滴定法、离子色谱法、高效液相色谱法、气相色谱法、高效液相/气相色谱-质谱法等[5-10]。目前胶体金免疫层析技术具有快速、容易、便宜、有效、安全的特性。这比传统的仪器方法要方便很多。食品中的非法添加剂及农兽药残留结果目前需要检测速度快,现场检测,并能让人直观地用肉眼进行检测分析。如今快速测试食品污染物能够缩将以前1天才能完成的试验缩短到现在的30分钟[11,12]。本实验构建水产品中苯甲酸快速检测单克隆抗体,为后续生产水产品中苯甲酸快速检测试纸条打下坚实的基础。
1 材料和方法
1.1 试剂
苯甲酸标准品、二甲基亚砜(DMSO)、融合剂(PEG/DMSO Solution)、弗氏不完全佐剂(FIA)、弗氏完全佐剂(FCA)、二硫苏糖醇、3,3′,5,5′-四甲基联苯胺(TMB)、显色液、辣根过氧化物酶-羊抗鼠、IgG 抗体、卵清蛋白(OVA)购自Sigma公司;胎牛血清、HAT、HT选择培养基、DMEM高糖培养基购自Gibco 公司;蛋白 Marker购自Fermentas公司;小鼠单抗Ig类/亚类鉴定用ELISA试剂盒购自上海金博生物有限公司;Tween-20、丙烯酞胺、双甲基丙烯酞胺购自Solarbio公司;盐酸、氢氧化钠、氯化钠、氯化钾(均为分析纯)购自天津化学试剂三厂;磷酸二氢钠、柠檬酸、碳酸氢钠、碳酸钠(均为分析纯)购自北京化学试剂厂。
1.2 主要仪器与耗材
恒温培养箱(型号:YY0027-90)上海跃进医疗器械有限公司;酶标仪(型号:Model 680)BIO-RAD公司;台式电子天平Sartorius 公司;CO2培养箱Thermo公司;生物安全柜LABCONCO公司;荧光显微镜ZEISS公司;台式离心机Beckman公司;倒置显
微镜(型号:CK31)Olympus公司;细胞培养板、96 孔酶标板、细胞冻存管CORNING公司
1.3 试验动物和细胞
7周龄BALB/C小鼠购自北京实验动物中心。小鼠骨髓瘤细胞系SP2/0 细胞由本实验室保存。
2 试验步骤与方法
2.1 苯甲酸人工抗原的制备
将60 mg牛血清白蛋白溶于1 mL水中,加入40 μL 1 mol/L NaOH,30 μL 1,4-丁二醇二缩水甘油醚,室温反应24小时。对生理盐水透析过夜。另将4.5 mg对羟基苯甲酸溶于80 μL 1 mol/L NaOH,加入上述BSA溶液中,室温反应48小时,对PBS透析两天,作为免疫原。包被原的制备同上,用卵清蛋白代替牛血清白蛋白。
2.2 苯甲酸人工抗原的鉴定
2.2.1 紫外图谱的扫描
用PBS与相应的BSA、OVA、DC-BSA及DC-OVA配成一定浓度,在200~400 nm波长下进行紫外光谱图扫描,观察吸收峰的变化。

2.2.2 偶联比的测定
偶联比就是计算偶联物中被偶联的两种分子的比率,其方法是依据检测偶联物中被偶联的两种分子含量的原理建立起来的。本文采用2,4,6-三硝基苯磺酸(TNBS)法测定偶联物偶联比。
将蛋白用蒸馏水配制成浓度为0 mg/mL、0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL、1.0 mg/mL的溶液,取0.5 mL加入到0.5 mL pH 9.0的碳酸盐缓冲液(0.1 mol/L Na2CO3、NaHCO3)中,再加入0.5 mL 0.1%的TNBS溶液,在室温下反应15 min,于420 nm波长下进行比色。
根据吸光值和蛋白浓度作出标准曲线,曲线斜率即为标准蛋白单位浓度的吸光值。将免疫抗原用蒸馏水配制成浓度为0 mg/mL、0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL、1.0 mg/mL的溶液,其余步骤与上述标准曲线操作相同,做出标准曲线,曲线斜率即为单位浓度的吸光值。同时进行抗原氨基消耗率的计算。
用于连接小分子半抗原常用的载体蛋白有BSA、KLH、OVA、HSA等。其中由于BSA和OVA来源丰富且价格便宜应用的最多。BSA由于可连接半抗原的赖氨酸活性基团较多,理论上一个BSA分子上有56个赖氨酸活性基团,因此常用作于免疫原的载体蛋白。OVA可连接半抗原的赖氨酸活性基团只有20个,因此常用作于包被原的载体蛋白。本文分别采用BSA和OVA作为免疫原和包被原的载体蛋白。将人工抗原的氨基消耗率与载体蛋白氨基个数相乘即可得出人工抗原中半抗原与载体蛋白的偶联比。
在200~400 nm间分别对各抗原和包被原的紫外吸收光谱进行测定,鉴定半抗原与BSA和(或)OVA是否偶联成功,并计算偶联比。
2.2.3 动物免疫试验
取6周龄~8周龄健康 BALB/c 小鼠雌性4只,雄性4只。按照性别分为2组,分别免疫苯甲酸人工抗原。取一定量-20℃保存的BA免疫原,用生理盐水稀释,再加入等体积的佐剂,于快速混匀器上混匀,充分乳化。免疫过程参见表1。
2.3 单克隆抗体的制备
具体单克隆抗体制备过程及腹水的制备纯化参见参考文献(杨帆,2010)。
2.4 鉴定单克隆抗体的免疫学特性
2.4.1 抗体亚型的测定
收培养好的集杂交瘤细胞上清液,根据小鼠单抗亚型试剂盒说明书采用间接ELISA法测定。
2.4.2 抗体效价的测定
2.4.2.1 包被
将包被抗原用稀释到2 μg/mL,用每种浓度的包被抗原分别包被两行,置于4℃过夜,100 μL/孔。
2.4.2.2 洗涤
洗板机上洗涤3遍,洗涤液300 μL,甩干。
2.4.2.3 封闭
甩干孔内液体,放37℃烘箱过夜烘干。
2.4.2.4 加样
除最前面一列孔加入阴性血清作为对照组外,其余各列孔加入从第一孔开始的倍比稀释的待检血清,每孔100 μL,37℃反应40 min,洗涤同2。
2.4.2.5 加二抗
每孔加入100 μL HRP-羊抗鼠IgG(10000稀释),37℃反应30 min,洗涤同2。
2.4.2.6 显色
加入显色液100 μL,37℃、10 min,50 μL的终止液以终止反应。
2.4.2.7 测定
测定各孔Abs450nm的值。
2.4.2.8 判定结果
Abs450nm=1.0左右的血清最高稀释倍数作为抗血清的ELISA效价。
2.4.3 间接竞争ELISA最佳工作条件的确定及其标准工作曲线的建立
为进行抗血清特异性及灵敏度测定,首先对抗原包被浓度和抗血清稀释倍数进行优化。本研究采用最大抑制法进行测定,即测算每个不同包被及抗血清稀释倍数下对相同浓度药物的B/B0值,B/B0值最小为抑制效果最好,反应灵敏度最高,该条件即为最佳包被浓度和最佳抗体稀释倍数。根据测定结果,0药物浓度孔的吸收值记为B0,各浓度药物孔的吸光值记为B,由下式计算抑制率:
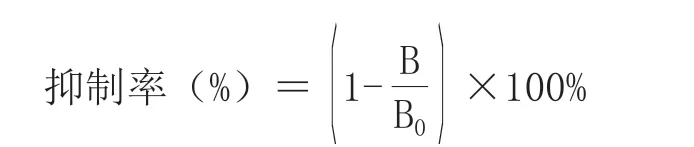
试验以抗血清效价以及Abs450nm/IC50比值来表征抗血清特性,效价越高、Abs450nm/IC50越大,其相应小鼠特性最好,表明其免疫抗原或免疫方式效果最好。按照上述方法在不同的包被浓度、抗体浓度、二抗浓度、一抗反应时间、二抗反应时间、缓冲溶液体系、吐温-20含量等条件进行优化,在确定最佳条件时,绘制间接竞争ELISA标准曲线,用Originlab进行四参数拟合,计算曲线IC50值、Abs450nm值。通过对苯甲酸单克隆抗体及多克隆抗体最优ELISA工作各条件的优化,在最优的工作条件基础上确定不同包被原间的ELISA标准工作曲线。
2.4.4 灵敏度测定
在确定最佳条件时,试验以间接竞争ELISA标准曲线的Abs450nm/IC50比值来表征ELISA反应灵敏度,Abs450nm/IC50越大,建立的ELISA方法灵敏度就越高。
2.4.5 特异性鉴定
抗体对其他药物的灵敏度越高,交叉反应率越大,反之越小。以苯甲酸IC50值作为对照,抗体对苯甲醇、苯酚、青霉素、螺旋霉素、土霉素、四环素等其他药物的交叉反应计算为:
交叉反应率(%)=IC50(苯甲酸)/IC50(竞争物)×100%
测定竞争药物分别为稀释的有机物标准品、以药物浓度100 ppb、500 ppb、1 ppm、3 ppm、9 ppm、27 ppm、81 ppm、243 ppm、2000 ppm做竞争曲线,计算各竞争物的IC50。同时,用上式计算各竞争物与对应抗体的交叉反应率。
3 结果与讨论
3.1 紫外扫描图谱分析
采用活泼酯法合成人工抗原,紫外可见光谱扫描鉴定人工抗原,在200~400 nm间分别对各抗原和包被原的紫外吸收光谱进行测定,鉴定半抗原与BSA和OVA是否偶联成功。由图2和图1可以看出,相比半抗原(最大吸收262 nm)和载体蛋白(最大吸收280 nm),人工抗原的特征吸收已经发生明显蓝移。这是因为在载体蛋白上成功偶联半抗原后,半抗原最大吸收和载体蛋白最大吸收相互叠加,导致其最大吸收发生蓝移。从紫外光谱扫描结果可以判定BA人工抗原合成成功。包被原的紫外吸收光谱也发生了变化,虽然戊二醛偶联使吸收光谱在超过300 nm出现了吸收,干扰了峰的对比,但用抗血清检测,包被原出现了很强的信号,证明对氨基苯甲酸已经偶联到蛋白质上。
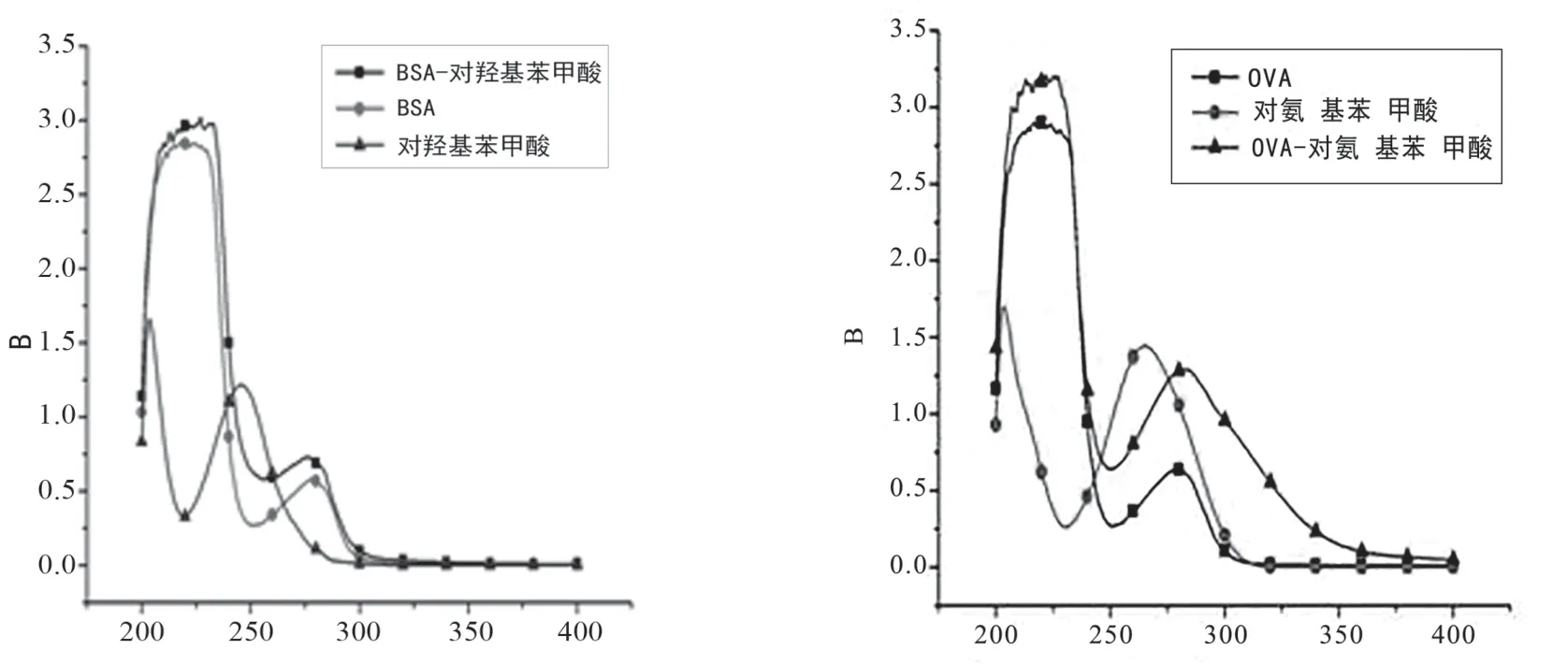
图1 苯甲酸免疫/包被抗原紫外扫描图

图2 BSA和OVA的标准曲线
3.2 偶联比的确定
如图2中所示,BSA的标准曲线为y=0.0432+0.294X(R2=0.99786)、OVA标准曲线为 y=0.0443+0.1865X(R2=0.99893)。根据2.2.2的测定方法,计算出偶联比BA-BSA为17∶1,BA-OVA为19∶1。
3.3 免疫小鼠血清滴度的测定和竞争分析
10只小鼠免疫三次后,尾静脉采血,BA-OVA稀释成1 μg/mL,包被酶标板,测定小鼠血清的滴度和对苯甲酸的竞争。
从表2和表3可以看出,小鼠产生了较高滴度的抗体,并且对苯甲酸有识别反应。

表2 小鼠血清的滴度实验

表3 小鼠血清的竞争实验
3.4 杂交瘤细胞株的建立及小鼠染色体计数
本次实验选取序号为5的小鼠进行融合,共铺设了4块96孔板。8天时,杂交瘤细胞孔为251个,融合率为65.4%。一天后再取培养上清用间接ELISA进行检测,其中的阳性孔有42个,阳性率为16.7%;取上清进行灵敏度筛选,随机选取其中10个孔最终得到4株杂交瘤细胞株:J3C4、J5F4、J8C1、J8B5。细胞见图3和图4。
图3 骨髓瘤细胞显微镜下状态

图4 杂交瘤细胞J5F4
从表4和表5可以看到得到了识别苯甲酸的较高灵敏度的单克隆抗体。

表4 苯甲酸单克隆抗体的细胞株培养上清滴度测定

表5 苯甲酸单克隆抗体细胞株培养上清的竞争实验
显微镜下,SP2/0细胞染色体50~60条,小鼠脾细胞染色体40条,杂交瘤细胞的染色体数目大约为90~100条,直接证明了细胞融合成功,免疫小鼠的脾细胞和小鼠骨髓瘤细胞SP2/0共同构成了杂交瘤细胞中的染色体,J3C4的染色体数为90,J5F4的为92,J8C1的为92,J8B5的为95,证明都是二者融合的细胞株。见图5和图6(以J5F4为例)。
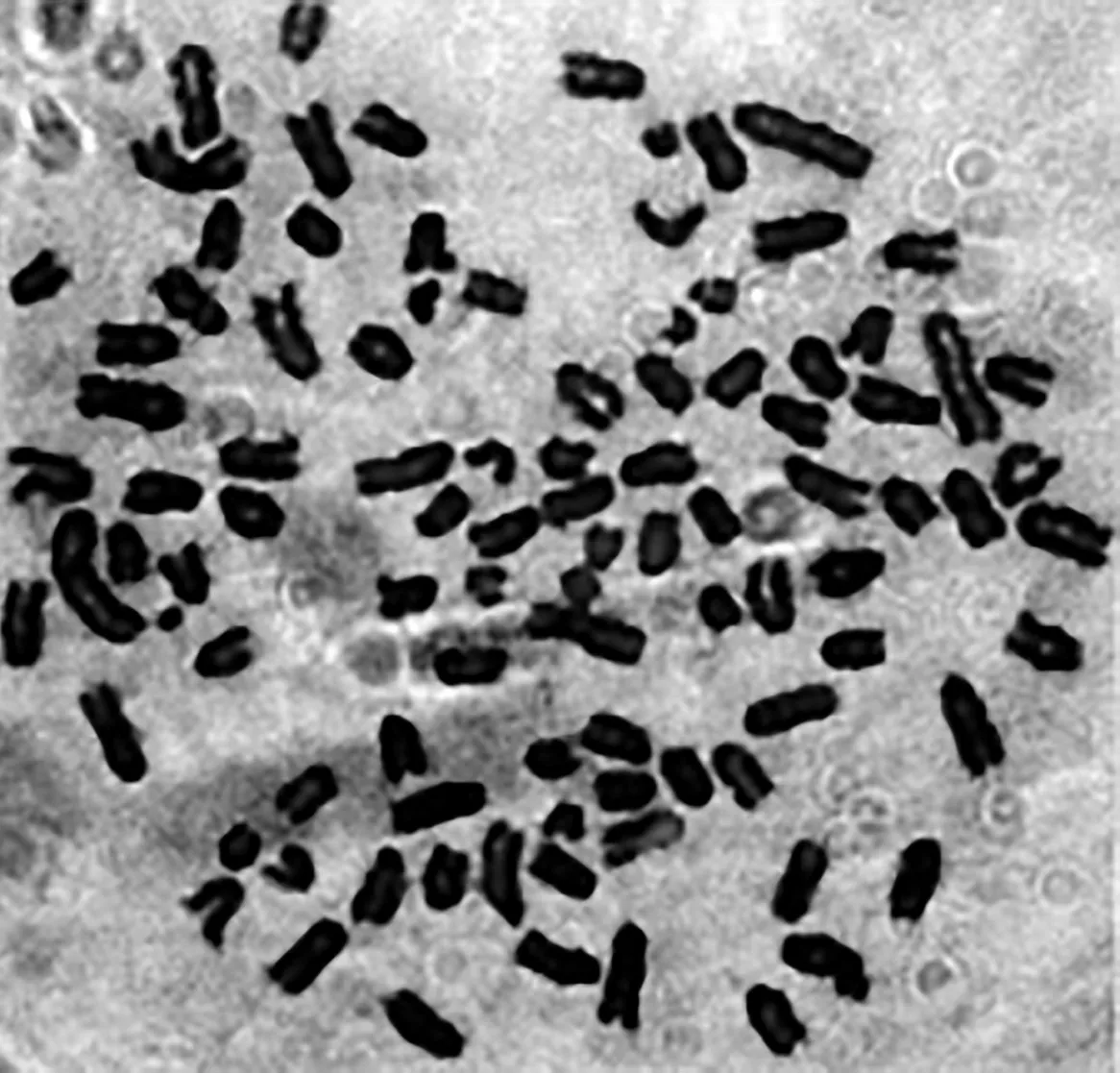
图6 杂交瘤细胞染色体
3.5 抗体亚型及效价测定
参考试剂盒相应的说明书,采用间接ELISA法,证明细胞株J3C4,J8C1单抗为IgG1型,细胞株J5F4,J8B5单抗为IgG2a型。
以Abs450nm=1.0左右的抗体最高稀释倍数作为后实验以此细胞株为准)做进一步实验。按照选定的最优包被浓度和抗体稀释倍数,梯度稀释苯甲酸标准品,采用间接竞争ELISA工作程序测定抗血清对苯甲酸的竞争曲线,计算曲线IC50值。以BA-OVA为包抗体的ELISA效价。检测结果表明,细胞培养上清和腹水分别达到1∶2~15×102和1∶5~20×104。
3.6 抗体灵敏度的测定
根据滴度和竞争实验,选取J5F4细胞株抗体(以被原,建立间接ELISA 标准曲线。该方法的IC50为225.3 ng/mL,线性范围为52.48~1824.2 ng/mL,LOD为21.33 ng/mL。
3.7 抗体特异性的测定
由表6可知,BA McAb对苯酚、苯甲醇的IC50分别为2354.8 ng/mL、3574.3 ng/mL,交叉反应率分别为9.57%、6.30%。可见该单克隆抗体与其他竞争药物无交叉反应性,具有较好的特异性。

图7 血清抗体对苯甲酸的竞争曲线

表6 单克隆抗体的交叉反应率
4 结论
本实验采用1,4-丁二醇二缩甘醚把半抗原和载体蛋白进行了偶联制备了免疫原;用戊二醛法制备了包被原,紫外光谱法对改造的抗原进行了初步鉴定。用BA-OVA为包被原,筛选出4株分泌抗BA抗体的杂交瘤细胞;通过动物免疫试验进一步验证;采用体内诱生法制备单抗腹水,并用辛酸-硫酸铵法和DEAE纤维素柱进行纯化;对获得的单克隆抗体进行亚型鉴定;建立间接ELISA和间接竞争ELISA法对血清多克隆抗体的效价和特异性进行了测定。经测定,单克隆抗体腹水效价为l∶5~20×l04,其中一株抗体(J5F4)对苯甲酸的IC50为225.3 ng/mL;同苯酚、苯甲醇的交叉反应率分别为9.57%和6.30%,得到的抗体特异性较好,可以应用于免疫学检测中。结果表明制作的改造抗原偶联是成功的,并且利用小鼠免疫方案可行性是很好的,为后续水产品中苯甲酸快速检测试纸条的制作打下坚实的基础。
