催乳素及血管抑制素对哺乳动物卵泡发育的调控作用研究进展
2022-10-12谢社风高凤磊韩贝贝李承德卫恒习
谢社风,高凤磊,李 菊,韩贝贝,李承德,卫恒习,3*
(1.华南农业大学动物科学学院,国家生猪种业工程技术研究中心,广东省农业动物基因组学与分子育种重点实验室,广东广州 510642;2.广东农工商职业技术学院热带农林学院,广东广州 510507;3.岭南现代农业科学与技术广东省实验室茂名分中心,广东茂名 525000)
催乳素(Prolactin,PRL)又称促乳素,最初因其能够刺激鸽子嗉囊上皮细胞增生,生成嗉囊乳而得名,与生长激素(Growth Hormone,GH)、胎盘催乳素(Placental Lactogen,PL)、催乳素样蛋白(Prolactin-Like Proteins,PLP)和催乳素相关蛋白(Prolactin-Related Proteins,PRP)形成PRL 激素家族,PRL 家族在结构上具有相似性,可能是从一个祖先基因进化而来。PRL 具有300 多种已知的生理功能,在动物生殖、妊娠和哺乳、生长发育、内分泌和代谢、免疫调节、水电解质平衡、促进血管生成、行为和癌症等方面具有重要的调控作用。然而,由PRL 蛋白水解产生的一种非典型形式的N 末端催乳素片段具有抗血管生成、抗血管舒张和抗血管通透性作用,未水解的PRL 中不存在抗血管生成特性,这些抗血管生成片段被命名为血管抑制素(Vasoinhibin,Vi)。PRL 和Vi 作为血管生成的刺激剂和抑制剂构成了一种有效且独特的调节机制,二者可能涉及不同信号受体的利用。PRL 通过与催乳素受体(Prolactin Receptor,PRLR)结合后作用于靶细胞,发挥其生理功能;但Vi 似乎通过不同的受体发出信号,这些受体迄今为止尚未明确。
雌性动物处于妊娠期或哺乳期时,PRL 的循环水平显著升高,高水平的PRL 会通过抑制下丘脑促性腺激素释放激素(Gonadotrophin Releasing Hormone,GnRH)的分泌而降低垂体促性腺激素(Gonadotrophins,Gn)的分泌,进而抑制卵泡发育。PRL 的分泌受到下丘脑分泌的多巴胺的强直抑制控制。在生产或临床上,PRL 分泌过高比PRL 分泌不足更为常见,任何干扰下丘脑多巴胺合成分泌、多巴胺向垂体的运送过程或多巴胺作用于多巴胺受体的过程,均可引起PRL 抑制性调节的减弱而使PRL 浓度升高,发生高催乳素血症(Hyperprolactinemia,HPRL)。HPRL 是因各种原因引起的外周血PRL 水平持续高于正常值的状态,以下丘脑-垂体-性腺轴内分泌紊乱为特征,多发于女性患者,可造成女性月经不调甚至闭经、不孕不育、乳房肿大、溢乳和男性性功能障碍等。母猪断奶后PRL水平降低,卵泡才能得以继续发育,在生产上通过调控母猪断奶后的PRL 水平能够实现卵泡发育和发情的同步化,表明PRL 是经产母猪卵巢卵泡功能的重要生理调控因子。母猪断奶后不发情可能与PRL 水平异常有关。
本文对PRL 与Vi 的结构与分泌调节、作用机制以及高水平PRL 在哺乳动物卵泡发育过程中的抑制调节作用的可能机制进行了综述,以期为探究动物卵泡发育调控机制提供参考。
1 PRL 与Vi 的结构
PRL 是由垂体前叶嗜酸性细胞合成与分泌的一种蛋白激素,由单一多肽链组成,其相对分子质量约为23 ku,广泛分布于多种组织器官。人、牛和猪的PRL由199 个氨基酸组成,大鼠和小鼠的PRL 有197 个氨基酸。PRL 分子内部含有3 个二硫键,位于氨基端、羧基端及中间区的三对半胱氨酸之间,使分子形成3 个环(L1-3),其三级结构中有4 个-螺旋(“上-上-下-下”,H1-4)呈反向平行排列。PRL 经过多种翻译后修饰,可形成分子量不同的PRL 变体:单体、二聚体和多聚体,糖基化、磷酸化和硫酸化都可使PRL 的结构和活性发生改变。成熟的PRL 蛋白分子有2 个结合位点,其氨基酸序列比较保守。
PRL 经蛋白水解可以产生Vi,可抑制毛细血管内皮细胞生长。据报道,Vi 不存在特异的编码基因,中枢及外周水平的组织蛋白酶D(Cathepsin D,CTSD)、骨形态发生蛋白1(Bone Morphogenetic Protein-1,BMP-1)和基质金属蛋白酶(Matrix Metallo proteinases,MMPs)在连接第3 和第4 个-螺旋的长环附近或之内的对应位点切割全长PRL,去除C-端部分片段(第4 个-螺旋),产生分子量范围在11~18 ku的血管抑制素(Vis)(图1)。Vis 均共享全长PRL的NH末端区域,由PRL 蛋白水解产生的COOH 末端片段不具有血管抑制素样活性,Vis 与全长PRL 的作用完全不同。未切割的PRL 没有抗血管生成特性,表明构象变化产生了新的生物活性域。分子动力学(Molecular Dynamic,MD)模拟表明,H4 的丢失暴露了PRL 的疏水核,通过环1(L1)的运动及其与-螺旋1(H1)的相互作用导致分子压缩成三螺旋束,产生新的L1 构象,具有不同于PRL 的静电和疏水表面,可能对应于Vi 的生物活性域。

图1 PRL 经组织蛋白酶裂解产生Vi 示意图[5]
2 PRL 与Vi 的分泌调节
2.1 PRL 的分泌调节 腺垂体是PRL 的主要合成分泌部位,PRL 也在垂体外部位产生,包括下丘脑和不同的脑区、卵巢、乳腺、胸腺、子宫内膜、子宫肌、胎盘、子宫蜕膜、泪腺、淋巴组织和免疫系统等许多部位都发现有PRL 合成和分泌,但有些部位(如子宫蜕膜、胎盘)分泌的PRL 结构上与垂体PRL 相同,并与相同的受体结合,但其作用针对特定部位,与垂体PRL 的调节不同,在一定情况下可以补充垂体PRL 的不足。
垂体PRL 的分泌受下丘脑、神经递质、激素、细胞因子等许多因素控制。其中,下丘脑对PRL 的分泌具有双重调节作用,下丘脑既可分泌催乳素释放抑制因子(Prolactin Release-Inhibiting Factors,PIFs),又可分泌催乳素释放因子(Prolactin Releasing Factors,PRFs);但在生理情况下,下丘脑主要以抑制PRL分泌为主。多巴胺(Dopamine,DA)是下丘脑分泌的最主要且作用最强的PIF,多巴胺释放到垂体门静脉毛细血管中,作用于垂体前叶嗜酸性细胞上的多巴胺D2 受体,下调PRL 基因表达而抑制PRL的分泌。参与抑制PRL 分泌的神经内分泌多巴胺(Neuroendocrine Dopamine,NEDA)神经元主要包括结节垂体(Tuberohypophyseal,THDA)、脑室周围垂体(Periventricular Hypophyseal,PHDA)和结节漏斗(Tuberoinfundibular,TIDA)神经元,TIDA 神经元在下丘脑调节PRL 分泌中起最突出的作用。同时,PRL 通过自分泌或/和旁分泌的途径与脑室内的PRLR结合,诱导多巴胺合成的限速酶酪氨酸羟化酶(Tyrosine Hydroxylase,TH)丝氨酸磷酸化引起酶活性增加,以及诱导信号转导和转录激活因子5(Signal Transducer and Activator of Transcription 5,STAT5)磷酸化增加酪氨酸羟化酶mRNA 的表达,促进下丘脑多巴胺的合成,形成短循环负反馈机制调控自身的分泌。多巴胺受体有许多亚型,主要是D2 受体在影响PRL 的合成及分泌。利用多巴胺D2 受体抑制剂左舒必利、奋乃静等药物,可促进PRL 分泌,利用多巴胺D2 受体激活剂溴隐亭、培高利特等,可降低PRL 分泌。除了多巴胺,促性腺激素联合肽(GnRH-Associated Peptide,GAP)、促黑素细胞激素(alpha-Melanocyte-Stimulating Hormone,-MSH)、-氨基丁酸(Gamma-Aminobutyric Acid,GABA)等对PRL 的释放也有抑制作用;催乳素释放肽(Prolactin-Releasing Peptide,PrRP)、促甲状腺素释放激素(Thyrotrophin-Releasing Hormone,TRH)、胆囊收缩素(Cholecystokinin,CCK)、作用于血管的肠肽(Vasoactive Intestinal Peptide,VIP)、生长激素释放激素(Growth Hormone Releasing Hormone,GHRH)、类阿片物(Opioids,OP)、神经降压素、P物质、缩宫素、Galanin 和抗利尿激素都具有促进PRL释放的作用。PIFs 与PRFs 间存在一定的动态性平衡,从而维持PRL 的正常浓度水平。
垂体PRL 的分泌受生殖生理状态、昼夜节律、应激等多种因素影响,具有脉冲式波动的特点,正常PRL脉冲性释放对泌乳和卵巢功能起到重要的调节作用。PRL 的分泌随生殖周期改变而有所不同。在生殖周期的大部分时间里,PRL 分泌保持在较低的基础水平,但排卵前阶段PRL 水平升高,出现一个短暂而明显的峰值,PRL 分泌峰的出现时间和发情前期LH 分泌峰相近;PRL 水平在卵泡后期显著升高,并在黄体期持续升高,起到促黄体作用。在妊娠期的大部分时间,血清中的PRL 浓度维持在较低水平且缓慢上升,在妊娠晚期至分娩前达到峰值,并在哺乳期保持PRL 高水平,直至哺乳结束才下降(图2)。在妊娠期间,雌激素可刺激催乳素细胞增生,垂体体积增大,出现PRL水平增高。鼠类在妊娠第1~9 天具有“妊娠PRL 依赖期”,孕鼠妊娠早期的PRL 水平显著高于妊娠中后期。在哺乳期,幼崽对母体的吮吸刺激会引起母体神经内分泌反射分泌PRL,终止吮吸刺激催乳素的分泌也停止。哺乳结束后血液中PRL 下降的速率与激素新陈代谢的速率成正比。
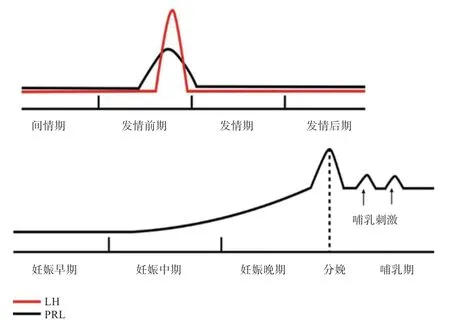
图2 PRL 周期变化规律[15]
2.2 Vi 的分泌调节 PRL/Vi 轴是最近定义的内分泌轴,是调控血管发生及其功能的重要系统,已成为人类癌症、先兆子痫、视网膜黄斑变性等疾病研究的热点。Vi是通过CTSD、MMPs、BMP-1 等酶对其直接前体PRL的蛋白水解切割生成的,Vi 的产生受到下丘脑、垂体和靶组织PRL 水平的调节,同时与相关蛋白酶的表达及其活性密切相关,PRL 水平越高,则Vi 水平越高,但并不呈线性关系。Vi/PRL 的比例随着不同的生理状态而变化,如雌性大鼠未怀孕时Vi/PRL 为0.22,在怀孕第9 天增加到0.37,在怀孕第12 天增加到0.77;通过药物处理可调控Vi/PRL 的比例,如利用奋乃静(多巴胺D2 受体拮抗剂)处理可使大鼠Vi/PRL 比例由0.22提高至0.99,雌激素也可提高该比例,而促甲状腺释放激素(TRH)可降低该比例。
3 PRL 与Vi 的作用机制
3.1 PRLR 及其功能 PRL 多效活性通过与PRLR 结合来介导,引起靶细胞的各种生理生化反应。
PRLR 是一种单一膜结合蛋白受体,属于细胞因子I 类受体超家族,在垂体和许多其他组织中表达,包括乳腺、子宫内膜、卵巢、心脏、肺、胸腺、脾脏、肝脏、胰腺、肾脏、肾上腺、骨骼肌、大脑、皮肤和成骨细胞。PRLR 由细胞外配体结合结构域、单个跨膜域和胞内域3 部分构成。胞外域分为NH-末端D1 和膜-近端D22 个亚区,D1 结构域中含有2 个二硫键(在CyS-Cys和Cys-Cys中);D2 结构域中有一段特殊序列(Tpr-Ser-x-Trp-Ser,x 为任意氨基酸残基)称为WS 基序(WS Motif),二硫键和WS 基序对于受体的正确折叠和转运必不可少。胞内域在启动与PRLR相关的信号转导机制中起着关键作用,胞内域含有两个相对保守的区域box1 和box2,近膜端的box1 由8 个氨基酸残基构成,多为脯氨酸与疏水性氨基酸残基,呈P-x-P 方式排列,box1 特有的结构特征能够被信号转导分子所识别,主要参与与酪氨酸激酶2(Janus Kinase 2,JAK2)结合以及JAK2 的磷酸化。PRLR 基因能通过可变剪切表达不同的亚型,其表达因物种和不同组织而异,根据胞内域氨基酸数目的不同,PRLR 可以分为长型、中间型、短型受体3 种类型;box1 存在于所有PRLR亚型,但box2 不存在于短型受体中。在啮齿动物中,小鼠中有1 种长型和3 种短型,大鼠中有短、中和长型;人类存在2 种短型、1 种中间型和1 种长型。不同的PRLR 亚型介导不同的生物学功能,PRL 只有结合长型受体同型二聚体引起细胞增殖和分化,而结合短型同型二聚体或杂合二聚体则会抑制PRL 的功能。PRL 长型受体和短型受体通常共表达于卵泡,长型受体在生长卵泡中的表达水平比短型受体高得多。
3.2 PRL 的主要信号转导通路 PRL 结合并激活PRLR后,通过经典的Janus 激酶2/ 信号转导和转录激活因子(Janus Kinase 2/Signal Transducer and Activator of Transcription,JAK2/STAT)途径将信息传递到细胞核,引起靶基因的转录和表达。首先,PRL 的结合位点1 与PRLR 的胞外域结合形成激素-受体二聚体,该初始激素受体复合物的形成是PRL 结合位点2 与第2 个PRLR的胞外域结合的先决条件,最后形成三聚体复合物(一分子PRL-两分子PRLR)可使PRLR 活化;PRLR 激活可导致胞浆及近膜内侧的JAK2 与之结合并发生磷酸化,进而使STAT5 与之结合并导致STAT5 磷酸化,随即磷酸化的STAT5 形成二聚体并通过核孔转移到细胞核内,与靶基因启动子中的特定反应元件结合,并启动靶基因的转录。PRL 激活后的信号转导途径还存在促分裂原活化蛋白激酶级联Ras-Raf-MAPK 途径和磷脂酰肌醇3-激酶(PI3K)。
3.3 Vi 的作用机制 Vi 直接作用于内皮细胞,抑制血管的生长、通透性和扩张。Vi 与由纤溶酶原激活剂抑制剂-1(Plasminogen Activator Inhibitor-1,PAI-1)、尿激酶纤溶酶原激活剂(Urokinase-Type Plasminogen Activator,u-PA)和内皮细胞膜上的尿激酶纤溶酶原激活剂受体的多组分以及其他未明确的结合伴侣/ 受体结合,通过阻断几种促血管生成因子如血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)、碱性成纤维细胞生长因子(Basic Fibroblast Growth Factor,bFGF)、缓激肽(Bradykinin,BK)、白介素-1(interleukin-1beta,IL-1)导致信号通路(Ras-Raf-MAPK、Ras-Tiam1-Rac1-Pak1、PI3K-Akt和PLC-IP3-eNOS)的激活阻断,进而抑制血管生成、血管舒张和血管通透性。
4 PRL 对卵泡发育的调节
4.1 PRL 对脑部生殖激素分泌的影响 PRL 在发情周期参与下丘脑-垂体-卵巢轴的调节,在生殖系统中起着关键作用。生理性(如妊娠、哺乳)或病理性(如高催乳素血症)PRL 浓度过高会抑制GnRH 的分泌,进而抑制LH 和FSH,导致卵巢功能抑制。PRL 对GnRH 的抑制作用可能通过作用于表达基因的特定下丘脑弓状核神经元群体来间接调节生殖轴,这为PRL 和LH 分泌峰相近的可能机制提供了方向。基因编码神经肽,称为kisspeptins,kisspeptin 是GnRH 神经元的强大激活剂,是GnRH 释放的关键调节因子,在生殖中至关重要。在人类和动物模型中,编码kisspeptins 或kisspeptin 受体的基因功能丧失性突变导致青春期中断和不育。弓状核中kisspeptin 神经元的间歇性激活驱动正中隆起的GnRH 脉冲性释放,进而推动垂体的LH 脉冲;然而,kisspeptin 也可以通过抑制TIDA 多巴胺的释放来急性刺激PRL 的分泌。因此,每次kisspeptin 释放触发LH 脉冲也可能导致TIDA 多巴胺水平的同步减少,导致PRL 分泌的暂时关联脉冲。大多数表达的神经元共同表达PRLRs,高水平PRL 直接抑制调控表达,从而抑制kisspeptin 的合成与分泌。此外,雌二醇(E)是刺激PRL 分泌的主要卵巢激素,E诱导PRL 分泌的功能与循环PRL水平相关,E在垂体调节基因表达,在下丘脑调节kisspeptin 神经元活动进而调节PRL 的分泌,表明表达的神经元也可以负反馈调节PRL 分泌。
4.2 PRL 对卵巢生殖激素的影响 PRL 在卵巢上通过自分泌和旁分泌的途径来调节卵巢功能,参与生殖功能调节。长型和短型PRLR 在卵巢颗粒细胞、间质细胞和黄体细胞上均有表达。在卵巢中,PRL 与促性腺激素协同作用,刺激黄体细胞产生孕酮,并诱导子宫中孕酮受体表达的增加。卵巢产生的孕酮是受精卵着床、维持妊娠和抑制排卵所必需的。PRL 信号传导中断导致小鼠的生殖缺陷。研究表明,或基因敲除雌性小鼠不孕。成年PRL-/-雌性小鼠有不规则的发情周期,在卵巢组织学上没有明显的缺陷,但突变体无法怀孕;PRLR-/-雌性小鼠PRLR 的缺乏使胚胎难以着床。尽管突变雌性小鼠表现出生殖缺陷,但PRL-/-雄性小鼠是完全可育的,而且大多数PRLR-/-雄性小鼠是可育的,这表明敲除雌性小鼠的不孕症是由于缺乏催乳素的黄体化作用。
卵泡液中PRL 来源于外周血,卵泡细胞中也可以合成,与雌激素和孕激素呈负相关。正常水平的PRL与卵巢组织表达的PRLR 结合,可以上调颗粒细胞FSHR 和黄体细胞LHR 表达,促进卵泡发育及排卵,促进孕酮的合成,调节卵巢激素分泌;PRL 水平过高会造成卵泡中E水平降低,垂体LHR 水平降低以及其敏感性降低,雌激素正反馈机制障碍,LH 的脉冲分泌减弱,致使排卵障碍。何海迎等研究表明在体外培养的绵羊颗粒细胞中添加PRL 会抑制E分泌,促进孕酮(P)分泌。
4.3 PRL 对卵泡血管发生和卵泡发育的影响 形态学研究表明,血管丰富的卵泡具有更好的发育能力,卵泡周围的血管网越发达,则营养供给就越丰富,能够获得更多的促性腺激素及调控因子,卵泡发育良好;相反,卵泡周围血管不足则引起卵泡闭锁。卵泡血管发生开始于次级卵泡膜层形成时,随着卵泡发育,逐渐形成两个相互联系的卵泡内膜和卵泡外膜毛细血管网。
PRL 具有促进血管发生的功能,血管生成对于卵泡的生长和成熟及其向黄体的过渡至关重要。卵泡内膜细胞产生的PRL 通过JAK2-STAT5 通路促进血管内皮迁移和管的形成,并刺激非内膜细胞产生FGF-2 和VEGF。VEGF 和FGF-2 是血管发生的关键信号分子,促进毛细血管内皮细胞的增殖、迁移和血管通透性。卵泡颗粒细胞是VEGF 的主要来源,随着卵泡的发育表达增加;卵泡膜细胞也能表达VEGF,但VEGF 受体(Vascular Endothelial Growth Factor Receptor,VEGFR)主要位于膜细胞层的内皮细胞,表明VEGF 通过旁分泌起作用。有研究发现,卵泡VEGF 浓度在中等卵泡液中变化很大,并且与血管密度和E浓度的增加密切相关。FGF-2 通常分布于血管基底膜和内皮下细胞外基质,在缺氧和伤口愈合时高表达,可能与VEGF 存在复杂的互作关系。Hunter 等在大量发育的卵泡中发现FGF-2 呈现高水平表达,主要分布于卵泡内膜细胞和外膜细胞。此外,促性腺激素可刺激颗粒细胞产生VEGF,促性腺激素支持不足可能降低卵泡血管化程度及随后的功能受损。在啮齿动物中,Vi 对VEGF存在拮抗作用,母猪断奶后不发情,推测母猪断奶后高水平的PRL 经过水解产生Vi,从而影响了卵泡血管发生。
5 结 语
卵泡是卵巢的基本单位,卵泡的正常发育与雌性个体的健康及繁殖行为息息相关。卵泡发育是非常复杂的生物学过程,除了促性腺激素,PRL 在此过程中同样发挥着重要作用,对PRL 进行挖掘和研究有助于明确卵泡/生殖细胞的生长和发育机制,为提高哺乳动物的繁殖力提供依据。
另外,关于PRL/Vi 轴系统,PRL 的糖基化对Vi 生理的影响尚不清楚;但糖基化可能会改变PRL 的蛋白水解切割,从而可能影响Vi 的生成及其作用和清除。由于缺乏定量分析方法,个体循环内源性Vi 的浓度难以确定。目前测定内源性Vi 相对可靠的方法是免疫沉淀和蛋白质印迹,但仅是半定量的,且存在较大的批间差异性。质谱技术已成功应用于确定血清中的Vi,但该技术仍是实验性的,未能商业化。Vi 在糖尿病并发症、癌症和妊娠相关疾病中的临床意义进一步强调了对Vi 的定量测定的迫切需求。若可以快速建立循环中的Vi 水平和参考范围,建立循环中Vi 的定量与诊断方法,对Vi 在健康和疾病中的作用的认识将大大增强,并为将来的生物医学研究提供方向。
