红枣及其制品链格孢毒素的QuEChERSUPLC-MS/MS 检测方法建立及其污染分析
2022-10-11鲁玲玲范盈盈张锐利
鲁玲玲,范盈盈,张锐利,
(1.塔里木大学食品科学与工程学院,新疆阿拉尔 843300;2.新疆农业科学院农业质量标准与检测技术研究所,新疆乌鲁木齐 830002)
红枣是新疆最具有资源优势和发展潜力的特色产业,同时也是支撑南疆地区农业经济发展的重要支柱。近年来,由链格孢属真菌引起的“黑斑病”成为新疆红枣产业最主要病害;其真菌毒素污染给消费者对红枣及其制品的食用带来安全恐慌。因此,掌握红枣中链格孢毒素的种类、含量及污染水平,是保障南疆红枣产业持续稳定发展急需解决的问题。
2003 年美国农村部Michelangelo 等研究人员开发的QuEChERS 主要应用于农产品中农药及兽药残留检测的快速样品前处理。QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe)是一种快速、便捷、低成本、高效率、稳固且安全的前处理技术,原理与高效液相和固相萃取相似,都是利用吸附剂填料与基质中的杂质相互作用,从而达到净化提取的目的。随着分析检测技术的不断发展,QuEChERS 技术逐渐被改良并应用在其他微量、痕量化合物的分析检测中。由于链格孢毒素的种类、含量的不确定性,为其准确检测带来较大影响。超高效液相色谱串联一级质谱或二级质谱方法具有灵敏度好、准确度高、无需对样品进行柱前衍生、检测周期短等优点。近年来,将QuEChERS 前处理技术与UPLCMS 相结合应用于农产品中真菌毒素检测的报道越来越多,但将其应用于红枣及其制品中链格孢毒素检测的报道甚少。
为掌握红枣及其制品中链格孢毒素的污染分布情况,本文探究了以QuEChERS 为基础的红枣链格孢毒素提取技术,建立了UPLC-MS 检测方法。针对南疆四个主要红枣产区的原料红枣和市售红枣制品进行链格孢毒素种类和含量的分析检测。以期为红枣及其制品的食用安全性评估奠定基础。
1 材料与方法
1.1 材料与仪器
原料红枣 2021 年11 月采集自新疆阿克苏、和田、喀什地区未经加工处理的骏枣,果形饱满、呈圆柱形或长倒卵形,果面深红色,无霉烂、浆头,无不熟果,无病果、虫果;红枣制品 当地特产超市,详情见表1;细交链孢菌酮酸(TeA,CAS: 610-88-8)、交链孢酚(AOH,CAS: 641-38-3)、交链孢酚单甲醚(AME,CAS: 26894-49-5)、腾毒素(TEN,CAS: 28540-82-1) 纯度≥98%,新加坡Pribolab 公司;交链孢霉烯(ALT,CAS: 889101-41-1) 纯度≥98%,加拿大TRC公司;乙腈、甲醇 色谱纯,Fisher Chemical;无水硫酸镁、氨水(分析纯)、甲酸、冰乙酸(色谱纯) 福晨(天津)化学试剂有限公司;氯化钠、碳酸铵 分析纯,天津市科密欧化学试剂有限公司。
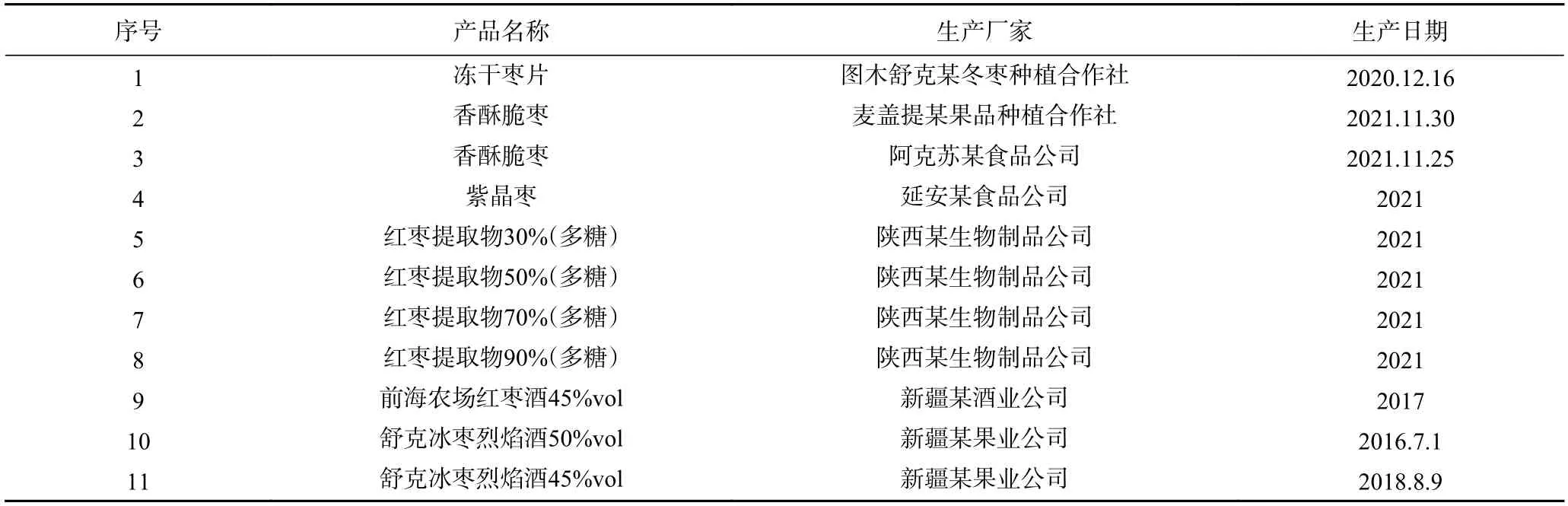
表1 红枣制品信息Table 1 Informations of jujube products
Oasis HLB 6 cc(500 mg)LP Extraction Cartridge 固相萃取柱 上海安谱实验科技股份有限公司;聚醚砜膜(PES)、聚四氟乙烯膜(PTFE)、尼龙膜(Nylon)、聚偏二氟乙烯膜(PVDF)过滤膜 直径 13 mm,孔径 0.22 μm,上海安谱实验科技股份有限公司;Vion IMS QTof MS 超高效液相色谱-高分辨质谱、Waters Vac 6 cc(500 mg)Alumina B Cartridges固相萃取柱 美国Waters 公司;Milli-Q 超纯水仪美国Millipore 公司;MS205DU电子分析天平Mettler Toledo 公司(中国上海);MTS 240C 自动水平振荡器 上海达姆实业有限公司(中国上海);MS3 Basic 漩涡振荡器 德国IKA 公司;JW-100S 超声波清洗器 深圳创美清洗设备有限公司;Eppendorf Centrifuge 5415D 高速冷冻离心机 艾本德中国有限公司;PHS-2F pH 计 上海仪电科学仪器股份有限公司(中国上海);RE-52A1L 旋转蒸发仪 济南泰医生物技术有限公司(中国济南)。
1.2 实验方法
1.2.1 标准溶液的制备 1 mg/mL 标品储备液的制备:准确称取TEA、AOH、AME、TEN、ALT 5 种毒素标品各0.0010 g 分别置于5 支1 mL 棕色容量瓶中,加乙腈定容,于-20 ℃冰箱中密封保存。
100 μg/mL 储备液的制备:吸取1 mg/mL 的TEA、AOH、AME、TEN、ALT 5 种毒素储备液各0.2 mL,置于同一棕色2 mL 容量瓶中,加乙腈定容,于-20 ℃冰箱中密封保存。
标准工作液:分别吸取相当体积的100 μg/mL储备液,用乙腈稀释配制成0.05、0.1、0.2、0.5、1、2、5、10、20、50 μg/mL 的5 种链格孢毒素标准工作液,于-20 ℃冰箱中保存。
基质工作液:浓度设置与标准工作液相同,以不含毒素的样品空白基质稀释配制。
1.2.2 毒素提取
1.2.2.1 QuChERS 方法提取固体样品中毒素 固体样品破碎处理后称取2.5 g 置于50 mL 离心管中,依次加入10 mL 超纯水和10 mL 乙腈(含1%乙酸),放入自动水平振动器在2500 r/min 条件下振荡提取5 min 使红枣样品均匀分散。随后立即加入4 g无水硫酸镁和1 g 氯化钠,涡旋振荡30 s。将离心管配平后放入冷冻高速离心机在8000 g 条件下离心10 min,取适量上清液在40 ℃水浴中旋转蒸发至近干,加入1 mL 乙腈-甲醇-甲酸混合溶液(乙腈:甲醇:甲酸=70:29:1,v:v)复溶,样液经0.22 μm PTFE滤膜过滤,等待上机测定。
1.2.2.2 固相萃取方法提取液体样品中毒素 取10 mL液体样品,用甲酸调整pH 至2.5,固相萃取小柱(以5 mL 甲醇和5 mL 超纯水活化),样液分两次注入,注意始终保持柱内填充物被液体覆盖,不能让液体流干,流速控制在1 mL/min;待样品过柱完毕后,依次用5 mL 超纯水和5 mL 甲醇-水溶液(甲醇:水=4:6,v:v)淋洗,弃去此前所有过柱的混合液。准备干净的试管收集洗脱液,先向固相萃取小柱中加入5 mL 甲醇,再加入5mL 含1%氨水的甲醇-乙腈溶液(甲醇:乙腈=1:1,v:v),减压抽干5 min 后将收集的洗脱液于40 ℃水浴中氮吹至近干,加1 mL 10%甲醇-水溶液复溶,0.22 μm PTFE 滤膜过滤,等待上机检测。
1.2.3 超高效液相色谱条件 Acquity UPLC HSS C(2.1×100 mm,1.8 μm)色谱柱;柱温40 ℃;进样量5 μL;流动相:A 为0.1 mmol/L 碳酸铵水溶液,B 为纯甲醇;流速0.3 mL/min;梯度洗脱程序:0~1 min、20% A;4~5.5 min、100% A;5.6~8 min、20% A。
1.2.4 串联质谱条件 串联质谱采用电喷雾离子源(ESI),多反应监测扫描(MRM)。离子源温度为150 ℃,电离电压4 kV,脱溶剂气流量350 L/h,脱溶剂温度350 ℃,碰撞气流量150 L/h,锥孔反吹气流量30 L/h。5 种链格孢毒素所用质谱参数详见表2。

表2 质谱参数Table 2 Mass spectrum parameters
1.2.5 基质效应 分别以标准溶液溶剂和样品空白基质配置100 μg/mL 5 种链格孢毒素混合标准液。根据实际测定值,通过下式计算基质效应(ME):ME=(A/B-1)×100%,式中:A 表示基质标准点峰面积;B 表示溶剂标准点峰面积。判别标准:当ME>0时,代表基质增强效应;当ME<0 时,代表基质抑制效应;当︱ME︱≤20%表示弱基质效应,当20%<︱ME︱≤50%表示中等基质效应,当︱ME︱>50%表示强基质效应。
1.3 数据处理
实验数据通过超高效液相色谱-高分辨质谱仪配备的MassLynx 软件下载获取,采用Microsoft Office Excel 2010 和Origin 2021 统计学软件进行统计分析。
2 结果与分析
2.1 色谱条件优化
为选择适合于TeA、AOH、AME、TEN 和ALT 5 种链格孢毒素色谱分离的流动相组合,本试验探索了以碳酸铵水溶液、甲酸铵水溶液、甲醇-甲酸水溶液3 种水相和乙腈、甲醇2 种有机相的6 组配比作为流动相时5 种链格孢毒素的色谱分离情况和峰形的对称性。结果表明,当以甲酸铵水溶液、甲醇-甲酸水溶液分别与甲醇、乙腈组合作为流动相时,ALT 未见出峰,TeA 与TeN 呈长拖尾峰,分离效果较差,为使5 种链格孢毒素充分分离,将水相换成碳酸铵水溶液分别与乙腈、甲醇组合作为流动相,发现以碳酸铵水溶液和甲醇作为流动相时ALT、TeA、TeN 的出峰情况有所改善。进一步优化碳酸铵水溶液的浓度(1.0、0.5、0.1 mmol/L)以提高5 种链格孢毒素的丰度和灵敏度,当使用0.1 mmol/L 碳酸铵水溶液和甲醇作为流动相时5 种链格孢毒素的丰度最好,色谱峰充分分离。优化后的5 种链格孢毒素MRM 色谱图见图1。
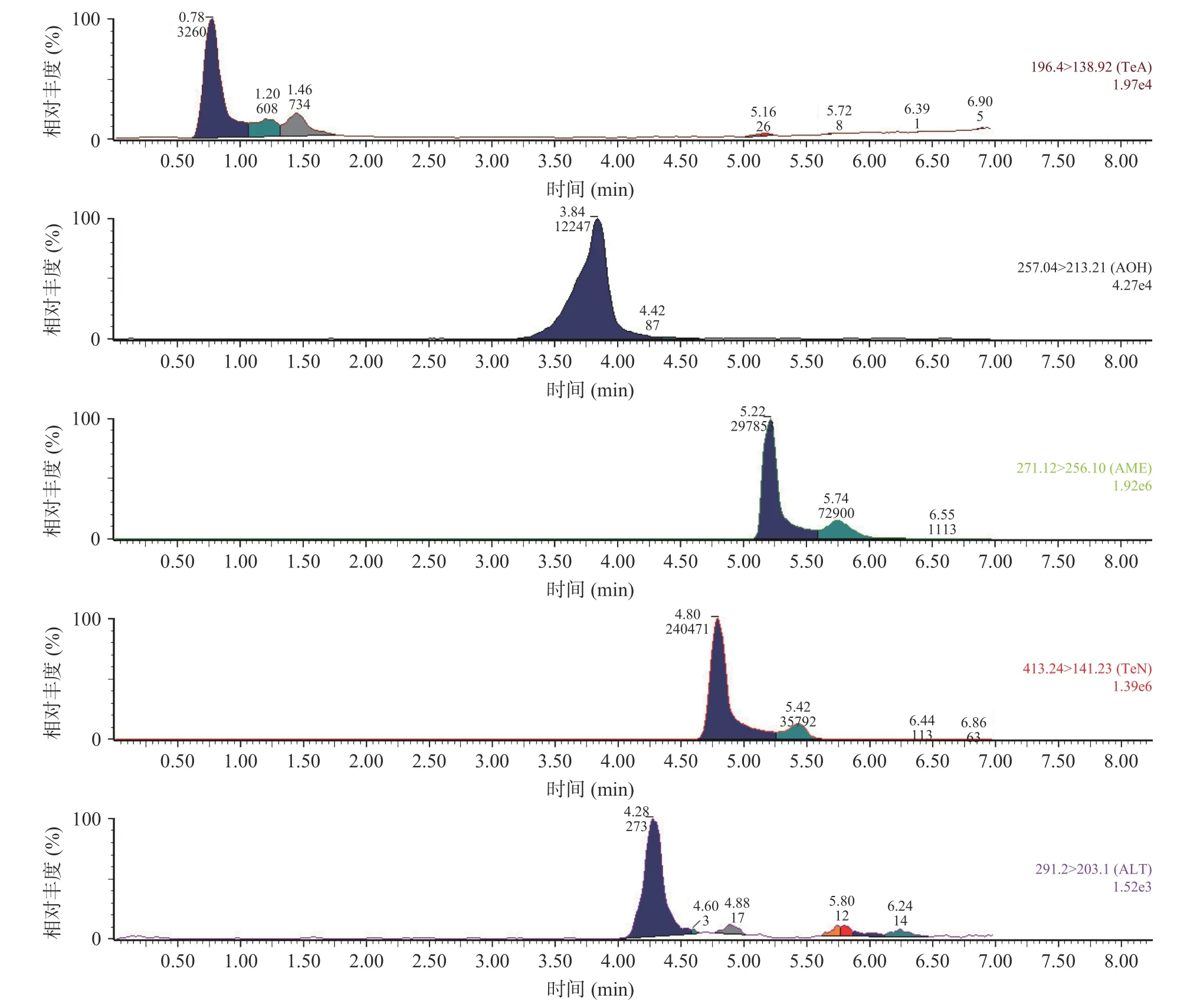
图1 链格孢毒素标准溶液MRM 色谱图Fig.1 MRM chromatogram of standard solution of Alternaria toxin
2.2 基质效应
为评价红枣样品中的基质效应,本试验针对红枣、红枣酒及红枣提取物展开基质效应分析。如表3,结果表明,红枣中ALT 为中等基质减弱效应,TEN为中等基质增强效应;红枣酒中TeA 为中等基质减弱效应,AOH 为弱基质增强效应;红枣提取物中TEN 为强的基质减弱效应;AOH 为强的基质增强效应。由于红枣和红枣提取物中糖类物质较多,在色谱分离过程中待测成分的离子化效应被增强,提高了信号的响应程度,此时的定量检测结果偏高;而红枣酒中水分含量较高,待测成分在色谱分离过程中的离子化效应被弱化,抑制了信号的响应程度,此时的定量检测结果偏低。这与易盛国等研究者:糖类、油脂、蛋白质等物质能增强基质效应,而含水量的增加在一定程度上抑制基质效应的报道一致。为补偿样品中的基质效应,保证定量检测结果的准确性,本试验采用空白基质配置标准曲线。

表3 链格孢毒素基质参数Table 3 Alternaria toxin matrix parameters
2.3 线性方程和相关系数
本研究试验以样品基质空白稀释配置线性范围在0.05~50 μg/mL 的5 种链格孢毒素标准溶液,以定量离子的相应峰面积为纵坐标(Y 轴)、相应的质量浓度为横坐标(X 轴)建立标准曲线,所得线性回归方程的相关性良好,相关系数均大于0.99,并根据信噪比(S/N=3)确定5 种链格孢毒素的LOD 和LOQ分别为0.13~86.19、0.61~259.53 μg/g,表明本方法具有较好的准确度和灵敏度,可满足红枣样品中5 种链格孢毒素的定性定量检测要求。线性回归方程、相关系数等见表4。
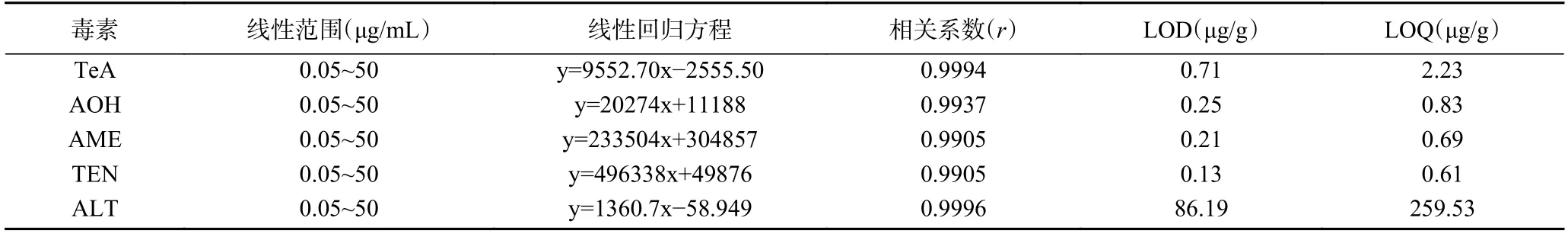
表4 链格孢毒素线性范围、回归方程、相关系数、LODs、LOQs(n=5)Table 4 Linear range,regression equation,LOD,LOQ and correlation coefficient of Alternaria toxin (n=5)
2.4 QuEChERS 方法提取毒素
2.4.1 样品量的确定 样品量的选择在一定程度上影响着实际测定值与真值间的相近程度。在称量过程中天平的绝对误差是固定的,因此样品量越大,相对误差越小;而超高效液相色谱-串联质谱灵敏度高,样品量不宜过大。为确定红枣及其制品中链格孢毒素测定的样品量,结合文献报道的红枣链格孢毒素既往分布情况,如图2,本研究分别在2.5、5、10 μg/g 3 个加标水平下(n=5),考察了0.2、1.0、2.0、2.5和5.0 g 样品量对5 种链格孢毒素回收率的影响。结果显示:当样品量取2.5 g 时,5 种链格孢毒素的加标回收率均大于75%,在可接受范围,其中TeA 回收率最高达到86.91%。故本研究选择2.5 g 为样品的称取质量。
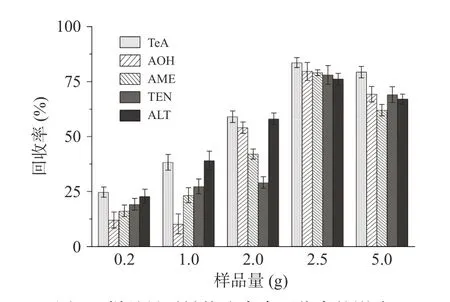
图2 样品量对链格孢毒素回收率的影响Fig.2 Effect of sample size on the recovery of Alternaria toxin
2.4.2 提取溶剂 在毒素提取过程中提取溶剂的选择至关重要。链格孢毒素种类繁多,因化学结构不同性质各异,在水中的溶解度不尽相同,但大都易溶于有机溶剂。乙腈是极性非质子有机溶剂,溶解力强、洗脱力好、能兼顾化合物的不同化学性质;研究显示酸性体系能提高链格孢毒素的提取效率。如图3,为确定提取红枣中链格孢毒素的溶剂,本实验分别在2.5、5、10 μg/g 3 个加标水平下(n=5)考察了1.0%乙酸乙腈、1.5%甲酸乙腈和2.0%甲酸乙腈对5 种链格孢毒素加标回收率的影响,发现以1.0%乙酸乙腈作为提取溶剂时,AME 的回收率最高为85.82%,其余4 种毒素的3 个加标水平回收率在51.50%~81.22%。为提高红枣中链格孢毒素的提取率,本研究提取溶剂选择1%乙酸乙腈溶液。

图3 提取溶剂对链格孢毒素回收率的影响Fig.3 Effect of extraction solvent on the recovery of Alternaria toxin
2.4.3 无水硫酸镁用量 QuEChERS 方法中加入无水硫酸镁的作用是去除有机物中的少量水分。如图4,为确定无水硫酸镁的具体用量,本研究试验在5 μg/g 加标水平下,分别考察了不加无水硫酸镁和加入2.5、4、5 g 无水硫酸镁对5 种链格孢毒素回收率的影响。结果显示,当无水硫酸镁的用量为4 g 时,AOH回收率最高达86.53%,TEN 回收率最低为72.51%,AME、TEN 和ALT 回收率在75.22%~82.63%。当无水硫酸镁的用量为5 g 时溶液过饱和,在复溶后的样品中有盐粒析出,增加了过滤时的阻力给后续工作带来不便。因此本研究选定4 g 为无水硫酸镁用量。
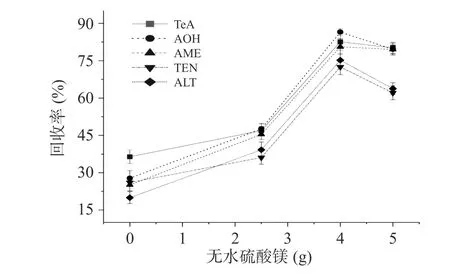
图4 无水硫酸镁用量对链格孢毒素回收率的影响Fig.4 Effect of the amount of anhydrous magnesium sulfate on the recovery of Alternaria toxin
2.4.4 氯化钠用量 在样品前处理过程中加入氯化钠可以加大水相化合物的密度,从而加快水相与有机相分离。如图5,为确定氯化钠的用量,本研究试验在5 μg/g 加标水平下,分别考察了0.2、0.4、1 和1.5 g氯化钠用量对5 种链格孢毒素回收率的影响。结果显示,当氯化钠用量为1 g 时,TeA 回收率最高为85.26%,ALT 回收率最低为67.41%,AOH 回收率为81.35%,TEN 回收率为66.41%,ALT 回收率为67.24%。本研究选择氯化钠用量为1 g。
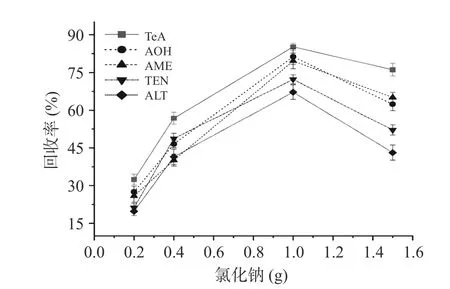
图5 氯化钠用量对链格孢毒素回收率的影响Fig.5 Effect of sodium chloride dosage on the recovery of Alternaria toxin
2.4.5 复溶溶剂 提取液经过旋转蒸发至近干后,使用一定配比的有机溶剂对待测组分进行复溶可以恢复链格孢毒素的化学结构和活性,便于上机检测。如图6,为确定复溶溶剂的配比,本实验研究在5 μg/g 加标水平下,分别考察了乙腈:甲醇=1:1、乙腈:甲醇:甲酸=70:29:1、乙腈:水=1:1 和甲醇:水=1:9 对5 种链格孢毒素回收率的影响。结果表明:当以乙腈:甲醇:甲酸=70:29:1 作为复溶溶剂时,AME 回收率最高达96.3%,ALT 回收率最低为64.93%,TeA、AOH 和TEN 回收率在82.67%~95.61%。因此本研究选择乙腈:甲醇:甲酸=70:29:1 作为复溶溶剂。

图6 复溶溶剂对链格孢毒素回收率的影响Fig.6 Effect of redissolved solvent on the recovery of Alternaria toxin
2.5 固相萃取法提取毒素
2.5.1 固相萃取柱 固相萃取方法中萃取柱的选择至关重要,根据待测组分的化学性质选择相应填料的固相萃取柱能在去除杂质保留待测物质的同时提高待测物质的提取率。如图7,为选择合适的固相萃取柱,根据链格孢毒素性质和固相萃取柱填料,本研究在5 μg/g 加标水平下分别对比了HLB LP Extraction 固相萃取柱和Vac Alumina B 固相萃取柱对液体红枣样品中链格孢毒素回收率的影响,发现使用HLB LP Extraction 固相萃取柱净化后的液体红枣样品中AOH 回收率最高为96.20%,TeA 回收率最低为79.63%,AME 回收率为95.47%,TEN 回收率为89.17%,ALT 回收率为94.23%。HLB LP Extraction 固相萃取柱对链格孢毒素的提取率高,准确性好,适用性强。这与邢家溧等研究人员报道的以HLB 小柱分离纯化婴幼儿奶粉中7 种链格孢霉毒素的回收率在73.1%~92.8%之间,效果略好于其他类型小柱,且HLB 小柱适用性强,在上样过程中,小柱干涸不影响分离效果的结果相一致。

图7 固相萃取柱对链格孢毒素回收率的影响Fig.7 Effect of solid phase extraction column on the recovery of Alternaria toxin
2.5.2 过滤膜 作为过滤杂质保留待测组分的最后一道工序,过滤膜的选择同样影响测定结果的准确性。目前可用于样品溶液过滤的滤膜种类较多,主要区别在于过滤膜的材质。如图8,为尽可能减小系统误差,探究过滤膜对链格孢毒素回收率的影响,本研究试验分别使用聚醚砜膜(PES)、聚四氟乙烯膜(PTFE)、尼龙膜(Nylon)和聚偏二氟乙烯膜(PVDF)4 种过滤膜过滤加标水平为5 μg/g 的样品溶液,发现使用PTFE过滤膜的AME 回收率最高为97.51%,ALT 回收率最低为67.64%,TeA、AOH 和TEN 回收率在82.93%~96.59%。PTFE 能在过滤杂质的同时最大程度保留待测组分,因此本研究选择聚四氟乙烯膜(PTFE)作为过滤膜。
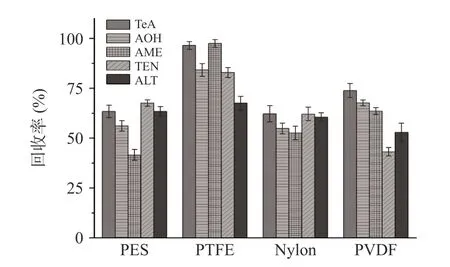
图8 过滤膜对链格孢毒素回收率的影响Fig.8 Effect of filtration membrane on the recovery of Alternaria toxin
2.6 回收率和精密度
如表5,以不含5 种链格孢毒素的固体红枣样品和液体红枣样品作为本底,在2.5、5、10 μg/kg 三个加标水平下进行回收率试验,每个加标水平重复测试5 次。结果表明,固体红枣样品中5 种链格孢毒素回收率在74.89%~98.04%,液体红枣样品中5 种链格孢毒素回收率在68.35%~99.83%,2 种形态红枣样品加标回收率的相对标准偏差均小于10%。本方法在2.5~10 μg/kg 标准添加量下均有较高的回收率,且精密度良好,能满足红枣中5 种链格孢毒素的检测要求。
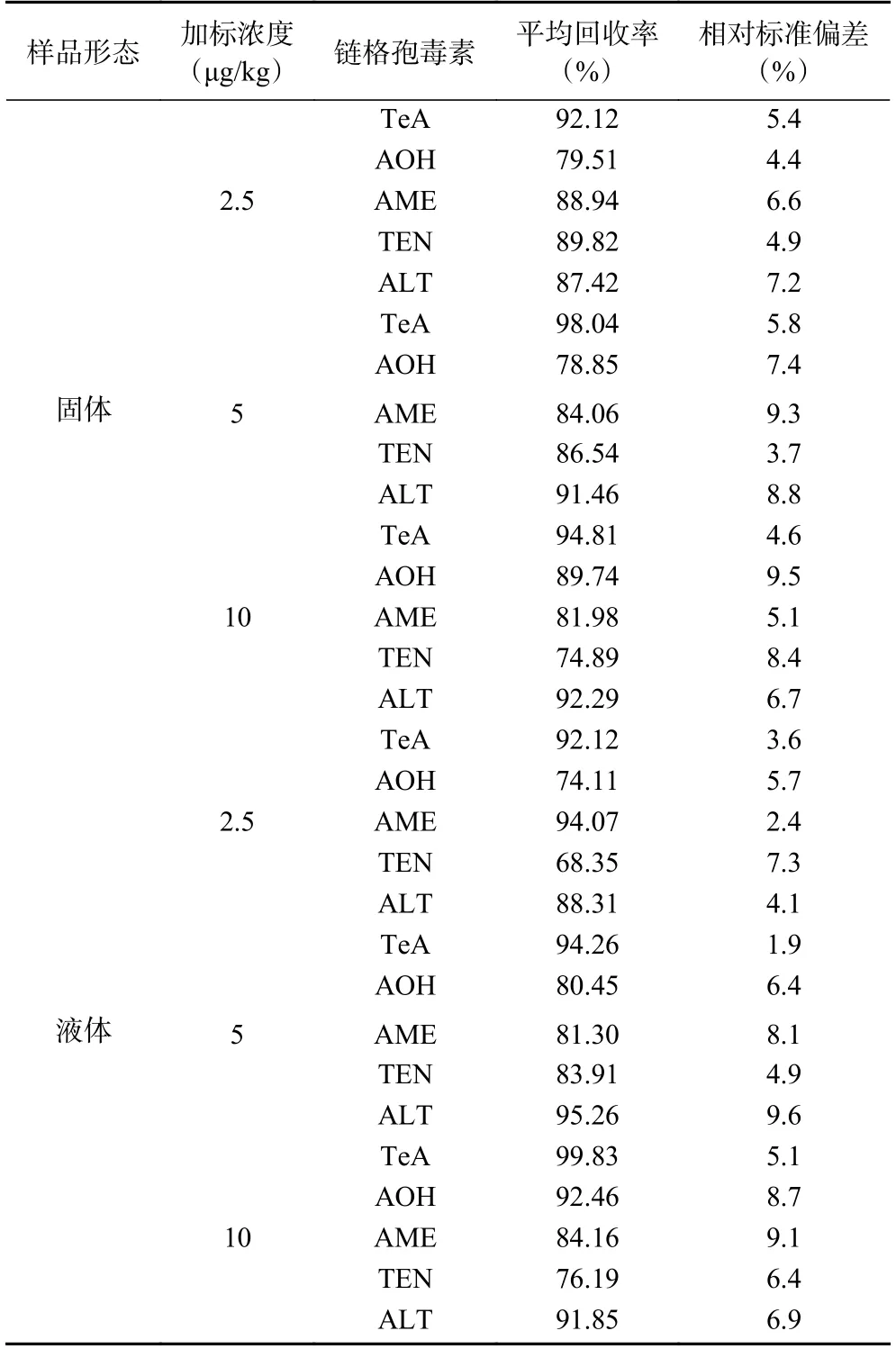
表5 红枣样品中链格孢毒素的加标回收率和精密度(n=5)Table 5 Recovery and precision of Alternaria toxin in jujube samples (n=5)
2.7 原料红枣中链格孢毒素测定
对采集自新疆阿克苏、喀什、和田地区三个主要红枣产区的原料骏枣进行链格孢毒素测定。如表6,三个主要红枣产区原料骏枣中共检出2 种链格孢毒素,分别是TeA 和AOH,其中喀什地区原料骏枣中TeA的检出率最高,达到99.22%,含量为5.12~10.76 μg/kg,这与程家兴等研究报道中TeA 检出率最高相一致。阿克苏地区原料骏枣中AOH 的含量最高,达11.12~53.22 μg/kg;链格孢毒素AME、TEN 与ALT在三个主要红枣产区的原料骏枣均未检出。

表6 原料红枣中链格孢毒素含量(n=5)Table 6 Content of Alternaria toxin in jujube (n=5)
2.8 红枣制品中链格孢毒素测定
本实验分别对冻干枣片、香酥脆枣、紫晶枣、红枣酒、红枣提取物中的链格孢毒素进行测定,如表7,结果显示,冻干枣片中检出链格孢毒素TeA 和ALT,这2 种毒素在冻干枣片中的平均含量分别为7.68、2.12 μg/kg;香酥脆枣中同样检出链格孢毒素TeA和ALT,平均含量分别为6.91、200.76 μg/kg;紫晶枣中检出链格孢毒素TeA、AOH 和ALT,平均含量分别为7.03、75.17、92.65 μg/kg;红枣酒中TeA 毒素含量在125.31~129.07 μg/kg 范围内;红枣提取物中 的TeA 毒素含量在121.73~132.86 μg/kg 范 围内。在所检5 种红枣制品中TEA 毒素均有检出,AOH 毒素仅在紫晶枣中有检出,ALT 毒素在香酥脆枣中的含量相对较高。就毒素种类而言,紫晶枣中检出的链格孢毒素种类最多,其次是冻干枣片和香酥脆枣,在红枣酒和红枣提取物中的种类最少。就产品品项而言,红枣酒受TeA 毒素污染最严重,其次是红枣提取物。所有红枣制品均未受到AME 和TEN的污染,这与原料红枣中的毒素分布情况一致。

表7 红枣制品中链格孢毒素含量Table 7 Content of Alternaria toxin in jujube products
3 结论
本研究以QuEChERS 为核心,结合固相萃取法建立了红枣及其制品中链格孢毒素的超高效液相色谱-串联质谱测定方法。分别采用QuEChERS 方法和固相萃取法提取固体、液体红枣样品中链格孢毒素;经超高效液相色谱-串联质谱检测,保留时间定性,外标法定量;5 种链格孢毒素在2.5~10 μg/kg 标准添加量下回收率均在68.35%~99.83%,相对标准偏差小于10%。该方法操作便捷、准确度高、灵敏性好,能够满足红枣及其制品中链格孢毒素的测定要求。应用该方法对阿克苏、喀什、和田三个地区原料骏枣和市售11 种红枣制品中的链格孢毒素进行污染分析。三个地区的原料骏枣中共检出TeA、AOH 2 种毒素,喀什地区原料骏枣中的TeA 含量最高,为5.12~10.76 μg/kg。11 种红枣制品中共检出TeA、AOH、ALT 3 种毒素,红枣酒中的TeA 含量最高,达到127.08 μg/kg,紫晶枣中检出AOH,含量在34.76~98.61 μg/kg;冻干枣片、香酥脆枣和紫晶枣中检出ALT,含量在2.04~399.64 μg/kg。为红枣采后贮藏及红枣加工制品中链格孢毒素的污染防治和管理措施制定提供技术支持,为红枣及其制品的食用安全性评价提供理论依据和参考。
