红极参肽的酶法制备工艺优化及其抗氧化评价
2022-10-11刘金丽何晓霞邹圣灿曹廷锋
刘金丽,樊 芳,何晓霞,邹圣灿,曹廷锋,
(1.青岛琛蓝生物科技有限公司,山东青岛 266200;2.青岛海关技术中心,山东青岛 266000)
红极参()又称冰岛红参或北极红参,是一种棘皮海洋动物,属海参纲瓜参科,主要产自靠近北极圈的冰岛,是生长于北大西洋海域水下30 英尺左右的野生海参,表层水温不超过4 ℃,参龄一般10 年以上,由于生长环境的特殊性和较长的生长周期,红极参体内几乎不含任何污染物且积累了丰富的营养物质,其参体体大肉厚,肉质金黄,富含蛋白质、海参多糖、海参皂苷、维生素和微量元素,品质高于一般品种的海参,且当地的红极参主要用于出口,价格低廉,因此红极参具有极大的开发应用价值。
不同品种的海参的粗蛋白含量有所差异,赵玲等对比了黑海参、绿刺参、糙刺参等10 种海参营养成分,结果显示黑北极参蛋白含量最高,为87.20%,绿刺参蛋白含量最低,为73.58%。海参肽是源于海参蛋白的肽类产品,具有高蛋白、低脂肪、易吸收的特点。近年来研究表明海参肽还通常具备特定的生物活性,王迪等通过复合酶酶解北极参,工艺优化后的多肽得率为15.38%;杨东达等利用刺参内脏酶解制备海参肽,优化的工艺条件下水解度可达48.9%。曹学彬等利用5 种蛋白酶酶解北极海参蛋白得到的5 种多肽对超氧阴离子和羟自由基均有不同程度的清除作用;另有报道由富含蛋白的仿刺参()制备的海参肽具有通过清除细胞内的活性氧(ROS)和DPPH 自由基来延缓衰老的作用;高云龙等制备的冰岛刺参内脏团抗氧化肽,对DPPH 自由基清除率和羟基自由基清除率分别为89.18%和71.86%;除抗氧化作用外,海参还有其他功效,例如Zhang 等发现海参来源的富含二十碳五烯酸的磷脂可通过抑制小鼠体内的脂滴相关蛋白FSP27 来抑制脂质积累。Wargasetia 等研究表明海参肽可通过抑制蛋白(EGFR,PI3K,AKT1,CDK4)的过量表达来抑制乳腺癌。海参种类繁多,目前较多的研究集中在刺参、糙刺参、茄参等大众熟知的种类,针对红极参的研究仍相对较少。
本文以去内脏的红极参体壁肉为原料,选用水产复合蛋白酶酶解,以水解度为指标,通过单因素与响应面试验确定酶解制备红极参肽的最优工艺。并对红极参肽粉的营养构成、氨基酸组成、相对分子质量和体外抗氧化作用进行分析,为红极参产品的开发利用和精深加工提供理论依据和科学参考。
1 材料与方法
1.1 材料与仪器
冰鲜红极参()、冰鲜土耳其刺参() 青岛蓝润生物工程有限公司;冰鲜仿刺参()、冰鲜海地瓜() 烟台浩霞水产服务部;复合蛋白酶(中性蛋白酶:碱性蛋白酶:木瓜蛋白酶为2:1:1)40 万U/g 南宁庞博生物工程有限公司;甲醇、乙腈 色谱纯,国药集团化学试剂有限公司;氨基酸标准品 美国Sigma 公司;其他化学试剂均为分析纯。
HH-6 数显恒温水浴锅 常州隆和仪器制造有限公司;L550 台式高速离心机 湘仪离心仪器有限公司;UV-5200 紫外可见分光光度计 上海元析仪器有限公司;SHW120J 实验室搅拌器 上海盛海威电气仪表有限公司;K9860 全自动凯氏定氮仪 海能未来技术集团有限公司;氨基酸分析仪 安捷伦科技(中国)有限公司;岛津LC-20A 液相色谱仪 岛津公司;TSKgel G2000 SWXL 色谱柱 东曹(上海)生物科技有限公司。
1.2 实验方法
1.2.1 红极参的酶解工艺 前处理:取冰鲜的红极参及土耳其刺参、仿刺参和海地瓜,经过化冻、去肠得到海参体壁肉,取出部分红极参肉均质打浆,粒度不大于2 mm,200 g 每袋分装冻存,用于酶解实验。其余3 种海参肉及剩余的红极参肉置于105 ℃鼓风干燥箱中烘干至恒重,磨粉,用于营养成分分析。
酶解过程:取200 g 红极参肉浆,加入定量的蒸馏水,搅拌混匀。调节料液pH,在恒温水浴锅中搅拌预热10 min,加入适量的复合蛋白酶,搅拌酶解。酶解结束后沸水浴10 min 灭酶,冷却后离心(5000 r/min,15 min),上清液即为红极参酶解液,用于水解度测定,酶解液依次通过1.2 和0.45 μm 滤膜除杂质,收集过滤清液并喷干即得红极参肽粉,用于肽粉的营养组分、氨基酸含量、抗氧化能力及分子量的测定。
1.2.2 营养组分的测定 水分、灰分、粗蛋白、粗脂肪、海参皂苷分别按照国标GB 5009.3-2016、GB 5009.4-2016、GB 5009.5-2016、GB 5009.6-2016、GB/T 33108-2016中方法测定;多糖的测定采用苯酚-硫酸法。
1.2.3 单因素实验 酶解实验中固定参数为:酶解温度55 ℃、酶解pH7.0、料液比1:2(w:v)、加酶量1200 U/g、酶解时间4 h;然后分别对酶解温度(30、40、50、60、70 ℃)、酶解pH(5.0、6.0、7.0、8.0、9.0)、料液比(1:1、1:1.5、1:2、1:2.5、1:3)、加酶量(600、800、1000、1200、1500 U/g)和酶解时间(2、4、6、8、10 h)5 个因素进行单因素实验,以水解度为指标,测定各因素对水解度的影响。
1.2.4 响应面试验 在单因素实验的基础上,以酶解温度(A)、加酶量(B)、酶解时间(C)为因素,根据Box-Behnken 中心组合设计3 因素3 水平的响应面试验,以水解度为响应值,对酶解工艺进行优化。其中因素水平表如表1 所示。

表1 响应面试验因素与水平Table 1 Response surface experimental factors and levels
1.2.5 水解度的测定 水解度是指蛋白质水解过程中被裂解的肽键数与底物中蛋白质总肽键数之比,红极参酶解液水解度按照下面公式进行计算,其中氨态氮含量的测定依据邻苯二甲醛法,具体操作步骤参考徐永霞等的方法,底物中总氮含量依GB 5009.5-2016 中的凯氏定氮法进行测定。水解度的计算公式为:

1.2.6 红极参肽相对分子质量分布的测定 采用高效液相色谱法,有关色谱条件及具体操作步骤参照GB 31645-2018。将红极参肽粉配制成浓度为5.0 mg/mL 的样品用于测定,利用相对分子质量回归方程计算红极参肽的相对分子质量大小,根据色谱峰峰面积计算不同分子量段的占比。
1.2.7 氨基酸组成测定 喷干的红极参肽粉氨基酸组成按照GB 5009.124-2016 食品安全国家标准 食品中氨基酸的测定中方法进行检测。
1.2.8 红极参肽体外抗氧化能力的测定
1.2.8.1 羟自由基清除率的测定 采用陈发河等的方法。将肽粉配制成不同浓度的待测溶液,向试管中依次加入1.0 mL 磷酸盐缓冲液(pH7.4)、1.0 mL番红花红试剂(100 mg/L)、1.0 mL EDTA-Fe试剂(1 mmol/L)、0.5 mL 待测液和1mL 3%的HO溶液,混匀,37 ℃水浴30 min,反应完毕后以1.0 mL磷酸缓冲液加3.5 mL 去离子水调零,测定520 nm处的吸光值A。以蒸馏水替代样品测定吸光值A,用蒸馏水替代样品和HO测定吸光值A。将V配制成与待测液相同的浓度,按上述步骤测定吸光值,作为阳性对照。羟自由基清除率公式为:
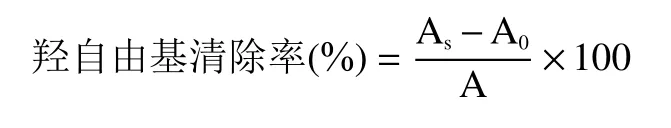
式中:A为样品组吸光值;A为空白组吸光值;A 为对照组吸光值。
1.2.8.2 超氧阴离子清除率的测定 超氧阴离子是由邻苯三酚在弱碱性环境中自身氧化分解产生。依据文献[23-24]的方法,加以改进,取Tris-HCl 缓冲液(pH8.2,0.05 mol/L)3.5 mL 和各浓度红极参肽粉溶液1.0 mL,混匀,25 ℃水浴中预热20 min。再加入0.5 mL 10 mmol/L 邻苯三酚试剂,充分混匀,25 ℃水浴中准确反应5 min,迅速加入 10 mol/L 的浓盐酸1.0 mL 终止反应。波长325 nm 处测得吸光值A,以相同体积的蒸馏水代替样品,测得吸光值A,同样将V配制成与待测液相同的浓度,按上述步骤测定吸光值,作为阳性对照。超氧阴离子清除率计算公式:

式中:A为空白组的吸光值;A为加入样品组吸光值。
1.3 数据处理

2 结果与分析
2.1 基本营养成分分析
红极参与仿刺参、海地瓜、土耳其刺参的基本营养成分占干基比重如表2 所示。红极参的蛋白含量和总皂苷含量在四种海参中最高,加之其无污染的生长环境和潜在的经济开发价值,后期选用红极参作为海参肽制备的实验材料进行研究。
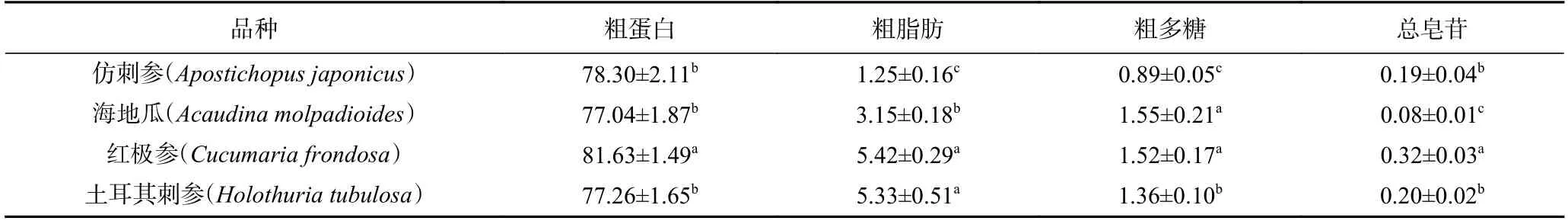
表2 不同品种海参中基本营养成分组成(干基,g/100 g)Table 2 Approximate nutrients in different kinds of sea cucumbers (in dry basis,g/100 g)
2.2 单因素实验结果
2.2.1 酶解温度对水解度的影响 酶解温度对蛋白质水解度的影响结果见图1。当温度由30 ℃升高至50 ℃,反应体系的蛋白质水解度快速升高,50 ℃时蛋白质水解度达到最大值26.17%±0.47%。当温度继续升高,水解度率呈下降趋势。这是因为温度过低会降低酶分子在酶解反应中运动的激烈程度,酶与底物结合几率变小;温度过高会影响酶分子的空间构型,导致酶活性降低,因此选择酶解温度为50 ℃。

图1 酶解温度对水解度的影响Fig.1 Effect of enzymatic hydrolysis temperature on the degree of hydrolysis
2.2.2 初始pH 对水解度的影响 图2 反映了初始pH在5.0~9.0 范围内酶解液蛋白质水解度的变化。从图中可以看出,随pH 的升高,酶解液的蛋白质水解度先显著增大(<0.05),pH 为7.0 时,蛋白质水解度为26.13%±0.58%,之后再增大pH,水解度缓慢降低,这是因为pH 影响蛋白酶的活性,过酸或过碱均会使酶活降低。红极参酶解料液的自然pH 在6.0~7.0 之间,而在这一范围内,水解度无明显变化,说明复合蛋白酶在此pH 范围具有良好的活性。另外,在实际工业化生产中,中性条件不易造成设备损害,因此选择红极参酶解的最适pH 为7.0。

图2 酶解初始pH 对水解度的影响Fig.2 Effect of initial pH of enzymatic on the degree of hydrolysis
2.2.3 料液比对水解度的影响 料液比对水解度的影响结果见图3。当料液比从1:1.0 变化到1:1.5时,水解度显著上升(<0.05),当料液比在1:1.5~1:2.5之间时,水解度无显著变化(>0.05),这是由于开始体系中水占比较小,酶解底物浓度过高,料液粘稠、蛋白吸水溶胀导致流动性差,不利于底物和酶的扩散,从而抑制了酶解作用,随着料液比增大,酶与底物充分接触,酶解反应加快,水解度升高,料液比为1:2 时水解度达到最大27.01%±0.34%,继续增大料液比,底物中红极参蛋白浓度降低,底物与酶分子结合的几率变小,水解度降低。在规模化生产中,酶解效果无明显差异时,优先选择较低的料液比,有利于增加产量,节省成本。综上所述,选择最佳料液比为1:1.5。
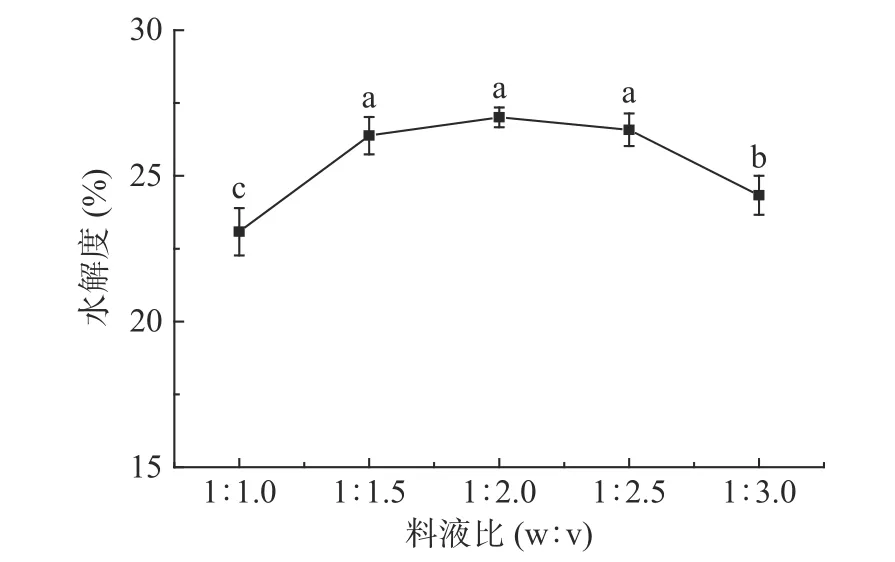
图3 料液比对水解度的影响Fig.3 Effect of material liquid ratio on the degree of hydrolysis
2.2.4 加酶量对水解度的影响 加酶量对蛋白质水解度的影响如图4 所示。结果显示,红极参蛋白质水解度随着酶制剂用量的增加而增大,当加酶量在600~1000 U/g 范围内时,水解度显著增加(<0.05),加酶量为1000 U/g 时的水解度为26.26%±0.33%;这是由于酶解过程中,酶量增多利于底物与酶的接触,酶解反应加速。继续增加酶制剂用量时,水解度无显著增加(>0.05)。这是由于酶解过程中,大分子蛋白被水解后减少,小分子多肽产物增多,产物的增多反馈抑制了底物与酶的结合,减缓了水解进程。由以上分析可知,选择适宜的加酶量既能达到理想的酶解效果,又能避免酶制剂的浪费。因此,选择最佳加酶量为1000 U/g。

图4 加酶量对水解度的影响Fig.4 Effect of enzyme dosage on the degree of hydrolysis
2.2.5 酶解时间对水解度的影响 酶解时间对蛋白质水解度的影响如图5 所示。随着酶解时间的延长,水解度逐渐增大,当酶解时间超过6 h,水解度无显著增加(>0.05)。原因是在酶解反应初期,底物与酶的浓度较高,酶解速度较快,随着酶解反应的进行,底物大蛋白分子逐渐被酶解,浓度降低,酶解反应变缓,水解度上不再增加。因此选择酶解时间为6 h。
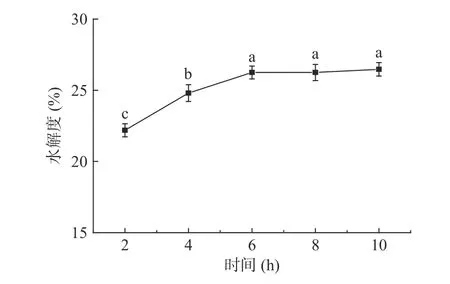
图5 酶解时间对水解度的影响Fig.5 Effect of enzymatic hydrolysis time on the degree of hydrolysis
2.3 响应面结果与分析
2.3.1 响应面试验设计与结果 基于复合蛋白酶各单因素实验结果,以酶解温度、加酶量、酶解时间为影响水解度的主要因素,按照Box-Behnken 试验原理设计三因素三水平的响应面试验,具体试验设计与结果见表3。

表3 响应面试验设计与结果Table 3 Response surface experimental design and results
2.3.2 模型回归及显著性分析 应用Design Expert 11 对表3 数据进行二次多元拟合,得到回归方程为Y=29.53-0.015A+0.88B+1.36C-1.16AB-0.67AC+0.3BC-2A-2.2B-2.22C,决定系数=0.9813,说明拟合度较好,可用于分析和预测。方差分析结果如表4 所示,该模型<0.0001,极显著;失拟项=0.3028>0.05,不显著;调整决定系数=0.9572,说明该模型能解释约95%响应值的变化,拟合度良好。由回归方程系数显著性检验可知,模型中一次项B(加酶量)、C(时间)对响应值的影响为极显著(<0.01),A(温度)影响不显著;由值可知,各因素对红极参水解度的影响顺序为:C(时间)>B(加酶量)>A(温度)。温度与加酶量的交互作用对响应值的影响极显著(<0.01),温度与酶解时间的交互作用对响应值的影响显著(<0.05) 。
2.3.3 因素间的交互作用分析 根据多元二次回归方程做相应曲面,如图6~图7 所示,响应面均呈陡坡状且等高线为椭圆形,说明温度、加酶量和时间两两之间存在交互作用,且温度与加酶量、温度与时间之间的交互作用对水解度影响较大。这与表4 中交互项AB 处于极显著、AC 处于显著水平是一致的。

图6 酶解温度与加酶量交互作用对红极参水解度的影响Fig.6 Effect of the interaction between enzymolysis temperature and enzyme dosage on the degree of hydrolysis of Cucumaria frondosa

图7 酶解温度与时间对红极参水解度的影响Fig.7 Effect of the interaction between enzymolysis temperature and time on the degree of hydrolysis of Cucumaria frondosa

表4 响应面模型的方差分析Table 4 Analysis of variance of the response surface model
2.3.4 最佳工艺参数验证 通过回归方程最终确定的优化酶解参数为温度49.32 ℃、加酶量1052.00 U/g、酶解时间为4.69 h,水解度为29.88%。为方便操作,将酶解温度调整为49 ℃,酶解时间为4.7 h,因此在优化后的酶解条件:料液比为1:1.5(w:w)、初始pH7.0、酶解温度49 ℃、加酶量1052 U/g、酶解时间4.7 h 下进行3 批次验证试验,测得红极参的水解度为30.51%±0.85%,与预测值29.88%相比无明显差异,且高于其他条件组合的结果,表明模型方案可靠,具有参考价值。
2.4 红极参肽粉组分分析
对酶解制得红极参肽粉的营养成分检测如表5所示,红极参肽粉具备高蛋白低脂肪的特点,同时在经过酶解、酶解液离心、过滤和喷雾干燥等过程后还保存了部分海参多糖和海参皂苷这些活性物质,因此红极参肽粉作为一种绿色健康的食品原料,具有很高的营养价值和潜在的功能性价值。

表5 红极参肽粉的组成成分Table 5 Nutrients in the Cucumaria frondosa peptide
2.5 分子量分布
红极参肽粉分子量分布谱图如图8 所示,各峰详细信息见表6,根据GPC 数据分析软件计算可知,红极参肽粉的平均分子量403 Da,分子量小于1 kDa的占比92.81%,分子量小于3 kDa 占比98.85%,小于5 kDa 占比99.89%,以上结果表明,最佳酶解工艺下酶解效果较好,产物中处于2~10 肽之间的低聚寡肽含量较高。现有研究表明,不同分子量的海参肽抗氧化能力不同,通常小分子的海参肽生物利用率高,比氨基酸更易吸收且抗氧化活性相对要好。史亚萍等的研究显示,分子量小于1 kDa 的海参肽对超氧阴离子的清除活性最强。曹学彬等研究的5 种酶解海参肽中,胰蛋白酶酶解的海参多肽中低分子量比重较大,综合抗氧化能力最好。因此推测制备的红极参肽粉可能具有抗氧化的作用。

表6 红极参肽相对分子质量分布Table 6 Molecular weight distribution of Cucumaria frondosa peptide

图8 红极参肽分子量分布色谱图Fig.8 Chromatogram of the molecular weight distribution of Cucumaria frondosa peptide
2.6 氨基酸含量分析
多肽的抗氧化作用不仅与分子量有关,还与组成多肽的氨基酸序列有关,因此对红极参肽粉进行了氨基酸组成的分析,结果如表7 所示,其中疏水性氨基酸含量达38.00%。葛晓鸣等研究曾发现疏水性氨基酸含量(21.39%)最高的海马多肽PH-V 在5 种多肽中抗氧化效果是最好的。这是由于疏水氨基酸有助于接近自由基,对抑制脂质过氧化有积极作用。两种酸性氨基酸天冬氨酸和谷氨酸含量总计为21.17%。有研究发现酸性氨基酸侧链羧基能钝化金属离子,终止自由基链式反应。除此之外,鲜味氨基酸占比为44.10%、必需氨基酸含量为21.27%,因此红极参肽粉是一种营养丰富,味道鲜美,同时可能具有抗氧化作用的高品质食品原料。
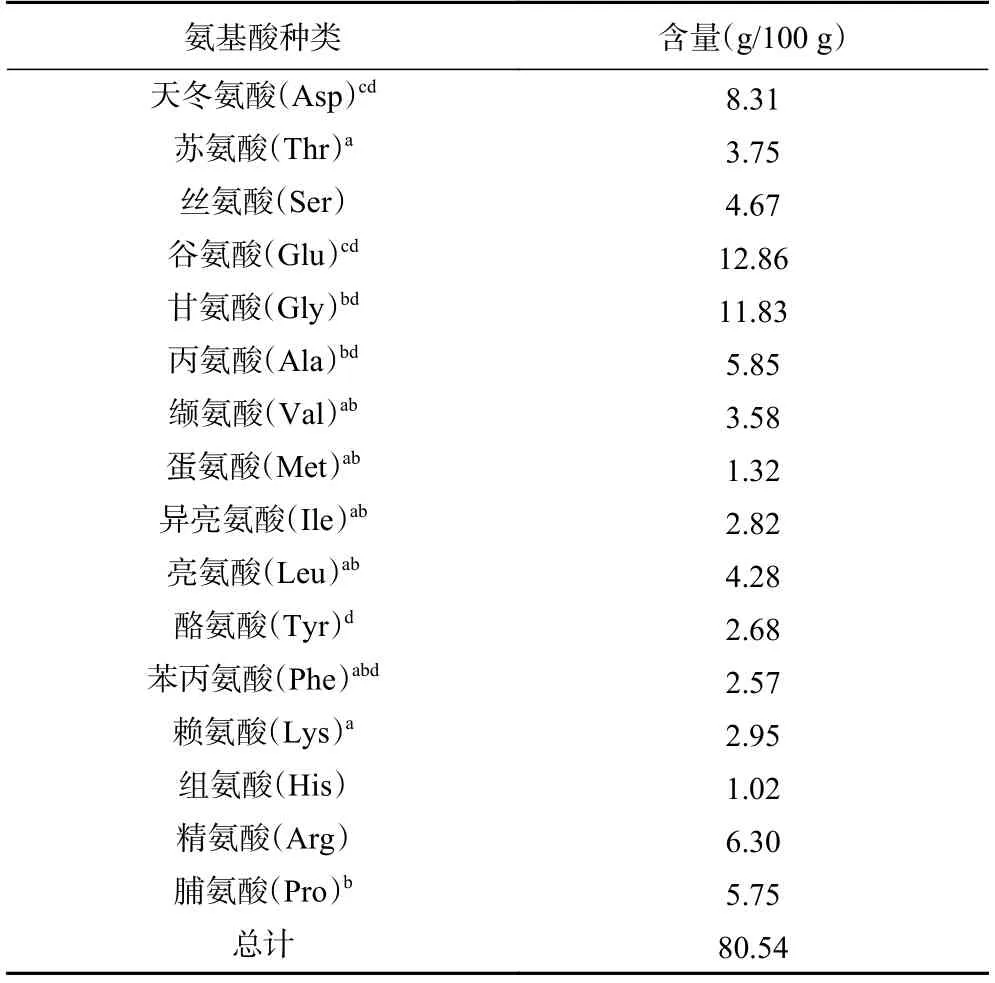
表7 红极参肽粉的氨基酸组成Table 7 Amino acid composition of Cucumaria frondosa peptide
2.7 红极参肽粉的抗氧化分析
羟自由基系活性氧的一种,是目前已知的对生物体毒性最强、危害最大的一种自由基,它可以杀死红细胞,降解DNA,还可与生物体内的多种分子作用,造成细胞膜、多糖化合物和脂类等物质的氧化损伤,从而引起机体功能的紊乱。超氧阴离子是活性氧的另一种的自由基,与羟基结合后的产物对细胞有较强的氧化毒性,与人体的衰老及癌症等疾病的发生有关。
对酶解制备的红极参肽粉进行羟自由基和超氧阴离子的清除率检测分析,结果如图9~图10 所示,随肽粉溶液浓度的增大,对羟自由基和超氧阴离子的清除能力也逐渐增强,其中对羟自由基的清除能力高于V,对超氧阴离子的清除能力不及V,这一结果与陈发河等报道的海地瓜多肽的抗氧化能力相符。肽粉浓度为0.50 mg/mL 时,对羟自由基的清除率为91.84%±1.19%;肽粉浓度为1.20 mg/mL 时,对超氧阴离子的清除率为92.32%±2.21%。红极参肽粉清除羟自由基和超氧阴离子的IC分别为0.19和0.49 mg/mL,表明红极参肽粉具备较好的体外抗氧化能力,这与其较低的分子量分布和特定氨基酸组成有密切关系。

图9 红极参肽和VC 对羟自由基的清除能力Fig.9 Scavenging rates of Cucumaria frondosa peptide and VC on hydroxyl free radicals

图10 红极参肽和VC 对超氧阴离子的清除能力Fig.10 Scavenging rates of Cucumaria frondosa peptide and VC on superoxide anions
3 结论
本研究以水解度为评价指标,通过单因素和响应面试验优化得到复合蛋白酶酶解红极参的最佳工艺:料液比1:1.5(w:w),温度49 ℃、初始pH 为7.0、加酶量1052 U/g、酶解时间4.7 h,此条件下红极参蛋白质水解度可达30.51%±0.85%,分子量小于1 kDa 的占比92.81%。红极参肽粉中富含疏水性和酸性氨基酸,对羟自由基和超氧阴离子清除率IC分别为0.19、0.49 mg/mL,显示了良好的抗氧化活性。红极参肽可作为膳食营养补充剂应用于保健食品或特殊功能性辅助食品中,也可应用于抗氧化、延缓衰老相关的护肤品原料,因此具备较大的开发潜力和市场前景。本研究为红极参资源的工业化利用提供了理论基础,但对抗氧化起决定性作用的肽段分子量及多肽序列有待更深入研究。
