鲭鱼发酵过程中挥发性风味成分与细菌种群演替的相关性研究
2022-10-11杜颖琦范丽莉欧昌荣汤海青温海英
杜颖琦,范丽莉,欧昌荣,2, ,汤海青,温海英
(1.宁波大学食品与药学学院,浙江宁波 315800;2.浙江省动物蛋白食品精深加工技术重点实验室,浙江宁波 315800;3.浙江药科职业大学食品学院,浙江宁波 315100)
鲭鱼是一种常见的经济鱼类,广泛分布于西太平洋,含有丰富的蛋白质、脂肪、维生素等营养成分,尤其是二十碳五烯酸和二十二碳六烯酸,对心脑血管健康有益,但鲜鱼在储存和运输过程中容易腐败,严重限制了产品的保质期,通过对鱼肉发酵可以增强食品的感官特性和营养价值,以及延长食品保质期,因此,发酵是许多国家的主要食物储存方法。传统的固态发酵鱼是通过复杂的微生物活动自然发酵,存在含盐量高,发酵周期长,产品稳定性难以控制以及显著的风味差异不利于大规模生产等缺点。采用现代生物发酵技术可以缩短发酵时间,稳定和提高发酵鱼的质量,使发酵鱼制品实现标准化和规模化生产。有研究报道,接种发酵剂植物乳杆菌和嗜酸乳杆菌的发酵制品比自发发酵的产品更安全,并且在其中检测到的生物胺更少。
发酵食品是一种复杂的微生态系统,依赖于酶与微生物代谢活动之间的相互作用。微生物群落在鱼类发酵过程中不仅可作为酶和必需营养素的来源,并且其代谢演替决定了风味物质的组成和含量。挥发性风味化合物及其前体是由发酵过程中蛋白质和脂类的降解和缩合反应产生的,与微生物活性密切相关,因此,研究食品发酵过程中风味形成的机理需要更关注微生物群落、风味和风味前体之间的关系。Illumina MiSeq 测序平台用于rRNA的高通量测序,是微生物多样性分析的重要研究工具。近年来,该方法已被用于研究各种发酵食品的微生物多样性,包括发酵牛奶和奥地利酸面团等。许多微生物在发酵鱼中具有开发风味的良好前景,逐渐引起研究者们的关注,已有研究人员成功研究了细菌成分与风味化合物之间的相关性,但是关于细菌演替与发酵鱼中挥发性风味成分之间的关系鲜有报道。因此,本研究采用气相色谱-离子迁移谱技术鉴定出接菌鲭鱼发酵过程中促进风味形成的特征挥发性化合物,并通过高通量测序手段显示出鲭鱼发酵过程中细菌群落动态变化,采用皮尔森(Pearson)相关性分析了鲭鱼发酵挥发性风味与细菌演替之间的相关性,确定接菌鲭鱼在发酵过程中的风味演替。
1 材料与方法
1.1 材料与仪器
鲭鱼 宁波路林水产品批发市场;植物乳杆菌24258()、嗜酸乳杆菌6074() 中国工业微生物菌种保藏管理中心;琼脂糖、细菌DNA 提取试剂盒 美国OMEGA 科技公司;DL2000、DNA Marker 上海意泓生物科技有限公司;6×Load Buffer 北京全式金生物技术有限公司。
H1850R 高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;JY-SPCT 电泳槽 北京君意东方电泳设备有限公司;NanoDrop-1000 微量分光光度计 美国BIO-RAD 公司;ArktikPCR 扩增仪 赛默飞公司;Flavour Spec 气相色谱-离子迁移谱(配有LAV Laboratory Analytical Viewer 和Library Search分析软件) 德国G.A.S 公司;H1850-R 台式高速冷冻离心机 湖南湘仪实验室开发有限公司;AL204天平 梅特勒-托利多仪器有限公司;Illumina MiSeq测序仪 美国Illumina 公司。
1.2 实验方法
1.2.1 样品处理
1.2.1.1 混合发酵剂的制备 参考Liao 等的菌种活化方法将植物乳杆菌和嗜酸乳杆菌接种于液体培养基中,37 ℃培养12 h,再以3%(v/v)接种量接种于肉汤培养基中扩培,并通过高速冷冻离心机在4 ℃下以5000 g 离心10 min 后弃去培养液收集菌体沉淀,加入适量无菌生理盐水(0.9% NaCI,w/v)洗涤两次后,调至菌液浓度为10~10CFU/g,按照植物乳杆菌发酵剂和嗜酸乳杆菌发酵剂体积比为1:1 制备混合发酵剂,将菌液于4 ℃保存,并于24 h 内使用。
1.2.1.2 鲭鱼样品的发酵 用蒸馏水洗涤、去头去尾,剔除鱼身中心主要骨刺并取出内脏,洗净腹腔黑膜,沥干后切成5 cm×3 cm×3 cm 的小块。将鲭鱼块与质量分数为8%的食盐,2%的蔗糖(以沥干鱼肉计重)混合翻拌混匀,压实,在4 ℃条件下腌制24 h,中间翻拌1~2 次,使鱼块腌制均匀。腌制结束后放置阴凉通风处,自然风干至表面没有水分后接种2%(v/v)的混合发酵剂,置于25 ℃恒温培养箱中发酵,分别在第0、6、12、18、24 d 取样测定鲭鱼发酵过程中挥发性风味化合物和细菌多样性变化,并进一步通过皮尔森分析两者相关性。样品按发酵时间进行编号(如MF06 表示发酵第6 d 样品)。
1.2.2 鱼肉DNA 提取和PCR 扩增
1.2.2.1 样品预处理 无菌条件下称取10 g 的发酵鲭鱼样品,加入10.0 mL 灭菌生理盐水,涡旋后离心5 min(4 ℃,2000×g)收集上清液,用四层纱布过滤,将上清液再次离心10 min(4 ℃,10000×g),收集菌体沉淀。
1.2.2.2 DNA 提取 按照DNA 试剂盒说明提取鱼肉样品DNA,并通过琼脂糖凝胶电泳实验检测DNA提取结果,用NanoDrop-1000 微量分光光度计测DNA 纯度,将检测合格的DNA 置于在-80 ℃冰箱备用。
1.2.2.3 PCR 扩增及测序 鱼肉用上游引物341F(5'-CCTACGGGNGGCWGCAG-3')和下游引物806R(5'-GGACTACNNGGGTATCTAAT-3')扩增细菌16S rRNA 基因的V3~V4 高变区,提取的DNA 用热循环聚合酶链反应系统进行扩增。
PCR 扩增体系总量为50 μL,包括2×Taq Master Mix(Dye)25 μL,正反向引物各2 μL、Template DNA 1 μL,补双蒸水(ddHO)至50 μL。扩增程序为:94 ℃预变性2 min;94 ℃变性30 s,50~65 ℃退火30 s,72 ℃延伸1 min,共35 个循环;72 ℃扩展2 min。利用PCR 纯化试剂盒对琼脂糖凝胶回收的PCR 产物进行纯化,然后用Nanodrop 2000 超微量分光光度计定量并按每个样本的测序要求进行混合,最后使用Illumina HiSeq 2500 平台对纯化的混合样本进行细菌rRNA 基因的高通量测序分析。为避免不同测序深度引起偏差对每个样品随机选取均一化到50000 序列用于后续的实验分析。
1.2.3 挥发性化合物检测
1.2.3.1 顶空进样条件 将2.5 g 样鲭鱼品置于20 mL顶空玻璃取样瓶中;顶空孵化温度40 ℃;孵化时间20 min;孵化转速500 r/min;进样体积500 μL;进样针温度85 ℃。
1.2.3.2 GC 条件 色谱柱:石英毛细管柱(15 m×0.53 mm,0.5 μm);色谱柱温度:60 ℃;载气:N(纯度≥99.999%);载气流速:开始2 mL/min;2~10 min,2~20 mL/min;10~20 min,20~100 mL/min;20~30 min,100~150 mL/min;分析时间:25 min。
1.2.3.3 IMS 检测条件 IMS 漂移装置安装在GC的顶部,漂移管长度:98 mm;漂移管温度:45 ℃;漂移气:N;漂移气流量:150 mL/min;放射源:射线。
1.2.4 相关性分析 将混和接菌鲭鱼发酵过程中微生物群落结构变化与挥发性风味物质的改变之间进行皮尔森相关性分析,结果显示细菌群落的变化与挥发性有机化合物的产生具有相关性。用Origin 作图,在属水平上相对丰度R>1%,0.01<<0.05 的用*标记;相对丰度R>1%,<0.01 用**标记。
1.3 数据处理
用FLASH 软件(version1.2.7,http://ccb.jhu.edu/software/FLASH/)对原始数据进行拼接二端序列;通过QIIME(quantitative insights into microbial ecology,http://qiime.org/)软件处理样品微生物群落的扩增子基因序列,去除质量较差的序列,包括质控和去除嵌合体;最后将相似性大于97%的序列聚类成操作分类单元(Operational Taxonomic Units,OTUs),去除古菌、叶绿体和非细菌序列及仅有一条序列的OTUs;采用Qiime 软件计算细菌群落丰富度和多样性;采用GC-IMS 设备自带的LAV(Laboratory Analysis tical Viewer)分析软件,GC-IMS Library Search 软件内置的2014NIST 数据库和IMS 数据库对特征风味物质进行定性分析;采用LAV 中Reporter和Gallery 插件程序构建不同样品间挥发性风味物质的差异图谱和指纹图谱;利用SPSS11.0 统计软件进行Pearson 相关性分析,Origin Pro9.0 软件作图。
2 结果与分析
2.1 鲭鱼发酵过程中风味物质变化规律
图1 为根据LAV 分析得到的鲭鱼发酵过程中的GC-IMS 三维谱图。可以直观看出,鲭鱼样品在发酵过程中挥发性有机物的种类较为相似,组间差异性观察存在困难。为了更好地横向比较分析贮藏时间对鲭鱼发酵过程中风味物质的影响,通过采用差异对比模式,将图1 进行降维处理得到图2。如图2 所示,纵坐标为保留时间,横坐标为迁移时间,红色竖线为反应离子峰,其两侧的每一点代表一种挥发性有机物。取发酵第0 d 的样品(MF00)作为参比,其他样品的谱图扣除参比。若背景为白色,表示挥发性物质浓度一致;若背景为蓝色,表示挥发性物质浓度低于参比;若背景为红色,表示挥发性物质浓度高于参比。可以看出,大多数信号保留时间范围为100~200 s,漂移时间为1.0~1.5 s,在相同的保留时间和漂移时间下,样品的挥发性物质含量各不相同。随着发酵时间的进行,样品挥发性物质含量明显增多,与发酵第0 d 相比,第6~24 d 的样品在200~400 s 的保留时间范围内发现更多红点,尤其是发酵后期颜色更深,表明随着发酵时间的延长,挥发性化合物的种类和浓度逐渐增加。
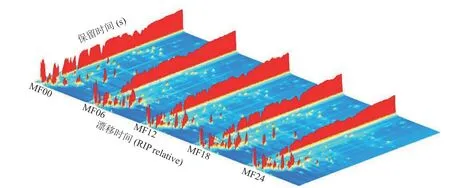
图1 鲭鱼发酵过程中挥发性风味物质的GC-IMS 三维谱图Fig.1 GC-IMS three-dimensional spectrogram of volatile flavor compounds during mackerel fermentation

图2 鲭鱼发酵过程中挥发性风味物质的GC-IMS 二维谱图Fig.2 GC-IMS two-dimensional spectrogram of volatile flavor compounds during mackerel fermentation
通过GC-IMS 技术对鲭鱼发酵过程中挥发性风味物质组分进行定性分析,共鉴定出酸类、醛类、醇类、酮类、酯类和呋喃类等51 种物质(见表1)。为进一步比较鲭鱼发酵过程中挥发性风味物质的动态变化情况,利用LAV 软件的GalleryPlot 插件,根据各物质组分在迁移谱中的信号峰生成指纹图谱,如图3 所示,横坐标表示挥发性化合物,纵坐标表示不同样品名称,数字编号表示未定性的化合物,已定性的化合物用其名称表示。其中,每行代表检测样品的所有信号峰,每列代表不同样品同一挥发性物质的信号峰。从挥发性风味物质的离子峰排列可明显看出,鲭鱼样品在第0 d 时含有的挥发性有机化合物以醛类、酮类物质居多,主要包括己醛、丙酮、2,4-庚二烯醛和2-戊烯醛等,此外还含有少量酸类和酯类物质。随着发酵时间的延长,鲭鱼中挥发性有机物的种类和浓度都有所增加,发酵第6 d,己醇、2-丁酮、丙酮、2-庚酮、3-甲基丁醛含量显著增加,3-羟基-2-丁酮和3-甲基丁醛的含量明显高于其他组,并产生了富含香气成分的乙酸乙酯等新的挥发性风味化合物,这是由于混合接菌的鲭鱼发酵过程中,在微生物及各种酶的作用下,一些大分子类物质被水解成小分子有机物。其中,醛类主要来源于脂质氧化,赋予发酵鲭鱼令人愉悦的青草或奶酪香味。酯类可赋予发酵鲭鱼香甜的果香味。酮类被认为是对发酵鲭鱼风味具有贡献的挥发性成分,赋予发酵鲭鱼花香及果香味,同时有助于消减鱼肉腥味。直至发酵第12 d,酯类、酮类含量增加,醛类相对含量减少,形成了独特的发酵风味,其中乙酸乙酯、2-甲基丁酸乙酯、乙酸异戊酯逐渐增加,之后继续发酵,酯类化合物的相对含量变化不明显,2-丁酮和2-庚酮含量显著降低,其含量之后基本无变化。2-庚醛(二聚体)、2-戊烯醛(二聚体)、2-庚酮(单体)等一些相对分子较大的物质含量增加,有辛辣和尖刺味的3-甲基丁酸及2-丁酮含量逐渐增加,并且具有水果香味的3-甲基丁醛含量逐渐降低,导致发酵鲭鱼风味不协调,鲭鱼发酵达到末期。由此可见,接菌发酵可以增加鱼肉挥发性风味物质的种类和含量,使发酵鱼肉风味更加浑厚,气味延绵。

图3 鲭鱼发酵过程中挥发性物质指纹谱图Fig.3 Fingerprint spectrum of volatile flavor compounds during mackerel fermentation

表1 鲭鱼发酵过程中的主要挥发性化合物Table 1 Volatile compounds during mackerel fermentation
2.2 鲭鱼发酵过程中微生物群落结构组成
通过对混合接菌鲭鱼发酵过程中微生物在门和属水平上的分布情况进行分析,结果如图4 所示。发酵鱼肉的细菌菌群主要有厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)和纤维杆菌门(Fibrobacteres)。在整个发酵过程中厚壁菌门的相对丰度最高,其它门只占少数。发酵第6 d,厚壁菌门相对丰度从97.0%下降至91.38%,而在发酵中后期,其相对丰度逐渐增加到98.81%。可见,厚壁菌门为发酵鲭鱼中的优势微生物,接种的植物乳杆菌和嗜酸乳杆菌均属于厚壁菌门,发酵中后期其相对丰度不断增加,抑制了相关腐败微生物生长;变形菌门的相对丰度先增加后减少最后又略微上升。

图4 鲭鱼发酵过程中细菌门水平的相对丰度Fig.4 Relative abundance of bacteria at phylum during mackerel fermentation
在属的水平上细菌共得到41 个属,由图5 可知,在发酵第0 d 乳杆菌属()、巨型球菌属()和葡萄球菌属()的相对丰度较大,是该发酵时期的优势微生物,三者的相对丰度分别为81%、10%和6.14%,这是由于鱼肉自身携带的微生物在适宜的条件下繁殖,随着发酵时间延长,接种的植物乳杆菌和嗜酸乳杆菌开始迅速增殖,抑制了大量微生物繁殖,仅有少量适应酸性环境的微生物生长,细菌丰富度减少。发酵第6 d,乳杆菌属()的相对丰度显著下降到46.74%(<0.05),随着发酵时间的延长,乳杆菌属()的相对丰度持续增加,这与Jiang 等的研究一致。发酵末期相对丰度达到94%,这是由于乳杆菌属()含有许多酶系,能产生能够分解脂肪酸、亚硝胺,产生控制内毒素等多种抗菌代谢产物,此外,乳杆菌属()与食品发酵过程中氨基酸的代谢有关,可以促进产品风味形成。巨型球菌属()在发酵过程中相对丰度一直减少,可能是发酵过程中代谢产物的影响。葡萄球菌属()在发酵第6 d 急剧增加到37.6%,随着发酵进行迅速下降至3.92%,之后趋于稳定,这可能是由于发酵过程中酸化作用和厌氧条件所致。该结果与Casaburi 等的报告结果一致,即酸化抑制了发酵香肠中葡萄球菌的生长。此外,也有研究报道,葡萄球菌可抑制脱羧酶生长,从而减少生物胺的产生,提高发酵鱼发酵质量。

图5 鲭鱼发酵过程中细菌属水平的相对丰度Fig.5 Relative abundance of bacteria at genus level during mackerel fermentation
除了占主导优势的乳杆菌属、葡萄球菌属和巨型球菌外,还有一些相对丰度较低的细菌存在发酵鱼样品中,如芽孢杆菌属()、不动杆菌属()、嗜甲基菌()、假单胞菌()、嗜冷杆菌()、青枯菌()、马赛菌()、鞘氨醇单胞菌属()、糖单胞菌()、魏斯氏菌属()等。其中,芽孢杆菌()能够分泌淀粉酶和糖化酶,主要与挥发性风味物质如吡嗪类、酮类、醛类、醇类的产生有关,部分芽孢杆菌属()有胺氧化酶或胺脱氢酶活性,在发酵过程中产生抗菌活性,可以有效降低生物胺的积累。鞘氨醇单胞菌()生命力旺盛,分布范围广泛,是海洋厌氧性超微细菌的代表,也是研究较多的藻类毒素的降解菌。有研究表明,不动杆菌()含量的增多会加速水产品品质的劣变进程,对水产品的品质特性有显著影响。马赛菌属()是产生甘露聚糖酶、淀粉酶、纤维素酶等多糖水解酶的菌株。魏斯氏菌()是一种产于发酵食品中的乳酸菌,在食品发酵过程中,能够发酵葡萄糖、甘露糖、麦芽糖等产生乳酸,赋予发酵食品新的感官质量和风味质量。糖单胞菌()的次级代谢产物对金黄色葡萄球菌和枯草芽孢杆菌有抑制作用。综上,乳杆菌属()、巨型球菌属()、葡萄球菌属()、芽孢杆菌属()、不动杆菌属()、嗜甲基菌属()、假单胞菌属()、魏斯氏菌属()等共同构成了发酵鲭鱼的细菌群落,为发酵鲭鱼特征风味的形成和产品安全特性提供良好的环境。
2.3 鲭鱼发酵过程中微生物多样性分析
利用Alpha 多样性可直观反应微生物群落的丰富度和多样性,包括一系列统计分析指数如Chao1指数、Shannon 指数、Richness 指数和Simpson 指数等。Chao1 指数数值越大,表明群落中的物种种类越多,丰富度越高。Shannon 和Richness 指数值越大,Simpson 值越小,表明群落多样性越高。多样性指数分析如表2 所示,鲭鱼发酵过程中细菌多样性整体呈现先上升后下降趋势。发酵早期,细菌群落多样性和丰度较高,可能由于经过一段时间的微生物代谢,环境中的代谢产物得到积累,能够为更多的微生物生长提供营养物质。随着发酵的进行,细菌种群多样性逐渐降低,这说明接种的发酵菌株能很好的适应发酵环境,产生大量酸类物质,从而抑制了其他不适应较高酸性发酵环境微生物的生长,物种数量也随之下降,同时发酵过程中乳酸菌具有较强酸的耐受力,逐渐成为丰度较高的主体,导致微生物多样性不断降低。吴燕燕等对腌干鱼加工过程中微生物进行分析,也发现腌制过程中鱼类细菌多样性呈先升后降的趋势。大量研究表明,发酵水产品在贮藏或加工过程中优势微生物的不断积累,抑制了其他微生物的生长,导致微生物多样性降低。

表2 鲭鱼发酵过程中微生物群落的多样性指数Table 2 Diversity index of microbial communities during mackerel fermentation
为研究样品的取样量能否代表原样品物种丰富度,对样品的个数和物种的种类做稀释分布曲线,从而评估所构建的文库的覆盖率是否达到饱和。结果见图6,随着测序深度的增加,Chao1 和Shannon指数曲线基本趋于平坦,表明测序数据量合理,测序深度能够反映出样品中绝大多数微生物的物种信息。
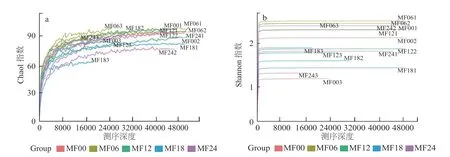
图6 鲭鱼发酵过程中鱼肉细菌群落Chao1 指数(a)和Shannon 指数(b)分析Fig.6 Curve analysis of Chao1 index (a) and Shannon index (b) of bacterial community in mackerel during fermentation
2.4 鲭鱼发酵过程中微生物群落与挥发性风味物质相关性分析
水产品中的蛋白质、脂质、碳水化合物等大分子化合物是风味物质形成的前体,在微生物及其相关酶系作用下,这些物质发生水解,参与氨基酸代谢及脂质代谢等途径,形成特征风味物质。由图7 可知,与挥发性有机化合物相关的细菌有22 个属,其中乳杆菌属、葡萄球菌属、不动细菌属和鞘脂菌属对挥发性风味物质的形成有显著影响。乳杆菌属与戊酮、乙醇、3-羟基-2-丁酮等物质存在极强的正相关,与3-甲基丁酸、3-辛酮等存在负相关性;葡萄球菌与酯类化合物存在极强的正相关,与酮类物质存在负相关;不动细菌属与9 种物质存在正相关,与10 种物质存在负相关,其中与醛类、酮类的相关性比较强。魏斯氏菌、鞘脂杆菌、不动杆菌、嗜甲基菌等微生物虽然相对丰度不高,但与挥发性风味的形成存在很大的相关性,例如,魏斯氏菌与吡嗪类、酮类、酸类、酯类等15 种挥发性物质存在相关性,鞘脂杆菌与多种酮类物质存在很强的负相关性。混合菌株接种的鲭鱼发酵过程中挥发性风味物质的变化与微生物群落演替联系紧密,多种微生物共同作用不仅提高了发酵鲭鱼的稳定性,而且使其风味更加浓郁协调。
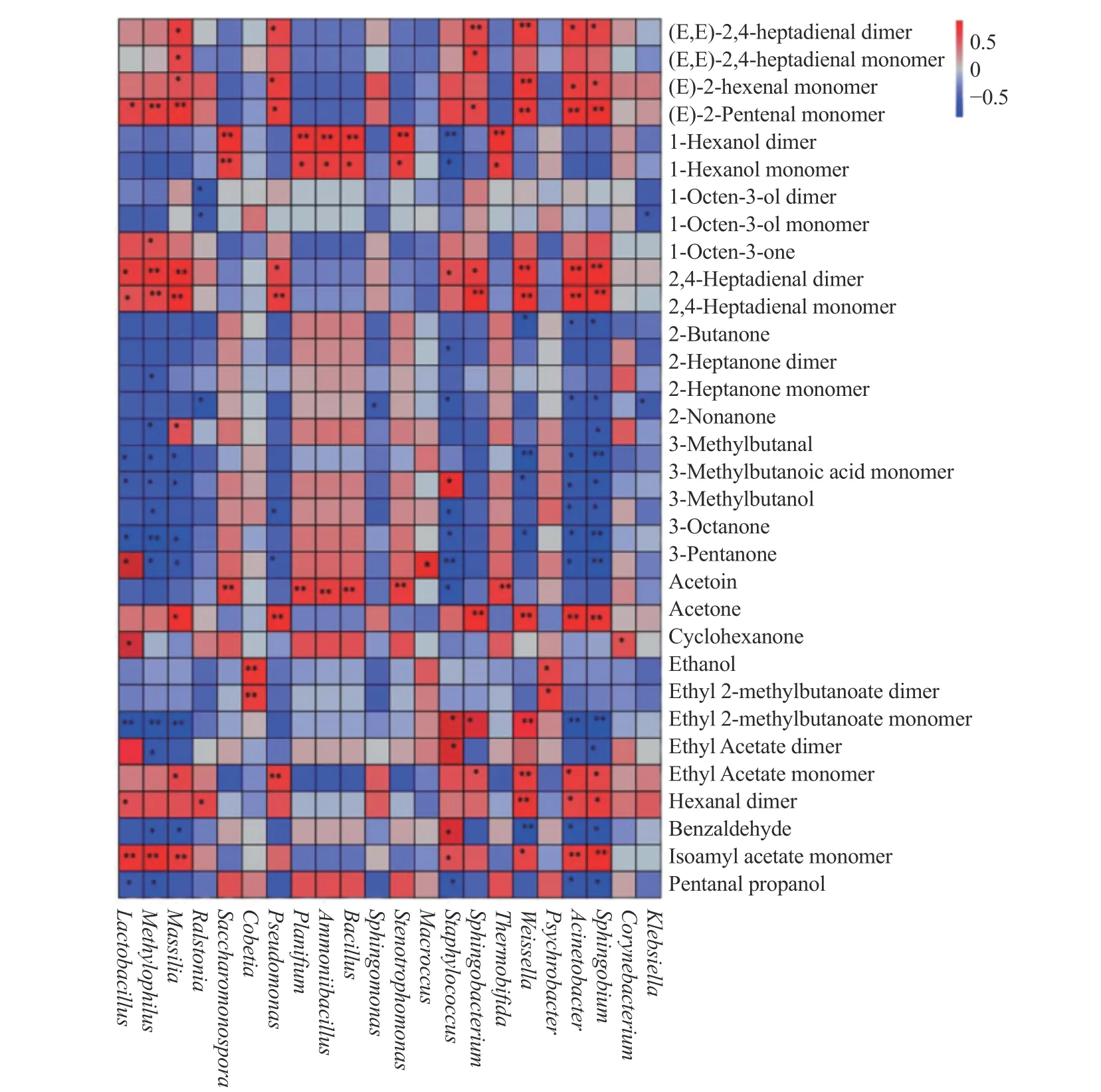
图7 鲭鱼发酵过程中细菌菌落与挥发性化合物相关性热图Fig.7 Mogram of correlation between bacterial colony and volatile compounds during mackerel fermentation
3 结论
本研究基于鲭鱼发酵过程中细菌群落组成和关键气味物质的特征,揭示了鲭鱼发酵过程中风味演替规律。主要结论如下:混合接种鲭鱼发酵过程中随着发酵时间的延长挥发性风味物质种类和含量逐渐增加。发酵初期以醛类和酮类为主,随着发酵时间的延长,酯类和酮类化合物相对含量增多,共同构成了发酵鱼肉独特的风味;接种鲭鱼发酵过程中微生物丰度随着发酵时间的延长呈先上升后下降趋势。门水平上分析表明,厚壁菌门是发酵鲭鱼中的优势微生物。属水平分析表明,细菌优势菌属从发酵前期的乳杆菌属()、巨型球菌属()和葡萄球菌属()逐渐转变为中、后期的乳杆菌属(),此外,丰度较低的芽孢杆菌属()、不动杆菌属()、嗜甲基菌属()、假单胞菌属()、魏斯氏菌属()等在发酵过程中也扮演着重要作用,共同构成了发酵鲭鱼的细菌群落,为发酵鲭鱼特征风味的形成和产品安全特性提供良好的环境;利用皮尔森(Pearson)相关性分析接菌鲭鱼发酵过程中微生物群落演替与挥发性风味形成的相关性,发现微生物菌落结构与挥发性风味物质关系复杂,其中乳杆菌属、葡萄球菌属、不动细菌属和鞘脂菌属对挥发性风味物质的形成有显著影响,丰度较低的魏斯氏菌、鞘脂杆菌、不动杆菌、嗜甲基菌等微生物与挥发性风味的形成也存在显著正相关性,可见挥发性风味物质的变化是多种微生物协同作用的结果。本研究为深入了解鲭鱼发酵的本质,探索挥发性风味物质与微生物的关系及为人工发酵剂的生产和发酵调控提供理论依据。
