泡菜母水中细菌群落的动态变化规律及结构解析
2022-10-11李静超杨晓燕
李静超,邓 巍,佘 容,2,3,杨晓燕,2,3, ,肖 文,2,3
(1.大理大学东喜玛拉雅研究院,云南大理 671003;2.中国三江并流区域生物多样性协同创新中心,云南大理 671003;3.大理大学三江并流区域生物多样性保护与利用云南省创新团队,云南大理 671003)
泡菜是我国一种有三千多年历史的家喻户晓的佐餐开胃菜,主要以新鲜蔬菜为原料,添加适量泡菜盐、水和调味料,利用蔬菜自身附着的微生物或添加乳酸菌发酵剂,自然发酵而成。泡菜不仅风味独特、营养丰富,又具有助消化、解腻开胃、抗氧化、降低胆固醇等作用,甚至抗菌、净肠、抗衰老、抗癌等保健功效,因此,深受广大人民群众的喜爱。研究发现,不同泡菜品种、不同地区腌制的泡菜其风味存在差异,除去添加物质的差异外,其中的微生物群落组成不仅影响泡菜的品质,也会影响泡菜风味。而原汁原味的泡菜也更符合广大消费者的需求,采用母水发酵制作泡菜能很好的解决这一问题。
母水发酵是我国私房泡菜的主要制作方法之一,也是四川泡菜特色工艺之一。泡菜母水中存在大量的乳酸菌、酵母菌等微生物以及多种风味物质,通过将母水添加到泡菜中可增加泡菜中微生物群落稳定性并保持原有风味,这是母水发酵制作泡菜的优势之一。由于母水中的微生物种群结构复杂,生物数量巨大,且在整个储存过程中并不是一成不变的,要保证母水发酵制作泡菜的品质和风味,就需要系统了解泡菜母水中微生物在密闭、室温保存状态下的群落结构动态变化规律,这是母水储存和发酵制作泡菜需要解决的主要问题。同时,解析泡菜母水中的微生物群落结构还能支持从泡菜微生物与肠道微生物互作的角度开展泡菜对肠道健康促进作用方面的研究,提高泡菜微生物资源的开发效率。相对于泡菜的腌制方法、食品安全、微生物群落及益生菌开发等的研究,有关泡菜母水的研究相对较少,需要加强。
细菌是泡菜体系中微生物群落的主要类群,主导着泡菜的发酵过程和储存时长,因此,解析泡菜母水中细菌的群落结构及动态变化规律是关键。由于目前能够实现纯培养的微生物仅占到微生物总数的0.1%~10%,已有研究采用高通量测序方法对泡菜母水的微生物群落结构进行了解析,发现无论是用单代次或多代次母水发酵,在发酵过程中微生物群落结构是持续变化的,但在发酵后期群落结构都逐渐趋于稳定。以上研究的主要目的是探究用母水制作泡菜的发酵过程中微生物群落组成及其动态变化规律,但不能解释母水微生物群落在密闭储存状态下的动态变化规律。考虑到细菌在泡菜发酵过程中的重要性,本研究应用更高分辨率的扩增子测序变体(Amplicon sequence variants,ASV)高通量测序技术,探究25 ℃密闭保存30 d 内泡菜汤中的细菌群落组成、动态变化规律及关键类群,了解驱动泡菜细菌群落动态变化的环境因子。研究结果不仅能为泡菜母水制作、储存和质控提供参考,加快母水产业化过程,还能为泡菜母水中功能细菌的开发和应用及泡菜的生理功能研究等提供数据支持。
1 材料与方法
1.1 材料与仪器
白萝卜、卷心菜、辣椒、生姜、花椒、冰糖、纯净水、食盐、泡菜坛 均购于大理菜市场;OMEGAsoil DNA Kit Omega Bio-Tek 公司;AxyPrep DNA Gel Extraction Kit Axygen 公司;琼脂糖 Biowest公司。
DW-86L388J 超低温冰箱 青岛海尔特种电器有限公司;HC-3018R 离心机 安徽中科中佳科学仪器有限公司;ABI GeneAmp® 9700PCR 仪 ABI 公司;NanoDrop2000 超微量分光光度计 Thermo Fisher Scientific 公司;DYY-6C 电泳仪 北京市六一仪器厂;Illumina Miseq 测序仪 Illumina 公司。
1.2 实验方法
1.2.1 泡菜汤制备和样品采集 将17.5 kg 白萝卜、17.5 kg 卷心菜、1 kg 辣椒、0.5 kg 生姜、0.5 kg 花椒、1.25 kg 冰糖、105 kg 纯净水(内含6%食盐),在大桶中混匀后分装至泡菜坛中,室温自然发酵7 d。用无菌纱布滤去泡菜,获得100 kg 泡菜母水,将母水混匀后分别分装至无菌培养瓶中,每瓶500 mL,共60 瓶。使用瓶盖加封口膜密封瓶口,25 ℃恒温培养。储存第1 d 到第10 d 每天采集样品,10~30 d 每两天采集一次样品。以随机抽取的3 瓶母水作为平行(用a、b、c 表示),共获得为期30 d 内、20 个时间点上的60 份样品。采样时,将每个培养瓶混匀后用无菌注射器吸取50 mL 泡菜母水于离心管中,8000 r/min离心10 min,取上清液测量pH,沉淀置于-80 ℃冰箱储存。所有沉淀样品在干冰储存状态下送至深圳微科盟科技集团有限公司进行高通量测序。
1.2.2 微生物群落分析 根据E.Z.N.A.® soil 试剂盒说明书进行总DNA 抽提。DNA 浓度和纯度利用NanoDrop2000 进行检测,利用1%琼脂糖凝胶电泳检测DNA 提取质量;用338F(5'-ACTCCTACGG GAGGCAGCAG-3')和806R(5'-GGACTACHVGGG TWTCTAAT-3')引物对V3~V4 可变区进行PCR 扩增。扩增程序为:95 ℃预变性3 min,27 个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。使用2%琼脂糖凝胶回收PCR 产物,利用AxyPrep DNA Gel Extraction Kit 进行纯化,纯化产物送深圳微科盟科技集团有限公司,使用Illumina NovaSeq 平台测序。所的原始序列首先使用QIIME 2 软件进行质控,修剪,去噪,拼接,并去除嵌合体,得到ASV 表格。将ASV 的代表序列比对到预先准备好的13_8 版本99%相似度的GREENGENES 数据库,得到物种的分类信息表。再使用QIIME 2 feature-table 插件剔除了所有污染性的线粒体和叶绿体序列。
1.3 数据处理
使用R 4.03 处理ASV 序列表格,序列抽平,计算物种相对含量,绘制物种稀释曲线;将抽平后数据导入图图云平台(http://www.cloudtutu.com/#/index)进行多样性指数箱型图、PCoA 的图形制作;使用Excel 进行散点图、物种分布堆积图、多样性指数折线图的绘制;使用图图云平台、GraphPad 进行LEfSe 图形制作。
2 结果与分析
2.1 稀释曲线
对60 个泡菜母水样品高通量测序得到下机序列平均在十万条,通过过滤、整合、去除嵌合体、去除叶绿体和线粒体序列、抽平后纳入分析序列为48976 条。对抽平后序列绘制物种稀释曲线,可以看到曲线几乎都处于平缓,再增加测序深度也不会有更多物种被检测到。因此,此次纳入分析序列数量合理,结果可反映样品中微生物的多样性和丰富度(图1)。
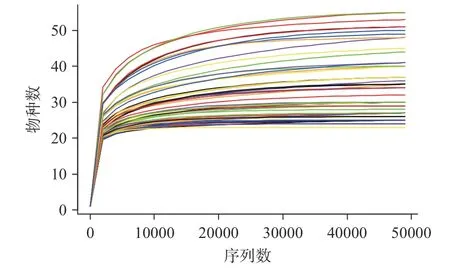
图1 稀释曲线Fig.1 Dilution curve
2.2 泡菜母水中细菌门和属水平相对含量
30 d 内共有10 个门被检出:Firmicutes(厚壁菌门)44.3%~59.1%、Proteobacteria(变形菌门)40.8%~55.7%、Actinobacteria(放线菌门)、unspecified__Bacteria(未指明细菌)、Euryarchaeota(古菌门)、Chloroflexi(绿弯菌门)、Cyanobacteria(蓝细菌门)、Bacteroidetes(拟杆菌门)、Acidobacteria(酸杆菌门)、Fusobacteria(梭杆菌门)相对含量小于1%(图2)。
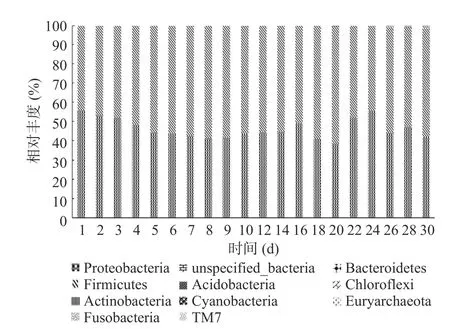
图2 泡菜母水细菌在门水平上的相对丰度Fig.2 Relative abundance of bacteria in the Paocai brine at the phylum level
30 d 内共有205 属检出,(肠杆菌属)18.8%~31.1%,(乳球菌属)4.6%~19.7%,(明串球菌属)7.1%~22.2%,unspecified__Enterobacteriaceae(未指明的肠杆菌科)11.3%~15.9%,unspecified__Lactobacillaceae(未指明的乳杆菌科)0.7~30.6%,unspecified__Lactobacillales(未指明的乳杆菌目)4.5%~10.6%,(微小杆菌属)2.3%~5.0%,(拉恩氏菌属)2.3%~5.1%,(欧文氏菌属)0.8%~1.6%,(枸橼酸杆菌属)0.7%~5.4%,(假单胞菌属)0.5%~1.6%,others(图3)。

图3 泡菜母水细菌在属水平上的相对含量Fig.3 Relative abundance of bacteria in the Paocai brine at the genus level
2.3 细菌群落结构的动态变化
2.3.1 优势属的变化 将相对含量大于1%的属定义为优势属,柱状堆积图显示:30 d 内共检出、、unspecified__Lactobacillaceae、unspecified__Lactobacillales、unspecified__Enterobacteriaceae(大洋芽胞杆菌属)12 个优势属。其中的、、、unspecified__Enterobacteriaceae、、在30 d内都保持在一个较稳定的水平;在30 d内呈现先增后减的趋势;在1~10 d 数量没有明显变化,10 d 以后整体上小幅下降;在28 d 内都保持在一个非常低的状态,但在第30 d 剧烈增加;在18 d 后呈现不同程度的增加(图4)。
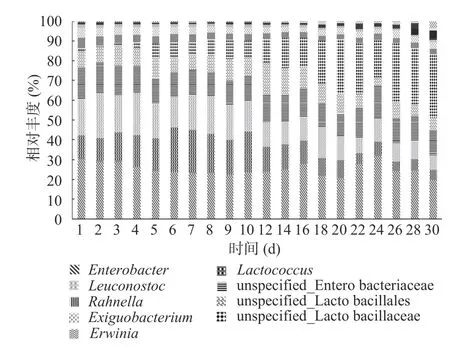
图4 30 d 内优势属的变化Fig.4 Changes of dominant genus within 30 days
2.3.2 次优势属的变化 将相对含量在0.1%~1%的定为次优势属,30 d 内共检出13 个次优势菌属,分别为(葡糖酸醋酸杆菌属)、(魏斯氏菌属)、(沙雷氏菌属)、(气单胞菌属)、(索丝菌属)、(肠球菌属)、unspecified__Aeromonadaceae(未指明气单胞菌科)、(不动杆菌属)、(泛菌属)、(瘤胃球菌属)、(罗尔斯通菌属)、unspecified__Lachnospiraceae、。、unspecified__Lachnospiraceae 第8 d 剧烈增加,在第12 d 以后、、发生大幅度波动(图5)。

图5 30 d 内次优势属的变化Fig.5 Changes of subdominant genus within 30 days
2.3.3 稀有属的变化 将相对含量小于0.1%的ASV定义为稀有属,30 d 内检测到179 个稀有属,从图中可看到1~7 d 内,稀有属的变化不明显,相对稳定。第8 d 发生较大变化,第8 d 之后,稀有属细菌持续发生较大的变化(图6)。
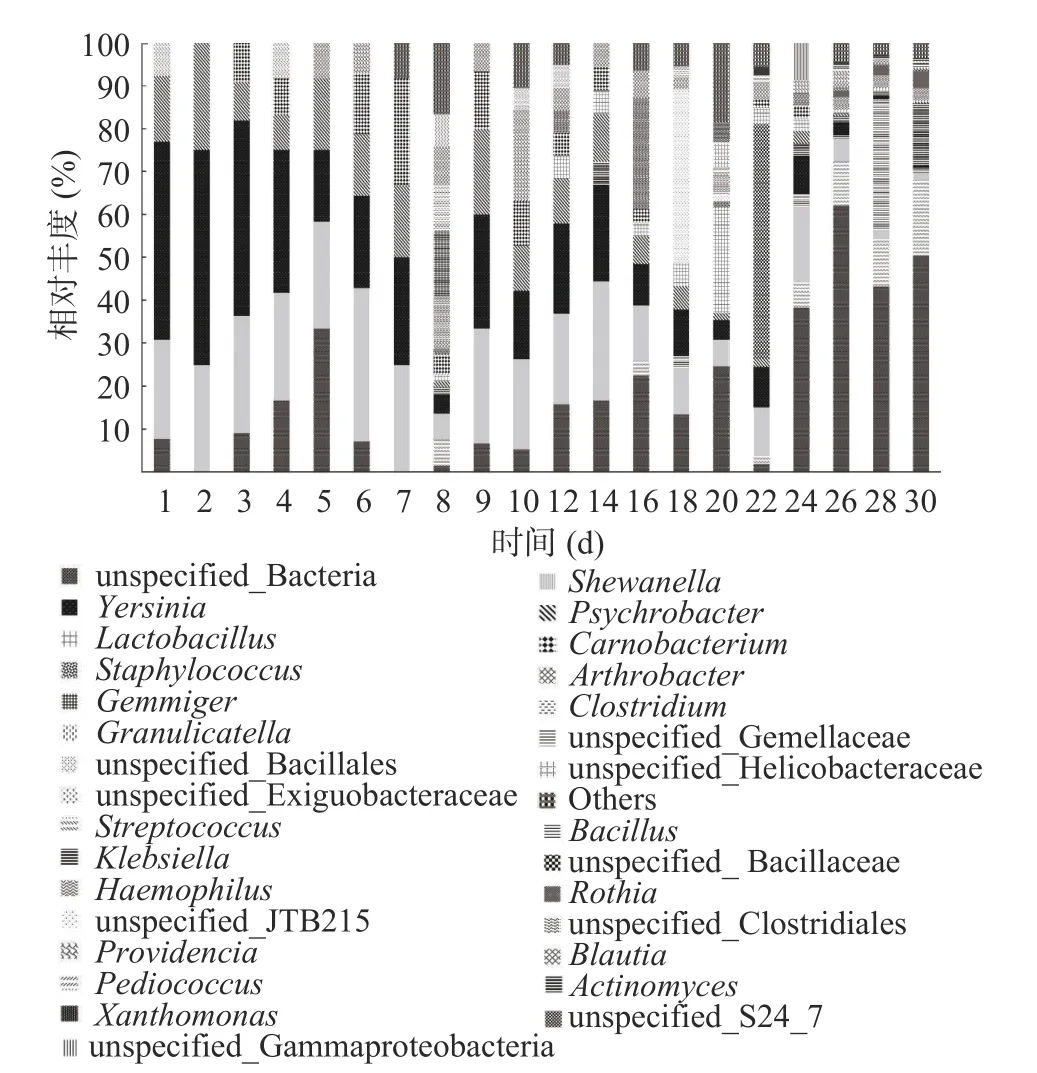
图6 30 d 内稀有属的变化Fig.6 Changes of rare genus within 30 days
2.4 pH 变化
泡菜母水pH 在保存开始的0~7 d 内由3.6 快速下降到3.02,下降趋势明显。第8~20 d,pH 整体呈波动下降趋势。第22 d 后,pH 相对之前动态变化有回升,但整体缓慢波动下降,逐渐趋于平稳。整体来看,pH 的波动可划分为三个时间段:1~7 d(A)、8~20 d(B)、22~30 d(C)(图7)。

图7 30 d 内泡菜母水pH 变化Fig.7 pH change of Paocai brine within 30 days
2.5 α 多样性指数变化
根据pH 的波动范围,以三个时间段对多样性指数进行分析,Chao1、Ace 指数变化趋势类似,1~7 d(A)数值基本稳定,8~20 d(B)、22~30 d(C)呈现逐渐上升。Shannon、Simpson 指数变化类似,8~20 d(B)、22~30 d(C)呈现逐渐上升(图8~图9)。
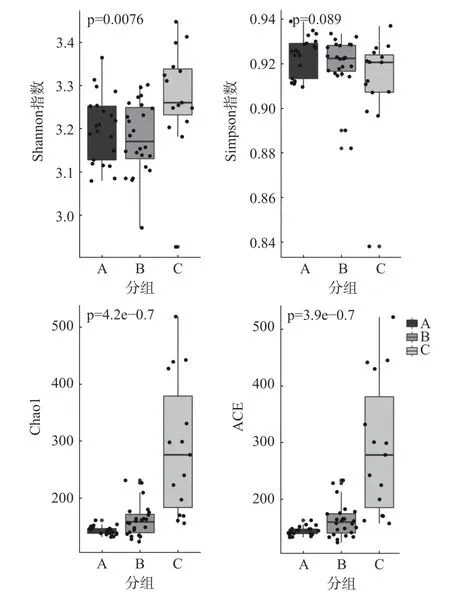
图8 细菌群落α 多样性指数Fig.8 α Diversity index of bacterial community
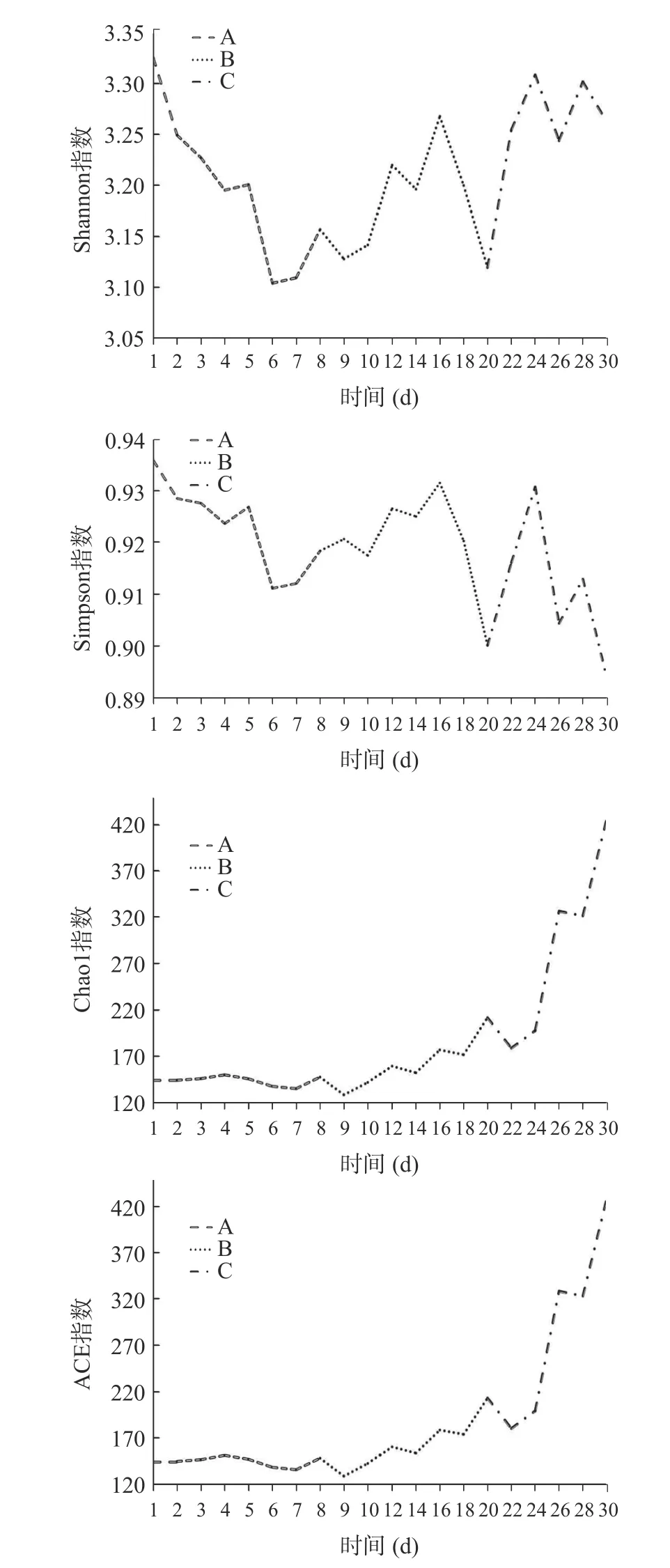
图9 细菌群落α 多样性指数动态变化Fig.9 Dynamic changes of bacterial community α diversity index
2.6 群落相似度分析
横轴贡献率达63.75%,纵轴贡献率达11.77%,横纵轴贡献率总共达到75.52%。根据pH 的波动范围,以1~7 d(A)、8~20 d(B)、22~30 d(C)三个时间段为分组进行PCoA、树状堆叠图分析。通过PCoA可以得出三个时间段中群落聚集程度分别为A>B>C,A 与B,B 与C 都有交叉聚集,但A 与C 无交集(图10)。

图10 30 d 内群落组成PCoA 分析Fig.10 PCoA analysis of community composition within 30 days
2.7 LEfSe 差异性分析
根据pH 的波动范围划分的三个时间段进行LEfSe 分析,LDA 阈值设置为2。确定各组的标识性物种。C 组所含标识性细菌类群最多,为39 个,稀有属细菌类群具有33 个,其中unspecified__Lactobacillaceae 的标识性作用最强;其次是A 组的标识性细菌类群具有6 个,分别为、、、、无稀有细菌类群在A 组产生差异B 组标识性细菌类群最少,仅、unspecified_S24_7、、、unspecified_Lactobacillales 共计5 个,稀有属细菌类群具有4 个。稀有属细菌类群占三个分组的标识性物种的86%(图11)。

图11 30 d 内群落组成LEfSe 差异分析Fig.11 Difference analysis of LEfSe community composition within 30 days
3 讨论
3.1 泡菜母水细菌群落的变化规律及驱动因子
在25 ℃密闭保存30 d 内,泡菜体系中的细菌数量和多样性发生了持续动态变化,主要体现为:Chao1、Ace 指数整体呈上升趋势;Shannon、Simpson指数也随时间不断变化,在8~20 d 达到高峰。与此相对应的是,稀有属和次优势属在第8 d 都发生了变化,但细菌群落第9、10 d 又基本恢复到8 d 前的结构;12 d 后次优势属细菌群落发生持续缓慢改变,稀有属变化则较为明显。这说明储存期内母水的细菌群落动态变化主要因稀有属和次优势属的改变所致。已有研究发现pH 往往是细菌群落变化的主要驱动因子。在本研究中,30 d 内泡菜汤pH 在1~7 d 内快速下降,第8 d 上升,与之对应的是次优势属和稀有属细菌的数量也急剧增加,而第9 d 的pH 又开始下降,说明第8 d 的稀有细菌属可能发挥了环境平衡的作用。同时在pH 增加的过程中(18、22 d)次优势属和稀有属细菌的变化是明显的。但由于密闭环境中的能量是确定的,在没有能量输入的情况下,随着pH 的变化,次优势属和稀有属细菌群落也在持续变化,这表明泡菜母水体系中细菌群落的动态变化也受母水pH 的影响。在发酵过程中细菌会改变母水环境,母水环境反作用于细菌群落,细菌通过群落调整适应环境的改变并调节母水pH,在未来的泡菜食品研究中应当重视这种细菌群落与泡菜母水环境的相互作用。
3.2 泡菜母水细菌群落持续改变的累积效应与泡菜母水的储存
鉴于我国大部分地区夏天的温度偏高,夏天又是酸爽泡菜最被偏爱的季节,因此,本研究选择在25 ℃条件下开展。结果显示,在30 d 的监测周期内,泡菜母水的细菌群落的持续变化出现了累积效应。根据pH 变化划分的三个时间段1~7 d(A)、8~20 d(B)、22~30 d(C)内,A 与B、B 与C 的群落相似度较高,说明泡菜群落是持续变化的,但这种持续变化的最终累积效应使C 的群落结构相较A 发生了较大变化。在泡菜母水保存起始的1~7 d 内细菌群落的稳定性说明泡菜母水在25 ℃条件下的最佳密闭保存时长为一周,因母水中稳定的微生物群落结构、数量及丰度更能保证泡菜的原有风味,即用此期间的母水制作泡菜是最佳选择。储存8~20 d 期间,泡菜母水中的细菌群落结构虽然发生缓慢改变,但与前7 d 的相似度较高,用此阶段母水制作泡菜理论上也是可行的,但这需要进一步验证。储存22~30 d 的母水细菌群落结构相较1~7 d 的变化较大,不建议使用。考虑到本研究选取的温度为25 ℃,且为恒温,而自然室温会存在昼夜温差,如果在气候凉爽的地区和季节,理论上泡菜母水的自然室温储存时间还可以适当延长。
3.3 稀有细菌属对泡菜母水细菌群落的平衡作用不容忽视
稀有微生物类群在微生物群落构建中的作用及其生态学功能逐渐被关注,如稀有细菌在硫酸盐还原、菲降解及生态系统的稳定性和功能调节方面不可或缺。本研究发现泡菜母水中优势细菌属在保存期内的变化并不明显,但稀有属细菌的阶段性变化明显,其在第8 d 的剧烈变化使母水细菌群落出现短暂恢复期,说明稀有属细菌类群对群落的稳定性可能发挥了重要的平衡作用。同时,在以pH 波动范围划分的三个时间段内稀有属细菌占据总标识性物种的86%,而泡菜水中稀有微生物虽然相对丰度比例占比较低,但却是和多样性的贡献者,其物种多样性能够影响群落的稳定性和恢复能力,这意味着低丰度群落在维持生态系统健康方面具有重要作用和意义。
4 结论
在25 ℃、密闭储存条件下,泡菜母水中的细菌群落组会发生持续改变,这种改变与母水pH 相互作用。细菌群落动态变化可分为三个阶段:1~7 d、8~20 d和22~30 d,1~7 d 内的细菌群落结构最稳定,是泡菜母水的最佳保存时段;后两个阶段内稀有属细菌持续发生较大变化,导致三个阶段内细菌群落的相似度逐渐降低。以往的研究主要关注优势物种,稀有属细菌的动态变化和功能被忽略,这方面的研究需要加强。本研究只涉及细菌类群和母水pH 的动态变化,而影响细菌群落动态变化的因素还有很多,如细菌类群与其他微生物的相互作用、营养物质的竞争等,后续研究需要继续开展相关工作,促进整体了解泡菜母水微生物体系的组成、群落动态和功能。
