常压室温等离子体诱变选育淀粉酶菌株及其酶学特性研究
2022-10-11黄家琪范坚强黄仕新邓小华陈善义
童 凡,黄家琪,范坚强,黄仕新,龙 腾,吴 鹏,何 伟,,邓小华,陈善义,唐 旭
(1.福建中烟工业有限责任公司技术中心,福建厦门 361021;2.自然资源部第三海洋研究所,福建厦门 361005)
-淀粉酶(-amy1ase,EC.3.2.1.1)是参与食物中糖类物质分解代谢的一种糖苷酶,能够水解淀粉、糖原或多糖的中的-1,4-糖苷键,生成麦芽糖、短链糊精和少量葡萄糖等产物,是一种内切型液化酶,广泛应用于烘焙、酿造、食品、饲料、医药等工业。-淀粉酶主要来自微生物和动植物,而微生物所产淀粉酶因工艺简单、生产成本低而被大范围开发与应用到工业生产中。同时随着工业的大规模生产,筛选出活力高且稳定的淀粉酶是酶制剂工业关注的焦点。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变技术相对于传统的诱变技术具有操作简易、条件温和、安全可靠等优势,现已成为诱变领域的研究热点。王兴吉等利用ARTP 诱变技术对中温淀粉酶进行诱变处理,筛选出诱变菌株BS-12,比原始菌株酶活提高了32.2%;林杨等在ARTP 技术下筛选得到一株蛋白酶酶活提高64.5%的乳酸菌;Wang 等对节杆菌进行ARTP诱变处理,筛选得到了酶活提升30%的产葡聚糖酶菌株。
目前,国内外对菌株产淀粉酶及产酶条件优化的研究较多,但关于利用ARTP 技术在提高淀粉酶酶活产量等性能的菌株诱变选育应用中报道比较少。因此本研究利用ARTP 技术诱变处理从烟叶原位筛选得到的产淀粉酶菌株,进一步提高其酶活产量,获得遗传稳定的诱变菌株,为进一步的深入研究及工业化生产和开发酶制剂打下理论基础并提供稳定高效的菌种资源。
1 材料与方法
1.1 材料与仪器
菌株FS-1 本实验室保藏菌种,经16S rDNA测序鉴定为韩国芽孢杆菌();胰蛋白胨、酵母提取物、蛋白胨、牛肉膏、琼脂等 均为分析纯,生工生物工程(上海)股份有限公司;其余试剂 均为国产分析纯;LB 培养基:胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g、琼脂18 g(固体)、蒸馏水1000 mL、pH7.2;发酵培养基:蛋白胨10 g、牛肉膏3 g、可溶性淀粉2 g、NaCl 5 g、CaCl0.5 g、蒸馏水1000 mL、pH7.0,以上培养基均在121 ℃下高温灭菌20 min;DNS 试剂:结晶苯酚6.9 g、NaSO6.9 g、酒石酸钾钠225 g、1%的3,5-二硝基水杨酸溶液880 mL、10%的NaOH 溶液315.2 mL。
BP-10 pH 计 德国Sartorius 有限公司;GR60DF全自动立式高压灭菌锅 厦门致微仪器有限公司;SW-CJ-IFD 超净工作台 苏州净化有限公司;生化培养箱 宁波莱福科技有限公司;MQT-60R 振荡培养箱 上海旻泉仪器有限公司;3K15 Sigma 台式高速冷冻离心机 Sigma 离心机有限公司;ARTP-M 诱变育种仪 无锡源清天木生物科技有限公司;EQU312蓝光切胶仪 生工生物工程(上海)股份有限公司;M5多功能酶标仪 美国Molecular Devices 有限公司。
1.2 实验方法
1.2.1 菌株活化 取保藏于-80 ℃冰箱的FS-1 接于LB 液体培养基,于37 ℃、转速180 r/min 振荡培养箱培养24 h 后,将富集菌液涂布至LB 固体培养基,置于37 ℃生化培养箱培养24 h 后得到纯化菌株。
1.2.2 ARTP 诱变菌株筛选及遗传稳定性 取对数生长期的FS-1 菌液10 μL,用涂布棒均匀涂布在灭菌载片表面,将载片放置ARTP 操作台凹槽中,调节气流量至10 L/ min,电源功率设为120 W,操作温度为20 ℃,发射源与菌悬液的工作距离为2 mm,诱变处理时间设为0、10、20、30、40、60、80、100 s,通过计算菌株致死率,绘制出致死率曲线。ARTP 诱变后菌株致死率计算公式为:
致死率(%)=(1-m)/n×100
式中,m 为ARTP 诱变处理后平均菌落数;n 为未经ARTP 诱变处理后平板菌落数。
对菌株FS-1 进行ARTP 诱变处理后,将挑选出的诱变菌株在LB 固体培养基上进行10 代接种划线,每代一测酶活,以验证诱变菌株的产酶能力是否稳定地遗传至下一代。
1.2.3 诱变前后菌株生物量及酶活测定 将诱变前后纯化单菌落接种至LB 液体培养基中,于37 ℃、转速180 r/min 振荡培养箱培养24 h 后得种子液。将种子液以1%接种量接至发酵培养基中,于37 ℃、转速180 r/min 振荡培养箱中培养,每隔12 h 取发酵液,测其生物量OD,直至96 h,同时将发酵液12000 r/min 离心3 min 后取上清为粗酶液,测定淀粉酶活力。
淀粉酶酶活测定采用DNS法,略有改动。比色管中加入1.0 mL 酶液,加入1.0 mL 1.5%可溶性淀粉溶液混匀后,60 ℃水浴恒温反应10 min 后立即加入2.5 mL DNS 试剂混匀后终止反应,后沸水浴10 min,冷却后加水定容至25 mL,充分摇匀。另取1.0 mL 经沸水浴灭活10 min 的酶液与1.5%可溶性淀粉溶液作为空白,按上述相同步骤,用空白调零点,于540 nm 测吸光度值。淀粉酶酶活计算公式如下:酶活采用国际单位,每分钟水解淀粉产生1 μg 的还原糖所需的酶量为一个酶活单位(U)。
酶活力(U/mL)=(N×N×G×10×1.0×10)/10×1
式中:N为粗酶液稀释倍数;N为比色反应稀释倍数;G 为葡萄糖标准曲线查得的葡萄糖浓度;10为mg 与g 的转换;1.0 标准曲线葡萄糖溶液的体积;10为mol 转化为μmol 的系数;10 为酶水解反应时间,min;1 为酶活测定时粗酶液的体积,mL。
1.2.4 诱变前后菌株酶学特性研究
1.2.4.1 最适反应温度及热稳定性测定 将菌株诱变前后所得酶液分别与1.5%可溶性淀粉溶液(pH5.5)混匀后置于40、50、60、70 ℃条件下测定酶活力。以最适温度下酶活性为100%,计算其它温度下相对酶活,确定诱变前后该淀粉酶反应的最适温度。
将菌株诱变前后所得酶液分别与1.5%可溶性淀粉溶液(pH5.5)混匀后置于40、50、60、70 ℃条件下处理30、60、90 min 后测定酶活力,计算其相对酶活。
1.2.4.2 最适反应pH 及酸碱耐受性测定 在菌株诱变前后所得酶液中分别加入1.5%可溶性淀粉溶液(pH3.0、4.0、5.0、6.0、7.0、8.0),最适温度下测定酶活力。以最适pH 条件下酶活性为100%,计算其它pH 下相对酶活,确定诱变前后该淀粉酶反应的最适pH。
将菌株诱变前后所得酶液中分别加入1.5%可溶性淀粉溶液(pH3.0、4.0、5.0、6.0、7.0、8.0)在4 ℃下冰浴30、60、90 min 后测定酶活力,计算其相对酶活。
1.2.4.3 金属离子对淀粉酶活力的影响 将菌株诱变前后所得酶液中分别加入终浓度为1 mmol/L 的Ca、Na、Mg、Mn金属离子溶液,测定此条件下的淀粉酶活力,同时都以未加金属离子的反应体系作为对照(相对酶活100%),分析不同金属离子对该淀粉酶活力的影响。
1.2.4.4 紫外光对淀粉酶活力的影响 为研究紫外光对淀粉酶结构稳定的影响,在4 ℃保持不失酶活前提下将菌株诱变前后所得酶液分别置于波长440~485 nm、功率120 W 的紫外光下进行照射,每隔1 h取样测定淀粉酶活力,直至6 h,分析紫外光照射时间对所产淀粉酶活力的影响。以未经紫外光照射的反应体系作为对照(相对酶活为100%)。
1.3 数据处理
本文中所有实验均设置三次重复,所有数据以平均值±标准差表示。本文图表数据处理采用Excel 2007 及Origin 软件进行分析与制图。
2 结果与分析
2.1 ARTP 诱变致死率曲线的测定
按1.2.2 中菌株诱变致死率公式计算,获得野生型菌株FS-1 的致死率结果如图1 所示。致死率随诱变时间增加而增加,诱变时间在0~30 s 时,致死率几乎呈大斜率线性增长,说明该菌株对ARTP 诱变射线十分敏感;诱变时间在30 s 时,致死率达到95.9%;诱变时间大于30 s 后,随时间增加,致死率呈近似水平线;诱变时间大于60 s,致死率大于98%。综上,0~30 s 之间,菌株细胞死亡殆尽,之后的时间内,菌株只剩下较少的细胞存活,基于菌株诱变死亡率>95%时正突变率最高,因此在诱变处理时间选择大于30 s。

图1 诱变致死率Fig.1 Mutagenic lethality rate
2.2 诱变菌株的筛选及遗传稳定性
通过对比不同诱变时间菌株发酵后的酶活高低,从中挑选出4 株酶活较野生型FS-1 提高20%以上的诱变菌株,编号为FS-103、FS-115、FS-141、FS-144,酶活分别提高了39%、25%、78%、50%,具体结果如表1 所示。对以上诱变菌株进行10 次传代培养,每代测一次酶活,只有FS-103 的酶活相对于FS-1 能稳定地保持在20%以上增长率,这表明菌株FS-103 产淀粉酶能力也具有良好的遗传稳定性。而其余三株FS-115、FS-141 和FS-144 均没有保持良好的遗传性状,在传代过程中酶活有所下降,并未达到20%的增长。结果如图2~图5 所示,因此后续研究选取FS-103 进行试验。

图2 菌株FS-103 的连续传代稳定性Fig.2 Stability of strain FS-103 in continuous passage

图3 菌株FS-115 的连续传代稳定性Fig.3 Stability of strain FS-115 in continuous passage

图4 菌株FS-141 的连续传代稳定性Fig.4 Stability of strain FS-141 in continuous passage
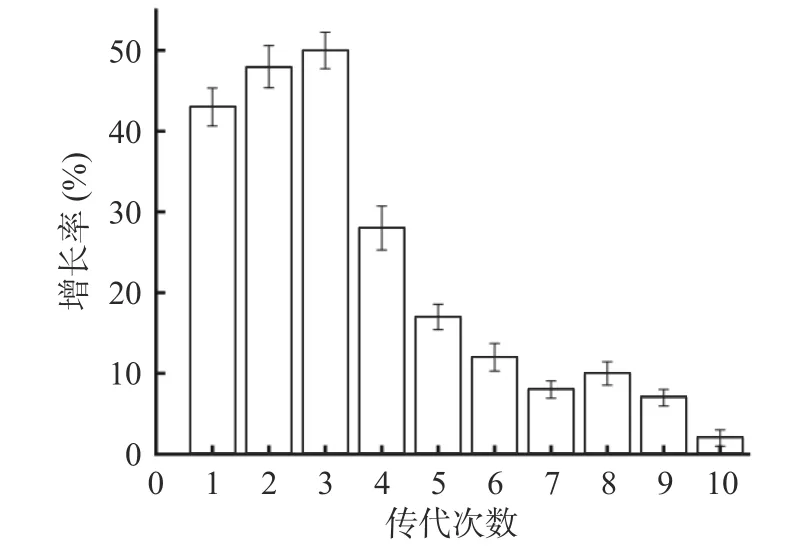
图5 菌株FS-144 的连续传代稳定性Fig.5 Stability of strain FS-144 in continuous passage

表1 诱变菌株筛选结果Table 1 Enzyme activity of mutagenic strain
2.3 菌株生物量与酶活曲线
野生菌株FS-1 与诱变菌株FS-103 在发酵培养基中的生长情况及淀粉酶积累情况如图6 所示。总体来看,诱变前后菌株的生长曲线与酶活曲线的变化趋势是相同的。在发酵培养中,FS-1(图6a)的生物量在12~24 h 逐渐增加,在24~60 h 进入平衡期前期,60~96 h 进入衰退期。相比之下FS-103(图6b)的生物量在12~36 h 逐渐增加,在36 h 生物量达到最高,60~96 h 进入衰退期。FS-1 与FS-103 所产生的淀粉酶在12~84 h 快速积累,60~84 h 积累淀粉酶维持在较高水平,其中FS-1 在发酵84 h 酶活达到最高值7028.26 U/mL,FS-103 在发酵84 h 酶活达到最高值9050 U/mL。此外,发酵时长大于12 h 的FS-103 酶活比FS-1 平均提高了45%左右,当发酵36 h 酶活提高大于90%。由此可见,经过ARTP 诱变后筛选得到的FS-103 产淀粉酶能力远高于野生型菌株FS-1。
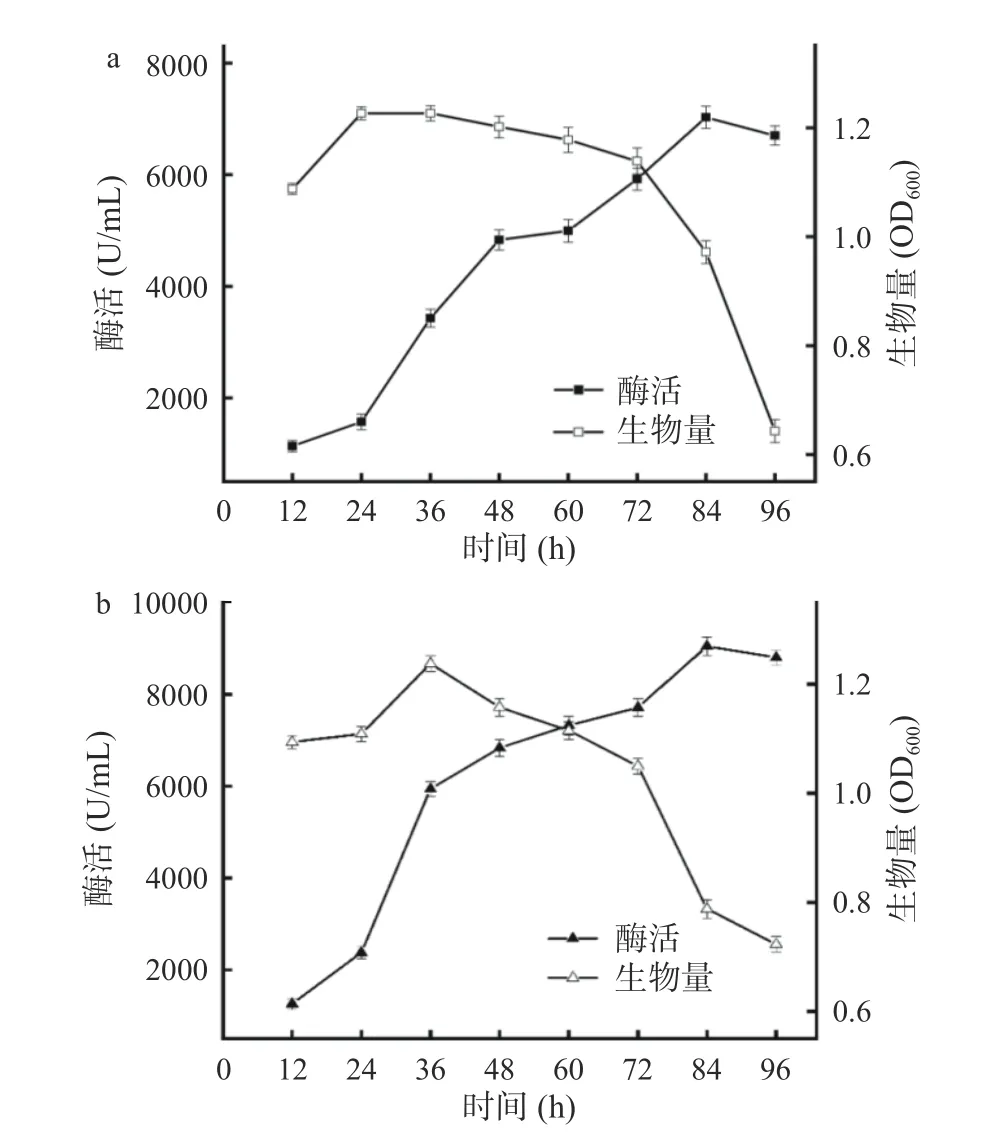
图6 菌株生物量与酶活Fig.6 Strain biomass and enzyme activity
2.4 诱变前后菌株酶学特性
2.4.1 最适反应温度及热稳定性分析 温度对酶活影响较大,一方面温度升高有利于酶促反应的进行,另一方面,大多数酶属于蛋白质,温度过高会导致其结构破坏从而降低酶活。由图7 可知,随着温度的升高,酶活先升高后降低,40~60 ℃间,野生型FS-1 与诱变菌株FS-103 的酶活均能维持在80%左右,FS-103 的最适温度为60 ℃,比FS-1 的50 ℃提升了10 ℃,不仅高于曹慧等筛选菌株XC2 的最适反应温度50 ℃,且当温度提升至70 ℃时,FS-103相对于FS-1 仍保留70%左右的酶活,而菌株XC2在60~70 ℃时相对酶活迅速下降。由此看出,诱变后菌株的耐热性提高。

图7 不同温度对酶活的影响Fig.7 Effects of different temperatures on enzyme activity
由于酶的结构受温度影响较大,因此其热稳定性对于酶制剂的保存和使用具有重要意义。由图8可知,40 ℃保存90 min 后FS-1(图8a)与FS-103(图8b)酶活为85%、90%,诱变型高于野生型;50~60 ℃野生型酶活下降速度快于诱变型;70 ℃保存90 min 后的FS-103 酶活仍以25%的高于野生型的20%。由此说明诱变菌株不仅耐热性优于野生型,且热稳定性高于野生型。

图8 不同温度对酶活稳定性的影响Fig.8 Effects of different temperatures on the stability of enzyme activity
2.4.2 最适反应pH 及酸碱耐受性分析 pH 不仅会影响酶分子构象的稳定、酶分子极性基团的解离状态同时也会影响到反应底物的解离或使反应底物不能与酶结合,最终影响酶的催化效果。由图9 可知,野生型FS-1 与诱变菌株FS-103 酶活先是随着pH 升高而逐步提升,在pH 为5.5 时酶活达到最高,然后开始下降。诱变并未改变最适产酶pH,该酶在中性条件下能够发挥较高的酶活力。

图9 不同pH 对酶活的影响Fig.9 Effects of different pH on enzyme activity
由于酶的结构受pH 影响较大,因此其酸碱稳定性对于酶制剂的使用具有重要意义。由图10 可知,野生型FS-1(图10a)与诱变菌株FS-103(图10b)在pH 大于4.0,4 ℃条件下保存90 min 后二者酶活力均保持在65%以上,而在pH 小于4.0 下酶活随保存时间越长而降低。这与杜东晓等筛选到的巨大芽孢杆菌()XT 的酸碱耐受性不同,XT 在中性和弱碱性条件下稳定性较好,而在工业应用中,耐酸性则是更为重要的条件,研究表明菌株FS-103 所产淀粉酶可以在中性和弱酸性条件下应用,更利于工业的大规模开展。
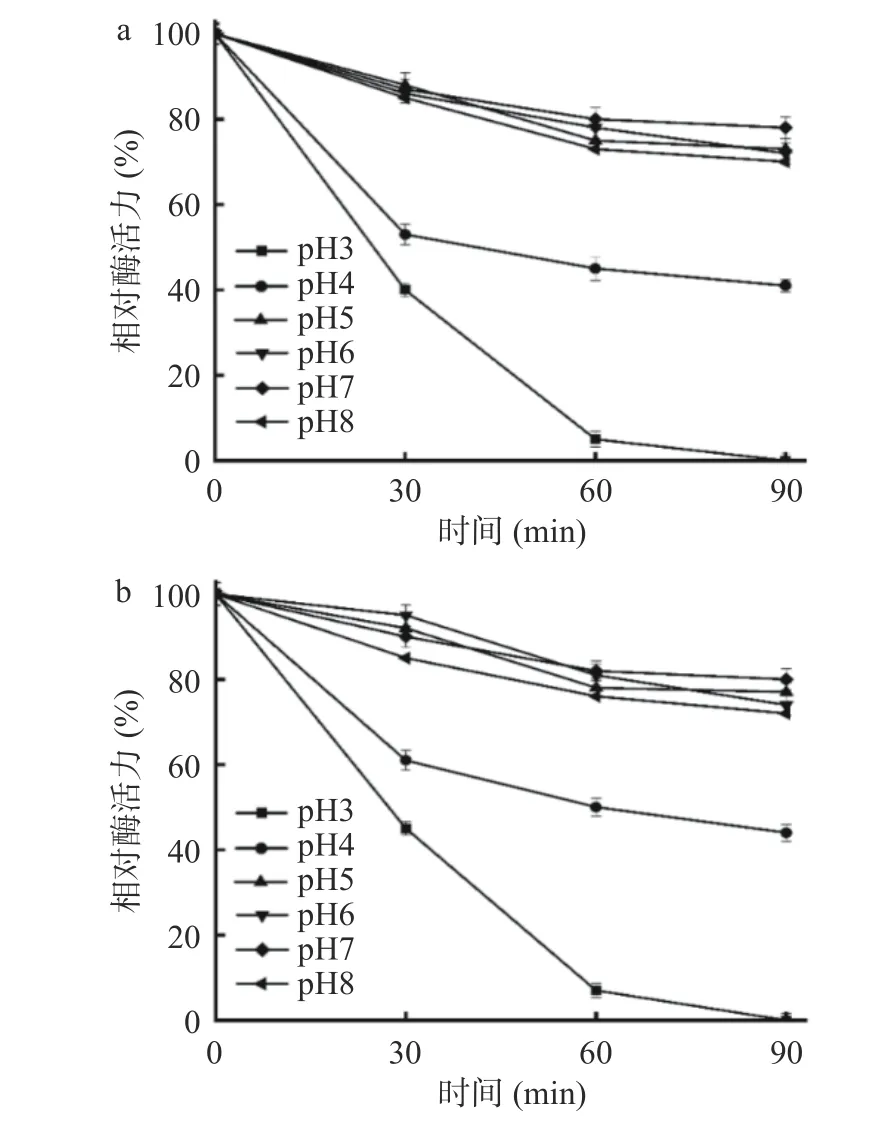
图10 不同pH 对酶活稳定性的影响Fig.10 Effects of different pH on the stability of enzyme activity
2.4.3 金属离子对酶活的影响 不同金属离子对酶活力主要有激活和抑制作用的影响。由表2 可知诱变菌株FS-103 相对于野生型FS-1 对金属Ca、Na、Mg依赖性降低,但Mn对酶活的抑制作用较为显著,这与淀粉酶的晶体结构研究结论具有共同之处。
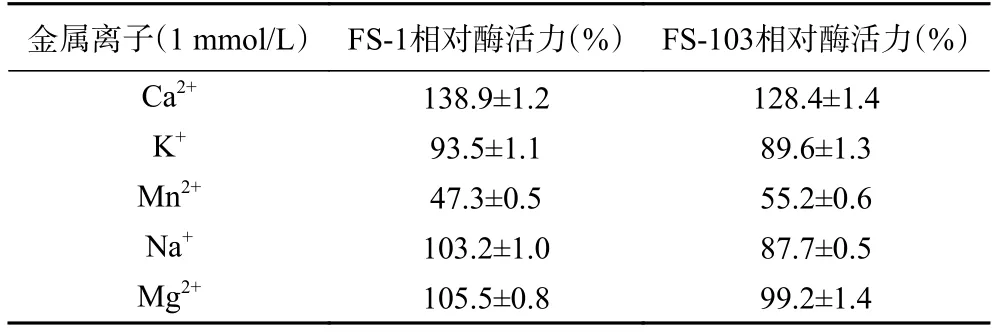
表2 金属离子对酶活的影响Table 2 Effects of metal ions on enzyme activity
2.4.4 紫外光对酶活的影响 紫外线(ultraviolet,UV)可穿透细菌细胞直接作用于DNA,使得碱基无法正常配对,造成基因突变从而影响酶活。由图11 可知,野生型FS-1 与诱变菌株FS-103 在照射的前3 h对酶活影响并不明显,但照射达6 h 后,FS-103 相对酶活剩余50%,而FS-1 相对酶活剩余21%,这说明长时间的紫外光照射,对淀粉酶的结构产生了一定的破坏作用,从而影响了酶活高低。通过对比FS-1 与FS-103 的紫外光照射结果,发现紫外照射较诱变型而言反而提高了菌株产淀粉酶的活力。
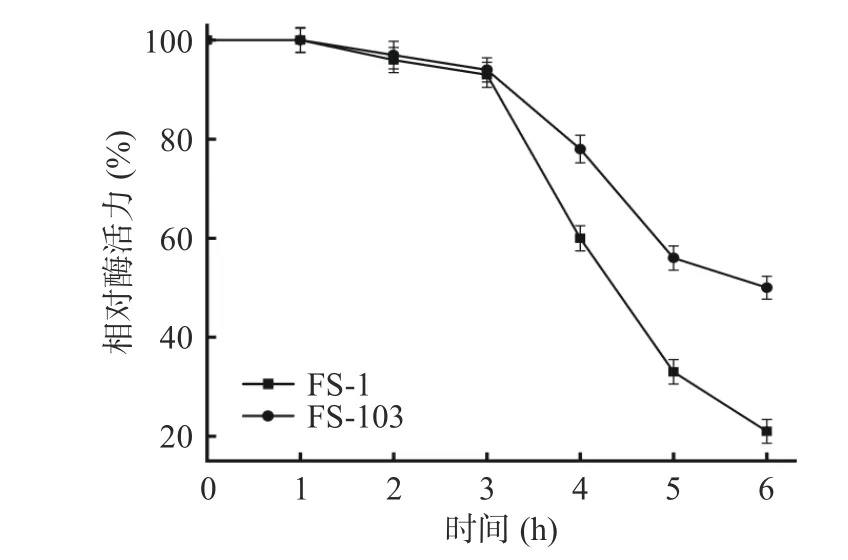
图11 紫外光对酶活的影响Fig.11 Effects of UV light on enzyme activity
3 结论
本文通过ARTP 技术对来自云南马龙C3F-2016烟叶表面原位筛选到的产淀粉酶菌株FS-1 进行诱变,获得一株酶活稳定提高20%以上的诱变株FS-103。相比野生型菌株,FS-103 在摇瓶培养36 h 条件下酶活达到最高值9050 U/mL,其酶活提高了90%;通过对诱变前后菌株酶学特性展开研究发现,诱变后菌株最适反应温度提升10 ℃,耐热且更为稳定,最适pH 与酸碱耐受性变化不大,所产淀粉酶偏中性与弱酸性酶,较能满足工业生产中对使用耐酸性中温淀粉酶越来越大的需求,对金属Ca、Na、Mg的依赖性降低,淀粉酶酶活力受紫外线影响降低。并通过传代试验验证该诱变株具有良好的遗传稳定性,一方面为工业化生产淀粉酶提供了优良菌株和育种的科学依据,为工业中选育其他产淀粉酶菌株提供参考方法;另一方面为研究产酶菌株的性能改良提供了一条新途径,为芽孢杆菌在食品加工、生物转化等工业领域的应用奠定基础。
