肺气肿症状对特发性肺间质纤维化患者治疗效果的影响分析
2022-10-10马彦丽
马 彦 丽
(西峡县中医院门诊部 河南西峡 474500)
特发性肺间质纤维化(IPF)是中老年人群常见病之一,发病率与年龄密切相关,虽然可发生于任何年龄阶段,但集中于中老年人群[1]。既往研究证实,IPF患者接受肺部CT检查可见弥漫性网状结节。IPF病因复杂,可能与吸入有害物质、药物诱发及放射性损害等密切相关[2]。IPF常常预后不佳,病死率极高,报道显示,IPF平均生存期仅有5年-6年[3]。IPF合并症众多,以肺气肿最为常见,IPF合并肺气肿综合征(CPFE)被认为是一种独立疾病,以肺纤维化、肺气肿两种病理改变共存于一体,无论是单纯IPF还是单纯肺气肿,临床治疗难度本就较大,而一旦发生CPFE可能对治疗效果、预后等产生明显影响,但临床相关研究较少[4-5]。本次选取西峡县中医院于2020年3月-2021年3月收治的70例IPF患者,研究IPF患者肺气肿症状对治疗效果的影响,报道如下。
1 资料与方法
1.1 一般资料
研究对象选取西峡县中医院于2020年3月-2021年3月收治的70例IPF患者,纳入标准:(1)均符合美国胸科学会制定的《特发性肺纤维化诊断临床指南》[5]中IPF诊断标准,经肺部CT检查确诊;(2)年龄>18岁;(3)患者知情同意;(4)患者影像学检查及病历等资料完整。排除标准:(1)合并精神系统疾病者;(2)合并已明确病因的其他肺间质疾病者;(3)合并心肝肾功能不全者。按是否合并肺气肿分为对照组(单纯IPF)与试验组(IPF合并肺气肿),各35例。入组者中,对照组男、女分别为20例、15例,年龄35岁-81岁,平均(52.94±2.45)岁。试验组男、女分别为18例、17例,年龄38岁-78岁,平均(52.49±2.56)岁。两组资料比较,P>0.05。
1.2 方法
两组均行呼吸科常规治疗,连续治疗2个月;回顾性分析患者临床资料,记录临床疗效、随访时间、实验室指标检测结果、血气分析及肺功能指标等数据。
1.3 观察指标
1.3.1 临床疗效
参照《中医内科疾病诊疗常规》[6]中疗效标准评估患者治疗效果:呼吸困难、干咳等症状均消失,CT检查结果正常,肺功能指标恢复正常,日常生活能力、工作能力等恢复正常为显效;呼吸困难、干咳等症状明显好转,CT检查明显改善,肺功能指标趋于正常,患者日常工作与生活轻度受限为有效;未达到上述标准即无效。总有效率=(显效+有效)例数/样本数×100%。
1.3.2 肺功能
设备选用Vmax 229型肺功能检测仪,于治疗前1d、治疗后14d测定肺活量(VC)、肺总量(TLC),并计算FEV1/FVC。
1.3.3 血气分析
设备选用BAYER860型血气分析仪,于治疗前1d、治疗后14d测定一氧化碳弥散量(DLCO)、动脉血氧分压(PaO2)水平。
1.3.4 血清学指标
采集3ml空腹静脉血(治疗前1d、治疗后14d),离心(转速3500r/min,时间10min,半径14cm)取上清液保存于-20℃冰箱中待检;测定血清血管内皮生长因子(VEGF)、转化生长因子β1(TGF-β1)水平(酶联免疫吸附法)。
1.4 统计学分析
经SPSS19.0软件分析研究数据,计量资料(符合正态分布)、计数资料分别用(±s)、%表示,分别经t、χ2检验。P<0.05即差异有统计学意义。
2 结果
2.1 两组治疗效果对比
对照组疗效为显效12例(34.29%),有效17例(48.57%),无效6例(17.14%),总有效率为82.86%(29/35);试验组疗效为显效13例(37.14%),有效15例(42.86%),无效7例(20.00%),总有效率为80.00%(28/35);两组总有效率比较,差异无统计学意义(P>0.05),见图1。

图1 两组治疗效果比较
2.2 两组肺功能指标对比
VC、TLC及FEV1/FVC水平比较,两组治疗前1d差异无统计学意义(P>0.05);试验组治疗后14dVC、TLC及FEV1/FVC水平均高于对照组(P<0.05),见图2。
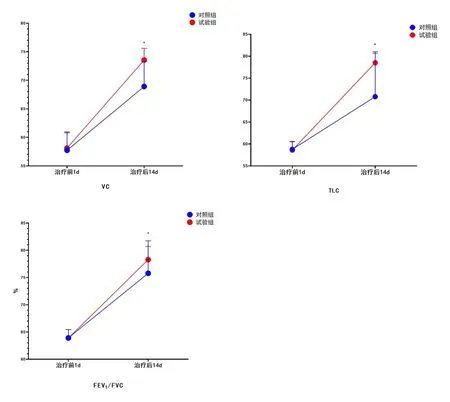
图2 两组肺功能指标比较
2.3 两组血气分析指标对比
两组治疗前1d、治疗后14d PaO2、DLCO水平差异无统计学意义(P>0.05),见图3。
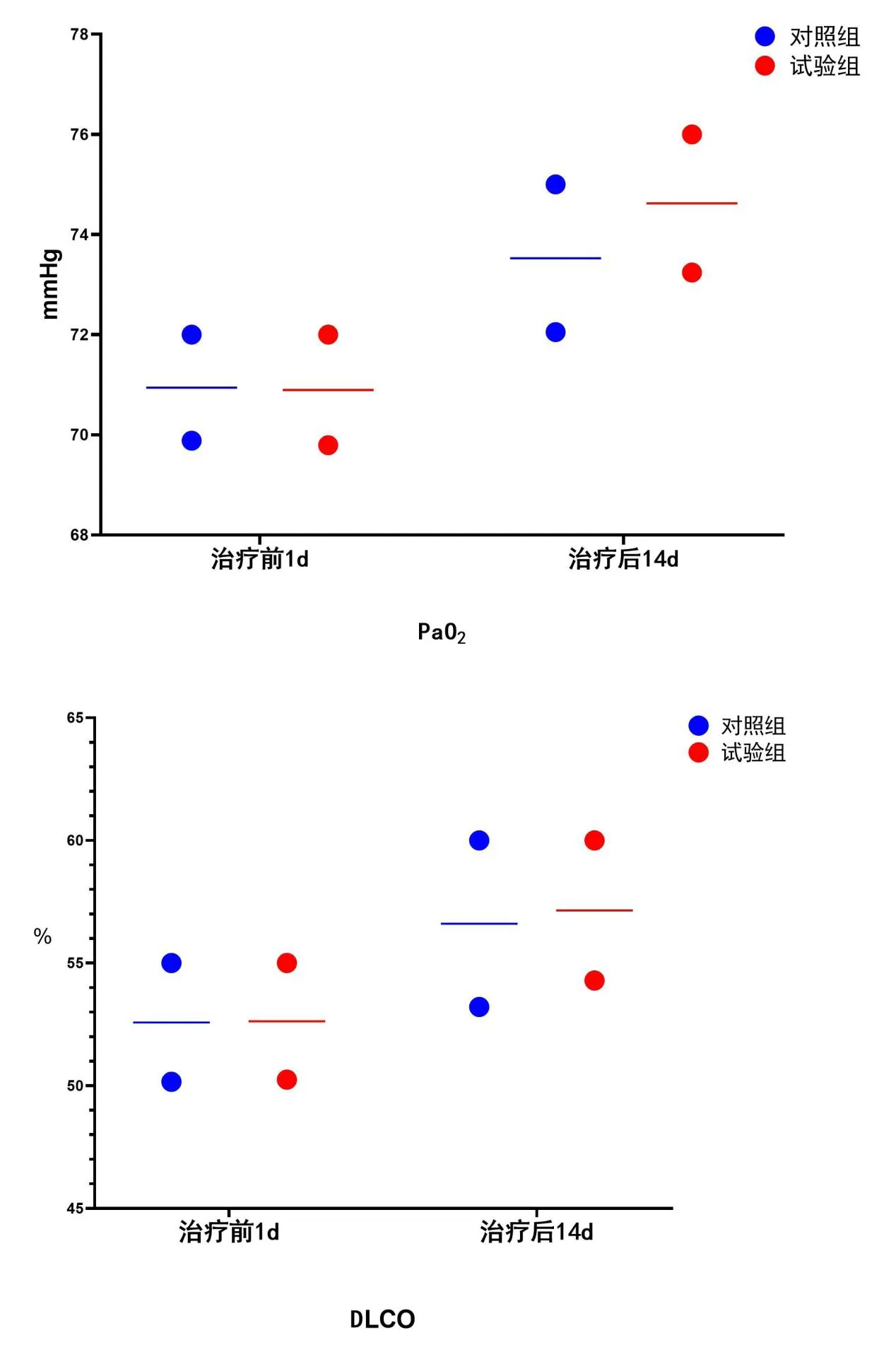
图3 两组血气分析指标比较
2.4 两组血清学指标对比
TGF-β1、VEGF水平比较,治疗前1d试验组均低于对照组(P<0.05),两组治疗后14d差异无统计学意义(P>0.05),见表1。
表1 两组血清学指标比较(±s,pg/L)

表1 两组血清学指标比较(±s,pg/L)
时间 组别 TGF-β1 VEGF治疗前1d 对照组(n=35) 183.54±27.29 527.59±41.29试验组(n=35) 158.45±23.46 465.98±33.58 t 4.124 6.848 P 0.000 0.000治疗后14d 对照组(n=35) 131.26±10.81 246.23±31.84试验组(n=35) 132.21±10.48 247.13±31.79 t 0.373 0.118 P 0.710 0.906
3 讨论
IPF是临床多发病之一,指临近肺泡腔受到弥漫性炎症性疾病影响,导致形成大量纤维结缔组织的一种呼吸系统疾病,患者以乏力、咳嗽及进行性呼吸困难等为主要表现,临床诊治难度较大。肺气肿是临床常见病理状态之一,患者多存在长时间的咯痰病史或咳嗽病史,导致支气管远端弹性产生一定减退情况,进而破坏气道。无论是何种疾病均可对患者工作及生活产生不利影响,严重者甚至危及患者生命。CPFE在临床并不少见,患者既可出现IPF症状,也可出现肺气肿症状。CPFE具有多种临床特征,包括突发性低肺量监测值、严重呼吸困难及严重性肺损伤等,部分患者可出现重度肺高压、运动低氧症等症状。有研究发现,吸烟可能提高CPFE发病风险,由此男性更易患该病,而随着男性年龄不断增长,肺腑异常更为多见,极易受到损害。肺气肿发生后可导致过度充气,而肺纤维化引起肺容量下降,两者可相互抵消,但对于CPFE患者来说,两种疾病对于机体肺弥散功能所产生的影响可相互叠加,可表现出弥散功能降低,而肺容积仍处于正常水平,使得患者无论在静息状态还是在运动状态均可能出现低氧血症[8]。报道显示,IPF合并肺癌发病率可达到48%,相较于未合并IPF患者,IPF可导致肺癌发生率增加14倍。CPFE患者肺癌发病风险也明显增加,可达到46.8%[9]。既往研究发现,肺癌发生的一项高危因素就在于肺纤维化,相较于健康人群,CPFE患者肺容量、通气功能及TLC等均与其接近,分析原因,可能是由于肺气肿所导致的过度充气可中和肺纤维化所致的通气功能障碍。此外,纤维化可对支气管产生牵拉,合并肺气肿该牵拉力可避免呼气气道发生塌陷,对小气道张力具有维持作用,进而维持FEV。研究证实,CPFE患者在气体交换所造成损伤的严重程度。不仅与肺泡沫增厚程度密切相关,还可受到肺血管床血流及肺毛细血管血流等减少的影响[10]。一项生存期分析报道指出,单纯IPF及肺气肿患者的平均生存期可达到38个月,但关于CPFE疗效与生存时间等相关报道较少。由此,对于CPFE患者两种疾病同时发生对临床疗效是否会产生影响,是本研究需解决的问题。
本研究发现,与对照组比较,试验组肺容量更低,分析原因,可能是由于肺纤维化病情在进展过程中可对肺部产生牵拉作用,一方面可对肺弥散功能产生影响,另一方面可阻碍小气道封闭,以降低肺容量。在血气分析指标方面,本研究发现,两组结果比较未见明显差异。提示PF患者合并肺气肿症状仅对肺容积产生影响,对治疗效果未见明显影响。但需要注意的是,本研究所选样本有限,往后研究中需扩大样本开展多中心研究,临床治疗时需仔细辨别并精确诊断,以患者症状表现、实际病情为依据制定相应治疗方案,以期延长患者生存期限。TGF-β1是临床研究IPF领域中所探究的一种热门细胞因子,既往研究证实该因子与IPF形成、发展等密切相关。TGF-β1可对杀好难过皮及神经外胚层起源细胞产生抑制作用,并刺激间充质起源细胞,对巨噬细胞的集落刺激因子(CSF)、IL-3敏感性起到抑制作用。此外,TGF-β1可对丝裂原、T细胞增殖及B细胞增殖等产生抑制作用。本研究中,IPF患者治疗前血清TGF-β1水平明显高于CPFE患者,提示该因子水平可反映治疗效果及疾病进展情况。有研究发现,TGF-β1与纤维化形成密切相关,原因可能在于:TGF-β1可对多种细胞外基质如胶原蛋白、纤黏连蛋白等高表达产生促进作用,通知书对细胞外基质(ECM)降解产生抑制作用,使得细胞形态发生一系列改变,出现异常增殖及分化情况。既往研究发现,对动物给予TGF-β1局部注射,可促进肉芽组织生成,且可发挥加速伤口愈合的作用。VEGF与多种疾病发生、发展密切相关,大量存在于血管内皮,可促进其增殖,增加血管内皮通透性。健康人群中VEGF蛋白于肺内合成,可对血管内皮细胞功能产生改善或维持作用,并对内皮细胞中抗凋亡蛋白表达产生诱导,以抑制内皮细胞凋亡。本研究中,试验组治疗前血清VEGF水平明显低于对照组,提示炎症期可使血清中VEGF升高,但肺气肿症状并不会IPF治疗后VEGF、TGF-β1表达产生影响。
综上所述,IPF患者合并肺气肿症状并不会对其临床疗效产生明显影响,仅对肺容积产生影响。
