干旱胁迫对三角梅生长及生理生化的影响
2022-10-10潘泰妙马晓华陈义增黄李光白羽张旭乐钱仁卷
潘泰妙, 马晓华, 陈义增, 黄李光, 白羽, 张旭乐, 钱仁卷*
(1.浙江原野建设有限公司, 浙江 温州 325102; 2.浙江省亚热带作物研究所,浙江 温州 325000;3.温州市林业技术推广和野生动植物保护管理站,浙江 温州 325005)
三角梅为紫茉莉科叶子花属观赏植物,原产于巴西,19世纪初引入欧洲,由欧洲传播至非洲、亚洲及大洋洲各国,是一种具有极高观赏价值的常绿攀援藤本植物[1-3]。因其花色艳丽、花型奇特,在城市造景中广泛应用。目前,三角梅在我国福建、海南等热带与亚热带地区都有大量栽培,北方寒冷地区以温室盆栽为主[4]。三角梅喜温暖湿润的气候,忌积水,生长旺盛期需要大量的水分,花期也可通过土壤水分含量的调整来控制花期的长短。三角梅的园林应用主要为桩景、绿篱等,以及庭院绿化和垂直绿化等,因立地条件的不同,土壤水分含量存在较大差异,使得不同地区的三角梅,即使在相同的气候条件下,花期的表现也不尽相同,且许多观赏价值较高的三角梅品种无法得到推广应用[5-6]。
植物本身对干旱都有一定的抵抗力和耐受力,但不同物种间差异很大,同一植物不同品种间抗旱性也存在显著差异[7]。水分缺失影响植物生长发育的各个阶段,对观赏植物的花卉品质及花期也有一定影响,严重时可致植株死亡,给生产带来巨大损失。三角梅生长对水分较敏感[8],园林绿化、园艺生产等领域对三角梅抗旱性研究一直倍加关注。目前全世界约有二分之一的地区受到干旱或半干旱的影响,特别是夏季高温时期。干旱条件下植物的渗透膜系统与抗氧化保护酶的相关反应研究已引起普遍关注[9]。在水分缺失条件下,植物通过增强抗氧化酶活性,减少活性氧的积累,以保护植物免受伤害,这在诸多观赏植物研究中已见报道[10]。三角梅除具有极高的观赏价值外,还表现出良好的药用、抗辐射、抗病毒、抗氧化等功能。许多研究表明,三角梅的根和叶中含有抗病毒蛋白,可抑制多种植物的病毒活性[11]。目前,关于三角梅的抗旱能力及其在水分缺失条件下的生理生化反应研究较少。因此,本研究以三角梅品种同安红为研究对象,探索其在干旱条件下的生理生化反应,以期为三角梅的栽培引种及推广应用提供理论参考。
1 材料与方法
1.1 试验材料
2020年7月,以一年生无病虫害、生长健壮、长势一致的三角梅品种同安红盆栽苗为试验材料,盆栽基质为等比例椰糠和营养土混合基质。试验处理开始前将三角梅盆栽至浙江温州亚作所培育基地的温室内,室温24~26 ℃,湿度70%~80%。育苗期间进行正常的栽培管理,保证幼苗健壮生长。
1.2 处理设计
以正常浇水处理为对照(CK),对三角梅进行自然干旱处理。选取健康良好、长势一致的三角梅进行3 d缓苗,每天早上9:00浇透水,3 d后停止浇水,使其自然干旱。在此期间,每7 d取样1次,分别在0、7、14、21、28、35 d取样,进行相关生理生化指标的测量。每处理重复5次,每重复10盆。
1.3 指标测定方法
试验期间,每隔7 d采盆栽土样,根据称重法测定三角梅盆栽基质水分含量,并用游标卡尺测三角梅地径[12],同时采集各处理三角梅当年生枝条距顶端3~4片健康、成熟的叶片(每处理的每个重复均保留1株不采样,留作测鲜质量使用),采用试剂盒(南京建成生物公司)测定超氧化物歧化酶(SOD)[13],以愈创木酚法测定过氧化物酶(POD)活性[13],以紫外吸收法测定过氧化氢酶(CAT)活性和抗坏血酸过氧化物酶(APX)[14],超氧自由基的产生速率采用Wang等[15]的方法测定,过氧化氢含量采用Patterson等[16]的测定方法,采用烘干法测定叶片含水量[17],利用Li-6400便携式光合仪测定光合参数[12]。
1.4 数据处理
采用SPSS 16.0软件统计处理进行数据分析,运用Duncan′s检验法进行多重比较,数据为平均值±标准差(n=5)。
2 结果与分析
2.1 干旱处理下三角梅土壤含水量的变化
如图1所示,CK处理保持三角梅苗期正常浇水管理,在试验处理初期土壤含水量为78.9%,随着处理时间的增加,含水量无显著差异,至处理35 d时,CK含水量为81.6%。而自然干旱胁迫处理后,三角梅盆栽的土壤含水量呈下降趋势,在试验处理开始(0 d)时,土壤含水量为80.10%,随着干旱处理时间的增加,含水量显著下降,至干旱胁迫后期(35 d),土壤含水量下降至最低,且显著低于对照组。本研究中,三角梅盆栽在胁迫21 d时,达到中度胁迫水平,此时土壤含水量为35.27%;胁迫28 d时,土壤含水量为27.65%;35 d时达到重度干旱胁迫水平,土壤含水量为19.30%。随着胁迫时间的增加,三角梅土壤含水量下降趋势显著,反映了干旱胁迫下土壤水分逐渐丧失的过程。
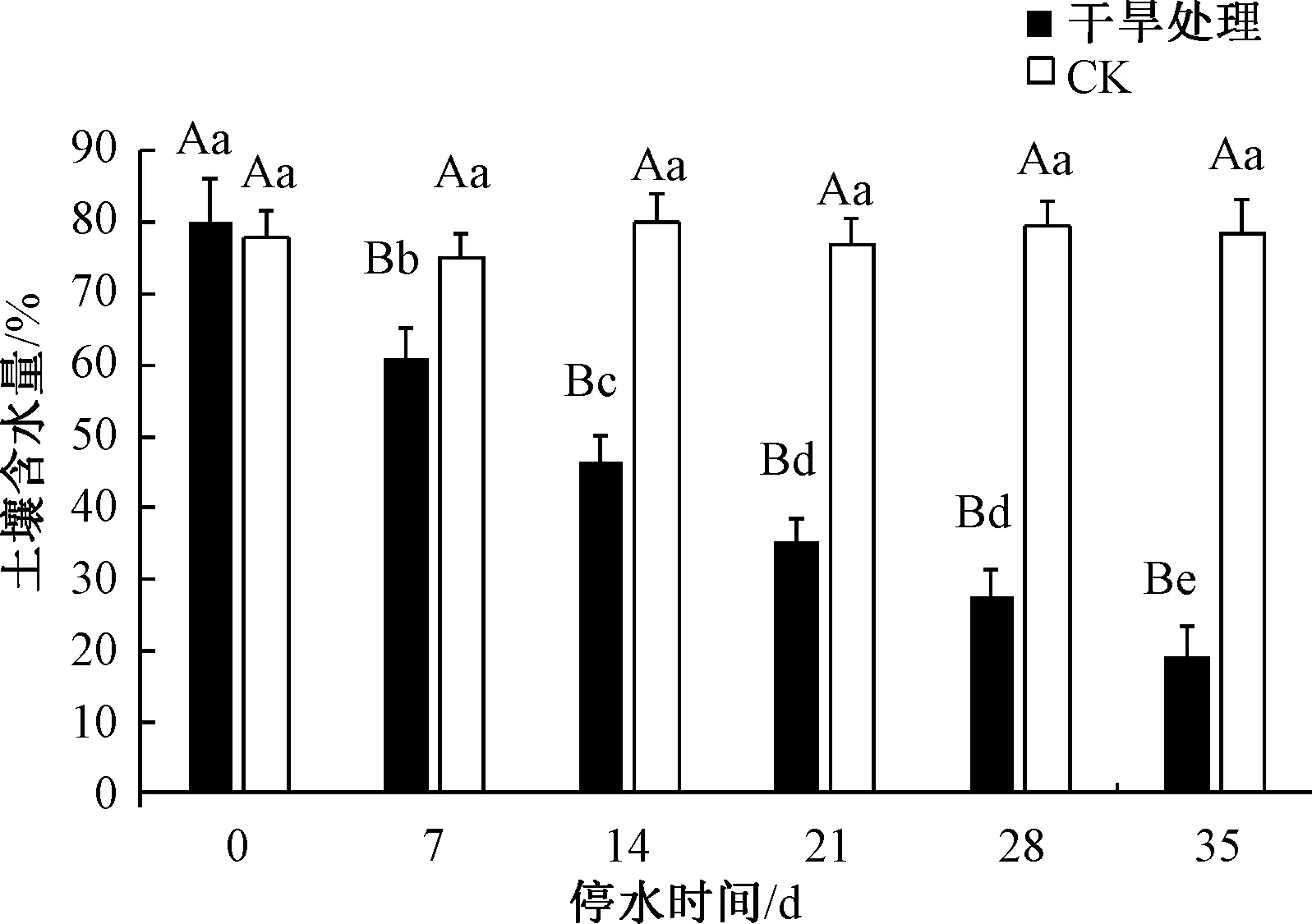
不同大小写字母分别表示各处理间在0.01和0.05水平存在显著差异。图2~6同。
2.2 干旱处理下三角梅地径增量的变化
如图2所示,随着对三角梅胁迫时间的增加,三角梅地径增量呈下降趋势。在停水28 d(中度干旱)、35 d(重度干旱)时,地径增量呈现出负增长,表明干旱胁迫抑制了三角梅地径的生长,并使三角梅的外部形态发生一定改变。而对照组的三角梅地径增量在停水14、21、28、35 d时显著高于干旱处理组。

图2 自然干旱胁迫下三角梅地径增量的变化
2.3 干旱处理下三角梅叶片相对含水量的变化
如图3所示,随着对三角梅干旱处理时间的延长,自然干旱处理的三角梅叶片的相对含水量呈显著下降趋势,至干旱胁迫35 d时,三角梅叶片含水量降至最低,并显著低于干旱胁迫0 d、7 d、14 d与21 d时三角梅叶片含水量;在停水14 d(轻度干旱胁迫),21 d(中度干旱胁迫)、28 d(中度干旱胁迫)、35 d(重度干旱胁迫)时,三角梅叶片相对含水量均与CK处理差异显著,并显著低于CK处理。与CK相比,三角梅叶片含水量在干旱胁迫21 d、28 d和35 d时,分别降低了5.5%、7.9%、10.4%。
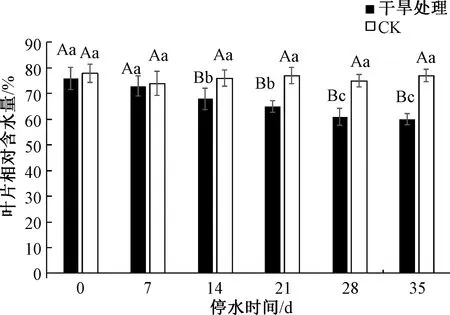
图3 干旱胁迫下三角梅叶片相对含水量的变化
2.4 干旱处理下三角梅叶片光合参数的变化
如图4所示,随着干旱胁迫时间的延长,净光合速率(Pn)呈下降趋势,在干旱胁迫21、28、35 d时期,相比CK,Pn分别下降6.33%、8.2%、8.61%。随着自然干旱时间的增加,细胞间隙CO2浓度(Ci)呈现先下降后上升的趋势,且在干旱胁迫21 d时降至最低,为CK的76.14%。蒸腾速率(Tr)和气孔导度(Gs)也随着处理时间的增加不断降低,至停水35 d时,分别只有CK的58.5%和33.3%。

图4 干旱胁迫下三角梅光合参数的变化
2.5 干旱处理下三角梅抗氧化酶的变化
如图5所示,随着对三角梅胁迫处理时间的延长,SOD活性呈现不断上升的趋势,在停水21、28、35 d时,SOD活性相比CK存在显著差异,分别是CK的1.50、1.65、2.48倍。POD活性随着自然干旱时间的延长呈先上升后下降的趋势,在停水7、14、21、28 d时,POD活性增加37.1%、70.3%、139.4%、65.9%,与CK存在极显著差异。随着胁迫时间的增加,CAT活性呈现不断上升的趋势,在停水7、14、21、28、35 d时,分别是CK的1.32、2.56、3.2、3.98和4.86倍,与CK相比显著增加。APX活性随处理时间的增加呈上升趋势,在停水35 d时达到最大值,为CK的5.63倍。
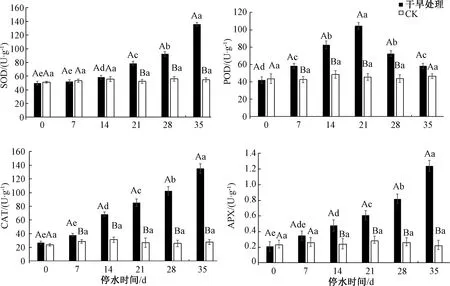
图5 干旱胁迫下三角梅抗氧化酶的变化
2.6 干旱处理下三角梅H2O2和的变化

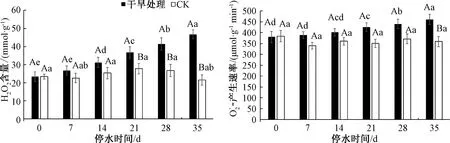
图6 干旱胁迫下三角梅H2O2和含量的变化
3 讨论
干旱胁迫作为自然环境中主要的非生物胁迫之一,是影响植物营养生长与生殖生长重要的环境因素之一,特别是对水分变化极为敏感的观赏类花卉,水分含量的变化会直接影响花卉品质及花卉观赏期[18-20]。植物生长为其生殖器官发育与开花提供必要的营养基础与养分积累[21]。本研究发现,在自然干旱条件下,随着停水时间的增加,三角梅的地径增量呈下降趋势,至重度干旱时期,呈现负增长现象,这表明自然干旱条件下土壤水分的流失限制了三角梅的生长,但在自然干旱初期,土壤含水量缺失较少,三角梅还可正常生长,而至重度干旱时期,土壤水量缺失严重,三角梅叶片内水分含量也急剧下降,导致其生长发育受到限制[22]。
光合作用是直接影响植物生长发育的生理生化过程之一。随着自然干旱时间的延长,土壤水分含量不断降低,三角梅的Pn、Gs和Tr也随之降低,这与刘晓洲在白姜花上的研究结果相似[23],表明随着干旱程度的不断增加,三角梅通过关闭气孔减少水分散失,以维持正常的光合作用。本研究发现,Ci随着自然干旱时间的延长而先增加后降低,表明在干旱程度的初期,Pn下降主要由气孔因素引起,而在重度干旱时期,Pn下降是由气孔因素和非气孔因素共同导致的。活性氧通常被认为是植物正常生长代谢过程中的副产品,其过度累积能引起植物体内大分子如脂类、蛋白质及DNA的损伤[24]。

4 小结
本文通过自然干旱条件下对三角梅生长及生理生化的响应特性的研究发现,在干旱程度初期,三角梅可以正常发育;随着干旱程度的增加,三角梅的生长受到显著抑制,Pn、Gs和Tr不断降低,且通过增强体内的抗氧化酶活性,清除体内过剩的活性氧,维持其正常的生长发育,表明三角梅可以抵抗程度轻微的干旱,而在重度干旱条件下生长受到抑制。
