离子色谱法同时测定药品中巴比妥酸和硝酸盐
2022-10-10潘忠全黄选忠
潘忠全,黄选忠
(1.湖北远安县疾病预防控制中心,湖北远安 444200; 2.湖北兴山县疾病预防控制中心,湖北兴山 443700)
巴比妥酸是合成巴比妥、苯巴比妥等镇静催眠药和维生素B12 等药品的中间体[1]。由于巴比妥酸在生理条件下99%以上是离子状态而无疗效[2],因此需要监测巴比妥、苯巴比妥和维生素B12 等药品中的巴比妥酸含量。
硝酸盐对人体有害,过量摄入可能导致高铁血红蛋白血症,并在体内转化成致癌性的亚硝胺[3],持续少量摄入也会引起消化不良、精神抑郁和头痛[4],中国药典对相关药品中硝酸盐的含量均有明确的限量要求,如维生素B1 原料药中硝酸盐含量不得大于0.25%[5],因此监测药品中硝酸盐含量对保障用药安全具有重要意义。
目前测定药品中微量巴比妥酸的方法已报道的有化学发光法[6]和分光光度法[7],其中,化学发光法需要专用仪器,而分光光度法则灵敏度偏低。离子色谱法已成为测定无机阴离子和有机酸的首选方法之一,应用于维生素B1 注射液中的EDTA 及硝酸根离子的同时测定[4]和水、尿液、食品等样品中邻苯二甲酸(根)、草酸、枸橼酸、琥珀酸、柠檬酸、酒石酸、乙醇酸、甲酸、乙酸、酒石酸、氨基磺酸等有机酸的定量分析[8-14],但测定药品中巴比妥酸尚未见报道。笔者用SH-AC-3 型阴离子交换柱和CIC-100 型色谱仪同时测定巴比妥、苯巴比妥和维生素B12 等药品中的巴比妥酸和硝酸盐,准确度高,重现性良好,操作简便快速,可用于巴比妥、苯巴比妥和维生素B12 等样品中微量巴比妥酸和硝酸盐的定量分析。
1 实验部分
1.1 主要仪器与试剂
离子色谱仪:CIC-100 型,配SHY-2 型自再生抑制器,青岛盛瀚色谱技术有限公司。
自动进样器:SHA-15 型,青岛盛瀚色谱技术有限公司。
0.45 μm 滤膜过滤器:Φ13 mm,青岛盛瀚色谱技术有限公司。
巴比妥酸:分析纯,C4H4N2O3·2H2O,北京国药集团化学试剂有限公司。
巴比妥酸标准溶液:1 000 mg/L,称取1.294 2 g巴比妥酸,用高纯水溶解定容于1 000 mL 容量瓶中。
磷酸二氢钾、溴化钾:分析纯,北京国药集团化学试剂有限公司。
H2PO4-标准溶液:1 000 mg/L,准确称取磷酸二氢钾0.140 2 g,于105 ℃烘烤2 h,用高纯水溶解,定容于100 mL 容量瓶中。
Br-标准溶液:1 000 mg/L,准确称取溴化钾0.148 9 g,于105 ℃烘烤2 h,用高纯水溶解,定容于100 mL 容量瓶中。
NO3-、F-、Cl-、SO42-标准溶液:质量浓度均为1 000 mg/L,标准物质编号分别为GBW(E) 080223、GBW(E) 080549、GBW(E) 080268、GBW (E)080266,中国计量科学研究院。
NO2-标准溶液:质量浓度为100 mg/L,编号为GBW(E)080223,中国计量科学研究院。
无水碳酸钠、碳酸氢钠:分析纯,北京国药集团化学试剂有限公司。
药物样品:(1)巴比妥,化学纯,含量(质量分数)大于98%,批号为180610,成都化学试剂厂;(2)苯巴比妥片,规格为30 mg/片,批号为36200701,精华制药集团股份有限公司;(3)维生素B12 片,规格为20 μg/片,批号为F200706,山西云鹏医药集团有限公司。
实验所用其它试剂均为分析纯。
实验用水为高纯水,电阻率为18.2 MΩ·cm。
1.2 仪器工作条件
色谱分离柱:SH-AC-3 型阴离子交换柱(250 mm×4.0 mm,10 μm,青岛盛瀚色谱技术有限公司);保 护 柱:SH-AC-3 型(50 mm×4.0 mm,青岛盛瀚色谱技术有限公司);淋洗液:5.0 mmol/L Na2CO3溶液,流量为1.0 mL/min;柱箱温度:35 ℃;电流:75 mA;检测器:电导检测器;自动进样器:全定量环取样,取样后清洗(每针之间);置换量:70 μL;取样体积:25 μL;进样深度:4 mm。
1.3 实验方法
1.3.1 系列混合标准工作溶液的配制
将巴比妥酸和NO3-标准溶液稀释成含巴比妥酸和NO3-均分别为10.0 mg/L(A 液)和100.0 mg/L(B 液),临用现配。再分别取A 液0.10、0.25、0.50、1.00 mL 及B 液0.50、1.0、2.0、3.0、4.0、5.0 mL 于10只10 mL 容量瓶中,加纯水至标线,混匀,配制成含巴比妥酸和NO3-均分别为0.10、0.25、0.50、1.00、5.00、10.00、20.00、30.00、40.00 和50.0 mg/L 的系列标准工作溶液。
1.3.2 标准曲线绘制
取1.3.1 制备的系列标准工作溶液,每种浓度各取1.5 mL 于样品瓶中,启动自动进样器进样,分别测定,以巴比妥酸和NO3-的质量浓度(x)为横坐标、以巴比妥酸和硝酸盐的色谱峰面积(y)为纵坐标绘制标准工作曲线,计算线性方程和相关系数。
1.3.3 样品处理
称取巴比妥0.250 g,用5 mL 无水乙醇溶解,再用高纯水定容至100 mL,取该溶液用高纯水稀释至2 倍体积,经0.45 μm 滤膜过滤后作为样品溶液A。该样品溶液中巴比妥的质量浓度为1.250 g/L。
将苯巴比妥片研磨均匀称取0.420 g(含苯巴比妥200 mg),加入10 mL 无水乙醇,充分搅拌溶解,用高纯水定容至100 mL,滤去不溶物,滤液用高纯水稀释至2 倍体积,经0.45 μm 滤膜过滤后作为样品溶液B。该样品溶液中苯巴比妥的质量浓度为1.000 g/L。
取维生素B12 片40 片(含维生素B12 约1000 μg),用高纯水洗去表面糖衣,用高纯水充分研磨溶解,定容至100 mL,滤去不溶物,滤液用0.45 μm滤膜过滤,作为该样品溶液C。该样品溶液中维生素B12 的质量浓度为10 mg/L。
1.3.4 样品测定
取样品溶液1.5 mL 于样品瓶中,启动自动进样器进样测定巴比妥酸和NO3-的色谱峰面积,以标准曲线法定量,同时进行加标回收试验。
2 结果与讨论
2.1 色谱条件的选择
2.1.1 淋洗液
考察了流量为1.0 mL/min,淋洗液中Na2CO3与NaHCO3溶液浓度(单位mmol/L)比分别为5∶0、5∶0.5、5∶0.75、5∶1.0 时,SH-AC-3 型柱对 巴 比妥酸、硝酸盐、H2PO4-与硫酸盐常见阴离子的分离情况,结果见表1。
由表1 可知,随着淋洗液中NaHCO3浓度的增加,硝酸盐的色谱峰分离度呈降低趋势,巴比妥酸的色谱峰分离度则无明显改变,而H2PO4-的色谱峰分离度逐渐增加,为使巴比妥酸和硝酸盐均有较高的色谱峰分离度,选择Na2CO3溶液作为淋洗液。选择不同浓度的Na2CO3溶液分别进行试验,当Na2CO3溶液浓度分别为4.0、5.0、6.0 mmol/L 时,巴比妥酸的色谱峰分离度分别为4.97、3.60、3.10,硝酸盐的色谱峰分离度分别为2.04、1.96、1.77,完全满足相邻组分完全分离的要求(R ≥1.5)[15],SO42-的保留时间分别为16.615、13.539、11.746 min,综合考虑待测组分的色谱峰分离度及SO42-的保留时间,最终选择5.0 mmol/L 的Na2CO3溶液为淋洗液,在此淋洗条件下巴比妥酸和硝酸盐与常见阴离子的分离良好。
2.1.2 色谱柱
以5.0 mmol/L Na2CO3溶液为淋洗液,流量为1.0 mL/min,等度洗脱,考察SH-AC-1 型和SHAC-3 型阴离子交换柱分别对巴比妥酸和硝酸盐与其它常见阴离子的分离效果。结果表明,SH-AC-1型阴离子交换柱虽然能将氯化物、硝酸盐和硫酸盐完全分离,但不能将氯化物与巴比妥酸完全分离且巴比妥酸严重拖尾、色谱峰形较差,SH-AC-3 型阴离子交换柱不仅能将氯化物与巴比妥酸完全分离且巴比妥酸的峰形良好,最终选择SH-AC-3 型阴离子交换柱为分离柱。
2.1.3 淋洗液流量
考察淋洗液流量分别为0.8、1.0、1.2 mL/min 时各组分的分离情况,试验结果见表2。
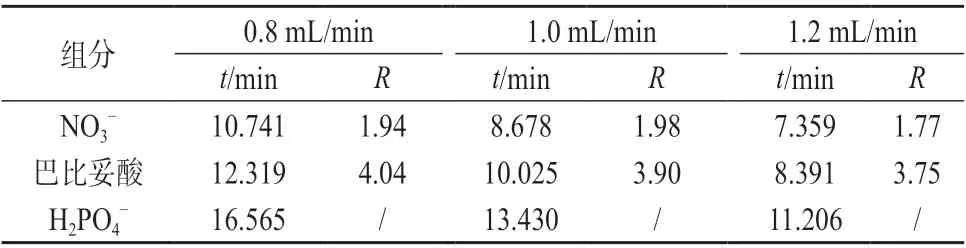
表2 不同淋洗液流量时各组分保留时间( t )及分离度(R)
由表2 可知,随着淋洗液流量的增大,各组分的保留时间(t)逐渐缩短,峰分离度(R)和色谱峰面积逐渐减小。当淋洗液流量从0.8 mL/min增大至1.0 mL/min 时,硝酸盐的保留时间缩短2.0 min,分离度变化较小;当淋洗液流量从1.0 mL/min 增大至1.2 mL/min 时,保留时间缩短1.3 min,峰分离度从1.98下降至1.77;当淋洗液流量从0.8 mL/min 增大至1.0 mL/min 时,巴比妥酸的保留时间缩短2.3 min,分离度从4.04 下降至3.90;当淋洗液流量从1.0 mL/min 增大至1.2 mL/min 时,保留时间缩短1.6 min,分离度从3.90 下降至3.75。另外,淋洗液流量每增加0.20 mL/min 巴比妥酸和硝酸盐的色谱峰面积约下降18%~20%。在保证目标分析物与其它离子良好分离的前提下,以使组分有较短的保留时间、较高的色谱峰分离度和检测灵敏度、系统有较低的压力,综合考虑,确定淋洗液流量为1.0 mL/min。
2.1.4 柱箱温度
考察柱箱温度分别为30、35、40 ℃时各组分的分离效果,结果显示,随着柱温的升高,巴比妥酸和硝酸盐的保留时间稍微缩短,色谱峰面积逐渐增加。当柱温从30 ℃上升到35 ℃时,硝酸盐色谱峰面积增加6.7%;从35 ℃上升到40 ℃时,硝酸盐色谱峰面积增加5.6%。当柱温从30 ℃上升到35 ℃时,巴比妥酸色谱峰面积增加4.4%;而从35 ℃上升到40℃时,巴比妥酸色谱峰面积仅增加1.6%。这与邻苯二甲酸根的试验结果[8]类似,同时硝酸盐的色谱峰分离度逐渐降低,分别为1.94、1.78 和1.65,巴比妥酸的色谱峰分离度则逐渐增加,分别为3.62、3.80 和4.54。综合考虑待测组分的检测灵敏度和色谱峰分离度,选择柱箱温度为35 ℃。
2.2 共存物质的影响
取各种标准溶液配制成含巴比妥酸20 mg/L,硝酸盐、磷酸盐各10 mg/L,氯化物、溴化物、硫酸盐、亚硝酸盐各5 mg/L,氟化物3 mg/L 的混合标准溶液,取1.5 mL 于样品瓶中,启动自动进样器进样测定,以考察巴比妥酸和硝酸盐与前述6 种常见阴离子的分离效果,巴比妥酸盐、硝酸盐与常见阴离子色谱图见图1。由图1 可知,在优化的实验条件下,巴比妥酸和硝酸盐与前述6 种常见阴离子可以完全分离,其中磷酸盐与硫酸盐不能完全分离,除磷酸盐与硫酸盐外,其余组分的出峰顺序均在待测物之前,均不影响巴比妥酸和硝酸盐的测定。
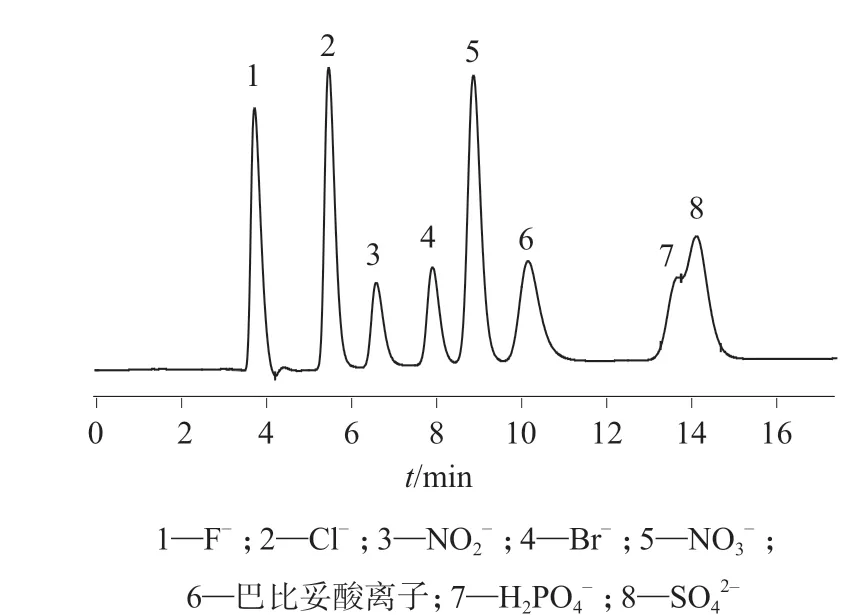
图1 巴比妥酸盐、硝酸盐与常见阴离子色谱图
2.3 线性方程、线性范围与检出限
按照1.3.1 配制系列标准工作溶液,依次测定并计算标准曲线线性方程、相关系数。测定仪器30 min 的基线噪声[16],以3 倍基线噪声除以标准曲线的斜率计算巴比妥酸和硝酸盐的检出限。巴比妥酸和硝酸盐的线性范围、线性方程、相关系数和检出限见表3。由表3 可知,巴比妥酸的色谱峰面积与其质量浓度在0.10~50.0 mg/L 范围内线性关系良好,相关系数为0.999 9;硝酸盐的色谱峰面积与其质量浓度分别在0.10~30.0 mg/L 和30.0~50.0 mg/L范围内线性关系良好,相关系数分别为0.999 4 和0.999 9。巴比妥酸和硝酸盐的检出限分别为0.10 mg/L 和0.03 mg/L。10 mg/L 的巴比妥酸和硝酸盐标准混合溶液的色谱图见图2。

表3 巴比妥酸和硝酸盐的线性范围、线性方程、相关系数和检出限
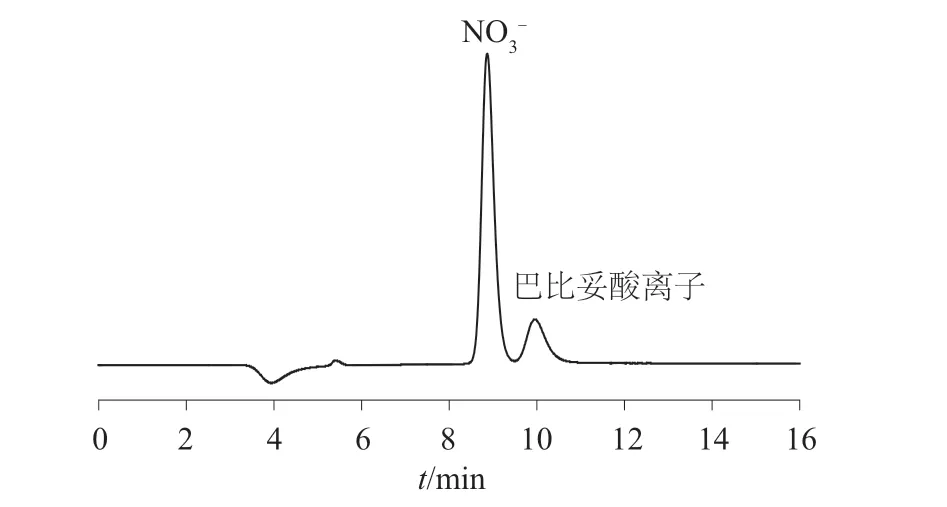
图2 巴比妥酸盐和硝酸盐混合标准溶液色谱图
2.4 样品测定及加标回收试验
按1.3 方法操作,测定巴比妥、维生素B12 和苯巴比妥等样品中的巴比妥酸和硝酸盐的含量。并在3 种样品中分别添加1.0、5.0、10.0 mg/L 的巴比妥酸和硝酸盐,平行测定5 次,计算加标回收率及测定结果的相对标准偏差,结果见表4。由表4 可知,巴比妥、苯巴比妥和维生素B12 等3 种样品中硝酸盐的加标回收率为98.0%~101.3%,测定结果的相对标准偏差为1.21%~2.66%;巴比妥酸的加标回收率为90.4%~101.4%,测定结果的相对标准偏差为1.71%~2.39%,表明该方法回收率较高、重现性良好。加标苯巴比妥样品色谱图见图3。
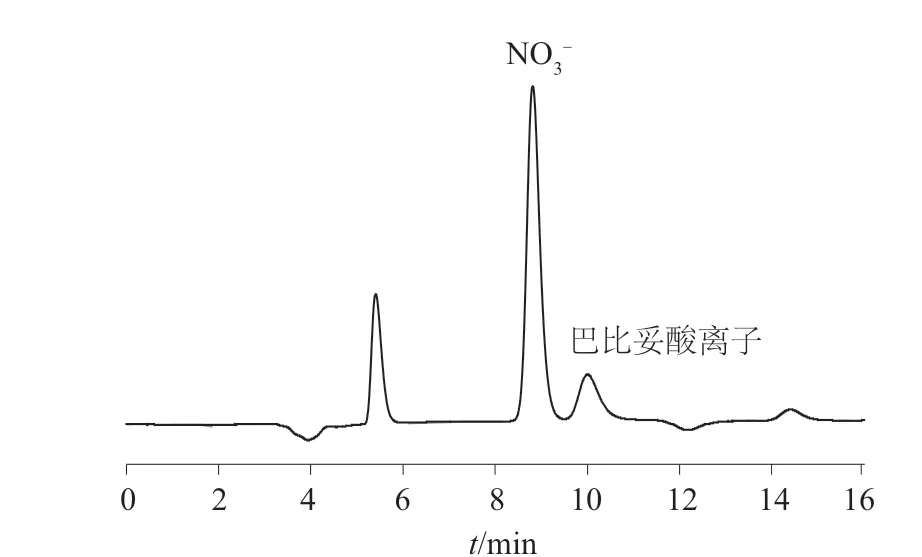
图3 苯巴比妥加标样品色谱图
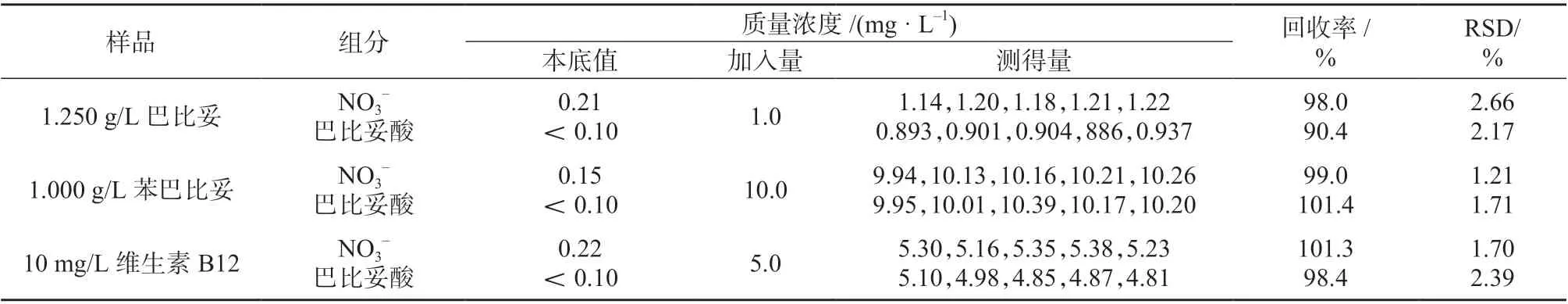
表4 巴比妥、苯巴比妥和维生素B12 样品测定及加标回收试验结果
3 结语
建立了以SH-AC-3 型阴离子交换柱为分离柱,以5.0 mmol/L Na2CO3溶液为淋洗液,流量为1.0 mL/min 等度洗脱,离子色谱-抑制电导检测法同时测定药品中巴比妥酸和硝酸盐的分析方法。该方法准确度高,重现性良好,操作简便快速,可用于巴比妥、苯巴比妥和维生素B12 等样品中微量巴比妥酸和硝酸盐的定量分析。
