甜叶菊水分胁迫响应基因SrDREB2A克隆及表达分析
2022-10-09张婷杨永恒孙玉明徐晓洋王银杰张永侠原海燕
张婷,杨永恒,孙玉明,徐晓洋,王银杰,张永侠,原海燕
(江苏省中国科学院植物研究所/南京中山植物园,南京 210014)
0 引言
菊科多年生草本植物甜叶菊(Stevia rebaudianaBertoni)是一种新兴保健型糖料作物,原产于南美巴拉圭和巴西交界的阿曼拜山脉,在当地已有数百年的食用历史。其叶片中富含的甜菊糖苷是一类四环二萜类物质,因具有高甜度(约为蔗糖的300~400 倍)、低热量(约为蔗糖的1/300)、预防和辅助治疗高血压、糖尿病和肿瘤等疾病的功效而被广泛应用于食品、饮料和医药等领域[1-2]。自1976 年首次从日本引种种植成功以来,目前我国已成为世界甜叶菊种植与原料生产和出口最大的国家,其中甘肃、新疆和内蒙古等省区则因为其日照较长、病虫害发生较轻等独特的区位优势已逐渐发展成为甜叶菊的优势产区[3]。然而,这些区域气候干燥且降水量少,而甜叶菊属浅根系植物、喜湿不耐旱[2],因此提高其耐旱性对于降低甜叶菊原料生产成本及节约水资源都具有重要意义。
AP2/ERF 类蛋白是植物特有的一类转录因子,它们均包含由大约60 个氨基酸组成的AP2 保守结构域。该家族可进一步被分为AP2、ERF、RAV、DREB 和Soloist 五个亚家族[4],其中DREB 亚家族又进一步被分为A-1~A-6亚组,A-1亚组蛋白主要参与植物冷胁迫响应,而A-2 亚组蛋白则在抗旱及耐热方面起重要作用[5],这两个亚组蛋白均可结合含有DRE/CRT 元件基序从而启动下游基因表达[6]。拟南芥中A-2 亚组包含8 个DREBs,其中只有DREB2A和DREB2B能够被干旱胁迫显著诱导表达,表明这两个转录因子可能在该亚组中起主要作用[7]。对AtDREB2A 蛋白激活活性研究发现其靠近AP2 结构域的部位存在一段负调控区域,去除这段序列(AtDREB2A CA)可以显著提高AtDREB2A的转录激活活性。过表达AtDREB2A CA可以明显增强植株的耐旱性,而过表达AtDREB2A基因全长则不能,表明AtDREB2A可能存在转录后修饰[8]。除了At-DREB2A,过表达水稻、玉米和苹果等的DREB2A同源基因均可提高植株的耐旱性[9-11],表明DREB2A在不同物种中的功能具有保守性。
本研究通过同源克隆的方法在甜叶菊中克隆拟南芥AtDREB2A的同源基因,对其组织表达及水分胁迫响应模式进行分析,并进一步明确其亚细胞定位和转录激活活性。以上研究为后续进一步明确SrDREB2A的分子功能及通过转基因手段提高甜叶菊的耐旱性奠定基础。
1 材料与方法
1.1 试验材料与种植条件
本试验采用的甜叶菊品种为‘中山6 号’,保存于江苏省中国科学院植物研究所甜叶菊种质资源圃。取生长一致的甜叶菊插穗扦插于营养土∶蛭石=1∶1的基质中,待生长至6片左右完全展开叶后取出植株并将根部洗净。自然失水胁迫处理方法参照张常青等的菊花耐旱性评价方法[12]并略作改动,其中胁迫时间点取0、1、4、8 h。用于亚细胞定位试验的烟草种植于光照培养箱中,培养基质为营养土∶蛭石=2∶1,培养条件为光照强度80~100µmol/(m2·s),光周期为16 h光照/8 h黑暗,进行正常的水分管理。
1.2 试验方法
取‘中山6 号’根、节、节间、叶以及自然失水胁迫试验的甜叶菊叶片于液氮中速冻,然后于-80 ℃保存。利用Trizol 试剂(TAKARA)提取总RNA,之后根据PrimeScript 1stStrand cDNA Synthesis Kit(TAKARA,D6110A)试剂盒进行反转录得到cDNA。通过拟南芥AtDREB2A(NCBI 登录号:AED90871)的序列信息,在本课题组甜叶菊转录组库中进行同源性比对,并利用NCBI在线引物设计网站(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计引物SrDREB2A-F/R(引物序列见表1)进行同源基因克隆。利用Pfu 高保真酶(TAKARA)进行扩增,扩增产物连接到pEASY-Blunt(全式金)载体上后转化大肠杆菌感受态DH5α细胞并涂布于含有氨苄抗性的LB培养基上,37 ℃过夜培养。挑取生长出的单克隆菌落进行PCR验证,然后进行琼脂糖凝胶电泳并选取含有目的条带的菌液委托测序公司(通用生物)进行测序进而得到目的基因序列。

表1 研究所用的PCR 引物Table 1 PCR primers used in this study
1.2.2 qRT-PCR分析
利用SYBR Premix Ex Taq 试剂(TAKARA)在CFX96 定量PCR 仪(BIO-RAD 公司)对SrDREB2A在不同组织及不同失水胁迫时间点进行定量分析,内参选择β-Actin(AF548026),并利用2-ΔΔCt方法计算SrDREB2A的相对表达量[13]。定量引物见表1。
1.2.3 进化树构建及结构域分析
在NCBI网站通过在线BLAST序列比对,下载不同物种中DREB 亚家族蛋白序列,并利用MEGA 5.0软件对所有序列进行系统进化树构建,选择Neighbor-joining 方法,Bootstrap 参数值设为1 000。另外将SrDREB2A 蛋白序列提交NCBI进行结构域分析,利用DNAMAN 软件将SrDREB2A 及其同源序列进行多序列比对并标注结构域所在位置。
1.2.4 亚细胞定位
利用SrDREB2A-GFP-F/R 引物(序列见表1)对SrDREB2A全长序列进行扩增,然后利用ClonExpress®II One Step Cloning Kit试剂盒(诺唯赞公司)并通过同源重组方法插入到pCAMBIA1305-GFP空载的GFP基因序列上游。GFP空载及SrDREB2A-GFP载体通过农杆菌介导的瞬时转化方法注射进生长5周左右的健康烟草叶片中。对烟草进行正常管理,2 d后利用激光共聚焦显微镜(Leica TCS SP5)观察绿色荧光的定位情况。
1.2.5 转录激活活性分析
粗糙集理论作为一种新型的信息处理数学工具,主要应用于已知信息不精确、不完备、不统一等场合。科学合理地将灰色系统理论和粗糙集理论进行结合,能更好地解决信息不确定、不完全处理领域的问题。粗糙集理论的重点内容是知识约简,即利用已知的决策对象、决策指标、灰色聚类结果形成一个原始决策表,考虑到元动作单元故障模式的已知数据存在不完全性并且聚类结果存在灰性(即信息不精确)的特点,若直接对所建立的原始决策表进行知识约简,那么很可能会导致极小决策算法与问题的实际意义相悖。为了优化决策算法,使决策规则更具柔性,笔者先对原始决策表进行离散化处理,然后对它进行知识约简。
选择合适的带酶切位点的引物(引物序列见表1)对构建在pEASY-Blunt 载体上的SrDREB2A序列进行扩增,得到SrDREB2A全长片段,然后利用胶回收试剂盒对产物进行回收,并通过同源重组的方法构建在pGBKT7 载体上。利用酵母转化试剂盒(Clontech)将pGBKT7 空载及目的质粒转化进酵母感受态细胞AH109,然后涂布于SD/-Trp 营养缺陷型培养基。30 ℃倒置培养3 d 后,随机选取3 个克隆分别用无菌ddH2O 重悬,点至SD/-Trp、SD/-Trp/-His、SD/-Trp/-His/-Ade、SD/-Trp/-His/-Ade+x-α-gal培养基上,30 ℃培养3~5 d。
分别随机取3 个转化进pGBKT7-SrDREB2A、pGBKT7 空载的酵母单克隆用2 mL无菌ddH2O 重悬,点至SD/-Trp/-His及SD/-Trp/-His含不同浓度3AT 的培养基上(3AT浓度设置为0、10、20、30、40、50、75、100 mmol/L),倒置培养3~5 d后观察酵母生长情况。
根据结构域将SrDREB2A基因序列截断成不同长度,并通过同源重组方式分别构建在pGBKT7 载体上。构建成功的载体质粒及pGBKT7 空载转化酵母感受态细胞AH109,并涂布于SD/-Trp 培养基,30 ℃倒置培养3 d。挑取单克隆于SD/-Trp液体培养基中培养,然后利用CPRG作为反应底物测定其β-gal活性。
1.3 数据分析
试验数据利用EXCEL 2010软件进行处理,采用SPSS 16.0软件进行方差分析。
2 结果与分析
2.1 SrDREB2A基因克隆与结构域分析
通过同源克隆的方法我们从甜叶菊中获得了SrDREB2A的全长序列并提交NCBI网站进行序列登录(登录号:MK163642)。该基因编码区长度为903 bp,编码301个氨基酸残基,通过BioXM 软件预测的蛋白分子量和等电点分别为33.12 kDa 和5.15,具有一个典型的AP2 结构域(图1A)。进化树分析表明,SrDREB2A 属于DREB亚家族的A-2亚组,与青蒿AaDREB2蛋白亲缘关系最近(图1B)。
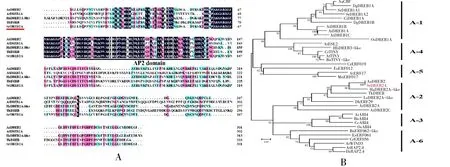
图1 SrDREB2A序列及进化分析Fig.1 Sequence and phylogenetic analysis of SrDREB2A
2.2 SrDREB2A表达模式分析
对甜叶菊根、节、节间和叶片组织定量分析发现,SrDREB2A在叶片和节中的含量较高(图2A),其中叶片中最高,约为节间和根中表达量的2 倍。甜叶菊叶片为其收获器官并且相对于其它组织对水分胁迫更为敏感,另外由于SrDREB2A在叶片中表达量更高,所以我们更关注其在叶片中的功能。自然失水胁迫试验表明,叶片中的SrDREB2A表达水平随着胁迫时间的延长而急剧升高(图2B),其中胁迫8 h 升高尤为显著,分别为胁迫0、1、4 h的184、158和18倍,表明叶片中SrDREB2A受水分胁迫显著诱导表达。
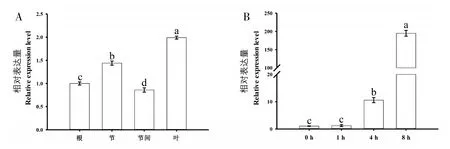
图2 SrDREB2A表达模式分析Fig.2 The expression pattern of SrDREB2A
2.3 SrDREB2A亚细胞定位
转录因子进核对于其行使功能至关重要。烟草亚细胞定位试验结果显示,空载体GFP分布于细胞核和细胞质,而SrDREB2A-GFP 的绿色荧光信号主要集中在细胞核中(图3),表明SrDREB2A 为细胞核定位蛋白,与其转录因子功能相吻合。

图3 SrDREB2A烟草表皮细胞中亚细胞定位分析Fig.3 Subcellular localization analysis of SrDREB2A in N.benthamiana epidermal cells
2.4 SrDREB2A转录激活活性分析
3 次重复试验均显示转化进pGBKT7 空载的酵母能在SD/-Trp 培养基上生长,但并不能在SD/-Trp/-His、SD/-Trp/-His/-Ade及SD/-Trp/-His/-Ade+x-α-gal培养基上生长。而转化进SrDREB2A 的酵母细胞均能够在4种培养基上生长,并且能在SD/-Trp/-His/-Ade+x-α-gal培养基上显色(图4),表明SrDREB2A 具有转录激活活性。

图4 SrDREB2A转录激活活性分析Fig.4 The transactivation activity of SrDREB2A
为了进行后续的酵母双杂交筛选试验,对抑制SrDREB2A 激活活性的3AT 浓度进行了筛选。3 次重复试验结果均发现较高浓度(100 mmol/L)3AT 并不能够抑制转化进SrDREB2A酵母细胞的生长(图5),表明SrDREB2A具有较强的转录激活活性。
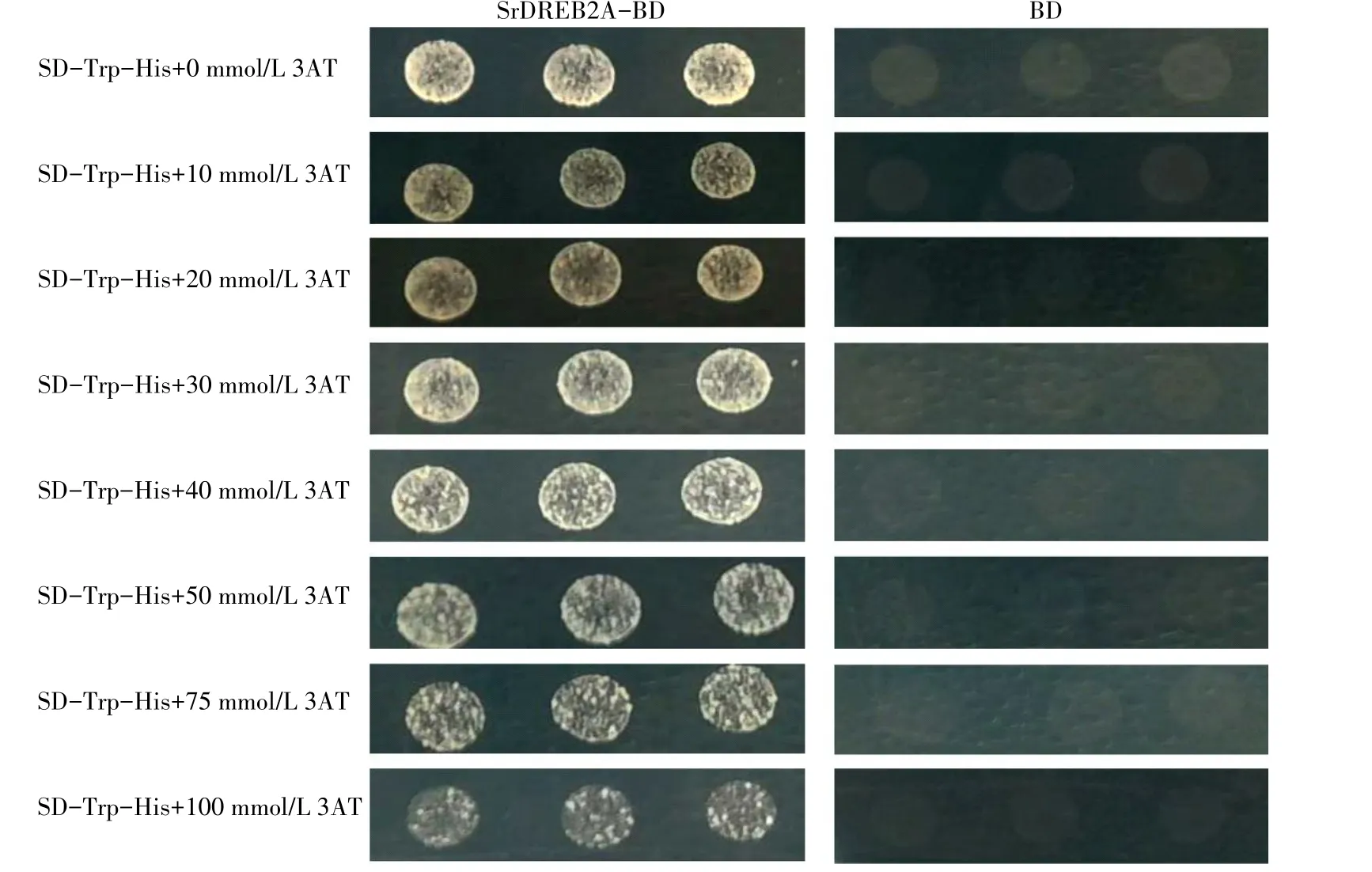
图5 3AT抑制SrDREB2A转录激活活性分析Fig.5 Analysis of 3AT inhibiting SrDREB2A transactivation activity
根据SrDREB2A 蛋白结构域所在位置对其进行分段并构建BD 载体。将不同载体转化入酵母细胞并对其β-gal 活性进行测定,结果表明SrDREB2A 的转录激活活性区段位于R(211~301 aa)段,并且缺失149~179 aa 区段并不影响SrDREB2A 的激活活性,而此区段据报道对拟南芥同源蛋白的活性具有抑制作用。此外,F(1~210 aa)段不具有转录激活活性(图6),因此可用于后续的酵母双杂交筛选,以便对其功能进行深入的研究。

图6 SrDREB2A全长及不同区段β-gal活性测定Fig.6 The β-gal activity of full length and different truncated version of SrDREB2A
3 讨论
目前关于甜叶菊耐旱方面的研究多集中于干旱条件下生理指标的变化及根据相关生理指标对甜叶菊不同品种耐旱性进行评价等方面。例如,任广喜等[14]通过终止灌溉5、10和15 d使甜叶菊植株处于不同干旱胁迫状态,然后测定5 份甜叶菊种质材料中的可溶性蛋白、相对电导率、丙二醛含量、超氧化物歧化酶、过氧化物酶活性及单株干叶产量等,从而对耐旱性强弱进行评价。SRIVASTAVA 等[15]通过对盆栽甜叶菊供给不同水平水分来研究在水分胁迫条件下甜叶菊的形态、生理指标变化及甜叶菊对水分胁迫的耐受性。研究发现水分胁迫下甜叶菊叶片电导率水平急剧增加,株高和叶面积都显著降低,抗氧化酶活性在轻度水分胁迫下有所提升而在重度干旱胁迫下降低。以上结果表明甜叶菊对水分胁迫十分敏感,因此在实际栽培过程中要保持合适的水分管理[16]。外源物质添加在缓解干旱胁迫方面已有较多报道,在甜叶菊中PRADHAN[17]发现一氧化氮和腐胺单独或联合施用可以降低干旱胁迫对甜叶菊试管苗的伤害。以上研究都较为浅显,而甜叶菊耐旱基因的挖掘及基于耐旱基因的分子育种方面的研究则尚未报道。
AP2/ERF 类转录因子参与了植物的生长发育和胁迫抗性等多个方面,本项目组前期克隆了该家族中与甜叶菊耐寒性相关的SrDREB1A1和SrDREB1A2及调控根发育的SrERF5基因[3,18]。本研究在此基础上进一步通过分子生物学手段同源克隆了甜叶菊中的SrDREB2A基因,水分胁迫可以强烈诱导该基因的表达,暗示其很可能正向调控甜叶菊的耐旱性。转录激活试验表明,SrDREB2A 的转录激活区段位于该蛋白C端,与拟南芥中AtDREB2A相类似,但去除在拟南芥中被证实具有抑制调节功能的149~179 aa区段[8],并没有使其转录激活活性提高,表明甜叶菊中SrDREB2A 可能存在一定的功能分化。在不参与逆境胁迫的情况下,过表达AtDREB2A 并不能诱导下游基因的表达,因此推测在非逆境胁迫情况下AtDREB2A 处于一种非激活状态,而逆境胁迫通过翻译后修饰从而使AtDREB2A 得以激活下游基因的表达。其中磷酸化被认为是一种很可能存在的修饰模式[19-20],此外AtDREB2A还存在泛素化修饰状态,相关的互作蛋白DRIP1、DRIP2、BPM等相继被克隆[21-22]。酵母双杂交手段被认为是寻找目的蛋白的互作蛋白,从而进一步阐释其功能的一种重要手段,而前期明确目的蛋白的转录激活活性是进行此项试验的基础保证。利用序列全长进行酵母筛库工作很可能会比用截断的蛋白得到更多信息,但试验发现即使较高浓度的3AT也不能够抑制SrDREB2A 的转录激活活性,因此利用全长进行筛库并不可行。因此,对SrDREB2A 序列进行截断分析,发现1~210 aa区段不具有激活活性,为后续通过酵母双杂交筛库探究SrDREB2A蛋白调控功能奠定了基础。
4 结论
(1)SrDREB2A属于DREB亚家族A-2 亚组,具有一个典型的AP2 结构域。该基因在叶片中表达量较高并且受水分胁迫显著诱导,表明SrDREB2A作为提高甜叶菊耐旱性的基因资源并可用于甜叶菊的耐旱育种工作。
(2)SrDREB2A 定位于细胞核并且具有较强的转录激活活性,其F(1~210 aa)区段可用于后续的酵母双杂交筛库研究。
