施加有机肥对农田有机质和氮素演化影响的光谱学分析
2022-10-09潘红卫童文彬雷宏军史利利
潘红卫, 童文彬, 雷宏军, 杨 光, 史利利
华北水利水电大学水利学院,河南 郑州 450046
引 言
水溶性有机物(dissolved organic matter, DOM)是指能溶于水、酸或碱溶液并能通过0.45μm滤膜的有机质总称,它的组成结构较为复杂,一般由有机酸、糖类等小分子和大量未知高分子化合物组成。DOM在土壤有机质中占比很小,但它却是土壤有机碳库中最为活跃的组分之一,在土壤氮碳循环、污染物的迁移、营养元素转化等过程中起着重要的作用[1]。土壤DOM的来源主要有两种途径:一是由土壤自身腐殖质腐解以及微生物活动代谢产生,二是由外界进入土壤,例如施加有机肥、动植物残体分解、排放污染物等[2]。因此,施加有机肥是改善土壤DOM组分结构的重要手段。已有研究表明,有机肥中含有大量易分解的有机质和植物生长所需的丰富的营养物质[3],施入土壤后有机肥中的DOM会被土壤吸附,同时有机肥中的大分子有机质会在土壤中分解产生大量的DOM,有效改善土壤DOM组分结构[4]。
目前对于土壤DOM组分结构已开展大量的研究,常用的三维荧光光谱技术(3D-EEM)技术利用了DOM分子特有的荧光属性可以有效分析出DOM分子中有价值的信息,结合PARAFAC分析后能够准确识别DOM的组成结构以及DOM各组成成分的相对含量[5]。还有学者提出了将PARAFAC解析的不同组分的激发载荷结合二维相关光谱(two-dimensional correlation spectroscopy,2D-COS)技术来识别DOM不同组分在时间或空间上的微小变化[6]。
利用三维荧光激发-发射矩阵光谱(3D-EEM)对施入有机肥后土壤DOM光谱学特性的影响进行了探讨,并结合PARAFAC分析法对土壤DOM各组分进行定量分析,还利用了2D-COS技术来探究施入有机肥后土壤DOM各组分随时间的变化顺序。此外,DOM在土壤氮碳生物地球化学循环中作为参与者或媒介者起着重要的作用,施加有机肥后土壤DOM组成结构改变可能会对土壤氮素产生影响。本文主要研究了施加有机肥对土壤铵态氮、硝态氮含量的影响,并采用典型关联度分析了DOM组分变化与硝态氮、铵态氮间的响应关系,以期为合理施用有机肥提升土壤肥力、降低面源污染提供理论依据。
1 实验部分
1.1 试验地点及材料
试验地点在华北水利水电大学农业高效节水试验场微灌试验区(北纬34°48′、东经113°50′、海拔111.1 m)。试验区土壤质地为粉砂壤土,平均容重为1.36 g·cm-3,田间持水量为19%,0~20 cm土层土壤有机质、全氮、碱解氮、速效磷、速效钾平均含量分别为0.69%,0.032 9%,4.2×,9.7×,98×。试验区种植作物为小麦,试验所用有机肥采用当地新鲜鸡粪经高温腐熟制成。
1.2 样品采集
土地平整后设置两个小区,每个小区面积为3 m×9 m,每个小区之间设置30 cm宽的排水沟以去除边缘效应,试验设置对照组(CK)、单施有机肥(CP)两个处理,有机肥按45 t·hm-2基施。施入有机肥后小区按常规田间管理方式进行灌水。用柱状取土器取土,采样时间分别为施入有机肥后7,15,30和45 d,每个小区按“S”型取样法选取5个采样点,每个采样点取0~20 cm深度的土壤,每次取土后将同一处理的5个采样点等质量混合均匀后迅速带回实验室测定。
1.3 方法
1.3.1 土壤DOM提取
将待测土壤自然风干并去除可见的动植物残体后研磨过100目筛,称取风干过筛后的土样5 g放入三角瓶中,并加入50 mL等离子水,在180 r·min-1转速恒温(20 ℃)振荡后12 h后在4 ℃下4 000 r·min-1离心5 min,取上清液过0.45 μm玻璃纤维滤膜,所得滤液即为土壤DOM提取液[7]。
1.3.2 土壤DOC含量测定
土壤可溶性有机碳(DOC)含量采用比色法[8]测定,在10 mL试管中加入待测DOM提取液2.5 mL,用超纯水补充至5 mL后加入2.5 mL 10 mmol·L-1的Mn(Ⅲ)-焦磷酸和2.5 mL浓H2SO4,摇匀后常温静置1 h,于490 nm处比色测定。标准曲线制作采用100 mg·L-1的草酸溶液。
1.3.3 土壤DOM溶液的三维荧光光谱测定
将土壤DOM待测液在HITAICHI F-4600荧光分光光度计上进行三维荧光光谱扫描,设置参数为:激发波长(Ex)扫描范围是250~450 nm,发射波长(Em)扫描范围是280~550 nm,激发和发射狭缝宽为5 nm,扫描间隔均为5 nm,扫描速度为12 000 nm·min-1, PMT电压为400 V,响应时间为0.004 s。
1.3.4 土壤硝态氮、铵态氮含量测定
取5 g过2 mm筛的新鲜土样放入三角瓶中,并加入50 mL 2 mol·L-1的KCl溶液在180 r·min-1浸提1 h后过滤。硝态氮采用紫外分光光度计法[9]测定,铵态氮采用靛酚蓝比色法[10]测定。
1.3.5 土壤总有机碳(TOC)测定
将土壤风干研磨后过100 目筛,然后采用重铬酸钾外加热法[11]测定。
1.4 数据分析
数据简单整理采用Excel 2019;SPSS 26.0进行典型相关度分析。采用中国地质大学(北京)水资源与环境学院何伟副教授课题组与北京大学城市与环境学院徐福留教授课题组合作开发的处理三维荧光光谱数据的efc软件平台[12-13]对所测得的三维荧光光谱数据进行消除瑞利散射和拉曼散射预处理、三维荧光光谱图绘制、寻找荧光峰、三维荧光参数计算以及PARAFAC分析。采用Origin 2019b中的2D Correlation Spectroscopy Analysis插件对DOM各组分的激发波长做同步-异步二维相关光谱,得出不同组分随时间的变动顺序。
2 结果与讨论
2.1 有机肥对土壤化学性质的影响
不同处理土壤的总有机碳(TOC)和可溶性有机碳(DOC)含量的变化特征见表1。整个试验期间,CK处理和CP处理土壤TOC含量呈一直下降的趋势,CK处理土壤TOC含量从27.34 g·kg-1下降至25.39 g·kg-1,CP处理土壤TOC含量从31.31 g·kg-1下降至28.33 g·kg-1,CK处理和CP处理土壤TOC含量一直下降可能是由于土壤有机碳的迁移、流失、分解矿化以及作物吸收而损失,而CP处理的TOC含量始终高于CK处理,说明施加有机肥能够提高土壤有机碳的含量。整个试验期间,CK处理土壤可溶性有机碳(DOC)含量呈一直下降的趋势,从46.56 mg·kg-1下降至29.21 mg·kg-1,而CP处理从施入有机肥后的第7 d到第45 d呈现先上升后下降的趋势,施入有机肥第30 d,有机肥中大部分有机质被分解,土壤DOM含量达最大值72.72 mg·kg-1,30 d后土壤DOC含量开始下降,且CP土壤DOC含量始终高于CK,说明施加有机肥能提高土壤的DOC含量。
不同处理下土壤硝态氮和铵态氮含量的变化特征见表1。整个试验期间,CK处理土壤硝态氮含量呈一直下降的趋势,从24.10 mg·kg-1下降至15.31 mg·kg-1,而CP处理从施入有机肥后的第7 d到第45 d呈现先上升后下降的趋势,施入有机肥第30 d,土壤硝态氮含量达最大值34.71 mg·kg-1,30 d后土壤硝态氮含量开始下降,且CP处理土壤硝态氮含量始终高于CK处理,说明施加有机肥能提高土壤的硝态氮含量。CK处理土壤铵态氮含量呈先下降后上升的趋势,在第15 d达到最小值3.01 mg·kg-1,而CP处理从施入有机肥后的第7 d到第45 d呈现先下降后上升的趋势,施入有机肥第30 d,土壤铵态氮含量达最小值1.71 mg·kg-1,30 d后土壤铵态氮含量开始上升,且CP处理土壤铵态氮含量始终低于CK处理,说明施加有机肥能降低土壤的铵态氮含量。
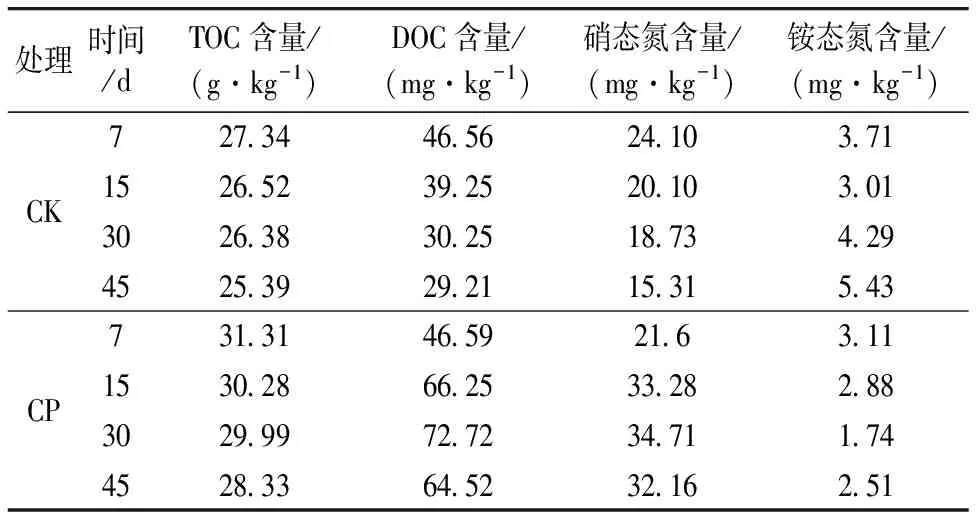
表1 不同处理下土壤的化学性质的变化特征
2.2 有机肥对土壤DOM的影响
2.2.1 施加有机肥后土壤DOM三维荧光光谱图变化特征
不同时期不同处理土壤DOM三维荧光光谱图如图1所示。用efc软件对荧光光谱数据进行平滑处理以去除杂峰,寻找在Ex和Em两个波长下都是峰值的位置以及荧光峰强度。寻峰结果显示,不同时期不同处理土壤DOM的各荧光光谱形状及荧光峰的位置基本相似,有3个较为明显的荧光峰。根据文献[14],Peak T(Ex 250~300 nm,Em 330~380 nm)为类色氨酸物质,主要来源于土壤微生物活动,Peak A(Ex 250~300 nm,Em 330~380 nm)为UV类腐殖酸,主要来源于植物源有机质;Peak M(Ex 300~370 nm,Em 420~480 nm)为高激发波长(UVA)类腐殖酸,主要为微生物源有机质,主要来源于微生物的腐殖化作用,相对分子结构较UV类腐殖酸更为复杂。CK处理Peak T的荧光峰强度在试验第7 d内要低于Peak M和Peak A的荧光峰强度,随着时间的推移,Peak T的荧光峰强度逐渐高于Peak M和Peak A的荧光峰强度,可能是由于CK处理无外源有机质的补充,类腐殖酸被微生物利用分解产生了类色氨酸物质,并且由图可以看出Peak M和Peak A出现了明显的蓝移,土壤UV和UVA类腐殖酸物质出现了明显的降低。CP处理Peak T,Peak A和Peak M的荧光峰强度出现了先上升后下降的趋势,在第30 d达到最大值,可能是由于有机肥施入土壤后分解促进了UV和UVA类腐殖酸物质生成,而随着有机肥在土壤被大量分解,土壤中UV和UVA类腐殖酸含量在第30 d达最大值。由图1还可知,在试验期间,CP处理Peak M,A和T的荧光峰强度始终高于CK处理的,说明施加有机肥能够提高土壤类色氨酸、UV类腐殖酸和UVA类腐殖酸含量。
2.2.2 有机肥对土壤DOM三维荧光光谱指数影响
BIX可以表示土壤DOM自生源的特征,也可体现DOM的生物可利用性,一般用Ex在310 nm下,Em在380和430 nm处荧光强度的比值表示[15]。BIX指数为0.6~0.7表示DOM中自生成分较少,生物可利用性低;BIX在0.7~0.8,DOM具有中度新近自生源特征,生物可利用性一般;BIX在0.8~1.0,DOM具有新生自生源较多,生物可利用性较好;而BIX>1.0则表示DOM具有强烈的自生源特征,微生物对DOM组分影响显著且生物利用性很高。由图2可知,施入有机肥后30 d内,CP处理和CK处理土壤DOM的BIX>1,说明该试验区土壤DOM的生物可利用性都很高,具有强烈的自生源特征,对微生物活动具有促进作用。分析图1还能发现施入有机肥后土壤DOM的BIX值先上升后下降,而不施加有机肥的土壤的BIX始终呈下降的趋势。施入有机肥第7 d,CP土壤DOM的BIX值小于CK,这可能是因为CP处理使用的有机肥经过堆肥腐熟,被土壤吸附以及自身分解所形成的DOM组分较为稳定,有机肥分解较慢,自生成分较CK的少,生物可利用性低于CK;施入有机肥第15 d,随着有机肥的分解,可利用的碳源增加,微生物活性增加,自生成分增多,DOM受微生物活动影响显著,BIX值增幅较大;随着时间的推移,有机肥有效成分逐渐被分解和利用,导致BIX值增长减缓,施入有机肥30 d后,BIX呈下降的趋势,且施入有机肥第15 d到45 d,CP的DOM的BIX值始终高于CK,这说明施用有机肥可以提高土壤DOM的生物可利用性。
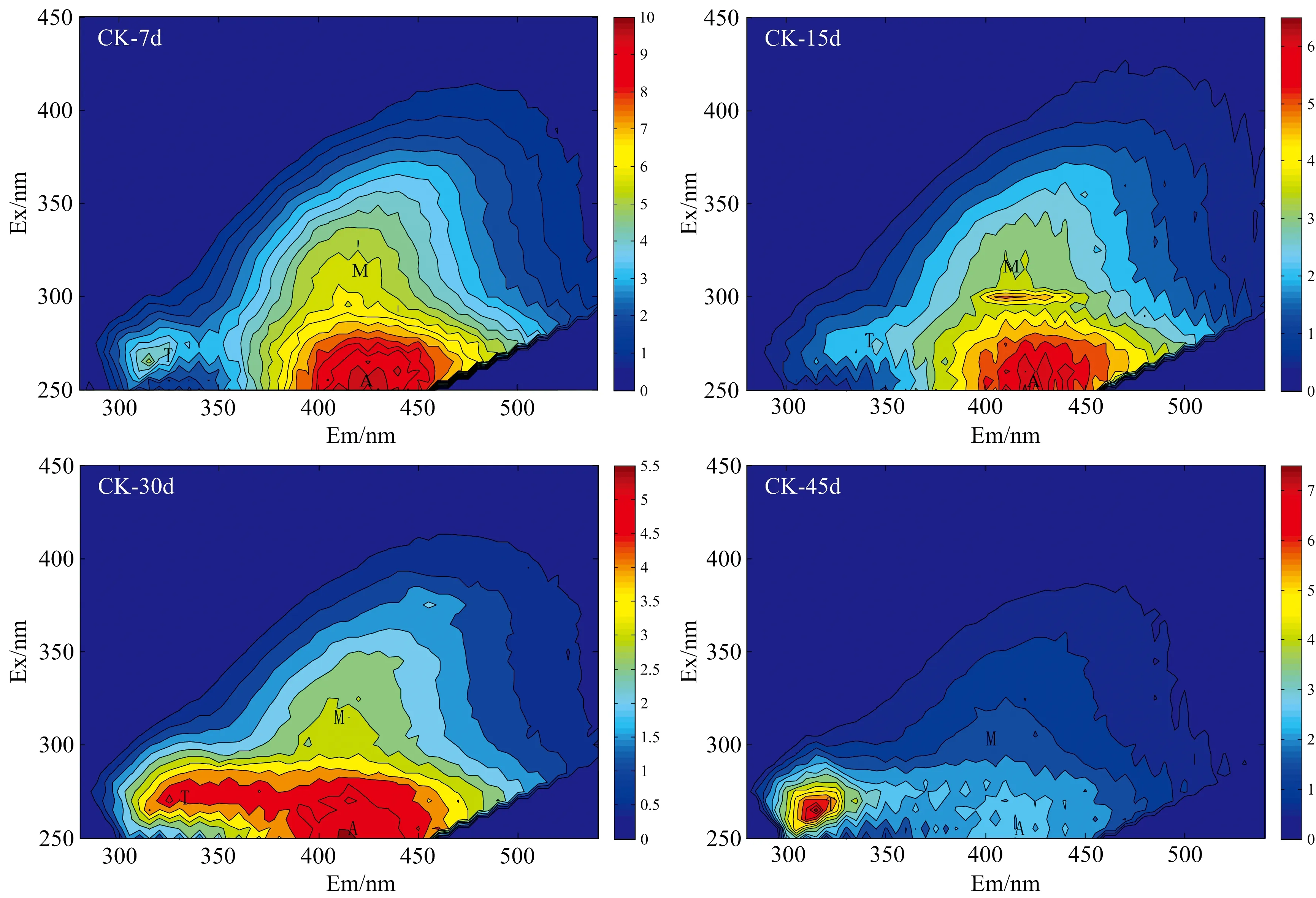
图1 土壤DOM三维荧光光谱图
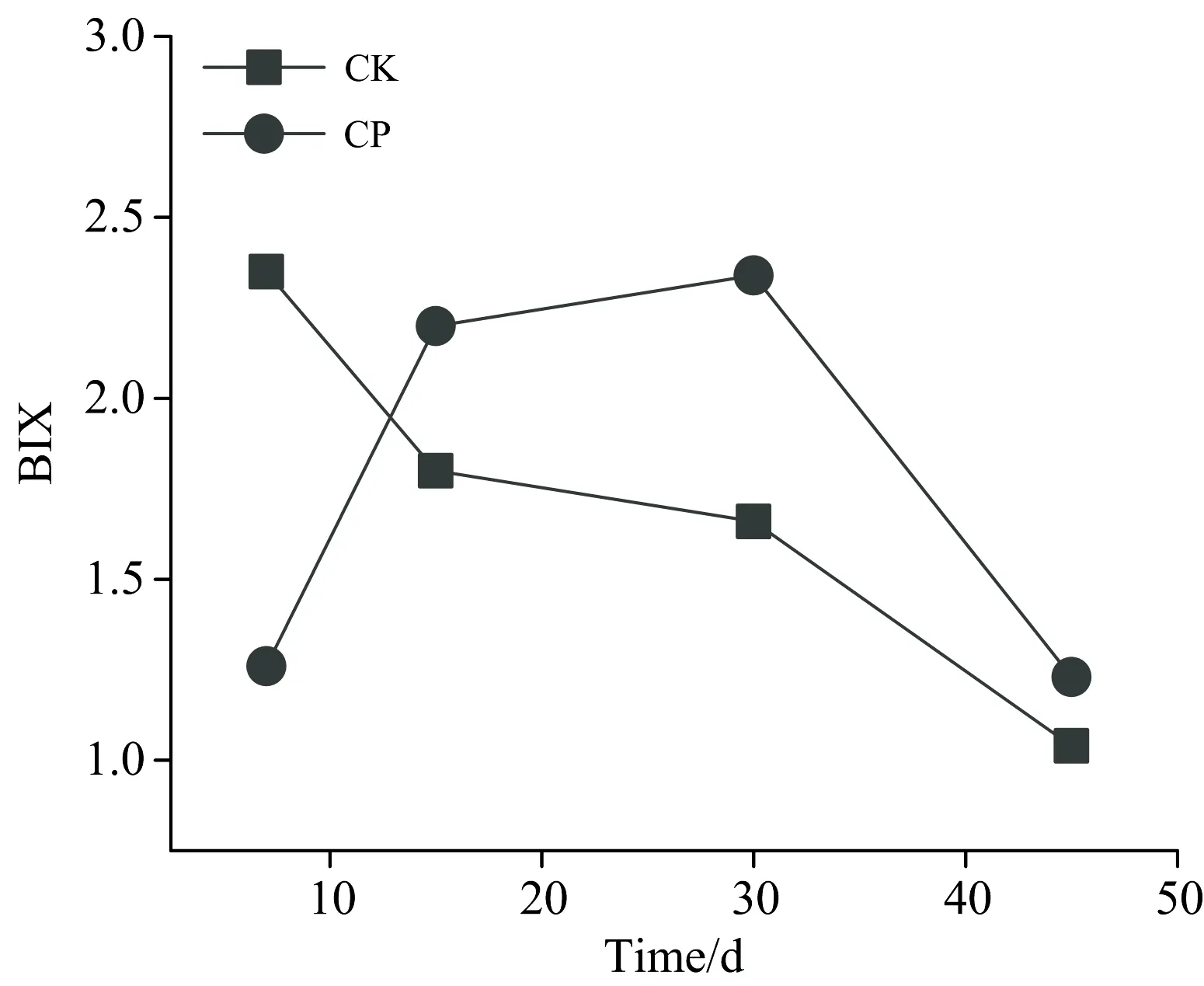
图2 土壤DOM的BIX的变化规律
HIX反映的是土壤DOM的腐殖化程度,HIX越高则代表土壤DOM的腐殖化程度越高,土壤DOM的稳定性越高,一般用Ex在254 nm,Em在435~480 nm的荧光强度积分面积与330~345和435~480 nm的荧光强度积分面积之和的比值表示[15]。由图3可知,不施加有机肥土壤DOM的腐殖化程度是逐渐升高的,土壤DOM在种植过程中逐渐趋于稳定;而施加有机肥后,土壤DOM腐殖化程度呈现先下降后上升的趋势,与施加有机肥后生物可利用性变化趋势恰好相反。这可能是因为施加有机肥后,土壤DOM自生源成分增加会促进土壤中大分子有机质分解为微生物可利用的小分子有机质,导致土壤DOM的腐殖化程度降低。对HIX和BIX进行相关性分析,如图4所示,结果表明HIX和BIX呈负相关(R2=0.732),这也很好地证实了这一结论。
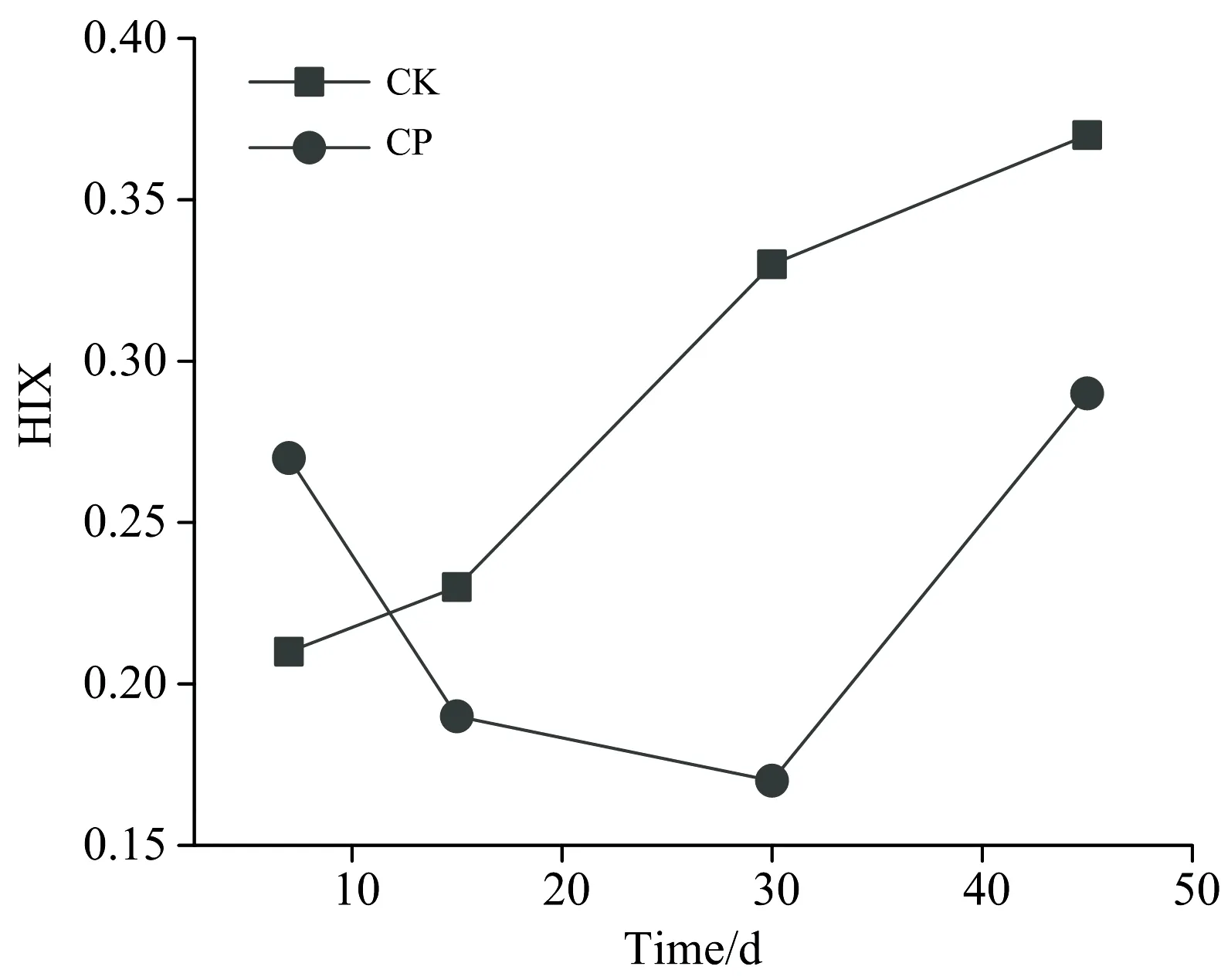
图3 土壤DOM的HIX的变化规律
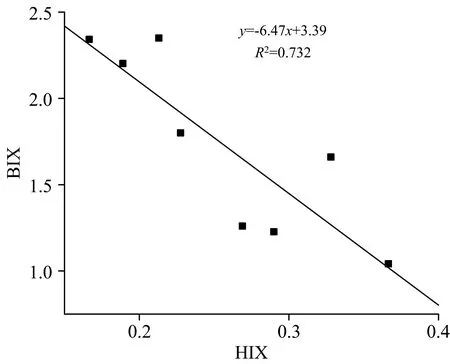
图4 土壤DOM的BIX与HIX的相关性分析
2.2.3 PARAFAC分析有机肥对土壤DOM荧光组分的影响
为了更好地反映施加有机肥后土壤DOM荧光组分的变化,对不同时期不同处理土壤DOM三维荧光光谱图进行PARAFAC分析,通过误差平方和比较、对半检验比较以及核一致性比较确定DOM的组分数。PARAFAC分析结果得出土壤DOM中共有3个组分(C1—C3,如图5所示)。C1出现两个峰(主峰Ex/Em 255/410,次峰Ex/Em 320/410),鉴定为陆地源类腐殖酸,植物源特征显著[16];C2也出现两个峰(主峰Ex/Em 260/455,次峰Ex/Em 355/455),鉴定为典型类腐殖酸,微生物源特征显著[17];C3(Ex/Em 270/455),鉴定为类色氨酸,主要成分是类蛋白质,主要来源于微生物活动代谢产物[4]。C1和C2对应DOM三维荧光光谱图中的A和M峰,均为类腐殖酸,但C2的荧光峰Ex的波长要高于C1,说明C2较C1的分子结构更为复杂,C3对应DOM三维荧光光谱图中的T峰。以荧光强度表征土壤DOM各组分的相对含量,结果见表2。CK处理C1和C2含量在整个试验期间是呈下降的趋势,而C3则呈现先下降后上升的趋势,在第30 d达到最小值。而CP处理C1,C2和C3含量均呈现先上升后下降的趋势,且都在第30 d达到最大值。比较CK和CP处理的荧光组分含量发现,CP处理C1,C2和C3组分的含量均高于CK处理。由此可见施加有机肥能够提高土壤类腐殖酸和类色氨酸含量。
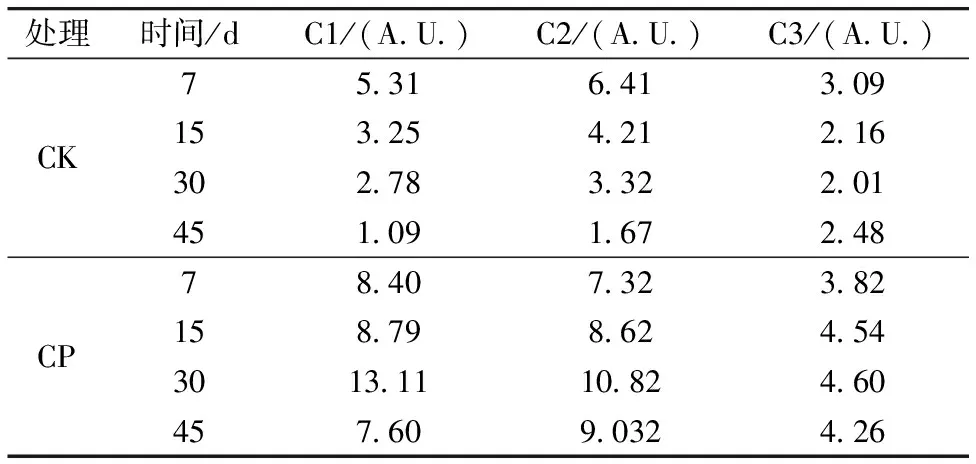
表2 不同处理下土壤的DOM荧光组分的变化特征

图5 DOM中(C1, C2, C3)3个PARAFAC模型荧光组分图
2.2.4 2D-COS分析施加有机肥后土壤DOM组分变化顺序
为了进一步探究施加有机肥后C1,C2和C3组分的变动顺序,对PARAFAC分析的施加有机肥后土壤DOM各组分的激发波长做同步二维相关光谱图和异步二维相关光谱图,见图6。DOM各荧光组分二维相关光谱分析结果见表3。由表3可知,在同步二维相关光谱中C1和C2呈正相关,在异步二维相关光谱中C1与C2呈负相关。因此,土壤施加有机肥后随着时间的推移土壤DOM各组分的变化顺序为:C1(C2)↑→C3,表明类腐殖酸变动幅度较大,施加有机肥对类腐殖酸的促进作用更为显著。
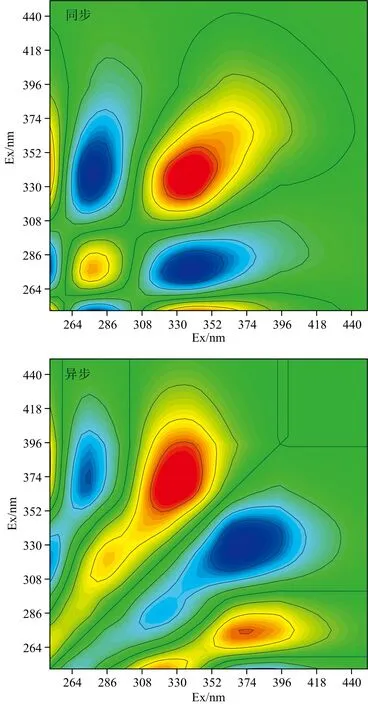
图6 DOM的各荧光组分的同步-异步二维相关光谱
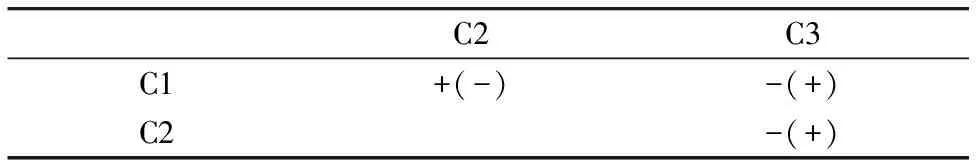
表3 DOM各荧光组分二维相关光谱分析结果
2.3 水溶性有机物和氮素变化响应关系
为探究水溶性有机物与氮素的响应关系,对DOM的各荧光组分的相对含量与硝态氮、铵态氮含量进行典型关联度分析。
2.3.1 典型相关系数
DOM荧光组分相对含量与硝态氮、铵态氮含量间的典型相关系数见表4。由表4可以看出,DOM荧光组分相对含量与硝态氮、铵态氮含量之间的第1组的典型相关系数就达到了0.971,所解释的信息达到了95.31%,表明DOM荧光组分相对含量与硝态氮、铵态氮含量之间有较强的正相关关系。

表4 DOM荧光组分相对含量与硝态氮、铵态氮含量间的典型相关系数
2.3.2 典型变量构成
DOM荧光组分相对含量与硝态氮、铵态氮含量之间的1对典型变量设置为
U=0.201×C1相对含量+0.221×C2相对含量+0.03×C3相对含量
V=0.523×硝态氮含量-0.519×铵态氮含量
U中C1和C2相对含量的系数较大、C3的系数较小,V中硝态氮和铵态氮含量均较大。由此可见,土壤C1,C2和C3含量增加能提高硝态氮含量、降低土壤铵态氮含量,尤其是C1和C2组分对铵态氮和硝态氮含量的影响较大。而本试验中,施加有机肥后C1和C2组分相对含量较CK有了显著的提升,因此,可以通过施加有机肥来提高土壤硝态氮含量、降低土壤铵态氮含量。
3 结 论
(1)相较未施加有机肥处理,施加有机肥提高了土壤总有机碳、水溶性有机碳和硝态氮含量,降低了铵态氮含量。施加有机肥后土壤总有机碳、水溶性有机碳含量呈先上升后下降的趋势,在第30 d达到最大值。
(2)分析三维荧光光谱图得出试验土壤DOM主要由UVA类腐殖酸、UV类腐殖酸和类色氨酸组成。施加有机肥后随着时间的推移,类色氨酸物质荧光峰强度无明显变化,UV类腐殖酸和UVA类腐殖酸荧光峰强度呈先上升后下降的趋势,在第30 d达到最大值。整个试验期间,施加有机肥处理类色氨酸、UV类腐殖酸和UVA类腐殖酸荧光峰强度始终高于未施加有机肥处理。PARAFAC分析结果显示,土壤DOM可分为3个荧光组分,C1为陆地源类腐殖酸,植物源特征显著,C2为典型类腐殖酸,微生物源特征显著,C3为类色氨酸,主要来源于微生物代谢产物,C2结构比C1要复杂。施加有机肥后C1,C2和C3的相对含量始终高于未施加有机肥处理,且施加有机肥后C1,C2和C3的相对含量均呈现先上升后下降的趋势,在第30 d达到最大值。2D-COS结果显示,不同荧光组分的变动顺序为:C1(C2)↑→C3,类腐殖酸变动幅度较大,施加有机肥对典型类腐殖酸和陆地源类腐殖酸的促进作用更为显著。
(3)施加有机肥能提高土壤的生物可利用性,降低土壤腐殖化程度。试验期间,施加有机肥后BIX值呈先上升后下降的趋势,在第30 d达到最大值;HIX值呈先下降后下上升的趋势,在第30 d达到最小值。BIX和HIX呈显著负相关(R2=0.732)。
(4)C1,C2和C3相对含量与硝态氮呈正相关,与铵态氮呈负相关,且C1和C2组分的相对含量对硝态氮和铵态氮含量的影响较大。
