埃及伊蚊肽聚糖识别蛋白PGRP-S2的克隆及原核表达*
2022-10-09蔡瑜婷杨小祯陈春梅王焌翔余思宸黄恩炯张灵玲
蔡瑜婷 杨小祯 陈春梅 王焌翔 余思宸 黄恩炯 张灵玲, 关 雄**
(1.福建农林大学生物农药与化学生物学教育部重点实验室,福州 350002;2.福建农林大学生命科学学院,福州 350002;3.福建医科大学公共卫生学院,福州 350122,4. 福州国际旅行卫生保健中心,福州 350001)
埃及伊蚊Aedesaegypti属双翅目昆虫,主要在白天与傍晚活动,栖息于避风幽暗处,如水缸底、床底、墙角等(谢晖等, 2011)。该蚊在叮咬骚扰人类的同时也传播登革热、寨卡病毒病、基孔肯雅热、黄热病等重要传染病(丁鲁民, 1999)。目前利用生防微生物对埃及伊蚊进行消杀是阻断蚊媒传染病进一步传播的重要途径之一。而埃及伊蚊自身的免疫能力在其抵御病原入侵方面发挥了一定作用。
昆虫免疫为非专一性的天然免疫,由细胞免疫和体液免疫组成。体液免疫主要包括凝结反应、黑化反应、Toll途径(由真菌和大部分革兰氏阳性菌激活)和Imd途径(由革兰氏阴性菌激活),诱导产生抗菌肽并将其释放到血淋巴中,同时包括溶菌酶作用及酚氧化酶原(PPO)级联反应等(宁媛媛等, 2009)。当受到外来病原侵染时,昆虫天然免疫会识别外来异物,随后引发、激活细胞外级联反应,启动Toll或Imd信号转导途径而诱导不同抗菌肽的产生。通过模式生物黑腹果蝇(Hoffman, 2003)的免疫研究,发现其对异己物的识别主要是由不同模式识别受体(PRPs)来实现的。其中肽聚糖识别蛋白(peptidoglycan recognition proteins,PGRPs)是昆虫免疫中重要的识别受体,能识别出细菌细胞壁中的肽聚糖(peptidoglycan,PGN),从而激活体液免疫中的 Toll 途径和 Imd 途径,诱导抗菌肽产生。PGRPs具有一个能与PGN结合的保守结构域,大约由165个氨基酸组成,称为PGRP结构域,该结构域与T7的溶菌酶高度同源。T7溶菌酶具有酰胺酶活性,能够裂解 PGN,因此,PGRPs根据其是否具有酰胺酶活性被划分为两类。另外,根据PGRPs的分子量大小可分为PGRP-L和PGRP-S两种类型。PGRP-L为长型(分子量>90 kDa),是跨膜蛋白、胞内蛋白或胞外蛋白,基因较复杂;PGRP-S为短型(分子量约20 ~ 25 kDa),是小分子的分泌型蛋白,基因较简单(Werneretal., 2000;吕成伟等, 2002)。
目前已对5种重要入侵昆虫(红棕象甲Rhynchophorusferrugineus、烟粉虱Bemisiatabac、意大利蜜蜂Apismelliferalingustica、日本龟蜡蚧Ceroplastesjaponicus和舞毒蛾Lymantriadispar)的免疫机制展开研究(曾令瑜等,2019)。有关红棕象甲免疫机制的研究主要定位于RfRelish编码基因和RfPGRP-LB蛋白(肖蓉等,2021);以黑腹果蝇(Basbousetal.,2011)为研究对象,发现其PGRP具有激活Toll和Imd信号途径、诱导抗菌肽产生和促进吞噬作用的功能;以烟草天蛾为研究对象,发现其PGRP具有激活酚氧化酶原产生黑化反应的功能(徐亚玲等,2010)。此外,在黑腹果蝇等其他昆虫中也有PGRP对其免疫应答功能的相关报道,但是对埃及伊蚊中不同种类PGRP功能的了解还相对较少(杨青泰,2018;姜欣伶,2020)。因此,本实验以埃及伊蚊为研究对象,通过克隆与测序分析其肽聚糖识别蛋白基因,了解其序列特征,并通过表达、纯化,为进一步开展埃及伊蚊的免疫机制研究提供基础。
1 材料与方法
1.1 埃及伊蚊
埃及伊蚊由军事医学研究院微生物流行病研究所惠赠,海口品系(Ae.aegypti,Haikou strain)在本实验室稳定传代40代以上。
1.2 菌株、质粒
大肠杆菌(Escherichiacoli)JM109菌株、BL21表达菌株和pCold-GST载体均购自TaKaRa公司。
1.3 主要试剂和仪器
质粒小提试剂盒、IN-Fusion HD Cloning Kit、预染分子质量蛋白标准、Protein Marker、一抗GST-tag monochonal antibiody和二抗AP标记山羊抗小鼠IgG(H+L)均购于日本Takara公司,BCIP/NBT碱性磷酸酯酶显色试剂盒购于碧云天公司,LB(Tyrptone、Yeast Extract、NaCl、琼脂条),IPTG,PBS,GST洗脱缓冲液(50 mmol/L Tris-HCl,谷胱甘肽,5 mmol/L NaOH),LSB,30%丙烯酰胺,1.5 mol/L Tris-HCl,1.0 mol/L Tris-HCl,TEMED,考马斯亮蓝R250,脱色液(乙酸,甲醇),BSA,Bradford溶液,PVDF膜,转膜buffer(Gly、Tris,SDS,甲醇),封闭液(脱脂奶粉,PBS),PBST(PBS,吐温20)。超微量分光光度计Q5000(Quawell,美国),Glutathione Sepharose 4B填料(GE,美国),层析柱(碧云天,中国)。
1.4 RNA提取和cDNA合成
收集5只埃及伊蚊成虫,按TRIzolTMReagent RNA提取试剂盒提取埃及伊蚊RNA。利用超微量分光光度计Q5000和凝胶电泳检测RNA。以提取的RNA作为模版,参照ImProm-IITMReverse Transcription System试剂盒合成cDNA,放至-20 ℃保存。
1.5 埃及伊蚊PGRP-S2基因的克隆与测序
根据埃及伊蚊PGRP-S2(AAEL007039)的CDS序列设计特异性引物(PGRP-S2-F: G G T A C C C T C G A G G G A T C C A T G C A G T G C C C A C G T A T C G T C AC,PGRP-S2-R: C TG C A G G T C G A C A A G C T T T T A A G G A T T T G G G T T G A A AC)。以提取的埃及伊蚊cDNA为模板,扩增PGRP-S2全长基因,PCR反应程序设置为:98 ℃ 30 s,35个循环(98 ℃ 5 s,55 ℃ 15 s,72 ℃ 20 s/kb),72 ℃ 2 min,4 ℃终止。PCR产物经凝胶电泳检验后,回收纯化,并委托铂尚生物技术(上海)有限公司进行测序。
1.6 埃及伊蚊PGRP-S2蛋白生物信息学分析
利用ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)分析埃及伊蚊PGRP-S2的阅读框。利用 CDD(https: / /www. ncbi. nlm. nih. gov/Structure/cdd/docs/cdd_search. html)预测埃及伊蚊PGRP-S2 的保守结构域。并选用部分昆虫,包括白纹伊蚊Aedesalbopictus、冈比亚按蚊Anophelesgambiae、阿拉伯按蚊Anophelesarabiensis、淡色库蚊Culexpipienspallens、致倦库蚊Culexquinquefasciatus、地中海实蝇Ceratitiscapitata、意大利蜂Apismellifera、家蚕Bombyxmori、果蝇Drosophilamelanogaster、家蝇Muscadomestica、斜纹夜蛾Spodopteralitura、小菜蛾Plutellaxylostella、蚱蚕Anthereapernyi、桔小实蝇Bactroceradorsalis、棉铃虫Helicoverpaarmigera、粘虫Mythimnaseparata等,根据供试昆虫的PGRP基因序列信息(Yoshidaetal.,1996;Yang,2015;任美佳,2019;郝志霞,2020;杜少萱等,2020),利用 MEGA7.0进行序列比对分析并构建埃及伊蚊PGRP-S2和其他昆虫 PGRPs 的系统发育树(贝叶斯法,1 000次重复)。
1.7 表达载体pCold-GST-PGRP-S2的构建
根据IN-Fusion HD Cloning Kit说明书,将埃及伊蚊PGRP-S2的回收产物与BamH Ⅰ和Hind Ⅲ双酶切的线性化pColdTMGST载体进行无缝克隆连接,并转化至大肠杆菌JM109,筛选具有氨苄青霉素抗性的单克隆菌落,阳性克隆子用PCR以及BamH Ⅰ和Hind Ⅲ单双酶切验证,并送至铂尚生物技术(上海)有限公司进行测序。测序验证正确后,将质粒热击转化进BL21表达感受态细胞。
1.8 诱导表达
将单克隆菌株接种至含100 μg/mL Amp的5 mL LB试管中,37 ℃、200 r/min过夜活化。吸取1 mL菌液转接于含100 μg/mL Amp的100 mL LB培养液中,37 ℃、200 r/min培养至菌体OD600为0.6~0.8,在冰上放置30 min后,加入终浓度为0.8 mmol/L的IPTG(异丙基-β-D-硫代半乳糖苷),15 ℃,200 r/min低温诱导24 h。诱导结束离心收集菌体,用20 mL GST结合缓冲液(10 mmol/L PBS,pH7.5)重悬沉淀后再次离心,洗去菌体中的培养基。放置在冰上进行超声波破碎,破碎后离心,用0.22 μmol/L滤膜将上清液过滤到新的离心管,即为可溶蛋白。
1.9 可溶蛋白PGRP-S2纯化
取1 mL Glutathione Sepharose 4B填料加入亲和层析柱。对目的可溶蛋白进行相应亲和层析纯化。利用2 mL GST洗脱缓冲液(50 mmol/L Tris HCI, 300 mmol/L KCl,1 mmol/L DTT, 10 mmol/L Glutathione, pH7.5)洗脱蛋白,4 ℃静置30 min,收集流出液。
1.10 重组蛋白的Western Blot检测
取纯化蛋白进行SDS-PAGE电泳,在恒压100 V、200 mA的条件下进行凝胶转膜,大约1.5 h;结束后用含5%脱脂奶粉的封闭液,37 ℃ 下将膜封闭2 h,用含吐温-20的磷酸缓冲液(PBST)洗膜3次;将膜放于封闭液稀释过的一抗(GST-tag monochonal antibody)中,室温摇床孵育2 h,PBST洗涤3次,再放于封闭液稀释过的二抗(AP标记山羊抗小鼠lgG)中,室温摇床孵育2 h,PBST洗涤4次;将膜转移到暗盒中,加入AP显色液,进行显色反应,直至膜上出现清晰的条带。
2 结果
2.1 埃及伊蚊PGRP-S2基因克隆及序列分析
设计埃及伊蚊PGRP-S2特异性引物,通过RT-PCR扩增,获得一条500 bp的条带,与预期大小一致(图1-A)。将PCR产物回收并与连接线性化pColdTMGST载体连接后成功转化于E.coliBL21表达菌株,用BamHⅠ单酶切获得1条5 500 bp的条带,用BamHⅠ和HindⅢ双酶切则分别获得1条5 000 bp的载体大小以及500 bp大小的目的基因条带(图1-B)。后经sanger测序确定质粒构建成功。

图1 PGRP-S2基因克隆电泳图
2.2 埃及伊蚊PGRP-S2基因序列分析
提取并测定PCR及单双酶切验证正确的阳性克隆子质粒,获得埃及伊蚊PGRP-S2基因全长序列。通过测序分析,发现该序列的开放阅读框长510 bp,可编码170个氨基酸。CDD结构域预测显示该序列具有典型的PGRP超家族保守结构域与酰胺酶结构域(图2)。选取埃及伊蚊PGRP-S2氨基酸序列及其他昆虫PGRPs,使用 MEGA7.0软件的邻比对法构建系统发育树,结果发现埃及伊蚊AePGRP-S2与其他两种埃及伊蚊的PGRPs聚类在同一分支上,说明二者亲缘关系最近(图3)。
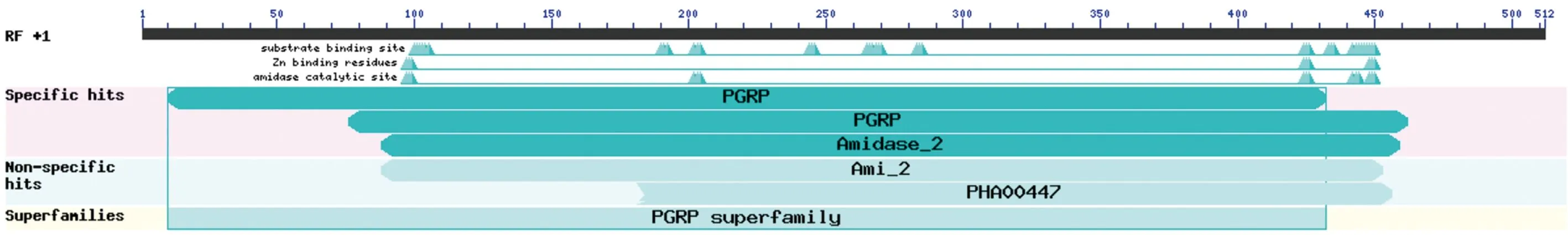
图2 埃及伊蚊PGRP-S2保守区域分析

图3 埃及伊蚊PGRP-S2与其他昆虫肽聚糖识别蛋白的系统发育树
2.3 重组蛋白的表达与纯化
将PGRP-S2基因重组到pCold-GST载体上,并转化到E.coliBL21(DE3)。提取并通过SDS-PAGE检测总蛋白,发现IPTG诱导后在46 kDa处有一条特异蛋白,与预期一致(图4-A)。为进一步确证该蛋白的表达,根据表达载体的GST标签选用GST抗体通过Western blot进行检测,发现GST标签26 kDa和PGRP-S2蛋白46 kDa可被特异性检出(图4-B),说明该蛋白已成功表达,且表达PGRP-S2蛋白可溶(图4-A,B)。

图4 SDS-PAGE 检测纯化的重组PGRP-S2蛋白
3 讨论
先天免疫是昆虫抵抗寄生虫入侵和外界微生物感染的重要途径。昆虫先天免疫主要依靠病原菌的病原体相关分子模式(PAMPs)与宿主的模式识别受体(PRRs),这些病原体相关分子模式(PAMPs)包括脂多糖、肽聚糖、脂磷壁等(任美佳,2019),而PGRPs能够识别微生物细胞壁上的肽聚糖,在昆虫免疫中具有重要作用。第一个关于PGRP的报道来自于家蚕血淋巴的纯化,分子量为19 kDa(Yoshidaetal.,1996)。后来陆续有多个PGRP家族成员被鉴定,根据5’端非翻译区和转录长度,被分为长型与短型。研究发现,家蚕中的BmPGRP蛋白具有激活抗菌肽基因表达的作用(Yang,2015),家蝇中的MdPGRP-LE受到干扰会降低幼虫体内分氧化物酶活性(郝志霞,2020),小菜蛾的PGRP-S2蛋白具有与细菌结合识别功能(杜少萱等,2020)。埃及伊蚊也可通过自身的肽聚糖识别蛋白来识别入侵微生物的PGN,从而启动免疫机制,提高虫体抵御这些微生物的能力。
为进一步了解埃及伊蚊PGRP基因序列特征,本研究克隆得到埃及伊蚊AePGRP-S2基因,通过基因序列分析(图2)发现该基因具有典型的PGRP超家族保守结构域与酰胺酶结构域。该结构域与Ⅱ型N-乙酰-L丙氨酸酰胺酶活性位点高度相似,AePGRP-S2蛋白极有可能具有杀菌活性。但有些具有酰胺酶结构域的PGRP蛋白没有直接的抗菌活性,但是在与细菌结合后,进一步激活Toll通路,从而引起抗菌肽的表达(Mellrothetal.,2006,罗嫚等,2016)。因此,AePGRP-S2蛋白的酰胺酶活性及作用机制还需进一步深入探讨。为进一步了解埃及伊蚊的与其他昆虫的亲缘关系,将埃及伊蚊AePGRP-S2基因与其他昆虫的S型PGRPs基因构建系统发育进化树(图3),结果显示AePGRP-S2与埃及伊蚊的其他两种PGRPs亲缘关系较高,说明二者在功能上具有一定的保守性。为进一步了解该基因的功能,本研究还体外异源表达了PGRP-S2,通过SDS-PAGE及Western Blot分析,发现该蛋白大小46 kDa。然而,PGRP-S2如何精细调控埃及伊蚊的免疫反应机制还不确定,本研究对于该蛋白的序列特性的了解及表达蛋白产物的获得为下一步工作开展该蛋白在埃及伊蚊体内的免疫机能研究提供了重要理论基础与实验材料。
