扩散加权成像联合扩散峰度成像对脑胶质瘤的分级诊断及预后评估的价值
2022-10-08王绍凯韩向军朱静怡赵宇李松柏
王绍凯,韩向军,朱静怡,赵宇,李松柏
胶质瘤是常见的原发性颅脑肿瘤,恶性程度不一,临床治疗以手术和放化疗为主,准确进行胶质瘤评估和分类是制订治疗方案的关键。有研究发现[1],同样类型和级别的胶质瘤患者接受相同治疗方案的预后也会有所不同,原因在于部分低级别胶质瘤虽生长缓慢,但具有去分化转变成高级别恶性胶质瘤的生物学潜能。研究认为[2],部分低级别胶质瘤存在一定的异质性,早期准确评估低级别胶质瘤及其生物学行为,对改善患者预后有重要意义。目前胶质瘤的准确分类需获取组织,在术前指导治疗及治疗后持续监测方面存在较大难度;此外,胶质瘤有一定的空间异质性,取样差异会给评估结果带来较大偏倚,如何通过无创手段获得胶质瘤的病理学和遗传学信息成为临床亟待解决的难题[3]。研究表明[4],MRI对反映胶质瘤的病理特征有较大的价值,常规MRI可通过平扫结合增强扫描进行胶质瘤分级,但敏感性和特异性较低,且无法定量评估胶质瘤增殖活性。扩散加权成像(diffusion weighted imagin, DWI)与扩散峰度成像(diffusion kurtosis imaging, DKI)属于非侵入性功能性MRI,其中DWI 可通过水分子扩散信息评估胶质瘤分级和细胞增殖活性。DKI 是非高斯扩散成像技术,DKI 的采集包括至少2 个非零b 值,每个b 值至少采集15 个非共线方向,对胶质瘤的异质性及生物学行为的评估有较大价值,可弥补DWI 的不足[5],但目前临床有关DWI 联合DKI 评估脑胶质瘤预后的相关研究仍较为缺乏。本研究创新性地分析了82 例胶质瘤患者的DWI 和DKI,并通过绘制受试者工作特征曲线(receiver operating characteristic, ROC)分析了DWI 联合DKI对预后的预测价值,现报道如下。
1 材料与方法
1.1 研究对象
回顾性分析本院2017年2月至2019年2月收治的脑胶质瘤患者病例82例,其中男42例、女40例,年龄24~62(42.43±6.12)岁。纳入标准:(1)颅内原发病灶,经病理证实为胶质瘤;(2)年龄>18岁;(3)术前2周内进行MRI检查,至少完成临床常规序列(平扫、DWI)和多b 值DWI、DKI 序列扫描。排除标准:(1)肿瘤实质部分过小(最大层面<25 mm2)者;(2)头动明显者;(3)影像数据存在错误或缺失者;(4)未完成随访者。本研究经本单位伦理委员会批准(批准文号:YDYY_kyk202204005),免除受试者知情同意。
1.2 方法
1.2.1 检查方法
所有患者术前均采用GE Discovery LS MR 750 3.0 T超导型磁共振扫描仪进行检查,32通道相控阵头线圈,行常规MRI、DWI及DKI扫描。横轴位所有序列的定位线与前后联合线平行,扫描位置一致,范围覆盖全脑。常规MRI序列包括平扫+增强,用作DKI和DWI解剖参考相。常规MRI平扫矢状位T1-液体衰减反转恢复(fluid-attenuated inversion recovery, FLAIR)及横轴位T1-FLAIR、T2-快速自旋回波(fast spin echo, FSE)、T2-FLAIR,增强扫描矢状位T1-FLAIR 及横轴位TI-FLAIR。常规DWI采用自旋平面回波脉冲序列采集,扫描参数:TR/TE 3000 ms/70 ms,激励4次,矩阵160×160,扫描20层,层厚、层间隔及视野(field of view, FOV)分别为5 mm、1.5 mm、24 cm×24 cm,b 值为1000 s/mm2,扩散敏感梯度场施加3 个垂直方向,扫描42 s。DKI 采集:采用自旋回波平面回波成像(spin echo-echo planar imaging, SE-EPI)序列采集,扫描参数:TR/TE 6500 ms/85 ms,激励1次,矩阵128×128,扫描43层,层厚、层间隔及FOV分别为3 mm、0 mm、25.6 cm×25.6 cm,b 值包括0、1250 s/mm2、2500 s/mm2,扩散敏感梯度场施加25 个方向,扫描时间5 min 45 s。
由2 名至少5 年临床经验的神经放射学主任医师进行阅片,采取双盲法,当意见不一致时通过讨论最终达成一致意见。审阅常规MRI 图像的矢状位+横轴位T1-FLAIR、横轴位T2-FSE、横轴位T2-FLAIR 及增强矢状位+横轴位T1-FLAIR 序列。分析胶质瘤病灶数量(单发和多发病灶)、信号(均匀和不均匀)、边界(清晰和模糊)、瘤周水肿(无水肿、轻度水肿和明显水肿)及肿瘤强化情况(肿瘤实体无强化、轻度强化和明显强化)。通过ImageJ 软件勾画最大层面肿瘤边界,计算面积后分为小面积(<15 cm2)和大面积(≥15 cm2)。DKI 采用软件包进行图像后处理,DWI采用ImageJ软件进行图像后处理。勾画感兴趣区前对横轴位增强T1-FLAIR、T2-FSE、T2-FLAIR序列和ADC 进行调整以匹配DKI 参数,包括平均峰度(mean kurtosis, MK)、轴向峰度(axial kurtosis, Ka)、径向峰度(radial kurtosis, Kr)、平均扩散系数(mean diffusivity,MD)和各向异性分数(fractional anisotropy, FA)。通过ImageJ 软件匹配各序列或参数图在断面上位置信息,首先横轴位增强T1-FLAIR、T2-FSE、T2-FLAIR和ADC图的图像分辨率调整为240×240 以匹配DKI 序列参数图像素;其次将横轴位增 强T1-FLAIR、T2-FSE、T2-FLAIR 和ADC 图 的 层 数 重 排 成43 层;后根据横轴位增强T1-FLAIR、T2-FSE、T2-FLAIR 和ADC图、DKI参数图将画布大小调整为256×256。
1.2.2 术后随访与预后
术后通过电话定期对胶质瘤患者进行复查及随访,随访3年,将胶质瘤患者死亡定义为事件发生。根据随访预后将患者分为存活组与死亡组。进行预后的单因素比较及多因素logistic回归分析,确定预后影响因素。
1.3 统计学处理
采用SPSS 19.0 进行统计分析,计量资料用(xˉ±s)表示,多组间比较采用单因素方差分析,进一步两两比较采取最小显著差异(least significant difference,LSD)t检验检验;计数资料采用χ2检验进行分析;采用多因素logistic 回归分析确定预后的影响因素,绘制DWI 和DKI 参数预测预后的受试者工作特征(receiver operating characteristic,ROC)曲线,以P<0.05为差异有统计学意义。
2 结果
2.1 常规MRI扫描特征
82 例胶质瘤患者的病理结果参照《2021 版中枢神经系统肿 瘤WHO 分 类 概 述》[6]。其 中 低 级 别38 例(1 级5 例、2 级33 例)、高级别44 例(3 级21 例、4 级23 例),见图1~3。不同级别胶质瘤的病变数量、信号、病灶面积的比较,差异均无统计学意义(P>0.05)。高级别胶质瘤(3 级、4 级)的水肿及强化情况更明显,但差异仍无统计学意义(P>0.05)。见表1。

表1 胶质瘤的常规MRI扫描特征比较 单位:例
2.2 胶质瘤DWI参数与DKI参数
随着胶质瘤级别的升高,ADC、MD 降低,MK、Ka、Kr 升高,差异有统计学意义(P均<0.05);胶质瘤级别与ADC、MD 呈明显负相关(r=-0.336、-0.241,P=0.002、0.029),与MK、Ka、Kr 呈明显正相关(r=0.374、0.342、0.317,P=0.001、0.002、0.004)。不同级别胶质瘤的FA 的比较,差异无统计学意义(P>0.05),胶质瘤级别与FA 之间无明显相关性(r=-0.195、0.173,P=0.079、0.120)。见表2。

表2 不同级别的胶质瘤DWI参数与DKI参数比较(xˉ±s)

2.3 随访预后
截至2021 年10 月,82 例胶质瘤患者中存活者40 例、死亡42 例。死亡组与存活组性别、年龄、MRI 信号、边界、病灶面积的差异无统计学意义(P>0.05)。死亡组中高级别胶质瘤、多发病变、明显水肿、明显强化的占比及MK、Ka、Kr 高于存活组,ADC低于存活组,差异有统计学意义(P<0.05)。见表3。

表3 不同预后患者的单因素比较
2.4 预后的多因素logistic回归分析
以患者预后作为因变量(死亡=1、存活=0),将单因素分析中有统计学意义的变量作为自变量进行多因素logistic 回归分析,结果显示胶质瘤级别、瘤周水肿、肿瘤强化、ADC、MK是预后的影响因素(P<0.05)。见表4。

表4 脑胶质瘤患者预后的多因素logistic回归分析
2.5 MK与ADC对预后的预测价值分析
MK预测脑胶质瘤患者预后的曲线下面积为0.835(95%CI:0.690~0.961),以0.550作为截断值时的敏感度与特异度分别为86.6%和80.5%;ADC 预测预后的曲线下面积为0.789(95%CI:0.633~0.945),以1.240作为截断值时的敏感度与特异度分别为82.9%和76.8%;MK 联合ADC 预测预后的曲线下面积为0.903(95%CI:0.808~0.994),敏感度与特异度分别为93.9%和85.4%(图4)。
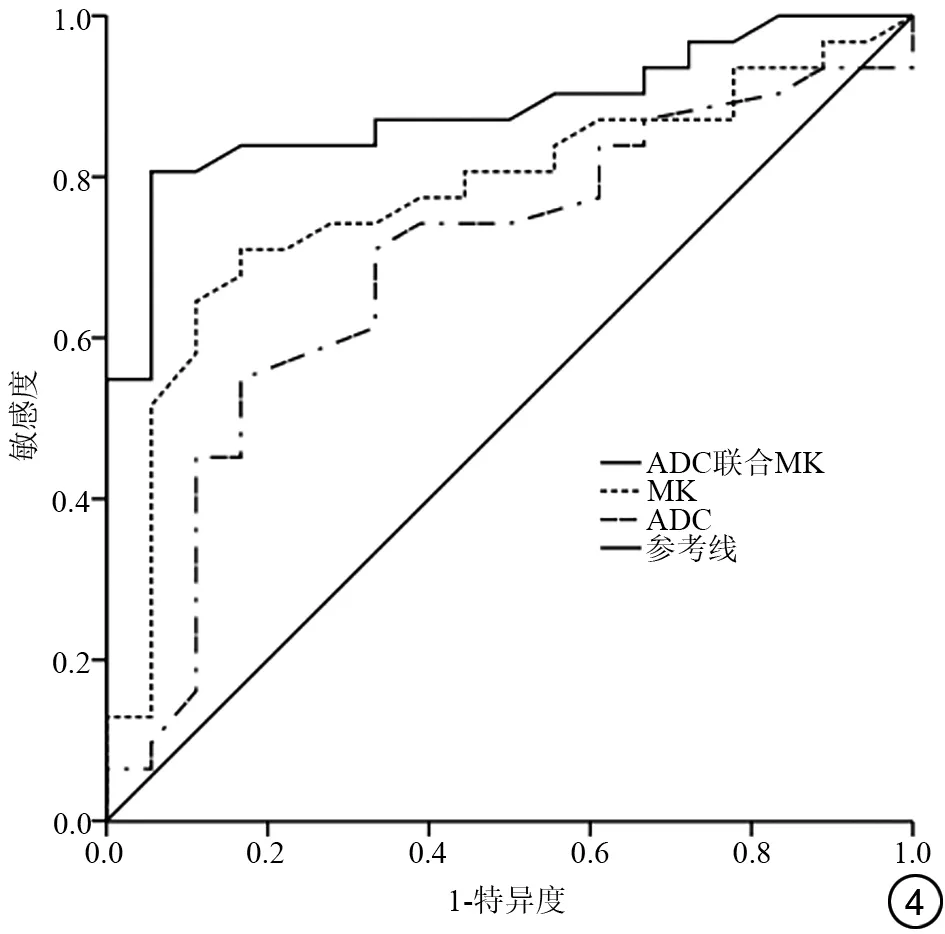
图4 MK与ADC预测预后的ROC曲线。MK:平均峰度;ADC:表观扩散系数;ROC:受试者工作特征。
3 讨论
本研究对86 例胶质瘤患者进行了DWI 和DKI 扫描,获取了ADC、MK、Ka、Kr、MD、FA 等参数,分析DWI 和DKI 对胶质瘤患者预后的预测价值,结果显示DWI 联合DKI 对胶质瘤预后的预测价值较高。目前认为,常规MRI 无法准确评估胶质瘤级别及胶质瘤细胞的增殖活性,MR 扩散成像可提供水分子扩散信息,但分级诊断的准确性不够高。而DWI 对肿瘤恶性进展的细胞学改变的敏感度不足,原因在于DWI 默认生物组织内水分子扩散位移服从高斯分布,但实际上中枢神经系统组织细胞结构复杂,水分子扩散位移概率分布偏离了高斯分布,造成DWI 的准确性降低,使得常规MRI 与单一DWI 对胶质瘤的评估价值受限[7]。与DWI 相比,DKI 属于高端非高斯扩散成像,通过水分子扩散位移概率分布偏离高斯分布的程度对胶质瘤进行评估,所测得的参数可反映组织微观结构的不均质性和复杂性[8-9],将DWI 与DKI 联合用于预测胶质瘤预后可通过更全面的信息提高预测价值,显示了DWI 联合DKI 对胶质瘤预后较高的评估价值,这是本次研究的创新之处。
3.1 不同级别胶质瘤的DWI与DKI分析
本研究比较了不同级别胶质瘤的常规MRI 扫描特征,在病变数量、信号、病灶面积、瘤周水肿及强化方面的差异均无统计学意义(P>0.05);而不同级别胶质瘤的肿瘤实性区ADC、MD、MK、Ka、Kr 均有统计学意义,其中胶质瘤级别与ADC、MD 呈明显负相关,与MK、Ka、Kr 呈明显正相关(P<0.05),提示DWI与DKI 在胶质瘤分级诊断中有较高的临床价值。国外研究认为,Ka 与扩散主方向平行,可反映轴突完整性及纤维束密度;Kr 与扩散主方向垂直,可反映髓鞘完整性和轴突密度;MK 是各扫描方向峰度的均值[10-11]。作为扩散张量成像(diffusion tensor imaging, DKI)序列的延伸,DKI 可提供与组织细胞微观结构有关的额外的峰度信息,反映组织微观结构的不均质性和复杂性。随着胶质瘤级别的升高,尤其是4 级胶质瘤的肿瘤实体组织内肿瘤密实,细胞数量多,细胞核大且异型性明显,存在明显的血管与内皮增生、坏死及出血等,肿瘤组织多不均质[12-13]。而低级别胶质瘤的均一性好,分化高,细胞大且量少,扩散屏障也更少[14]。因此,高级别胶质瘤组织的组织复杂性和不均质性更明显,使肿瘤细胞内外水分子扩散运动受到明显限制,造成峰度参数增高,而扩散参数减低[15-16]。也有研究认为,峰度参数可在组织细胞微观结构改变的早期阶段被峰度参数探测到,而此时ADC 可能尚未发生改变,因而ADC无法识别组织细胞微观结构改变,这或许是峰度参数评估胶质瘤分级更有效的原因[17-19]。
3.2 不同预后胶质瘤的DWI与DKI分析
随访结果显示,不同预后胶质瘤患者的胶质瘤分级、病变数量、水肿、强化情况及MK、Ka、Kr、ADC 的差异有统计学意义,进一步多因素logistic 回归分析显示,胶质瘤级别、瘤周水肿、肿瘤强化、ADC、MK是胶质瘤患者预后的影响因素。高级别胶质瘤组织内细胞密实,细胞间隙窄,易出现新生血管,且存在明显的组织坏死、出血、内皮增生,上述病理改变在MRI 上形成水肿与强化等征象,则提示肿瘤恶性度高、生长迅速,侵袭力较强,因此患者生存时间缩短,预后相对低级别胶质瘤更差[20-21]。国外研究认为,肿瘤强化明显通常意味着肿瘤生长破坏了正常的血脑屏障和正常脑组织,侵袭力强,恶性度高,生存时间缩短;而瘤周明显水肿往往提示肿瘤组织浸润到瘤周水肿组织内,肿瘤细胞散而广,手术难以切除干净,肿瘤更易复发,死亡风险更高[22-23]。ADC 反映的是肿瘤实体区水分子扩散受限情况,ADC 越低,水分子扩散受限越严重[24]。肿瘤组织越密、细胞越多,异型性越明显,水分子扩散屏障越多,扩散受限也越明显,相应的侵袭力也越强,生长越迅速,死亡风险越高[25-26]。MK 反映的是肿瘤实性区的平均峰度,对于胶质瘤而言,主要肿瘤内出现出血、内皮增生及血管生成等,细胞微观结构内的不均质性和复杂性就会变高,造成MK 增大,同时为胶质瘤增殖活性提供了信息,这是MK 成为胶质瘤预后影响因素的主要原因[27]。绘制的ROC 曲线显示ADC、MK 对胶质瘤的预后有较高的预测价值,且二者联合对预后的预测价值更高,考虑与MK 可敏感地检测出胶质瘤细胞增殖活性增高引起的细胞微观结构变化,ADC 与MK 联合可将肿瘤的水分子扩散情况与细胞增殖活性相结合,因此对胶质瘤预后的预测价值更高。
有研究采用MRI 多模态定量与定性分析对脑胶质瘤进行分级诊断,扫描序列包括T1WI、T2WI、T1 增强、DKI、磁敏感加权成像、动脉自旋标记、磁共振波谱,共获得10 个定量参数,但经Fisher 逐步判别筛选,最终仅FA 和最小ADC 这两个由DKI 获得的参数对胶质瘤的分级诊断有一定效能[28]。DKI 是DKI 序列的延伸,除获得上述两项参数外,还可获得MK、Ka、Kr等参数,较之多模态MRI 在脑胶质瘤的分级及预后评估方面有更大临床价值。
3.3 局限性
本研究的局限性:(1)样本量较小,且仅分析了随访3 年的生存情况,未对无进展生存情况及更长随访时间的预后进行分析,有待进一步扩大样本量及延长随访时间进行探讨;(2)在影像学基础上联合Ki-67 等血清学指标有利于提高胶质瘤预后的评估价值[29],但本研究未能纳入血清学指标,因此在DWI、DKI 基础上联合血清学指标是否能进一步提高胶质瘤预后的预测价值仍有待后续验证,是后续研究的主要方向。
综上所述,DWI 和DKI 是胶质瘤分级的有效评估方法,其中ADC与MK可将肿瘤的水分子扩散情况与细胞增殖活性相结合,二者联合对胶质瘤患者的预后有较高的预测价值。
作者利益冲突声明:全体作者均声明无利益冲突。
