多参数扩散加权成像对乳腺TIC-Ⅱ型病变良、恶性的鉴别价值
2022-10-08王洪杰王唯伟吕四强褚瑶刘尚宽朱来敏陈月芹孙占国
我国乳腺癌发病率呈快速上升趋势,早期诊断对降低患者死亡风险具有重要意义
。目前乳腺病变的主要影像学检查方法中,MRI具有较高的敏感度和特异度且对致密型乳腺的病变检出更具优势。常规MRI平扫结合动态增强成像(dynamic contrast-enhanced magnetic resonance imaging, DCE-MRI)是目前临床常用的乳腺MRI 扫描序列,除获取病变形态、信号特征外,还可通过时间-信号强度曲线(time-signal intensity curve, TIC)对病变血流动力学信息进行半定量评估。乳腺癌的TIC以流出型(TIC-Ⅲ型)多见,但仍有约34%的乳腺癌表现为平台型(TIC-Ⅱ型)
,与部分乳腺良性病变存在重叠,给诊断带来一定困扰。传统单指数扩散加权成像(diffusion-weighted imaging, DWI)通过表观扩散系数(apparent diffusion coefficient,ADC)定量反映病变组织的水分子扩散运动,其联合常规MRI 征象对TIC-Ⅱ型乳腺良恶性病变鉴别具有较高的敏感度和特异度
。然而,传统ADC受水分子真实扩散和微循环灌注的双重影响,且乳腺恶性病变中的水分子实际扩散不符合高斯分布,对其诊断效能产生一定影响
。文献报道,基于双指数模型的体素内不相干运动扩散加权成像(intra-voxel incoherent motion-DWI, IVIM-DWI)和基于非高斯扩散模型的扩散峰度成像(diffusion kurtosis imaging,DKI)能够提供更全面的病变内扩散信息,从而提高MRI对乳腺良恶性病变的鉴别诊断效能
。目前尚未见DWI、IVIM 及DKI 联合用于乳腺TIC-Ⅱ型病变鉴别的文献报道。本研究回顾性分析TIC-Ⅱ型的乳腺病变患者的MR 数据,旨在探讨多参数扩散加权成像联合应用对乳腺TIC-Ⅱ型病变良恶性的鉴别诊断价值,为临床术前诊断及制订治疗方案提供重要信息。
英语作为世界语,在对外经济文化交流中依然发挥着重要的作用。另外,根据所调查的企事业单位反馈,32%的用人单位需要日语人才,23%的用人单位需要韩语人才,15%的用人单位需要阿拉伯语人才。此外,俄语,德语,法语人才也是非常稀缺。因此,除了具备一定的英语能力外,外语人才迫切需要掌握其它小语种语言。
1 材料与方法
1.1 一般资料
回顾性分析2019 年10 月至2021 年1 月就诊于济宁医学院附属医院,因发现乳腺占位而行乳腺MRI检查的患者病例743 例。纳入标准:(1)检查序列包括乳腺MRI 常规平扫、DCE-MRI、DWI、IVIM 及DKI 序列;(2)乳腺病灶TIC 表现为TIC-Ⅱ型;(3)乳腺病灶直径>1 cm;(4)最终诊断经穿刺或术后病理证实。排除标准:(1)MR 序列不完整或图像质量不能满足本研究需求;(2)MRI 检查前已行穿刺、手术或放化疗。本研究为回顾性研究,经济宁医学院附属医院伦理委员会批准,所有患者均被免除签署知情同意书,批准文号:2021C003。
学院成立“三师”型师资队伍建设领导小组,组长、副组长负责“三师”型师资队伍建设工作的组织、实施、协调。其他成员负责相关文件、方案、制度的起草、完善以及材料的收集、汇总和考核。每位专职教师负责在所任课班级搞好教学、时政宣讲、思政引导工作。学校层面的工作由领导小组安排落实。
1.2 检查方法
使用GE Discovery 750W 3.0 T超导型MR及8通道乳腺专用线圈。患者取俯卧位,双乳悬垂于线圈双孔内。行常规平扫序列(T1WI、T2WI-FS)扫描后,行DWI、IVIM及DKI序列扫描,最后行DCE-MRI扫描。(1)DWI:采用单次激发平面回波技术,TR 3600 ms,TE 73 ms,矩阵128×128,b 值为50、1000 s/mm
,激励次数分别为1 次、6 次。(2)IVIM:TR 2500 ms,TE 90 ms,矩阵128×128,b 值为20、30、50、70、100、150、200、500、700、1000、1500、2000 s/mm
,激励次数2 次,扫描时间6 min 40 s。(3)DKI:TR 5000 ms,TE 89.9 ms,矩阵128×128,b 值为0、1000、2000 s/mm
,每个b 值均施加30个方向的扩散敏感梯度场,扫描时间5 min 55 s,激励次数2次。以上所有序列层厚均为4 mm,层间距为0.4 mm,FOV 350 mm×350 mm。(4)DCE-MRI:采用FLASH-3D 脂肪抑制TIWI 序列,TR 4.5 ms, TE 2.0 ms,层厚2.0 mm,FOV 320 mm×320 mm;无间隔重复扫描8期,每期扫描时间60 s,第1期为蒙片。
1.3 图像分析
使用GE AW4.6 后处理工作站Functool 模块(9.4.05)进行图像后处理。采集DWI、IVIM与DKI序列各参数:ADC、真实扩散系数(true diffusion coefficient,D)、灌注相关扩散系数(perfusion-related diffusion coefficient, D
)和灌注分数(perfusion fraction, f)及平均扩散率(mean diffusion, MD)、平均扩散峰度(mean kurtosis, MK)。所有感兴趣区(region of interest,ROI)的勾画均由2名具有5 年以上乳腺MRI 阅片经验的主治医师在对病理结果不知情的前提下独立完成,多处病变取最大病灶测量。参照增强图像,在病灶的实性成分最大层面手动勾画ROI,避开出血、坏死、血管及囊变区域,其他参数的ROI 由工作站自动复制,形状与位置均一致;每处病灶的各参数均测量3次取平均值。
1.4 统计学分析
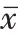
本研究结果示D 值与MK 值为鉴别乳腺TIC-Ⅱ病变良恶性的独立影响因素。D 值表示病变组织真实的扩散受限程度,病变细胞异质性越强、排列越紧密,其扩散受限情况越明显,则D 值随之越小。MK 值代表多b值下扩散峰度在所有梯度方向的平均值,组织中分子水平的超微结构越复杂,水分子运动偏离高斯分布越显著,MK 值随之增大。因此,在IVIM 及DKI参数中,我们推荐使用D或MK值用于TIC-Ⅱ型乳腺病变的良恶性鉴别。
2 结果
2.1 一般资料
本研究基于DWI、IVIM 及DKI 技术获取乳腺病灶的多个定量参数,比较TIC-Ⅱ型乳腺良、恶性病变各参数的差异并建立诊断预测模型,结果显示TIC-Ⅱ型恶性病变的ADC值、D值、f值、MD值、MK值与TIC-Ⅱ型良性病变存在差异(
<0.005),其中D 值、MK 值为二者鉴别的独立影响因素(
<0.005),且MK 值具有最高的优势比;各联合模型间AUC 差异均无统计学意义(
>0.05),其中以三模型联合的诊断效能最大(AUC=0.915)且高于单一的DWI 序列(AUC=0.816)(
<0.05)。既往相关研究主要针对乳腺病变的良恶性鉴别、乳腺癌分子亚型评估及乳腺癌新辅助化疗效果的预测等,多未考虑TIC类型这一因素,聚焦TIC-Ⅱ型乳腺病变的研究更少。本研究首次联合DWI、IVIM及DKI技术定量分析TIC-Ⅱ型乳腺良、恶性病变的差异,并探索多参数扩散加权成像序列的优化组合应用,为临床术前诊断及制订治疗方案提供一定的参考和思路。
2.2 两观察者参数测量的一致性分析
两观察者的各参数测量结果具有良好的一致性,ADC 值、D 值、D
值、f 值、MD 及MK 值的ICC 值分别为0.895(95%
:0.849~0.928)、0.964(95%
:0.954~0.974)、0.894(95%
:0.861~0.920)、0.788(95%
:0.727~0.839)、0.981(95%
:0.973~0.987)、0.963(95%
:0.945~0.973)。
2.3 良、恶性组DWI、IVIM 及DKI 各参数的差异及相关性
恶性组的ADC 值、D 值、f 值、MD 值低于良性组,D
值、MK 值高于良性组,除D
值外,其余各参数两组差异均有统计学意义(
<0.05)(表1,图1~2)。

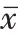
2.4 TIC-Ⅱ型乳腺良、恶性病变鉴别的单因素及多因素logistic回归分析
TIC 主要反映病变的血供情况,乳腺病变中毛细血管密度、血管壁的通透性及肿瘤间质的血容量均可影响病变TIC 的类型
。恶性病变倍增时间短,肿瘤内局部缺氧环境及肿瘤细胞分泌的血管内皮生长因子共同促进血管生成,形成众多杂乱无章的血管网以及大量的动静脉吻合
,使得大部分乳腺恶性肿瘤表现为早期明显强化随后迅速廓清的TIC-Ⅲ型
。然而由于肿瘤的异质性,一定比例的乳腺恶性肿瘤可能具有特定的微血管结构,存在丰富的微血管但尚未形成动静脉吻合,血流动力学较稳定,从而表现为TIC-Ⅱ型
,如Luminal A 型乳腺癌约67%表现为TIC-Ⅱ型
。另外,部分乳腺良性病变如乳腺炎症、富血供纤维腺瘤可通过炎症反应或过量表达血管内皮生长因子促进毛细血管生成,使病变间质血容量增大,亦表现为迅速且持续强化的TIC-Ⅱ型
。因此,乳腺TIC-Ⅱ型病变中存在一定程度的良、恶性重叠
。
本实验利用内蒙古传统发酵乳制品奶豆腐,通过初筛和复筛,挑选出16株发酵性能良好的嗜热链球菌(T1~T16),并结合镜检观察、生化试验以及16SrDNA基因序列分析对菌株进行鉴定。结果显示这16株菌发酵酸乳至70°T所需时间为4-8 h,各菌株在产酸、持水性以及蛋白水解能力存在差异。菌株T 9和T16各方面的性能均比较好,具有良好的产酸能力,后酸能力弱,并且持水性和蛋白水解能力均比较好,制备的发酵乳酸奶风味浓郁,口感优越,质地良好,可用于开发具有良好发酵特性的直投式酸奶发酵剂。
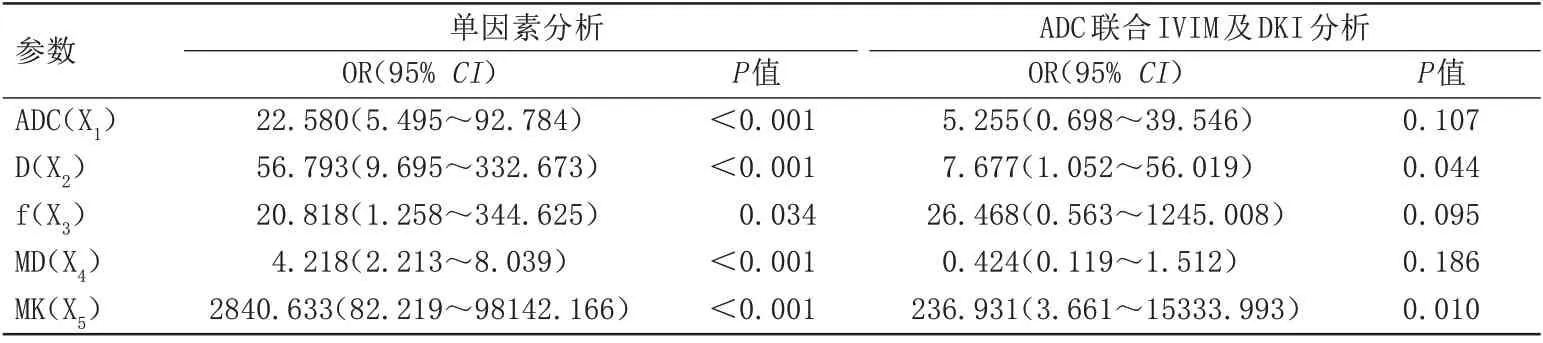


其中
为风险概率值,e 为自然对数;当
<0.321时,该病变更可能为恶性病变。
多因素logistic 回归分析示D 值(X
)与MK 值(X
)为鉴别TIC-Ⅱ型乳腺良、恶性病变的独立影响因素,其中MK值的优势比最大(表2)。
2.5 DWI、IVIM 及DKI 各参数及联合模型对乳腺TIC-Ⅱ型良恶性病变的鉴别诊断效能
各参数中,MK值对乳腺TIC-Ⅱ型良、恶性病变鉴别的诊断效能最大,对应AUC 为0.871,特异度为88.0%,敏感度为80.8%,准确度为78.6%;f值的诊断效能最小,对应AUC为0.634,与其余各参数的差异均具有统计学意义(
=2.021~2.873,
=0.0041~0.0432)(表3,图3)。


各联合模型中,DWI+IVIM、DWI+DKI 及DWI+IVIM+DKI间的AUC差异均无统计学意义(Z=0.558~1.091,
>0.05),以三模型联合的诊断效能最大,对应AUC为0.915,敏感度为92.3%,特异度为84.0%,准确度为86.4%。三模型联合的AUC 高于DWI(AUC 为0.816),差异具有统计学意义(
=2.070,
=0.038)(表3,图4)。
3 讨论
本研究最终纳入患者103 例,均为女性,年龄27~88(49.2±10.5)岁,共纳入乳腺TIC-Ⅱ型病灶103 个。根据病理结果分为良、恶性组,其中良性组25 例(25 个病灶):乳腺纤维腺瘤16 例、乳腺腺病伴纤维腺瘤2 例、乳腺腺病3 例、乳腺腺病伴发炎症2 例、乳腺囊性增生病1 例、富于细胞性神经纤维瘤1 例;恶性组共78 例(78 处病变):浸润性导管癌66 例、导管原位癌3 例、浸润性小叶癌2 例、囊内乳头状癌2例、乳腺其他恶性病变5例。
3.1 TIC-Ⅱ型乳腺病变的特征
将ADC 值(X
)、D 值(X
)、f 值(X
)、MD 值(X
)及MK值(X
)纳入单因素logistic 回归模型,结果显示上述各值对鉴别诊断的影响均有统计学意义(
<0.05)(表2)。
近年来,MRI 检查在乳腺癌术前诊断、治疗随访和预后评估中发挥着越来越重要的作用
。常规MRI 平扫结合DCE-MRI 对TIC-Ⅱ型病变的鉴别存在一定局限性,无法完全满足术前诊断需求。近期一研究发现,测量乳腺癌病灶ADC 值与健侧胸大肌ADC值的比值有助于鉴别TIC-Ⅱ型良恶性病变,且不受绝经与否的影响
。然而,传统ADC 受水分子真实扩散和微循环灌注的双重影响,且仅考虑水分子的高斯扩散分布,可能无法准确评估病变的真实扩散信息
。恶性肿瘤的微观结构复杂性高于良性病变,促使真实的水分子扩散受限程度增加且偏向非高斯扩散运动。IVIM 能够将组织扩散和灌注信息分别评估,DKI 能够反映水分子的非高斯扩散分布,二者有望获得更真实的组织水分子扩散信息,理论上能够为TIC-Ⅱ型病变良恶性的鉴别提供更多参考。
3.2 DWI、IVIM 及DKI 序列各参数在乳腺TIC-Ⅱ型良、恶性病变中的差异
另外,本研究结果显示乳腺TIC-Ⅱ型恶性病变的
值低于良性病变,与既往研究结果不符
,可能主要与研究对象不同有关,本研究仅针对TIC-Ⅱ型病变患者,而其他研究的研究对象涵盖了所有TIC类型病变;本组TIC-Ⅱ型良性病变多为血供丰富的纤维腺瘤或腺病,而f值主要与病变组织中毛细血管密度及血流速度相关
,因而所得f值偏大。
本研究结果中,恶性病变组的ADC 值、D 值、MD 值均低于良性病变组,与既往研究结果相符
。同时,两组的D值均低于ADC值,且D值的鉴别诊断效能高于ADC 值,这主要与D 值除去了血流灌注对扩散的影响有关
;此外,相比于其他IVIM 参数,D 值在不同b 值选择情况下更为稳定,因而结果也更为可靠
。本组恶性病变的MK 值高于良性病变,可能与恶性病变复杂的微观结构促使水分子偏向非高斯扩散运动有关。既往报道也表明MK值对乳腺癌诊断的敏感度及特异度均高于MD值及ADC值
。
3.3 DWI、IVIM 及DKI 序列诊断乳腺TIC-Ⅱ型良、恶性病变的影响因素
翌日上午取回采样纸,用工业显微镜把附着药液的1.2mm2试纸放大160倍,读入计算机中,利用图像处理技术统计上面的雾滴的粒数和当量粒径;再利用Excel软件统计和计算平均粒径的大小及粒数[3]。由于雾滴在采样纸上的痕迹大致为圆形,应校正为球体直径,按下列公式计算,即
3.4 DWI、IVIM 及DKI 序列鉴别乳腺TIC-Ⅱ型良、恶性病变的临床意义
本研究发现相比于DWI,其联合IVIM可将敏感度提升11.5%,而联合DKI 能将特异度提升12%,均可以提升一定的诊断效能,这与其他的研究结果相似
。DWI 联合IVIM 能够在乳腺MRI 早期筛查中检查出更多TIC-Ⅱ型乳腺病变,给予更多的手术机会;而联合DKI则能够更准确地鉴别出TIC-Ⅱ型乳腺恶性病变,减少不必要的手术以期降低患者所受的创伤;两者不能互相取代,在临床工作中应根据不同的情况选择合适的乳腺MRI序列组合。将DWI、IVIM及DKI三者联合应用能获得最高的鉴别诊断效能,相比单独运用DWI 序列的诊断效能显著提高;同时相比于DWI 联合IVIM或DKI,分别能提升12%的特异度和11.5%的敏感度,且能获得更高的诊断准确度(86.4%)。因此,我们推荐在常规乳腺MRI 检查及DWI 序列的基础上,增加IVIM 及DKI 序列扫描,以获取乳腺TIC-Ⅱ型病变的最佳诊断效果。
位置在刀具尺寸>φ7×40mm时发生了突变。刀具的安装位置也会影响换能器谐振频率,刀具夹持长度越短,换能器的谐振频率越小,但对位移节点位置影响可以忽略。
3.5 本研究的局限性
本研究存在一定的不足之处,一是纳入的总病例数偏少,仅纳入了病灶直径>1 cm 且经穿刺或术后病理证实的病例,恶性病变例数占比约76%,可能导致统计学偏倚,有待扩大良性病变的样本量进一步探讨。二是本研究恶性病变的病种例数不平衡,以浸润性导管癌为主,其他恶性病变较少,影响结果的普适性和可靠性,下一步进行多中心验证是必要的。三是本研究ROI 由乳腺专业方向的医师在病灶最大实性层面进行手动勾画完成,仍存在一定的主观性且不能充分反映肿瘤异质性,在后续研究中我们将借助人工智能等技术进行更加客观、高效的ROI勾画,如自动获取病灶的3D-ROI 并提取直方图和纹理特征,以获取更加准确、全面的测量数据。
1.运用问题情境教学,落实了学生的主体地位。问题情境教学为学生搭建了一个自主学习的平台,让学生在各种教学情境中去探究并获取知识,获得情感体验和能力提升,规避了传统教学模式上的教师唱主角传授知识的课堂教学模式。
综上所述,相比较于单独使用DWI 序列,基于DWI、IVIM 及DKI 的多参数扩散加权成像对TIC-Ⅱ型乳腺病变的良恶性鉴别具有更好的诊断效能,其中D值及MK值为鉴别诊断的独立影响因素。
全体作者均声明无利益冲突。
[1] Ding YN,Chen XG,Zhang QJ,et al.Historical trends in breast Cancer among women in China from age-period-cohort modeling of the 1990-2015 breast Cancer mortality data[J]. BMC Public Health, 2020,20(1):1280.DOI:10.1186/s12889-020-09375-0.
[2] Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.DOI:10.3322/caac.21660.
[3] Lei SY, Zheng RS, Zhang SW, et al. Breast cancer incidence and mortality in women in China: temporal trends and projections to 2030[J]. Cancer Biol Med, 2021, 18(3): 900-909. DOI:10.20892/j.issn.2095-3941.2020.0523.
[4] Kuhl CK, Mielcareck P, Klaschik S, et al. Dynamic breast MR imaging: are signal intensity time course data useful for differential diagnosis of enhancing lesions?[J]. Radiology, 1999, 211(1): 101-110.DOI:10.1148/radiology.211.1.r99ap38101.
[5] Chen YD, Long LL, Peng P, et al. Diagnosis value of ADC values combination with MRI signs on breast lump lesions with the type of TIC Ⅱ[J]. J Pract Radiol, 2018, 34(3): 370-373, 377. DOI:10.3969/j.issn.1002-1671.2018.03.011.陈钇地,龙莉玲,彭鹏,等.ADC 值和乳腺MRI 征象对TIC Ⅱ型曲线肿块样病变的诊断价值[J].实用放射学杂志,2018,34(3):370-373,377.DOI:10.3969/j.issn.1002-1671.2018.03.011.
[6] Jiang L, Lu X, Hua B, et al. Intravoxel incoherent motion diffusion-weighted imaging versus dynamic contrast-enhanced magnetic resonance imaging: comparison of the diagnostic performance of perfusion-related parameters in breast[J]. J Comput Assist Tomogr, 2018,42(1):6-11.DOI:10.1097/RCT.0000000000000661.
[7] Li K, Machireddy A, Tudorica A, et al. Discrimination of malignant and benign breast lesions using quantitative multiparametric MRI: a preliminary study[J].Tomography,2020,6(2):148-159.DOI:10.18383/j.tom.2019.00028.
[8] Uslu H, Önal T,Tosun M, et al. Intravoxel incoherent motion magnetic resonance imaging for breast cancer: a comparison with molecular subtypes and histological grades[J]. Magn Reson Imaging, 2021, 78:35-41.DOI:10.1016/j.mri.2021.02.005.
[9] He MZ, Ruan HP, Ma MP, et al. Application of diffusion weighted imaging techniques for differentiating benign and malignant breast lesions[J/OL]. Front Oncol, 2021, 11 [2021-6-21]. https://www.frontiersin.org/articles/10.3389/fonc.2021.694634/full.DOI:10.3389/fonc.2021.694634.
[10] Leithner D,Wengert GJ, Helbich TH, et al. Clinical role of breast MRI now and going forward[J]. Clin Radiol, 2018, 73(8): 700-714. DOI:10.1016/j.crad.2017.10.021.
[11] Ma D, Lu F, Zou X, et al. Intravoxel incoherent motion diffusion-weighted imaging as an adjunct to dynamic contrast-enhanced MRI to improve accuracy of the differential diagnosis of benign and malignant breast lesions [J]. Magn Reson Imaging, 2017, 36: 175-179.DOI:10.1016/j.mri.2016.10.005.
[12] Yang YW, Hu CH, Zhu M, et al. The differential diagnosis value of MRI apparent diffusion coefficient value combined with dynamic contrast enhanced MRI time-intensity curve type for mass plasma cell mastitis and breast cancer[J]. Chin J Magn Reson Imaging, 2019,10(7):530-534.DOI:10.12015/issn.1674-8034.2019.07.010.杨义文,胡春洪,朱默,等.MRI 表观扩散系数联合动态增强TIC 类型对肿块型浆细胞性乳腺炎及乳腺癌的鉴别诊断价值[J].磁共振成像,2019,10(7):530-534.DOI:10.12015/issn.1674-8034.2019.07.010.
[13] Zhao R, Ma WJ, Tang J, et al. Heterogeneity of enhancement kinetics in dynamic contrast-enhanced MRI and implication of distant metastasis in invasive breast cancer[J/OL]. Clin Radiol, 2020, 75(12)[2021-7-30].https://www.clinicalradiologyonline.net/article/S0009-9260(20)30318-4/fulltext.
[14] Long N, Ran C, Sun J, et al. Correlation study between the magnetic resonance imaging features of breast cancer and expression of immune molecular subtypes[J]. Eur Rev Med Pharmacol Sci, 2020, 24(22):11518-11527.DOI:10.26355/eurrev_202011_23793.
[15] Thakran S, Gupta PK, Kabra V, et al. Characterization of breast lesion using T1-perfusion magnetic resonance imaging: qualitative vs.quantitative analysis[J]. Diagn Interv Imaging, 2018, 99(10): 633-642.DOI:10.1016/j.diii.2018.05.006.
[16] Mumin NA, Hamid M, Hamid SA, et al. MRI breast: current imaging trends, clinical applications, and future research directions[J/OL]. Curr Med Imaging, 2022 [2022-1-27]. https://www.eurekaselect.com/article/122604.DOI:10.2174/1573405618666220415130131
[17] Chou SS, Romanoff J, Lehman CD, et al. Preoperative breast MRI for newly diagnosed ductal carcinoma in situ: imaging features and performance in a multicenter setting (ECOG-ACRIN E4112 trial)[J/OL].Radiology, 2021, 301(1) [2021-11-08]. https://pubs.rsna.org/doi/abs/10.1148/radiol.2021204743.DOI:10.1148/radiol.2021219016.
[18] Yang XP, Dong MS, Li S, et al. Diffusion-weighted imaging or dynamic contrast-enhanced curve: a retrospective analysis of contrast-enhanced magnetic resonance imaging-based differential diagnoses of benign and malignant breast lesions[J]. Eur Radiol, 2020, 30(9): 4795-4805. DOI:10.1007/s00330-020-06883-w.
[19] Thompson JL, Wright GP. The role of breast MRI in newly diagnosed breast cancer: an evidence-based review[J]. Am J Surg, 2021, 221(3):525-528.DOI:10.1016/j.amjsurg.2020.12.018.
[20] Gilbert FJ, Hickman SE, Baxter GC, et al. Opportunities in cancer imaging: risk-adapted breast imaging in screening[J]. Clin Radiol,2021,76(10):763-773.DOI:10.1016/j.crad.2021.02.013.
[21] Tang W, Chen L, Jin Z, et al. The diagnostic dilemma with the plateau pattern of the time-intensity curve: can the relative apparent diffusion coefficient (rADC) optimise the ADC parameter for differentiating breast lesions?[J].Clin Radiol,2021,76(9):688-695.DOI:10.1016/j.crad.2021.04.015.
[22] Zhang Q,Peng YS,Liu W,et al.Radiomics based on multimodal MRI for the differential diagnosis of benign and malignant breast lesions[J]. J Magn Reson Imaging,2020,52(2):596-607.DOI:10.1002/jmri.27098.
[23] Ma WL, Mao JW, Wang T, et al. Distinguishing between benign and malignant breast lesions using diffusion weighted imaging and intravoxel incoherent motion: a systematic review and meta-analysis[J/OL]. Eur J Radiol, 2021, 141 [2021-6-3]. https://www.ejradiology.com/article/S0720-048X(21)00290-4/fulltext.DOI:10.1016/j.ejrad.2021.109809.
[24] Palm T, Wenkel E, Ohlmeyer S, et al. Diffusion kurtosis imaging does not improve differentiation performance of breast lesions in a short clinical protocol[J]. Magn Reson Imaging, 2019, 63: 205-216. DOI:10.1016/j.mri.2019.08.007.
[25] Liang JY, Zeng SH, Li ZP, et al. Intravoxel incoherent motion diffusion-weighted imaging for quantitative differentiation of breast tumors: a meta-analysis[J/OL]. Front Oncol, 2020 [2020-10-20]. https://www.frontiersin.org/articles/10.3389/fonc.2020.585486/full.DOI:10.3389/fonc.2020.585486.
[26] Lee YJ, Kim SH, Kang BJ, et al. Associations between angiogenic factors and intravoxel incoherent motion-derived parameters in diffusion-weighted magnetic resonance imaging of breast cancer[J/OL].Medicine, 2021, 100(41) [2021-10-15]. https://journals.lww.com/md-journal/Fulltext/2021/10150/Associations_between_angiogenic_factors_and.30.aspx.DOI:10.1097/MD.0000000000027495.
[27] Li ZP,Li XM,Peng C,et al.The diagnostic performance of diffusion kurtosis imaging in the characterization of breast tumors:a meta-analysis[J/OL].Front Oncol, 2020, 10 [2021-10-27]. https://www.frontiersin.org/articles/10.3389/fonc.2020.575272/full.DOI:10.3389/fonc.2020.575272.
[28] Ma Y, Shan D, Wei J, et al. Application of intravoxel incoherent motion diffusion-weighted imaging in differential diagnosis and molecular subtype analysis of breast cancer[J].Am J Transl Res,2021,13(4):3034-3043.
[29] Song GJ, Shi JH, Li Q, et al. Comparative study of three diffusion imaging techniques in differential diagnosis of benign and malignant breast lesions[J].J Clin Radiol,2019,38(6):1010-1014.DOI:10.13437/j.cnki.jcr.2019.06.016.宋赣军,史军华,李强,等.三种扩散成像技术在乳腺良恶性病变鉴别诊断中的对比研究[J]. 临床放射学杂志, 2019, 38(6): 1010-1014.DOI:10.13437/j.cnki.jcr.2019.06.016.
