动脉炎病毒PRRSV和EAV的Nsp4蛋白对mTANK蛋白的降解
2022-10-08洪锦璇李训良宋中宝
吴 磊, 袁 旭, 洪锦璇, 陈 叶, 李训良, 宋中宝
[1.福建农林大学动物科学学院(蜂学学院);2.闽台动物病原生物学福建省高校重点实验室,福建 福州 350002]
动脉炎病毒科属套式病毒目,含有5个成员,分别为马动脉炎病毒(equine infectious arteritis virus, EAV)、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)、猴出血热病毒(SHFV)、鼠乳酸脱氢酶增高病毒(LDV)和负鼠病病毒(WPDV)[1-2].其中,EAV和PRRSV是兽医学研究领域中非常重要的病原体,给世界的马产业和养猪业带来巨大的经济损失.动脉炎病毒感染可导致严重的临床症状,主要表现为动脉病变、水肿、严重的呼吸道症状或肺炎以及妊娠动物流产[3].种马对EAV极为易感,持续性感染的种马还可通过精液感染母马,引起妊娠母马流产;EAV感染马驹可引起致命性的支气管间质性肺炎或肺肠综合症[4].PRRSV感染主要引起母猪繁殖障碍、仔猪死亡以及各年龄段猪不同程度的呼吸症状[5].作为动脉炎病毒,EAV和PRRSV具有相似的生物学特性,如巨噬细胞嗜性和复制策略.两种病毒都可在宿主体内建立持续性感染,急性感染后,病毒通常不能被完全消除,并且会继续在淋巴组织(PRRSV)或生殖道(EAV)中低水平复制[3].其主要原因是病毒具有强大的免疫抑制能力.尽管病毒感染早期能够诱导机体产生抗体,但这些抗体并不具有中和作用,而具有保护作用的中和抗体往往产生得较晚[6].此外,EAV和PRRSV感染还可下调宿主的先天性免疫应答,从而引起机体的免疫抑制.
动脉炎病毒是有囊膜的单股正链RNA病毒,基因组大小为12~16 kb,包含10~12个开放性阅读框(open reading frames, ORFs)(ORF1a、ORF1b、ORF2a、ORF2b、ORF3~ORF7、ORF5a)[5].ORF1a和ORF1b位于基因组的5′端,负责编码两个大的多聚蛋白前体pp1a和pp1ab.这些多聚蛋白可被ORF1a编码的蛋白酶裂解成成熟的非结构蛋白(nonstructural proteins, Nsps).其中,动脉炎病毒ORF1a编码的Nsp4蛋白具有木瓜样3C蛋白酶活性,主要负责切割病毒的多聚蛋白前体形成成熟的非结构蛋白[7].PRRSV Nsp4蛋白的酶活性位点分别位于E39、E64、E118处,EAV Nsp4蛋白的酶活性位点分别位于E39、E65、E120处,任一位点的突变都将导致蛋白酶活性的丧失[4].动脉炎病毒Nsp4蛋白在加工多聚蛋白pp1a和pp1ab形成非结构蛋白指导病毒基因复制和亚基因组mRNA(sg-mRNA)的合成过程中发挥着必不可少的作用.
TRAF家族成员相关NF-κB激活因子(TRAF family member-associated NF-κB activator, TANK)又称I-TRAF,能够负调控TRAF2和TRAF6介导的NF-κB信号通路的激活[8-9].此外,也有研究指出TANK可与IKK-ε、TBK1互作调控I型干扰素信号通路[10].
本研究以PRRSV Nsp4蛋白为诱饵,利用质谱和免疫沉淀技术确定其宿主细胞中的靶蛋白,进一步揭示病毒与宿主之间的互作关系,对于阐明病毒的致病性与免疫具有重要意义.
1 材料与方法
1.1 材料
Marc-145细胞和高致病性PRRSV BB0907毒株由南京农业大学姜平教授馈赠;DH5α感受态细胞、pCAGGS-HA质粒和HEK293T细胞由本实验室保存.
2×Phenta Mix高保真酶、2×Taq Mix和反转录试剂盒购自南京诺唯赞公司;T4 DNA连接酶,限制性内切酶SacⅠ、KpnⅠ和XhoⅠ,Lipofectamine 3000转染试剂购自Thermo Fisher公司;胶回收试剂盒、质粒小提试剂盒和RNA提取试剂盒购自北京天根公司;Flag鼠单抗、HA鼠单抗和β-actin鼠单抗购自Proteintech公司;TANK兔多抗购自北京博奥森公司;MG-132、NH4Cl和Z-VAD-FMK购自上海碧云天公司;3-MA购自CST公司.
1.2 方法
1.2.1 RNA提取及反转录 收集Marc-145细胞和PRRSV毒株,按照RNA提取试剂盒说明书操作分别提取细胞和病毒的RNA,并测定浓度.按照反转录试剂盒说明书操作获得cDNA,置-20 ℃保存.
1.2.2 引物设计与合成 参照NCBI数据库中猴源TANK (monkey TANK, mTANK)基因的mRNA序列(序列号:XM_007965137.2)和BB0907 Nsp4的基因序列(序列号:HQ315835.1)分别设计引物及其突变体引物,送北京擎科公司合成.
1.2.3 PCR扩增与质粒构建 PCR反应体系50 μL:25 μL 2×Phenta Mix,上、下游引物各2 μL,20 μL ddH2O,1 μL 100 ng·μL-1模板.PCR反应程序:98 ℃预变性3 min,98 ℃变性30 s,60 ℃退火30 s,72 ℃延伸40 s,共35个循环.PCR产物经1%琼脂糖凝胶电泳,切下目的条带,用胶回收试剂盒回收.回收的目的基因和载体质粒pCAGGS经内切酶SacⅠ/KpnⅠ酶切后回收,利用T4连接酶于25 ℃连接30 min,并转化DH5α,于37 ℃摇床振荡培养1 h后涂布含氨苄抗性的LB固体培养基,于37 ℃温箱培养过夜.次日,挑取单菌落进行PCR鉴定,并将阳性菌扩大培养16 h,利用质粒提取试剂盒提取质粒,送上海生工公司测序鉴定.经序列比对发现,成功构建重组质粒pCAGGS-mTANK-HA、pCAGGS-GST-HA和pCAGGS-PRRSV-Nsp4-Flag.pCAGGS-EAV-Nsp4-Flag质粒由上海生工公司合成.
1.2.4 免疫沉淀 将pCAGGS-PRRSV-Nsp4-Flag质粒、pCAGGS-EAV-Nsp4-Flag质粒和空载体pCAGGS-HA分别与pCAGGS-mTANK-HA质粒共转染HEK293T细胞,转染24 h后收取细胞裂解液,于4 ℃、12 000×g离心10 min,取上清加入1 μg小鼠IgG和20 μL Protein A+G,于4 ℃缓慢摇晃4 h,去除非特异性吸附.于4 ℃、1 000×g离心5 min,取上清加入1 μg Flag单抗,于4 ℃缓慢摇晃12 h,加入40 μL蛋白A+G继续摇晃4 h,于4 ℃、1 000×g离心5 min,弃上清,用预冷的PBS洗涤3次,最后用100 μL PBS重悬沉淀.采用Western blot分析蛋白的互作情况.
1.2.5 Nsp4对mTANK表达影响的检测 将pCAGGS-PRRSV-Nsp4-Flag、pCAGGS-EAV-Nsp4-Flag质粒分别与pCAGGS-mTANK-HA、pCAGGS-GST-HA质粒共转染HEK293T细胞,转染24 h后收取细胞裂解液,用BCA试剂盒测定浓度后,采用Western blot分析Nsp4对mTANK表达的影响.
1.2.6 PRRSV感染对mTANK表达影响的检测 将Marc-145细胞接种于12孔细胞板中,待次日细胞长满单层,接种PRRSV BB0907毒株1.0 MOI,分别在病毒感染后12、24、36 h收取细胞裂解样品,采用Western blot分析PRRSV对mTANK表达的影响.
1.2.7 抑制剂处理对Nsp4降解mTANK的检测 将pCAGGS-PRRSV-Nsp4-Flag、pCAGGS-EAV-Nsp4-Flag质粒分别与pCAGGS-mTANK-HA质粒共转染HEK293T细胞,转染12 h后,分别用抑制剂MG-132(10 μmol·L-1)、NH4Cl(10 mmol·L-1)、Z-VAD-FMK(20 μmol·L-1)、3-MA(5 mmol·L-1)处理细胞12 h,收取细胞裂解样品,采用Western blot分析Nsp4对mTANK表达的影响.
2 结果与分析
2.1 PRRSV和EAV的Nsp4与mTANK的互作
将pCAGGS-PRRSV-Nsp4-Flag质粒和空载体分别转染Marc-145细胞,24 h后收取细胞样进行免疫沉淀,采用Western blot检测沉淀物,并将沉淀物送上海欧易公司进行质谱分析.图1A显示,免疫沉淀物中各蛋白正常表达.质谱分析结果如表1所示,本研究选择了评分最高的TANK蛋白进行深入研究.为了验证质谱的结果,将pCAGGS-PRRSV-Nsp4-Flag与pCAGGS-mTANK-HA质粒共转染HEK293T细胞,利用免疫沉淀验证两者的互作关系.结果(图1B)显示,mTANK可以被PRRSV Nsp4沉淀.为了研究EAV Nsp4是否也可沉淀mTANK,将pCAGGS-EAV-Nsp4-Flag与pCAGGS-mTANK-HA质粒共转染HEK293T细胞.结果(图1C)显示,EAV Nsp4成功下拉mTANK.以上结果证明,PRRSV和EAV的Nsp4可与宿主蛋白mTANK互作.
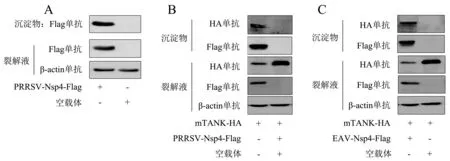
A:将pCAGGS-PRRSV-Nsp4-Flag质粒和空载体分别转染Marc-145细胞,使用Flag单抗做免疫沉淀,采用Western blot检测蛋白表达水平;将pCAGGS-mTANK-HA质粒分别与pCAGGS-PRRSV-Nsp4-Flag(B)、pCAGGS-EAV-Nsp4-Flag(C)质粒共转染HEK293T细胞,使用Flag单抗做免疫沉淀,采用Western blot检测蛋白表达水平(+表示转染该质粒,-表示没有转染该质粒).

表1 免疫沉淀样品质谱分析结果
2.2 PRRSV和EAV的Nsp4对mTANK的降解
前期研究表明,Nsp4-Flag与mTANK-HA质粒共转染HEK293T细胞时,mTANK蛋白的表达量总是少于对照组(图1),推测Nsp4可能具有抑制mTANK表达的作用.为了验证这个猜想,将pCAGGS-PRRSV-Nsp4-Flag质粒、pCAGGS-EAV-Nsp4-Flag质粒、空载体pCAGGS-HA分别与pCAGGS-mTANK-HA、pCAGGS-GST-HA质粒共转染HEK293T细胞,采用Western blot检测每个蛋白的表达水平.结果显示:PRRSV Nsp4对mTANK具有降解作用且呈剂量依赖关系,但对GST蛋白并没有作用(图2A、2B);同样地,EAV Nsp4也具有相同的作用(图2C、2D).此外,在病毒水平上检测PRRSV感染后不同时间点mTANK的表达情况,结果(图2E)显示,PRRSV感染可降低mTANK的表达.
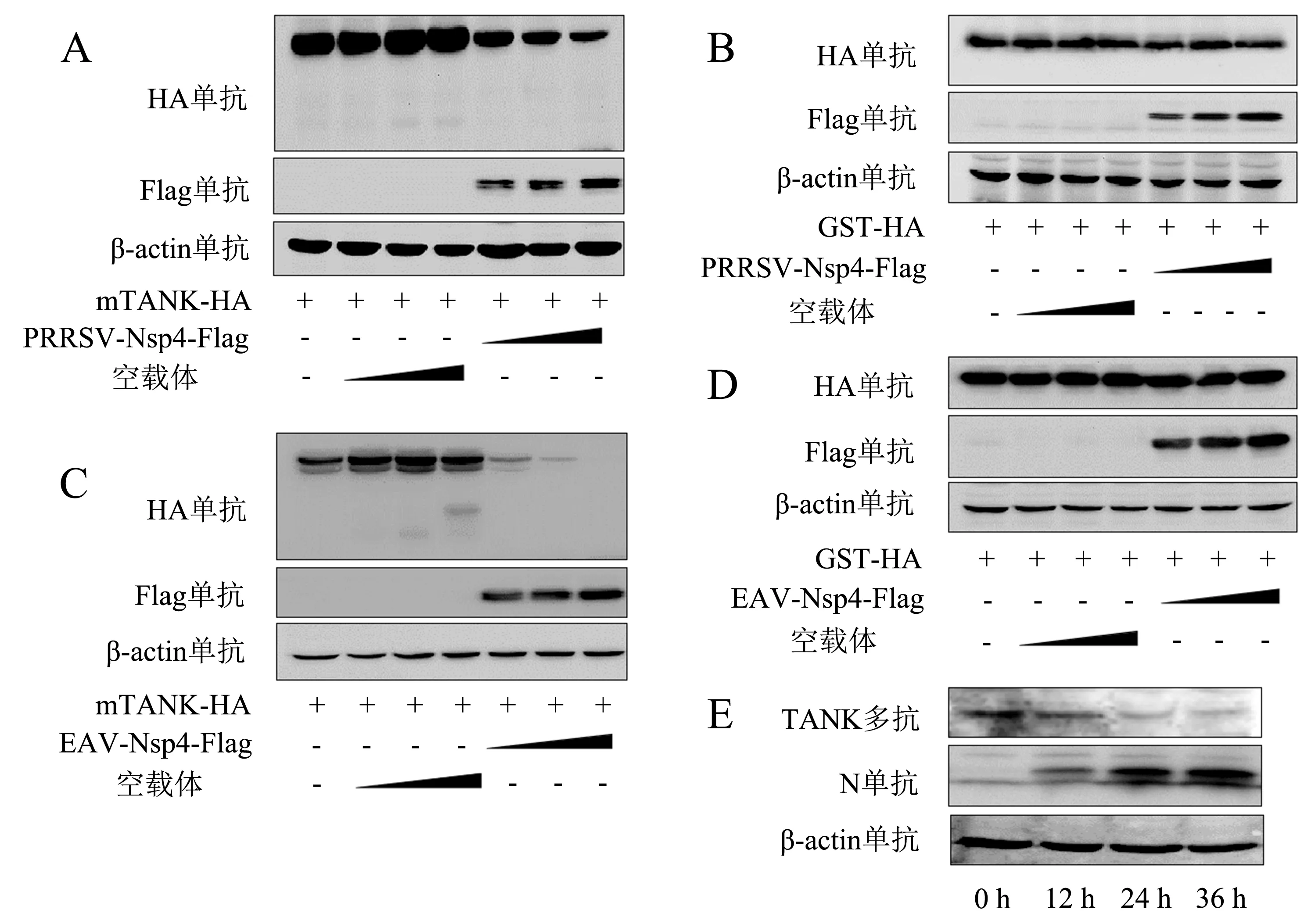
将pCAGGS-PRRSV-Nsp4-Flag质粒以不同剂量分别与pCAGGS-mTANK-HA(A)、pCAGGS-GST-HA(B)质粒共转染HEK293T细胞,转染24 h后收取细胞样本检测蛋白表达水平;将pCAGGS-EAV-Nsp4-Flag质粒以不同剂量分别与pCAGGS-mTANK-HA(C)、pCAGGS-GST-HA(D)质粒共转染HEK293T细胞,转染24 h后收取细胞样本检测蛋白表达水平;E:用PRRSV毒株1.0 MOI感染Marc-145细胞,分别在感染后的12、24、36 h检测mTANK表达水平(+表示转染该质粒,-表示没有转染该质粒).
2.3 PRRSV和EAV的Nsp4依赖酶活性对mTANK的降解
为了研究Nsp4降解mTANK的途径,用蛋白酶体抑制剂MG-132、凋亡途径抑制剂Z-VAD-FMK、溶酶体抑制剂NH4Cl和自噬抑制剂3-MA分别处理共转染的HEK293T细胞,采用Western blot检测mTANK蛋白的表达水平.结果(图3A、3B)显示,4种抑制剂处理都不影响Nsp4对mTANK的降解作用,说明Nsp4降解mTANK与泛素蛋白酶体途径、凋亡途径、自噬溶酶体途径无关.
动脉炎病毒Nsp4具有3C样蛋白酶活性,为了验证Nsp4降解mTANK是否与酶活性有关,采用点突变试剂盒分别构建了PRRSV Nsp4蛋白E39A、E64A、E118A和EAV Nsp4蛋白E39A、E65A、E120A的突变体质粒[4].将野生型质粒pCAGGS-PRRSV-Nsp4-Flag、pCAGGS-EAV-Nsp4-Flag及突变体质粒分别与pCAGGS-mTANK-HA质粒共转染HEK293T细胞,结果(图3C、3D)表明,PRRSV和EAV Nsp4蛋白的酶活性丧失后无法降解mTANK,说明Nsp4降解mTANK依赖于3C样蛋白酶活性.
尽管PRRSV和EAV的Nsp4可以降解mTANK,但未发现mTANK被降解产生的片段,猜测Nsp4降解mTANK的靶点位于C端,随后将HA标签放在mTANK蛋白的N端构建了pCAGGS-HA-mTANK质粒.将pCAGGS-PRRSV-Nsp4-Flag和pCAGGS-EAV-Nsp4-Flag质粒分别以不同剂量与pCAGGS-HA-mTANK质粒共转染HEK293T细胞,结果(图3E、3F)显示,EAV Nsp4降解mTANK后在30和25 ku附近出现两条清晰的条带,PRRSV Nsp4降解mTANK后在30 ku附近有一条清晰的条带.
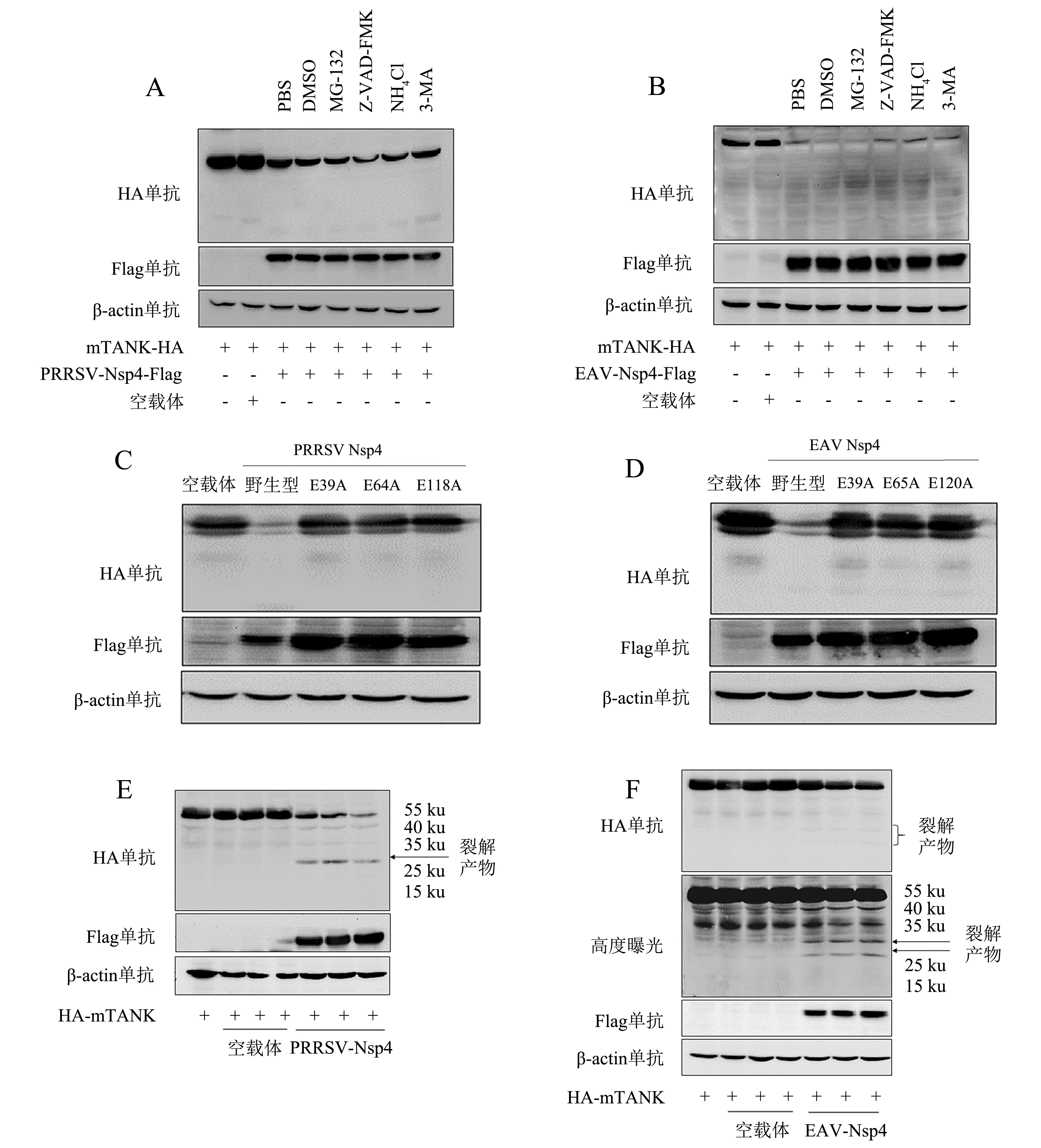
将pCAGGS-PRRSV-Nsp4-Flag(A)、pCAGGS-EAV-Nsp4-Flag(B)质粒分别与pCAGGS-mTANK-HA质粒共转染HEK293T细胞,转染12 h后分别使用抑制剂MG-132、NH4Cl、Z-VAD-FMK、3-MA处理细胞12 h,收取细胞样品采用Western blot检测蛋白表达水平;将pCAGGS-EAV-Nsp4-Flag(C)、pCAGGS-PRRSV-Nsp4-Flag(D)及其突变体质粒分别与pCAGGS-mTANK-HA质粒共转染HEK293T细胞,转染24 h后采用Western blot检测蛋白表达水平;将pCAGGS-EAV-Nsp4-Flag(E)、pCAGGS-PRRSV-Nsp4-Flag(F)质粒分别与pCAGGS-HA-mTANK质粒共转染HEK293T细胞,转染24 h后采用Western blot检测蛋白表达水平(+表示转染该质粒,-表示没有转染该质粒).
3 讨论
动脉炎病毒PRRSV和EAV是养猪业和马产业中重要的病原体,给世界的养殖业造成了巨大的经济损失,目前尚无有效的疫苗用于这些动脉炎病毒的防控.动脉炎病毒非结构蛋白Nsp4含有两个胰凝乳蛋白酶样结构域,分别为C端α/β结构域和小的保守结构域,具有3C样丝氨酸蛋白酶活性,在加工多聚蛋白pp1a和pp1ab、释放非结构蛋白、指导基因组复制及亚基因组mRNA(sg-mRNA)合成过程中发挥了重要的作用[7,11-12].
研究表明:动脉炎病毒PRRSV和EAV具有强大的免疫逃逸策略,其中,Nsp4是病毒发生免疫抑制的最重要蛋白之一[4,13];PRRSV Nsp4可通过其酶活性切割NF-κB激活必需分子NEMO和MAVS,下调IFN-β的水平[14-15];PRRSV Nsp4可切割STAT2蛋白上的E719,阻断JAK-STAT信号通路的信号传递[16];同样地,EAV Nsp4也可靶向NEMO的4个氨基酸位点(E166、 E171、Q205、E349)降解NEMO,从而抑制宿主的I型IFN反应[4];此外,Nsp4还可靶向ISGs阻断抗病毒作用,PRRSV Nsp4可作用于干扰素诱导蛋白DCP1a的第238位谷氨酸位点,通过3C样蛋白酶活性切割DCP1a,降低DCP1a的抗病毒活性[17].本课题组前期研究表明,干扰素诱导ZAP蛋白抑制PRRSV的复制,然而,病毒利用Nsp4降解ZAP蛋白可致弱宿主产生抗病毒反应[18-19].除此之外,有研究指出,脑心肌炎病毒(EMCV)的3C蛋白可依赖其3C样蛋白酶活性切割TANK蛋白以调控宿主的NF-κB信号通路[20].而Qian et al[21]指出,塞内卡病毒(SVV)的3C蛋白也可通过其蛋白酶活性切割宿主的TANK蛋白以调控干扰素的表达.综上说明,3C样蛋白酶活性在病毒调控宿主先天性免疫过程中发挥了十分重要的作用.
本研究采用表达PRRSV Nsp4的质粒转染Marc-145细胞,通过免疫沉淀技术下拉宿主蛋白,并结合质谱分析发现PRRSV Nsp4可与宿主蛋白mTANK互作,且同为动脉炎病毒科的EAV的Nsp4也可与mTANK互作.表达PRRSV和EAV的Nps4的质粒和mTANK-HA质粒共转染HEK293T细胞时,mTANK蛋白的表达水平显著降低,且Nps4并不影响GST蛋白的表达.本研究还检测了PRRSV感染Marc-145细胞后不同时间点mTANK的表达量,发现PRRSV感染可降解mTANK.为了研究Nsp4降解mTANK的机制,本研究利用蛋白酶体抑制剂MG-132、凋亡途径抑制剂Z-VAD-FMK、溶酶体抑制剂NH4Cl和自噬抑制剂3-MA分别处理共转染的HEK293T细胞,发现这些抑制剂处理并不影响Nsp4对mTANK的降解.为探究Nsp4降解mTANK是否依赖于3C样蛋白酶活性,本研究检测了酶活性缺失的Nsp4对mTANK表达的影响,发现Nsp4无法降解mTANK,说明Nsp4对mTANK的降解作用依赖于3C样蛋白酶活性.然而,本研究没有检测到mTANK被降解产生的条带,因而猜测Nsp4的作用靶点靠近C端,降解产生的条带太小以至于无法检测到,因此构建了N端标签的pCAGGS-HA-mTANK质粒.当pCAGGS-PRRSV-Nsp4-Flag、pCAGGS-EAV-Nsp4-Flag质粒分别与pCAGGS-HA-mTANK质粒共转染HEK293T细胞时,mTANK被切割产生了明显的条带,分别位于30和25~30 ku附近.PRRSV和EAV的Nsp4的3C样蛋白酶活性可特异性识别底物P1位的谷氨酸 (E)及P1′位的丙氨酸(A)、甘氨酸 (G)或丝氨酸(S),并在E位点切割从而降解底物蛋白.此外,EAV Nsp4还可识别底物P1位的谷氨酰胺(Q)从而切割底物蛋白.本研究结果尚未解析Nsp4降解TANK的氨基酸位点,后续有待进一步探究.
综上,本研究通过免疫沉淀和质谱技术成功鉴定了动脉炎病毒PRRSV和EAV的Nsp4的互作蛋白,并发现Nsp4以3C样蛋白酶活性依赖方式降解mTANK,进一步丰富了动脉炎病毒与宿主之间互作的分子机制.
