≥75岁急性缺血性脑卒中患者肾小球滤过率估算值对1年死亡的影响研究
2022-10-08张瑜瑜刘仲仲蔺雪梅吴松笛
张瑜瑜,刘仲仲,张 娜,蔺雪梅,王 芳,吴松笛
(陕西省西安市第一医院,西北大学附属第一医院神经内科,陕西 西安 710002)
全球疾病负担研究显示,脑卒中仅次于缺血性心脏病,是导致患者死亡和残疾的一个重要原因[1]。我国属于人口大国,随着社会人口老龄化加重,老年人已成为脑卒中的高危人群,已受到学界的广泛关注[2]。查阅文献发现,尽管已有相关研究关注老年脑卒中患者,但高龄,尤其是年龄≥75岁的急性缺血性脑卒中(acute ischemic stroke, AIS)的预后及其相关危险因素还较少有研究报道。估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)作为评估肾脏功能较好指标被多数研究用于分析肾功能损伤与相关疾病及其预后的关系[3-4]。研究显示,肾脏功能损伤与心脑血管疾病及其不良结局独立相关[5-7],然而,目前国内≥75岁AIS患者eGFR与脑卒中后发生1年死亡的相关研究较少。基于此,本研究利用西安脑卒中数据库登记研究平台,探讨西安地区≥75岁AIS患者eGFR水平与1年死亡的关系。报告如下。
1 资料与方法
1.1一般资料 前瞻性连续收集2015年1—12月于陕西省西安市4所市级三甲医院神经内科住院治疗的年龄≥75岁的AIS患者506例,平均年龄(79.7±4.2)岁,其中男性265例(52.4%),女性241例(47.6%)。纳入标准:①临床诊断为AIS(包括脑梗死和短暂性脑缺血发作),符合世界卫生组织诊断标准,并经头颅CT或MRI证实;②年龄≥75岁;③同意参与本研究并签署知情同意书。排除标准:①合并导致神经功能病变的非脑血管病,如原发脑肿瘤、脑转移瘤、硬膜下出血、颅脑外伤等;②非AIS患者(包括脑出血、蛛网膜下腔出血);③发病至入组时间≤7 d;④拒绝参与本研究及失访者。
本研究经医院伦理委员会审核通过,伦理批准号[2014伦审(5)]。
1.2方法 从3 117例急性脑卒中患者中,排除非AIS患者416例,年龄<75岁的患者1 426例、发病前改良Rankin量表(modified Rankin scale,mRS)评分>2分72例,无eGFR值14例,1年失访53例,最终纳入年龄≥75岁的AIS患者506例。将纳入的患者按照eGFR水平从低到高的水平排序后进行四分位分组(Q1组~Q4组),Q1组127例,Q2组126例,Q3组126例,Q4组127例。各组分界范围分别为:Q1≤60.2 mL·min-1·(1.73 m2)-1,Q2 60.3~70.7 mL·min-1·(1.73 m2)-1,Q3 70.8~78.1 mL·min-1·(1.73 m2)-1,Q4≥78.2 mL·min-1·(1.73 m2)-1。eGFR是根据慢性肾脏病流行病学协作肌酐方程来计算[8]。采用改良mRS评分量表评估发病前的致残情况;采用美国国立卫生研究院脑卒中量表(national institutes of health stroke scale,NIHSS)评估神经功能损伤程度。吸烟定义为:发病前至少吸烟1支/d,且连续或累计6个月以上;戒烟是指曾经达到吸烟的定义标准,但已经连续6个月不吸烟;饮酒定义为发病前50 mL/周左右白酒的标准饮酒量。其他相关定义与中国人颅内动脉粥样硬化研究相同[9]。死亡定义为全因死亡,是指因AIS住院后发生的全部死亡事件。从患者入院确诊起,分别在3个月和1年时通过电话问询患者本人或者家属的方式对入组患者的生存状态进行随访,各个时间段的随访误差为7 d。终点事件为研究对象在随访期间发生死亡。对于连续3 d,每天3次打电话仍不能联系或者半途拒绝继续接受随访的患者视为失访。
1.3数据收集 收集所有患者入院24 h内的相关临床信息,包括基线人口学特征和相关资料(性别、年龄、吸烟、饮酒、体重指数、入院收缩压、入院舒张压和心率)、既往病史(既往卒中)、合并症(合并肺炎、糖尿病、高血压以及心房颤动)、神经功能相关评估(入院NIHSS评分),次日的实验室相关检查(总胆固醇、三酰甘油、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、空腹血糖、丙氨酸转氨酶、天冬氨酸转氨酶、碱性磷酸酶、同型半胱氨酸、尿素氮、尿酸、白细胞计数)。随访时分别收集3个月和1年时的生存状态。
1.4统计学方法 应用风锐统计(版本v1.3)与R软件(版本3.3.2)分析数据。计量资料比较采用单因素方差分析和SNK-q检验、秩和检验,计数资料比较采用χ2检验或Fisher确切概率法。Kaplan-Meier生存分析法进行1年随访的生存分析。多因素Cox回归分析年龄≥75岁AIS患者eGFR水平与1年死亡的关系。校正变量的筛选根据该变量对效应值HR的影响是否超过10%以及其临床意义来确定。P<0.05为差异有统计学意义。
2 结 果
2.1不同eGFR水平组患者临床特征比较 与其他组相比,Q1和Q2组男性比例较高、平均年龄较高;与其他组相比,Q4组从不吸烟占比较高,Q1组仍在吸烟患者占比较高;与其他组相比,Q1组中合并肺炎比例、糖尿病比例以及尿素氮、尿酸、白细胞计数水平均较高,Q4组中总胆固醇较高,差异有统计学意义(P<0.05)。各组饮酒、既往脑卒中史、入院NIHSS评分、高血压、心房颤动、三酰甘油、高密度脂蛋白、低密度脂蛋白、空腹血糖、丙氨酸转氨酶、天冬氨酸转氨酶、碱性磷酸酶、同型半胱氨酸、体重指数、入院收缩压、入院舒张压、心率比较差异无统计学意义(P>0.05),见表1。
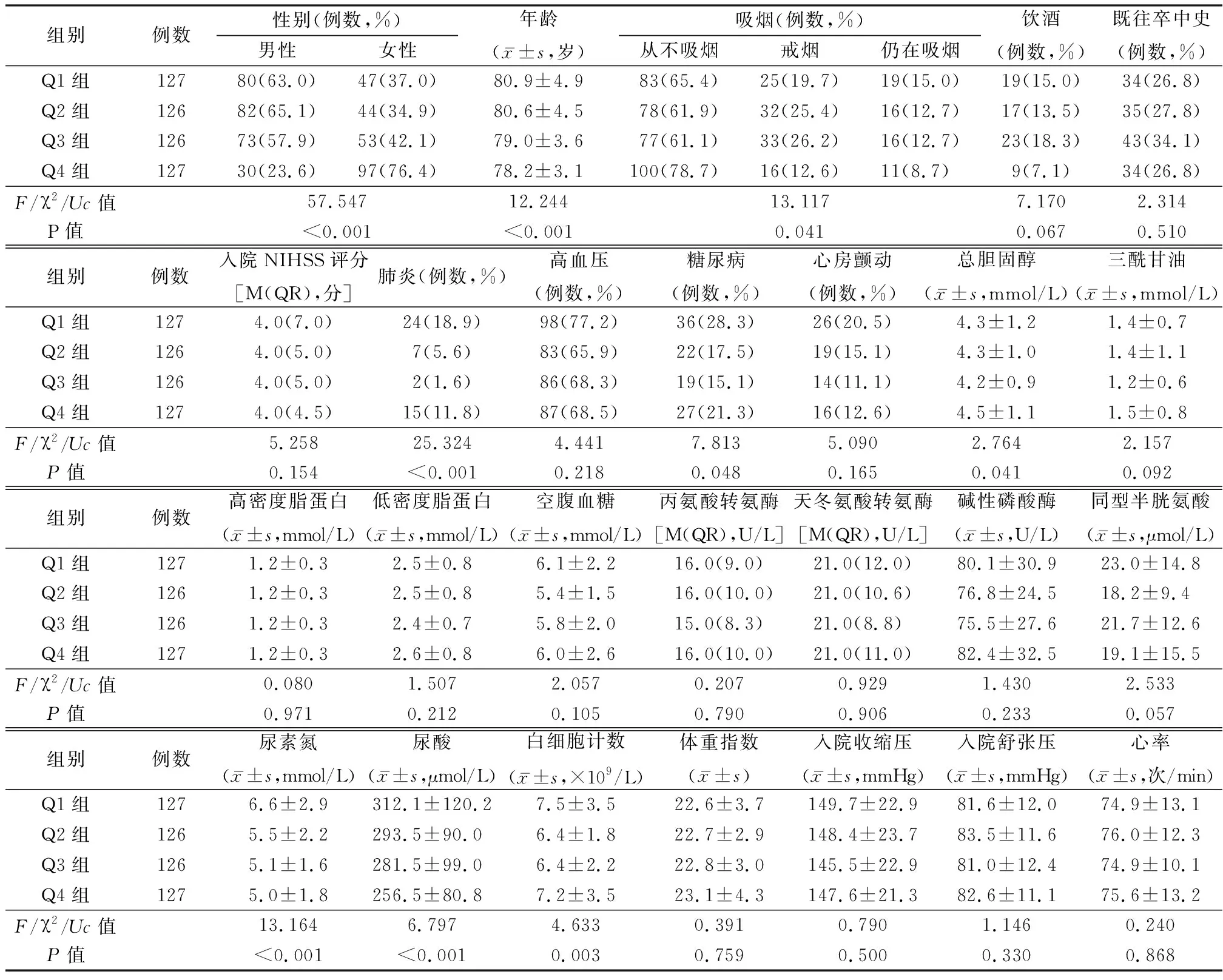
表1 不同eGFR水平AIS患者临床特征比较Table 1 Comparison of clinical characteristics of AIS patients with different eGFR levels
2.2不同eGFR水平患者3个月和1年病死率比较 3个月随访时死亡38例(7.5%),Q1组3个月病死率明显高于其他3组,差异有统计学意义(P<0.05)。1年随访结束时共死亡76例(15.0%),Q1组病死率明显高于其他3组,差异有统计学意义(P<0.05)。见表2。
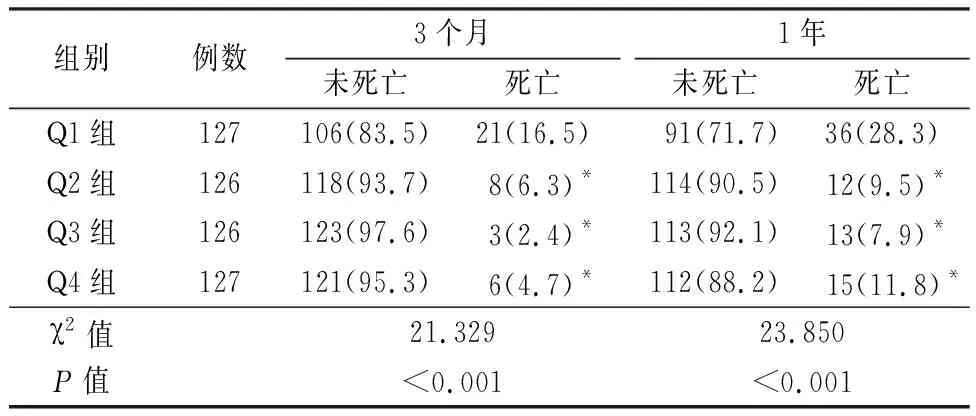
表2 不同eGFR水平患者3个月和1年病死率比较Table 2 Comparison of 3-month and 1-year mortality among patients with different eGFR levels (例数,%)
2.3≥75岁AIS患者eGFR与死亡的Cox回归分析 以生存状态(死亡=1,存活=0)为因变量,以eGFR(连续性变量)为自变量,校正相关混杂因素后,进行多因素Cox回归分析,结果显示,eGFR水平每升高5 mL·min-1·(1.73 m2)-1,≥75岁AIS患者的3个月死亡风险降低14.7%(HR=0.853,95%CI:0.766~0.949,P=0.004),1年死亡风险降低12.3%(HR=0.877,95%CI:0.823~0.935,P<0.001)。将eGFR按照四分位分组后,以Q4作为参照,校正相关混杂因素后,多因素Cox回归分析发现,与Q4组相比,eGFR处于Q1组患者的3个月死亡风险升高1.890倍(HR=2.890,95%CI:1.010~8.241,P=0.048);eGFR处于Q1组患者的1年死亡风险升高1.267倍(HR=2.267,95%CI:1.118~4.596,P=0.023)。与Q4组相比,Q2和Q3组3个月和1年的死亡风险差异无统计学意义(P均>0.05)。趋势检验结果显示,Q4组到Q1组的3个月和1年死亡趋势差异有统计学意义(P=0.017,P=0.013)。进一步通过Kaplan-Meier生存分析发现,与其他组相比,Q1组3个月和1年时生存率均明显下降趋势,差异有统计学意义(P<0.05)。见表3,图1。

表3 Cox回归分析Table 3 Cox regression analysis
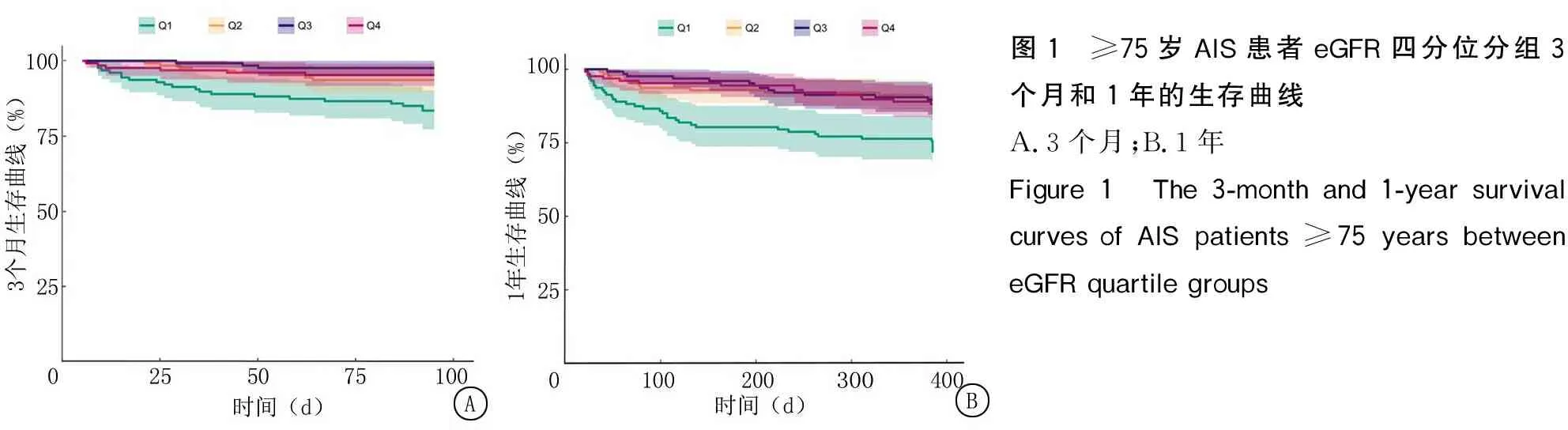
图1 ≥75岁AIS患者eGFR四分位分组3个月和1年的生存曲线A.3个月;B.1年Figure 1 The 3-month and 1-year survival curves of AIS patients ≥75 years between eGFR quartile groups
3 讨 论
研究显示,慢性肾脏功能损伤与心脑血管疾病的发生及不良结局密切相关[10],约38%的急性脑卒中患者合并慢性肾脏疾病。虽然既往已有研究显示,eGFR水平与中老年急性脑卒中的发生和发展相关[11]。但关于高龄AIS患者的探究较少,本研究在既往研究的基础上,通过西安脑卒中数据库平台,对≥75岁AIS患者eGFR水平与死亡的关系进行了分析。
本研究将eGFR按照四分位数分组(Q1组~Q4组),比较不同eGFR水平1年死亡的情况结果显示,与其他3组比较,Q1组3个月病死率和1年病死率均较高,差异有统计学意义(P<0.05)。Eun等[12]研究发现,AIS患者eGFR<30 mL·min-1·(1.73 m2)-1的住院期间病死率较eGFR≥90 mL·min-1·(1.73 m2)-1明显较高。Li等[13]研究发现,eGFR最低分位数<45 mL·min-1·(1.73 m2)-1较最高分位数≥90 mL·min-1·(1.73 m2)-1的院内病死率明显较高,可能由于不同的研究设计、纳入患者的年龄结构以及脑卒中类型不同,本研究纳入年龄≥75岁的高龄AIS患者,eGFR水平在Q1组的3个月和1年病死率约为其他组的3~4倍,和既往研究提示低水平的eGFR可显著增加AIS患者1年死亡风险的结果一致,可能由于年龄差异,使得最适eGFR的范围存在差异,这也提示后续的研究应继续探索不同年龄范围eGFR可能存在的最适范围和阈值效应,即eGFR水平在哪一范围时1年死亡风险最低。
为了进一步探讨年龄≥75岁AIS患者eGFR水平与1年死亡的独立作用关系,本研究通过校正性别、年龄及其他相关混杂因素后,将eGFR按照连续性变量进行多因素Cox回归分析发现,eGFR每升高 5 mL·min-1·(1.73 m2)-1,年龄≥75岁AIS患者的3个月和1年死亡风险分别降低14.7%和12.3%;与同样按照连续性变量处理的既往研究发现低水平eGFR与心脑血管事件的死亡风险相关的结果相似[14-15]。eGFG水平偏低预示患者可能伴发肾功能损伤,提示年龄≥75岁AIS患者若合并肾功能疾病,更易发生1年死亡。本研究进一步将eGFR按照四分位数分为四组(Q1组~Q4组),以Q4组作为参照进行相关混杂因素校正后的多因素Cox回归分析发现,与Q4组相比,eGFR处于Q1组患者的3个月死亡风险升高1.89倍,1年死亡风险升高约1.3倍。与Q4组相比,eGFR水平处于Q2和Q3组时,3个月和1年死亡风险差异无统计学意义(P>0.05)。与既往研究发现eGFR最低分位数的急性脑卒中患者死亡风险明显高于最高分位数的结果相似[16-17]。本研究结果显示,年龄≥75岁的AIS患者eGFR水平处于Q1组[eGFR≤60.2 mL·min-1·(1.73 m2)-1]较其他组更易发生3个月和1年死亡。本研究进一步通过Kaplan-Meier生存分析,比较不同水平eGFR随着时间的累计死亡情况,结果发现,年龄≥75岁AIS患者eGFR水平处于Q1组的3个月和1年生存率均较其他组明显降低。这一结果提示不同组AIS患者1年死亡风险的差异,年龄≥75岁的AIS患者eGFR水平与1年死亡风险存在阈值效应,临床上对于高龄患者eGFR的最适范围应在60.2 mL·min-1·(1.73 m2)-1以上水平。临床医生应该关注此类患者eGFR水平,早期给予干预和治疗,将eGFR水平控制在适宜的范围,有助于降低因合并肾功能不全导致患者发生1年死亡。
关于eGFR与年龄≥75岁AIS患者死亡的潜在机制尚不完全清楚。第一,eGFR水平与颈动脉粥样硬化性狭窄有关,低eGFR水平患者颈动脉粥样硬化性狭窄程度较重,且导致的病死率较高[16]。第二,低eGFR可能与非传统的血管危险因素,如氧化应激、进红细胞生成素分泌减少,引发血小板功能障碍,从而更易导致血栓形成,使得远端循环灌注不足,造成严重的血管病变,也可能导致由代谢应激和组织缺氧引起的继发性脑损伤,促进血肿生长和血肿周围水肿,最终加重出血性中风的结局[18]。此外,与其他组相比,eGFR水平处于Q1组的年龄≥75岁的AIS患者发生3个月和1年病死率明显较高,这可能与该组患者的临床特征有关,包括:①男性比例较高,年龄偏高,提示年龄偏高的男性患者更需要关注eGFR的水平;②目前仍吸烟率较高,合并肺炎和糖尿病占比较高,提示低eGFR可能与高龄患者戒烟和合并症有关,临床医师需要关注;③总胆固醇、尿素氮、尿酸、白细胞计数水平均较高,提示高龄AIS患者eGFR偏低可能与患者的血脂、血糖代谢异常以及炎症反应等因素有关,也为后续继续深入探索eGFR与高龄脑卒中发生死亡的潜在机制提供新的方向。
综上所述,低水平eGFR是年龄≥75岁AIS患者患者1年死亡的危险因素;当eGFR≤60.2 mL·min-1·(1.73 m2)-1时,3个月和1年死亡风险均显著升高。临床医生应关注中年龄≥75岁AIS患者eGFR水平,早期干预和治疗,有助于降低因合并肾功能疾病导致的病死率。本研究也存在一定的局限性。首先,本研究纳入的患者均来自西安市区并不能代表社区及乡镇该类患者的情况。第二,本次研究未纳入相关药物治疗的影响,还需在后期的研究中尽可能的收集相关信息并进行深入分析。
