陕西圈养林麝遗传多样性评估及核心种质构建1)
2022-10-08曹新芳郑雪莉王洪永蒋本模卜书海
曹新芳 郑雪莉王洪永 蒋本模卜书海
(西北农林科技大学,陕西·杨凌,712100)(凤县逢春济民养殖有限公司)(西北农林科技大学)
林麝(Moschusberezovskii)是我国一级保护动物和东亚特产经济动物,以雄麝香囊腺所产的分泌物——麝香而闻名。20世纪60年代,非法偷猎和栖息地丧失导致麝资源急剧下降,野生麝数量减少到历史的3%~5%[1]。为保护麝资源和实现麝香的可持续利用,我国开始提倡人工养麝,但该种群数量增长缓慢,长期处于饲养规模较小的境况[2]。近十几年来,随着活体取香、疾病防治和饲养管理等技术的深入研究,以及医药企业和个体养殖户的加入,麝养殖种群得到快速增长[3]。目前,我国林麝养殖数量约3万只,其中陕西省占70%以上[4-5]。尽管如此,天然麝香产量仍不能满足市场需求,扩大林麝养殖规模依然迫切。
我国林麝养殖奠基种群数量小,种源调配缺乏管理,个体间随机交配造成该种群存在近亲繁殖趋势[3,6],显著影响了幼体的存活率,导致种群某些等位基因频率下降甚至消失[7]。遗传多样性是防止种群退化、保持种群持续增长潜力的关键因素[8];分子标记辅助育种能够有效抑制近交衰退,快速建立优异种群[9]。因此,评估圈养群体遗传多样性,进一步筛选优良种质,对抑制种群遗传退化、利用和保护优异种质资源起支撑作用。
微卫星标记是目前动物遗传育种中应用最多的一种分子标记方法,在家畜、鱼类和鹿科动物中均得到了广泛应用[10],但多集中在遗传多样性评估、亲缘关系鉴定等,在优异种质筛选方面的研究较少。牛丽莉[11]初步提出了微卫星标记构建畜禽核心种质的方法;鲁翠云等[9]利用微卫星分子标记对镜鲤群体进行选育。本研究拟利用12对高度多态性的微卫星引物对陕西圈养林麝的遗传多样性进行评估,根据等位基因最大化留样原则,运用逐步聚类法构建核心种质,旨在为现有林麝资源保护、繁育管理以及优质麝香资源利用提供优异的种质资源。
1 材料与方法
1.1 试验材料
成年雄麝的毛发样本分别采自陕西省镇坪逢春养殖场(52份)、凤县养殖场(102份)和凤县麻省沟农户(12份),种源分别起源于巴山和秦岭山脉;由于母麝处于孕期,为避免应激反应和配合麝场管理要求,仅在凤县养殖场采集了64份样品。采集带有毛囊的毛发样品,装进紫外灭菌的自封袋冰盒保存,带回实验室置于冰箱中-80 ℃保存备用。
1.2 微卫星分子标记
采用PCR仪法提取林麝基因组DNA[12],PCR体系包含100 μL Hair Buffer Stock和1 μL蛋白酶K(20 mg/mL);反应程序为58 ℃ 30 min,75 ℃ 15 min,4 ℃ 5 min。采用质量分数为1%琼脂糖凝胶电泳检测基因组DNA的完整性。
选用12对具有高度多态性的微卫星引物(见表1),其中11对由本实验室通过Rad-seq和近缘物种扩增所开发,另1对(Mb40)来自Zhao et al.[13]的研究,所有引物由北京擎科生物公司合成。PCR-SSR扩增体系20 μL:Taq酶10 μL,上下游引物各0.5 μL,模板DNA 1 μL,ddH2O 8 μL。扩增程序:94 ℃预变性4 min;94 ℃变性30 s,退火30 s,72 ℃延伸40 s,循环30次;72 ℃延伸10 min。6%非变性聚丙烯酰胺凝胶分离扩增产物,110 V电压下电泳60 min,1%硝酸银染色,显色、洗净后拍照统计条带。

表1 12对微卫星引物信息
1.3 数据分析
Gel-Pro analyzer分析电泳条带的相对分子质量,同一位点上扩增出的条带从小到大依次按A到Z标记。应用PopGene1.32计算遗传多样性参数,包括等位基因数(Na)、有效等位基因数(Ne)、Shannon’s信息指数(I)、观测杂合度(Ho)、期望杂合度(He)、近交系数(Fis);PIC-CALC计算多态信息含量(PIC)。在Excel中将电泳图谱数据整理为[0,1]矩阵(0代表无带,1代表有带),利用NTsys2.1软件中的SM相似系数计算遗传相似系数;运用MEGAX软件通过UPGMA法绘制聚类图,并在工具栏对图片进行简单美化。
1.4 核心种质的构建与评价
根据等位基因数最大化法则留样,通过逐步聚类法进行核心种质筛选。从聚类分析图最低水平的分支中选择等位基因数目最多的个体,若两个个体等位基因数相同,则随机选取,若只有一个个体直接进入下轮筛选。PopGene1.32计算筛选种质的遗传多样性参数,并利用SPSS21软件对核心种质和原始种质的Na、I、H和He共4个遗传参数及进行t检验;GenAlEx 6.503软件对原始和核心种质进行PCA分析,确认筛选的核心种质。
2 结果与分析
2.1 林麝群体遗传多样性
由表2可知,12对SSR引物对230份林麝样本共扩增出145个等位基因(Na),平均每个位点12.083 3个,各位点的有效等位基因数(Ne)范围为4.573 1(MaI02)~8.995 8(Mb40);Shannon’s信息指数(I)范围为1.744 4(MaI02)~2.379 7(Mb40);观测杂合度(Ho)为0.097 3(MaI32)~0.615 4(Mber40G),期望杂合度(He)为0.783 2(MaI02)~0.890 8(Mb40);多态信息含量(PIC)为0.750 4(MaI02)~0.878 9(Mb40),每个位点均具有高度多态性(PIC>0.5)。
由表3可知,按性别将林麝种群分为两个群体来看,雄麝群体的Na、Ne、I、Ho、He和PIC值均高于雌麝群体,表明其种群具有较高的遗传多样性。两个群体的观测杂合度均低于期望值,且近交系数(雄麝0.596 0;雌麝0.598 8)较高,表明该种群均存在一定程度的近亲繁殖趋势。

表2 林麝12个SSR位点的遗传多样性参数
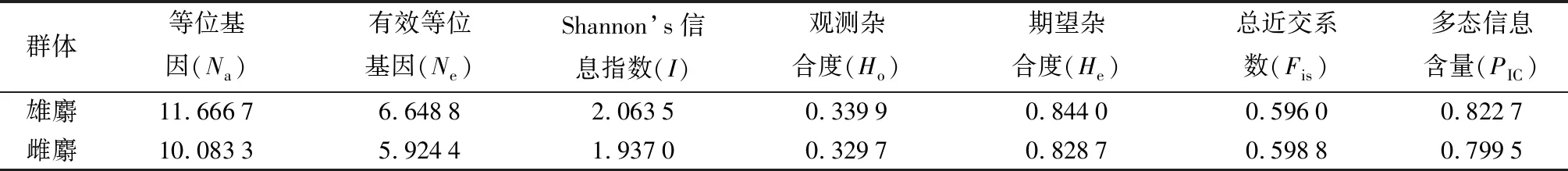
表3 雄麝和雌麝群体遗传多样性参数
2.2 核心种质资源的构建
由图1可知,林麝原始种质仅有1只雄麝独自聚为一支,其余以2~20个个体聚为大小不同的37个分支;有5只雌麝分别聚为一支,其余以2~7个个体聚为大小不同的16支。雄麝存在不同地理来源的林麝样本被聚为一支的情况,表明该种群存在基因渗透现象。
由表4、表5可知,根据聚类结果,采用逐步聚类等位基因最大化取样法对雄麝和雌麝种群分别进行了三轮筛选,第一轮筛选得到105份雄麝种质和40份雌麝种质,分别占原始种质的63.25%和62.50%;第二轮分别为67份和25份,各占原始种质的40.36%和39.06%;第三轮分别为43份和18份,各占原始的25.9%和28.13%。
由于私有等位基因在生产繁殖过程中极易出现不可逆转的丢失,应使携带私有等位基因的13只个体全部参与繁殖,在第三次压缩得到的群体中加入未参与的含私有等位基因个体,最终成功构建出核心种质(雄麝:47份,雌麝:23份)。核心种质的遗传多样性分析显示,雄麝遗传多样性参数保留率达到了95%以上,且产优质麝香的个体占比从原始种质的44.81%提高到了55.56%;雌麝遗传参数保留率达到了86%以上,表明筛选出的核心种质保留了较高的遗传多样性。

QL为秦岭种群;BS为巴山种群。
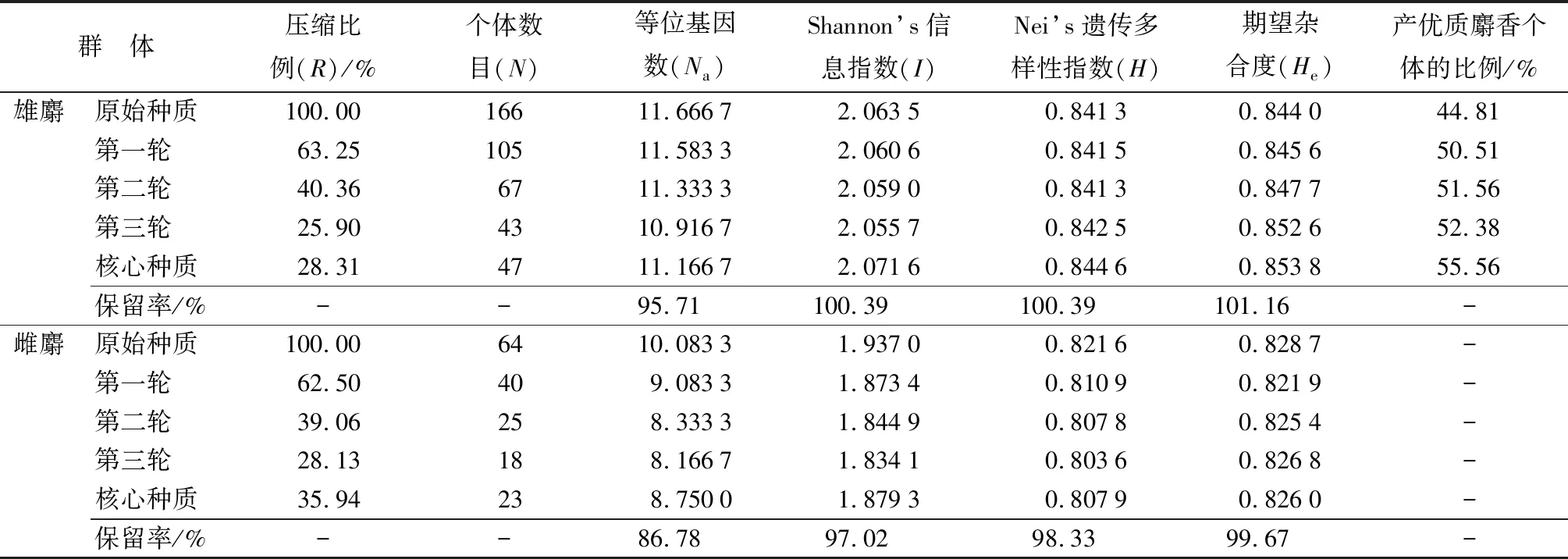
表4 不同压缩群体遗传多样性

表5 含私有等位基因的林麝个体
2.3 核心种质的评价与确认
由表6可知,原始种质和核心种质的4项遗传参数t检验结果显示,雄麝核心种质的等位基因数(Na)、Shannon’s信息指数(I)、Nei’s遗传多样性指数(H)和期望杂合度(He)在P=0.05水平上与原始种质均无显著差异;雌麝核心种质的I、H和He与原始种质无显著差异(P>0.05)。关键的遗传多样性指标(I、H)无较大变化,表明构建的核心种质能够以最小数量保留原始种质的遗传信息,具有较好的代表性。
由图2可知,林麝原始种质和核心种质的主成分二维分布显示原始种质中样本分布较为密集;而核心种质明显降低了原始分布的紧密度,分布形式也与原始种质较为相似且覆盖均匀,能够代表原始群体在主成分中的几何分布,表明筛选出的核心种质剔除了遗传冗余,并较好保留了原有的遗传信息。

表6 原始种质和核心种质的遗传参数t检验
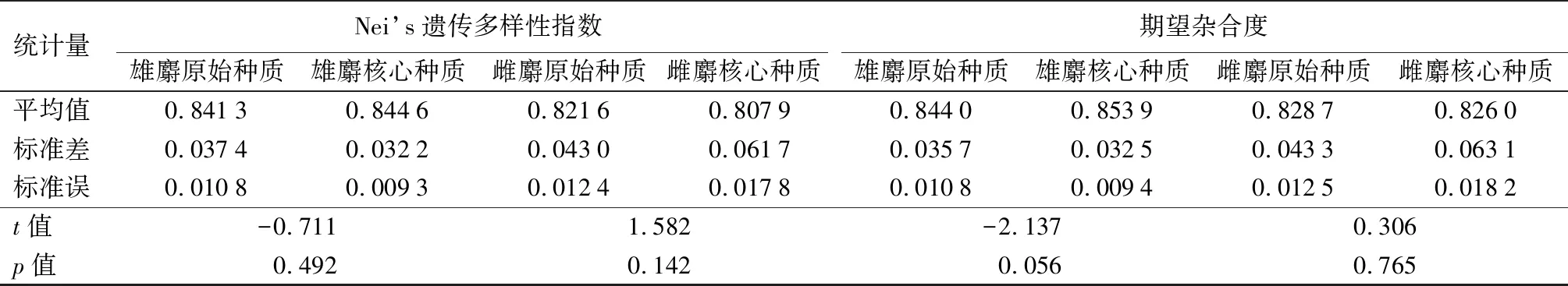
统计量Nei’s遗传多样性指数雄麝原始种质雄麝核心种质雌麝原始种质雌麝核心种质期望杂合度雄麝原始种质雄麝核心种质雌麝原始种质雌麝核心种质平均值0.84130.84460.82160.80790.84400.85390.82870.8260标准差0.03740.03220.04300.06170.03570.03250.04330.0631标准误0.01080.00930.01240.01780.01080.00940.01250.0182t值-0.7111.582-2.1370.306p值0.4920.1420.0560.765
保留种质是指原始种质去掉核心种质后剩余的部分,可作为备选种质资源,核心种质缺失时可从中寻找替代样本。由表7可知,保留种质的遗传参数Ne、I、H和He均低于核心种质,表明筛选到的核心种质去除了遗传多样性较低的样本,以少量样本较好的代表了原始种质的遗传多样性。雌麝核心种质的Na小于保留种质,可能是由于取样比例小,导致了少量等位基因被剔除。
3 结论与讨论
3.1 林麝群体遗传多样性评估
本研究利用12对SSR引物对230份林麝资源进行遗传多样性检测,各位点等位基因数范围为10~16个。有研究表明SSR标记检测群体遗传多样性时,要求样本最好在50份以上[14],各位点的等位基因数至少为4个[15],本研究符合检测要求。多态信息含量(PIC)是衡量基因变异程度的指标,当PIC>0.5时,该基因座具有高多态性[16],当PIC>0.7时,该位点可作为最理想的标记[17]。本实验中各SSR位点的PIC值为0.750 4~0.878 9,均大于0.7,表明选用的12个位点可作为检测林麝群体遗传多样性的理想标记,收集的圈养林麝资源有着高度信息量。
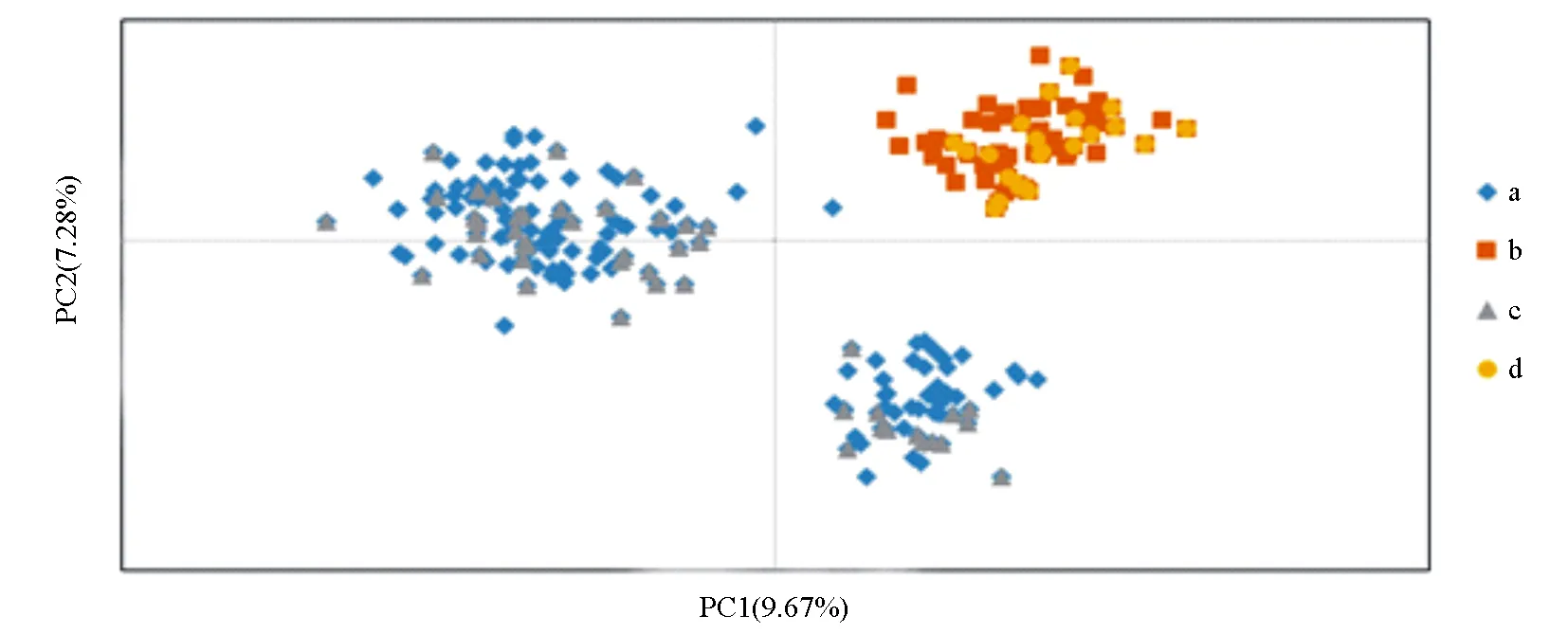
a为雄麝原始种质,b为雌麝原始种质,c为雄麝核心种质,d为雌麝核心种质,PC1、PC2分别表示第一、第二主成分。
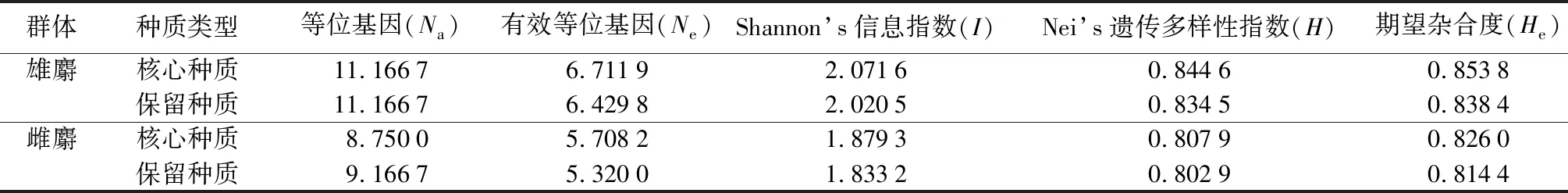
表7 核心种质和保留种质遗传多样性参数
群体杂合度即基因多样度,可作为群体遗传变异的检测指标[18]。平均杂合度高,表明群体遗传变异丰富。本研究中,林麝群体平均期望杂合度(He)为0.845 9,高于麋鹿(He为0.46~0.54)、梅花鹿(He为0.601 8)和藏羚羊(He为0.83 8)等濒危兽类[19-21];同时也高于王豆等[22]对圈养林麝的研究结果(He为0.830 2),表明本研究收集到的林麝资源具有丰富的遗传多样性。这是因为陕西秦巴山区是野生林麝的核心分布区[23],且陕西是最早开始林麝养殖的省份之一,前期野生种源能够得到充分补充。而平均观测杂合度(Ho)为0.337 8,低于期望杂合度,且明显低于四川圈养林麝(Ho为0.552)和野生林麝(Ho为0.74)的期望杂合度[24-25],表明群体内存在近交现象,说明当前的“轮配繁育管理系统”(BMS-RM)难以准确记录林麝遗传谱系[26],致使圈养林麝群体遗传多样性存在降低的风险。
3.2 核心种质的构建
核心种质是通过科学的方法筛选出种质资源的一部分,能够以最少数量和遗传重复代表整体资源的遗传多样性。通常依据具体群体选择原始资源的10%~30%[27],一般遗传多样性较低或种群数量大的群体,取样比例相对较小。在核心种质构建中等位基因数目最大化取样策略最具优势,能够筛选到遗传多样性最为丰富的种质资源,满足遗传学要求[28]。本研究中以等位基因数最大为筛选依据,对原始种质进行了三轮逐步聚类,得到雄麝25.90%和雌麝28.13%的压缩种质集。私有等位基因(在单个群体中出现的特有等位基因)可作为衡量遗传多样性的参数[29],在生产繁殖过程中极易丢失,造成遗传资源损失。Li et al.[30]和Huang et al.[31]的研究已经分别将保护私有等位基因、防止其丢失作为圈养大熊猫和圈养林麝的养殖管理的策略之一。因此,本研究将携带私有等位基因个体全部加入选育,得到47份雄麝核心种质和23份雌麝核心种质。
3.3 核心种质的评价
以分子标记手段构建的核心种质通常借助遗传多样性参数进行评价,主要参数包括等位基因数、杂合度、Shannon’s信息指数、Nei’s遗传多样性指数等[11,32]。核心种质是否具有代表性,需要对原始和核心群体的遗传参数进行t检验,并结合PCA图中样本分布的相似性进一步确认核心种质。本研究通过Shannon’s信息指数(I)、Nei’s多样性指数(H)这2项重要遗传参数的t检验确定了核心种质的代表性(P>0.05)。保留率是用来检测核心种质中是否保留了足够多的遗传变异,是核心种质实用性检验的重要参数[33]。本研究中雄麝种质的Na、I、H、Ho和He等5项遗传参数的保留率为84.08%~101.16%,雌麝为86.78%~98.33%。构建核心种质的等位基因保留率需大于70%,其他遗传参数越高越好的标准[34],表明本研究构建的林麝核心种质能够较好地保留原始的遗传多样性。各别遗传参数的保留率出现大于100%的情况,可能是去遗传冗余过程中各种等位基因频率不规律增减所导致。
收益是衡量养殖过程中动物生产力的重要指标,通过对目标经济性状进行选育,可以提高群体中有利基因的频率[35]。麝香是雄性林麝育种的重要经济性状,生产香味浓郁、黑色或棕褐色颗粒状的优质麝香是饲养企业最为关心的目标。本研究将产优质麝香个体比例作为核心种质选育成功重要评价指标,结果显示产优质麝香个体比例原始群体44.81%提高到55.56%,基本达到核心种质筛选目标。
综上所述,本研究通过逐步聚类法分别构建了雄、雌麝核心种质,初步为防止优异基因和种质的丢失,同时也为陕西圈养林麝进一步种质改良提供优质种源。核心种质处于一个不断变化的动态过程,可以在不够完善的数据中尽可能选取具有代表性的样本,再随着后续研究的深入逐渐补充和完善缺乏的数据。在今后林麝核心种质构建工作中,随着管理规范、家系清楚,以及雌麝的产仔数、幼仔存活率等指标的加入,以期得到更为全面的核心种质群,为林麝资源保护、繁育管理提供参考依据。
