不同环境条件下Mn(II)在磁铁矿表面的催化氧化
2022-10-08秦张杰胡康生冯雄汉何小林
秦张杰,胡康生*,梁 丰,冯雄汉,张 嵚,何小林,兰 帅*
(1.江西农业大学 国土资源与环境学院/江西省鄱阳湖流域农业资源与生态重点实验室,江西 南昌 330045;2.华中农业大学 资源与环境学院,湖北 武汉 430070;3.江西省农业技术推广中心,江西 南昌 330045)
【研究意义】土壤环境中的铁和锰都是活性很强的变价元素,因此经常会参与土壤中各种氧化还原反应,如有机质的氧化降解[1-3]和污染金属离子的形态毒性变化等[4-7]。由于铁和锰在化学性质上很接近,故两者的地球化学行为紧密相关,常在不同环境中共存,尤其是在南方红壤中水旱交替的环境下,两者常在不同环境因素的影响下形成不同的铁锰共生体[8-10],进而对共存物质的氧化还原行为产生不同的影响[4,11-12]。其中锰是土壤中含量最多的微量元素,其在土壤溶液中主要以离子态Mn(II)形态存在,Mn(II)的氧化沉淀过程在共存物质的迁移转化反应中起着举足轻重的作用[13-15]。虽然在热力学理论基础上Mn(II)在一定电子活度、pH范围内可以发生自动催化氧化,但事实上均质体系下Mn(II)被O2氧化的速率在pH 值小于8.5 条件下极为缓慢,即使在溶解氧存在的条件下也可处于未氧化阶段长达7 年[16-17]。然而,Mn(II)的氧化沉淀速率和程度可以通过多相的催化促进作用被显著提高,如当细菌、金属氧化物或其他细小颗粒存在时可促进Mn(II)的氧化沉淀,O2会加速这一过程[17-19]。而大量研究已经证实,土壤中与锰时常共存的水铁矿和针铁矿等氧化铁可通过界面催化或电化学催化等途径催化与其共存Mn(II)的氧化沉淀,且产物类型和数量受环境pH、共存物质(如腐殖质)、催化矿物特性和Mn(II)初始反应浓度等影响[15,17,19-20]。Mn(II)在不同条件下会在氧化铁表面催化氧化生成不同的锰氧化物沉淀,形成不同的铁锰共生体。然而,关于磁铁矿与Mn(II)的相互作用,及其催化Mn(II)氧化的特性和途径与水铁矿、针铁矿等其他氧化铁的差异还鲜少报道。【前人研究进展】磁铁矿广泛分布于岩石、土壤和沉积物中,主要通过一系列微生物反应形成,或者直接由母岩风化而来,是一种黑色、同时含有Fe(II)和Fe(III)且具有亚铁磁性的矿物,是最重要的强磁性铁氧化物[21-25]。因为磁铁矿的结构是以Fe2O3和FeO 为晶格的基本骨架,故八面体位点可被Fe3+或Fe2+占据,电子可以在这两种形态间相互传递[26],尤其在O2存在时易形成氧化性很强的超氧自由基[27]。此外,磁铁矿是半导体矿物,且相较于同为半导体的活性炭类物质,其在充当电子通道的同时还可直接提供电子,从而对相同的氧化还原反应产生更加显著的影响[27]。鉴于此,磁铁矿同时具备良好的催化能力和较强的氧化还原活性[25,28-32],从而会对共存物质的氧化还原循环产生显著影响。可见,磁铁矿对Mn(II)氧化的催化作用与其他只含有Fe(III)的氧化铁相比可能会有很大差异,但具体内容尚需探索。【本研究切入点】还原态锰在矿物表面的催化氧化过程主要分为3个部分,包括反应剂在矿物表面的吸附、反应剂之间的电子传递和产物释放3 个过程[33],Mn(II)的氧化沉淀过程本质为电子的传递[34],而磁铁矿内部同时存在Fe(III)和Fe(II)两种价态的离子,电子极易在这两种形态之间相互传递[11,35];此外,同作为半导体氧化铁,由于其电子传导性能与矿物的带隙能大小息息相关,带隙能较小的磁铁矿(0.1 eV)[25]通常会比其他带隙能高的氧化铁矿物(如水铁矿为2.7 eV,针铁矿为2.1 eV)[36-37]具备更强传递电子的能力;最后,矿物内部的Fe(II)还与芬顿反应息息相关,其在氧气存在等条件下可形成氧化性很强的活性氧自由基(ROS)[29]。然而,上述磁铁矿的各种特殊矿物特性对其表面Mn(II)氧化的催化具体会产生如何的影响还未可知。【拟解决的关键问题】本研究以土壤中广泛存在的磁铁矿为研究对象,采用动力学氧化实验和长期老化实验,结合X-射线衍射(XRD)这一技术手段,模拟并阐明不同环境中磁铁矿催化作用下Mn(II)的氧化产物数量及类型。同时选择了具备不同带隙能的另外两种氧化铁(水铁矿和针铁矿)作为对照,探究磁铁矿对Mn(II)氧化的催化作用与两者的异同,进而探讨磁铁矿催化Mn(II)氧化的途径和机制。以上研究可为了解富铁锰土壤中铁和锰元素的相互作用及两者耦合的地球化学行为提供更为详细的理论数据。
1 材料与方法
1.1 矿物的合成
1.1.1 磁铁矿 磁铁矿购于Aladdin网(国药集团化学试剂有限公司),分子式为Fe3O4,分析纯。利用5 点BET方法所测比表面为7 m2/g,单位质量Fe含量为16.67 mmol/g。
1.1.2 2 线水铁矿 将40 g 的Fe(NO3)3·9H2O 溶于500 mL 的去离子水中,然后搅拌条件下逐滴加入约330 mL 的1 mol/L NaOH,直到溶液pH 至7~8,接着搅拌平衡老化2 h。最后将所得沉淀产物用去离子水洗涤多次,直至电导率小于20µS/cm,并离心,冻干,磨碎,过60 目筛后于4°C 冰箱储存。测得其比表面为292 m2/g,单位质量Fe含量为9.81 mmol/g。
1.1.3 针铁矿 搅拌条件下,将180 mL 的5 mol/L NaOH 溶液滴加到100 mL 1 mol/L Fe(NO3)3溶液中,然后用去离子水稀释至2 L,接着在密闭和70°C 条件下老化60 h。最后洗涤,离心,烘干,磨碎,过60 目筛后于干燥器中备用。所测比表面为41 m2/g,单位质量Fe含量为12.89 mmol/g。
以上3种矿物经XRD鉴定,均为纯相矿物(图1)。
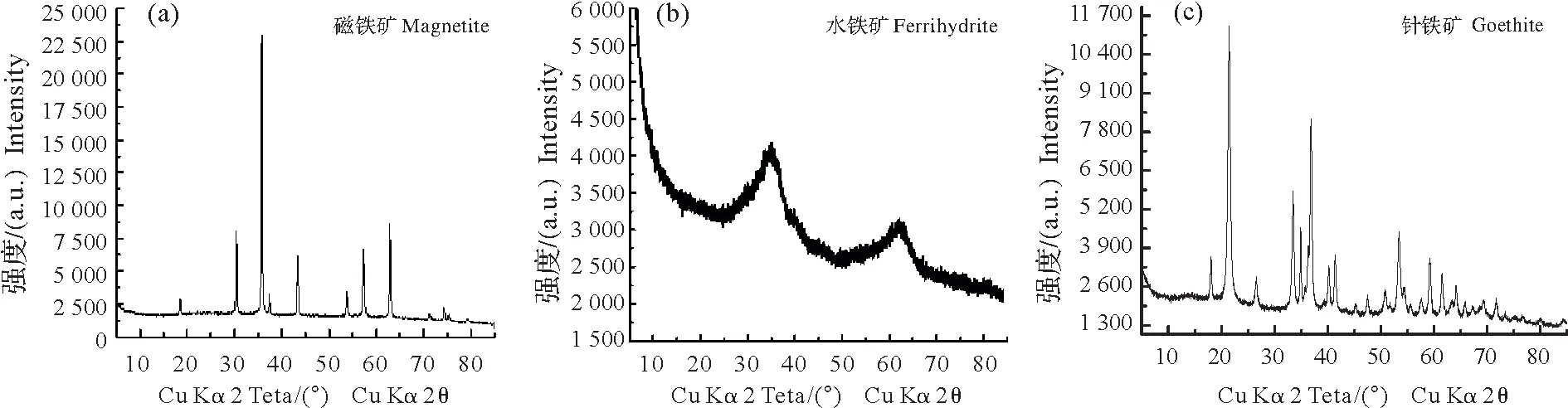
图1 不同铁氧化物的XRD图谱Fig.1 XRD patterns for different iron oxides
为了避免光照产生的活性氧自由基(如HO·和O2·等)对Mn(II)氧化反应的光催化影响,本研究中的反应均在遮光条件下进行。
1.2 Mn(II)在磁铁矿体系中的动力学氧化
称取0.5 g 磁铁矿(总表面积为3.5 m2)于250 mL 锡箔纸包裹避光的反应池中,接着向反应池加入100 mL 超纯水。然后加入8.37 mL 初始浓度为0.430 3 mol/L 的Mn(NO3)2溶液,并用超纯水定容使得Mn(II)初始反应浓度为24 mmol/L,反应悬液终体积为150 mL。混匀后,利用塑料搅拌器均匀搅拌并迅速用电位滴定仪(Metrohm 907)自动滴加1 mol/L NaOH 将悬液pH 控制为7(Metrohm 6.0280.300),持续通入速率为0.15 m3/h 的O2,在25 °C 恒温条件下反应10 h。反应过程中定时取样并迅速利用0.22 µm 滤膜过滤分离上清液和矿物,上清液中的Mn(II)浓度利用火焰原子吸收光谱(AAS,Varian AAS 240FS)进行检测(测定两次,求平均值),所得终产物利用超纯水洗涤、真空干燥后利用XRD 进行分析鉴定。同时,设置了Mn(II)在水铁矿体系氧化对照实验以检测两种氧化铁对Mn(II)氧化的不同催化性能及差异。
为了探明共存腐殖质对磁铁矿表面Mn(II)氧化行为的影响,选择醌类腐殖质:蒽醌-2,6-二磺酸盐(anthraquione-2,6-disulfonnat:AQDS)为腐殖质代表物质,在以上氧化体系下加入1 mmol/L 的AQDS,探究其对Mn(II)氧化的影响,其他实验条件和操作步骤同上。
1.3 ATR-FTIR表征Mn(II)在磁铁矿表面的吸附-氧化
Mn(II)在磁铁矿表面吸附氧化的ATR-FTIR 光谱表征在室温条件下(~25°C)进行。取0.047 27 g干燥的磁铁矿,加入1 mL 去离子水并超声分散5 min,均匀铺样并自然风干(12 h),然后样品放入Bruker Equinox 55 型傅立叶变换红外光谱仪开始进行Mn(II)氧化过程的原位表征:首先以1.0 mL/min 匀速通入0.1 mol/L的KNO3背景电解液(pH 预先调为7)并开始收集红外光谱,直至光谱峰形不再发生改变,此时两铁矿表面基团达到饱和。然后以0.5 mL/min 的速度分别通入不含AQDS 或含有1.0 mmol/L AQDS 的初始浓度为0.5 mmol/L 或15 mmol/L 的Mn(II)溶液(pH 预先调为7),背景电解质为0.1 mol/L KNO3,定时测试,每隔既定时间收集红外光谱,实时检测有无AQDS 体系下Mn(II)在磁铁矿或水铁矿表面的氧化成矿过程。测试波数范围为1 800~800 cm-1,分辨率为4 cm-1,扫描次数为512,采用DTGS检测器,利用软件OPUS 进行数据处理。
1.4 不同环境因素条件下Mn(II)在不同氧化铁体系中的60天老化
称量0.294 3 g 磁铁矿(总表面积为2.06 m2)于250 mL 锥形瓶中(锥形瓶预先进行酸浸泡,以排除微生物等杂质的影响),并在超声5 min 后加入8.37 mL 初始浓度为0.430 3 mol/L 的Mn(NO3)2溶液使得Mn(II)的初始浓度为24 mmol/L,接着用适量超纯水将体积定容至150 mL,然后使悬液在pH 7 和室温(~25 ℃)条件下静置老化60 d。老化期间用NaOH或者HNO3维持pH恒定,适时取样并迅速利用0.22µm滤膜过滤分离上清液和矿物,测定悬液中Mn(II)浓度。老化结束后,将终产物洗涤后直接进行XRD分析。
为了探究不同环境因素(如pH、温度、Mn(II)初始反应浓度和和AQDS 等)对其的影响,设置了相同实验条件下不同温度(60 ℃)、不同pH(pH 9)及不同初始Mn(II)反应浓度(8 mmol/L)条件下Mn(II)在磁铁矿体系的老化试验。其他实验条件和操作处理步骤同上。
为了比较不同氧化铁对Mn(II)催化性能的差异,另外分别称量0.500 0 g水铁矿(总表面积为146 m2)和0.380 5 g 针铁矿(总表面积为15.6 m2)于250 mL 锥形瓶中,使得两者与磁铁矿体系具有相同Fe/Mn摩尔比。为了在实验效果显著可见的基础上尽量避免Mn(II)在不同氧化铁表面的不同自催化氧化对其氧化终产物的影响,本研究选取8 mmol/L 的低浓度Mn(II)为初始反应浓度,使Mn(II)在3 种氧化铁体系进行氧化,并加入初始反应浓度为1.0 mmol/L 的AQDS 电子穿梭体,以观察不同氧化铁体系下Mn(II)的不同催化氧化。
2 结果与分析
2.1 Mn(Ⅱ)在磁铁矿和水铁矿表面的动力学氧化
图2a 的XRD 图谱表明Mn(II)在水铁矿表面催化氧化的产物种类很多,包括亚稳态六方水锰矿、水锰矿、斜方水锰矿和少量黑锰矿和六方锰矿,产物主要以Mn(III)矿物为主。而当磁铁矿催化Mn(II)氧化时,产物主要为高价Mn(IV)矿物-水钠锰矿,另外还有少量很难显著检测到的六方水锰矿和水锰矿等Mn(III)矿物。可见,相对于水铁矿,磁铁矿更易催化Mn(II)氧化生成含更高价态Mn(IV)的锰氧化物的生成。
另外,相对于Mn(II)在水铁矿体系的催化氧化(图2b),其在磁铁矿体系中的去除速率和去除最大量都远远小于前者,且在反应600 min后,上清液中单位铁锰比的磁铁矿对Mn(II)的去除率仅达到4.99%,然而单位铁锰比的水铁矿对Mn(II)的去除率是磁铁矿的近两倍,约9.36%。尽管如此,水铁矿体系中Mn(II)氧化生成的锰氧化物的价态却比磁铁矿体系中的低,这表明磁铁矿虽对Mn(II)的吸附去除能力低,但却更易催化促进Mn(II)氧化生成更高价态的含Mn(IV)的锰氧化物。可见,磁铁矿对Mn(II)氧化的催化作用强于水铁矿。
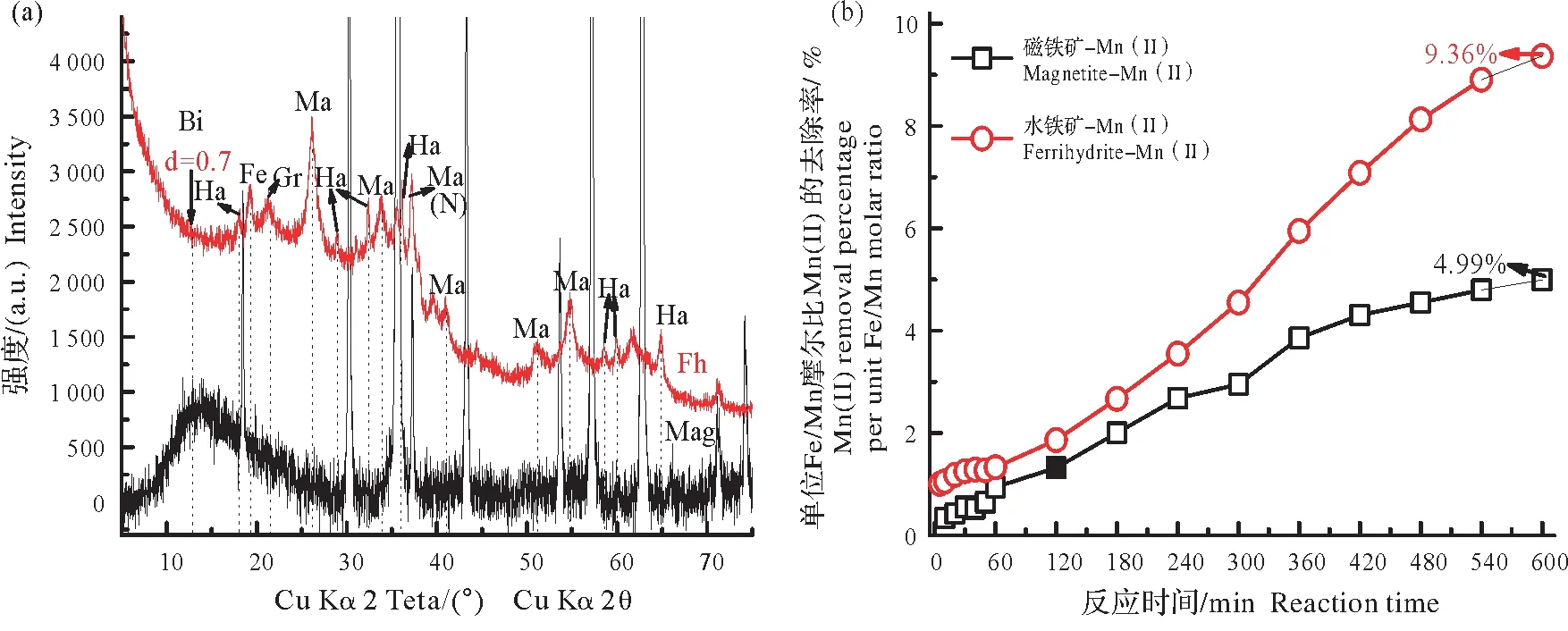
图2 ~25 ℃、pH 7和O2流速为0.15 m3/h时,24 mmol/L Mn(II)在磁铁矿或水铁矿体系中氧化终产物的XRD图(a)及相应反应过程中Mn(II)去除率(b)随时间的变化Fig.2 XRD patterns of the final products of 24 mmol/L Mn(II)oxidation at pH 7,25 ℃with an O2 flow rate of 0.15 m3/h in the presence of magnetite and ferrihydrite(a),and the corresponding Mn(II)removal percentages(b)
2.2 环境因素对磁铁矿催化Mn(Ⅱ)氧化的影响
2.2.1 AQDS 对磁铁矿催化Mn(Ⅱ)氧化的影响(1)AQDS 存在或不存在体系中Mn(Ⅱ)在磁铁矿表面的60 d 老化。图3a 显示,无AQDS 存在时,Mn(II)在磁铁矿催化作用下产生了少量的含Mn(IV)的锰氧化物:布塞尔矿,另外还有水锰矿。当反应体系加入浓度为1.0 mmol/L的AQDS后,终产物XRD衍射峰的种类不变,然而代表布塞尔矿的衍射峰增强,半峰宽也略微增大;反观,水锰矿衍射峰的强度减弱,半峰宽减小。可见,AQDS 作用下,Mn(II)氧化产生的布塞尔矿增多,而水锰矿减少,即AQDS 更易促进Mn(II)在磁铁矿表面氧化生成含Mn(IV)的锰氧化物,而不利于含Mn(III)矿物的形成,这与之前水铁矿体系下AQDS 对Mn(II)氧化的催化作用类似[11]。另外,随着AQDS 的加入,反应体系中相对应的Mn(II)去除量在前44 d 内相对减小(图3b),这可能是由于体系中加入的AQDS 在催化过程中需要少量吸附于磁铁矿表面,从而与矿物表面吸附的Mn(II)发生了微量的竞争吸附。此外,AQDS 的加入使Mn(II)的氧化速率大大加快,但快速的Mn(II)氧化速率反而会不利于产物的结晶生长,从而降低了Mn(II)的消耗。44 d 后,含有AQDS 体系的Mn(II)去除量逐渐超越了无AQDS 体系,这可能是由于AQDS 体系中前期产生了相对较多的含有Mn(IV)的布塞尔矿,而此矿物对Mn(II)的去除率要大于含有Mn(III)的水锰矿[11],故使后期Mn(II)的去除率变大,并逐渐超越无AQDS 体系。图3b 还显示磁铁矿体系中Mn(II)的去除率在后期有少许降低,这可能是由于矿物表面前期生成的锰氧化物中部分发生了歧化反应,重新生成了少量Mn(II)[38]。
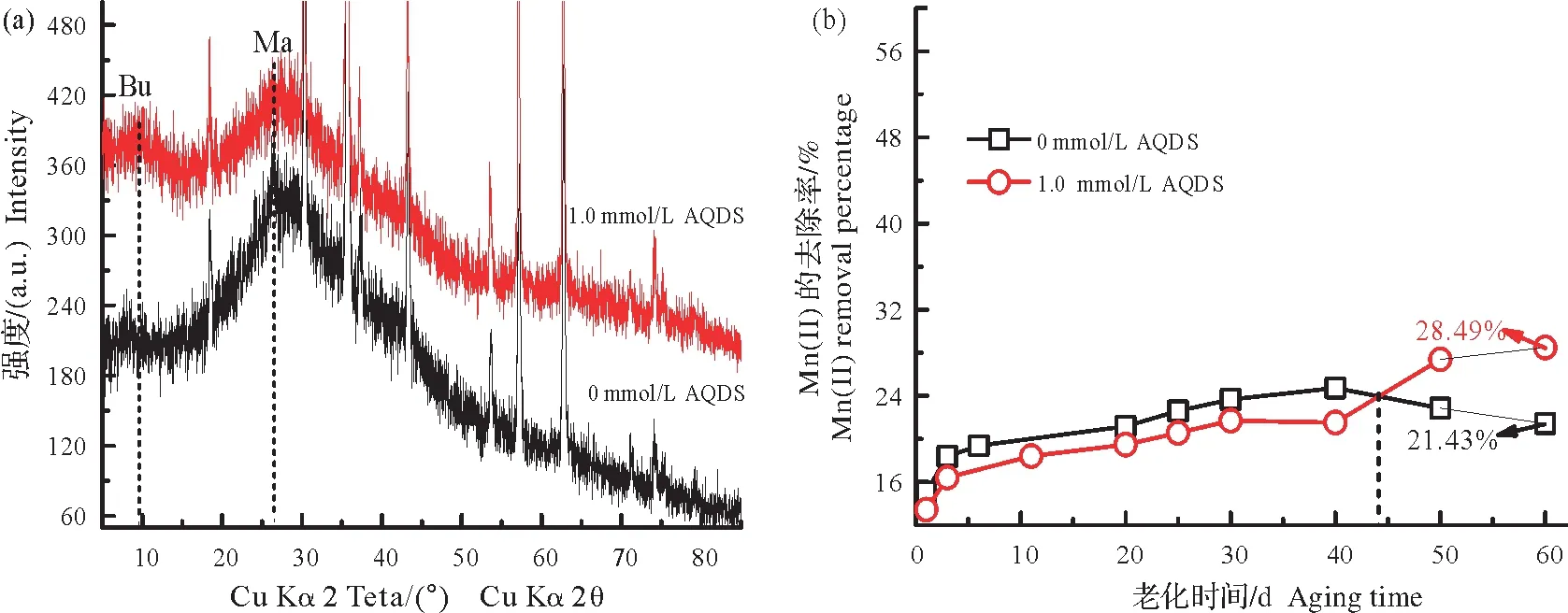
图3 常温(~25 ℃)和pH 7条件下,0 mmol/L或1.0 mmol/L AQDS存在时24 mmol/L Mn(II)在磁铁矿体系中老化60 d后终产物的XRD图谱(a)及上清液中Mn(II)去除百分比随老化时间变化(b)Fig.3 XRD patterns of the final wet products of 24 mmol/L Mn(II)aged for 60 days in the presence of magnetite with 0 or 1.0 mmol/L AQDS at pH 7,room temperature(25 ℃)(a),and the corresponding Mn(II)removal in supernatant(b)
(2)ATR-FTIR 表征有无AQDS 体系下Mn(Ⅱ)在磁铁矿表面的氧化。为了进一步确定AQDS 对Mn(II)在磁铁矿表面氧化过程的具体影响,采用HATR-FTIR表征有无AQDS存在时Mn(II)在磁铁矿表面的吸附氧化行为(图4)。由红外图谱可知,AQDS的确对Mn(II)在磁铁矿表面的吸附氧化行为产生了显著影响:无AQDS时,Mn(II)在矿物表面吸附5 min时基本未发生任何反应(图3a),在1 h时才仅在1 040 cm-1处产生了一个斜方水锰矿的振动吸收峰,且随着反应的进行,峰形和强度并未产生太大的变化(图4b~h)。而AQDS 加入以后显著加速了Mn(II)在磁铁矿表面的吸附氧化,使Mn(II)在吸附1 h时就同时产生了分别代表斜方水锰矿、六方水锰矿和水锰矿的1 030/1 040 cm-1、1 070 cm-1和1 169 cm-1这4个较强的振动吸收峰(图3b),即Mn(II)在磁铁矿表面快速吸附并即刻氧化,从而使斜方水锰矿、六方水锰矿和水锰矿在矿物表面迅速沉积;且当Mn(II)的吸附氧化进行到第2个小时,又新形成了代表水锰矿的1 108 cm-1吸收峰,同时1 040 cm-1的吸收峰逐渐减弱(图3c 和3d)。但随着反应继续进行,1 040,1 108 cm-1吸收峰都逐渐减弱并消失(图3e、3f 和3h)。以上表明,Mn(II)的氧化沉淀在AQDS 的促进作用下快速而多变,产物积累较快,且不断有新的水锰矿矿相生成,形成较多种类的锰氧化物。此外,AQDS加入后Mn(II)在矿物表面氧化产物的每一个吸收峰都比无AQDS体系下的强很多,这表明AQDS同时显著提高了Mn(II)氧化的速率和程度。可见,AQDS在磁铁矿体系下依然有利于电子传递,促进多种电子传递途径的形成,进而形成了更多种类的锰氧化物,其在Mn(II)的催化氧化中发挥着不容小觑的作用。另外,由于布塞尔矿和水钠锰矿在1 200~900 cm-1范围内没有特征吸收峰[41],因此,AQDS加入此反应体系后是否促使含Mn(IV)矿物的生成还有待进一步证明。
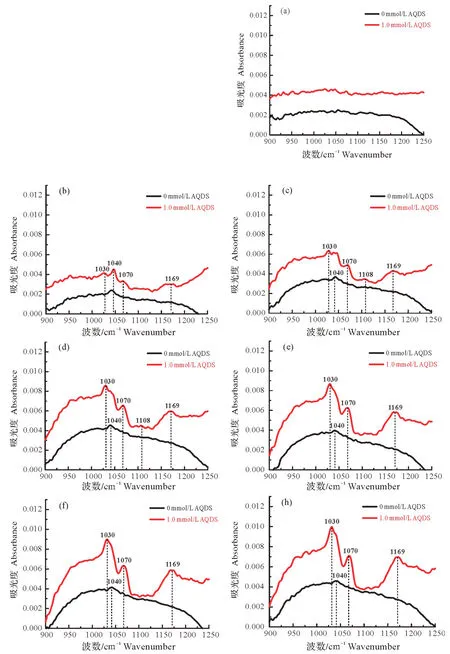
图4 常温(~25 ℃)和pH 7条件下,无AQDS或1.0 mmol/L AQDS存在时磁铁矿在与15 mmol/L Mn(II)作用过程中5 min(a)、1 h(b)、2 h(c)、3 h(d)、4 h(e)、5 h(f)和6 h(h)时中间产物的原位FTIR光谱图Fig.4 Time-dependence of in situ FTIR spectra of intermediate products derived from the interaction between magnetite and 15 mmol/L Mn(II)in the presence of 0.0 or 1.0 mmol/L AQDS at 5 min(a),1 h(b),2 h(c),3 h(d),4 h(e),5 h(f),and 6 h(h)at pH 7,room temperature(25 ℃)
2.2.2 不同初始Mn(Ⅱ)反应浓度下其在磁铁矿表面的60 d老化 图5a中的终产物XRD图谱显示当Mn(II)的初始反应浓度为8 mmol/L时,其在磁铁矿体系下氧化的产物具有明显可见的水锰矿衍射峰,但并未有显著的代表Mn(IV)产物的衍射峰。当Mn(II)的初始反应浓度增大到24 mmol/L时,水锰矿的衍射峰显著增强,且有显著的代表布塞尔矿的衍射峰。可见,随着Mn(II)初始反应浓度的增大,水锰矿的含量和结晶度增加,且形成了更高价态的锰氧化物。以上表明,较高的Mn(II)初始反应浓度更有利于更高价态锰氧化物的形成。这可能是由于磁铁矿为半导体矿物,Mn(II)在其表面催化作用下的氧化途径包括界面催化和电化学催化两个途径,而较高的Mn(II)浓度更有利于电化学催化途径的实现[17],进而更有利于锰氧化物的形成,包括四价锰矿物。

图5 常温(~25 ℃)和pH 7条件下,不同含量Mn(II)在磁铁矿体系老化60 d终产物的XRD图谱(a)及上清液中Mn(II)去除百分比随老化时间变化(b)Fig.5 XRD patterns of the final products of Mn(II)with different concentrations(8 mmol/L and 24 mmol/L)aged for 60 days in the presence of magnetite at pH 7,room temperature(25℃)(a),and the corresponding Mn(II)removal in supernatant(b)
此外,相对于较高的Mn(II)初始反应浓度,具有较低Mn(II)初始反应浓度的体系中Mn(II)的去除率在前25 d 略高于高初始反应浓度体系,但没有太大差异。然而在25 d 以后,其去除率开始逐渐增大,并逐渐显著高于后者。这主要是由于初始反应阶段Mn(II)主要在磁铁矿表面进行吸附氧化[42],此时两者的反应过程类似,因此去除率差距不是非常大;而后期Mn(II)反应以自催化氧化为主[42],故由于初期阶段两反应体系形成的主要锰氧化物类型不同或上清液剩余Mn(II)的浓度的较大差异,造成了后期不同的Mn(II)自催化氧化过程,从而使得后续去除率产生显著差异。
2.2.3 不同pH 体系中Mn(Ⅱ)在磁铁矿表面的60 天老化 图6a 为24 mmol/L 的Mn(II)在pH 7 或pH 9体系下氧化终产物的XRD 图谱。图谱显示,pH 7 体系下Mn(II)氧化的产物主要为水锰矿,同时还有少量的布塞尔矿;反应过程中Mn(II)去除量逐渐增大,最终趋于平稳,达到约21.43%(图6b)。而在pH 9体系下,大部分的Mn(II)氧化生成了黑锰矿,还有少量不显著的布塞尔矿(图6a)。这可能是由于该体系中Mn(II)氧化生成的黑锰矿量多,且结晶度比布塞尔矿相对较好,故对布塞尔矿的衍射峰起到一定的掩盖效果。另外,此体系上清液中Mn(II)的去除量在第3 天即达到最大值,约99.24%,去除率显著大于pH 7体系(图6b)。
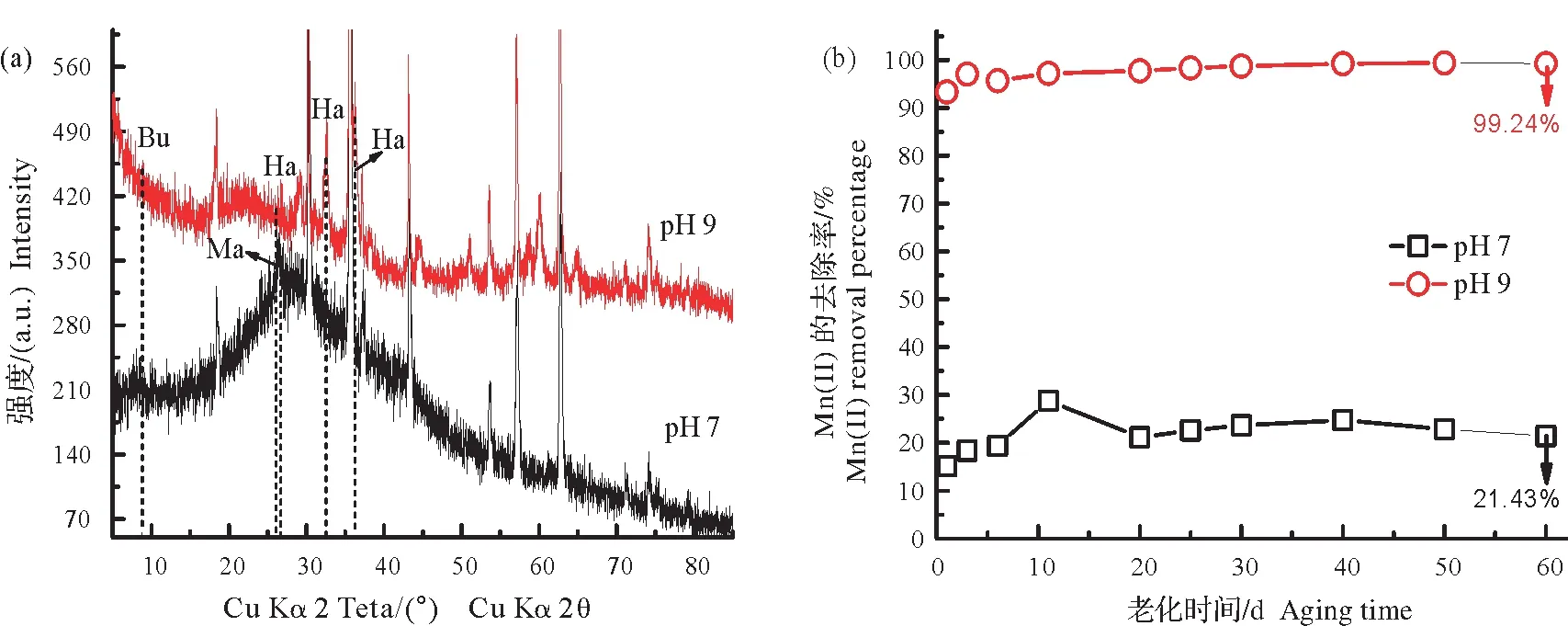
图6 常温(~25 ℃)和不同pH(pH 7和pH 9)条件下,24 mmol/L Mn(II)在磁铁矿体系老化60 d终产物的XRD图谱(a)及上清液中Mn(II)去除百分比随老化时间变化(b)Fig.6 XRD patterns of the final products of 24 mmol/L Mn(II)aged for 60 days in the presence of magnetite at room temperature(25 ℃)with different pHs(pH 7 and pH 9)(a),and the corresponding Mn(II)removal in supernatant(b)
这主要是由于pH 7体系下,Mn(II)的反应开始可能主要以在磁铁矿表面的吸附氧化为主,后期还伴有其在新生成的锰氧化物表面的吸附氧化[20,42]。然而,当pH增大到9时,Mn(II)自身就会瞬间发生沉淀,生成Mn(OH)2沉淀,故产生了Mn(II)在反应开始就被大量去除的现象。接下来,新形成的锰氧化物沉淀会发挥和磁铁矿类似的催化作用,促进Mn(II)的吸附氧化,生成大量的黑锰矿,并在此基础上生成布塞尔矿[17,43]。同时,由于pH较高时Mn(II)氧化成矿的反应能会减小[44],因此生成锰氧化物的速率更快,产量也会相对较多。
2.2.4 不同温度条件下Mn(Ⅱ)在磁铁矿表面的60 天老化 图7a 显示24 mmol/L Mn(II)在室温条件下(~25 ℃)氧化的产物为水锰矿和布塞尔矿;当反应温度为60 ℃时,其产物的类型不变(水锰矿和布塞尔矿),然而衍射峰峰强都相对减弱。这表明温度升高后,Mn(II)氧化产物的量减少,结晶度减弱。产生此现象的原因可能是反应体系温度的升高使反应溶液中可溶解的O2减少,故不利于Mn(II)的氧化和锰氧化物的形成;同时高温使反应的速率加快,因此不利于结晶的形成,使产物的结晶度降低,造成衍射峰变弱。
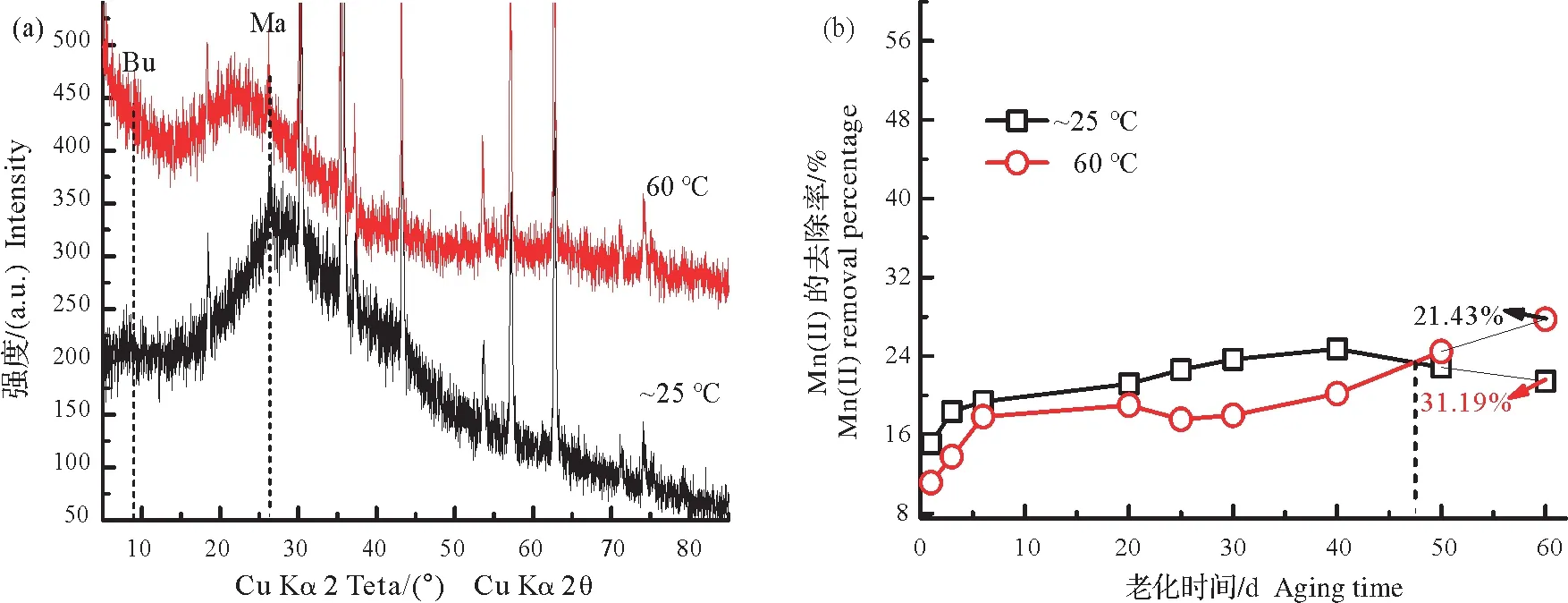
图7 pH 7和不同温度(~25 ℃常温和60 ℃)条件下,24 mmol/L Mn(II)在磁铁矿体系老化60 d终产物的XRD图谱(a)及上清液中Mn(II)去除百分比随老化时间变化(b)Fig.7 XRD patterns of the final products of 24 mmol/L Mn(II)aged for 60 days in the presence of magnetite at pH 7 and different temperatures(room temperature of 25 ℃and 60 ℃)(a),and the corresponding Mn(II)removal in supernatant(b)
另外,两体系中Mn(II)的去除率显示,前48 d期间低温度反应体系上清液中Mn(II)的去除率相对较大,可见参与反应的Mn(II)的确相对较多;然而其去除率在48 d后逐渐低于高温体系。这主要是由于高温体系中氧气含量少,Mn(II)的氧化沉淀作用比较弱,产物结晶也较慢,故会随时间增长逐渐形成含量更多且比表面积相对较大的弱结晶三价锰矿物,由于其对Mn(II)的吸附去除量高于相对较强结晶的锰氧化物,因此造成后期高温体系中Mn(II)的去除量逐渐大于低温体系。
2.3 不同氧化铁体系中Mn(Ⅱ)的催化氧化
为了深入探讨磁铁矿催化Mn(II)氧化的作用与其他铁氧化物的差异,使相同浓度的Mn(II)在含有1.0 mmol/L AQDS 的不同氧化铁体系中进行长期老化。实验结果显示,水铁矿体系中Mn(II)长期老化的产物主要为水锰矿(图8a);而针铁矿和磁铁矿体系中Mn(II)氧化的产物除了含Mn(III)的水锰矿外,还有一定量的布塞尔矿,且磁铁矿体系中产物的布塞尔矿衍射峰稍强于针铁矿体系(图8a)。以上表明,3 种氧化铁对Mn(II)氧化的催化能力由大到小依次为磁铁矿、针铁矿和水铁矿。另外,反应过程中体系上清液中单位面积矿物对Mn(II)的去除率大小顺序和催化能力一致(图8b)。
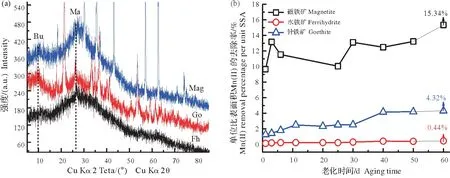
图8 常温(~25 ℃)、pH 7和相同Fe/Mn比条件下,8 mmol/L Mn(II)在不同氧化铁体系(磁铁矿、水铁矿和针铁矿)老化60 d终产物的XRD图谱(a)及上清液中Mn(II)去除百分比随老化时间变化(b)Fig.8 XRD patterns of the final products of 8 mmol/L Mn(II)aged for 60 days in the presence of different iron oxides(magnetite,ferrihydrite,and goethite)at the same Fe/Mn mole ratio at pH 7 and room temperature(25 ℃)(a),and the corresponding Mn(II)removal in supernatant(b)
3 讨论
3.1 Mn(II)在磁铁矿表面的催化氧化途径及机制
综上实验结果不难看出,同为氧化铁,磁铁矿对Mn(II)氧化的催化能力显著大于水铁矿,稍大于针铁矿。这可能取决于氧化铁作为半导体所具备的传递电子能力的差异。先前的研究已经证实,Mn(II)在半导体氧化铁表面主要具有3 种传递电子的途径。途径一:电子通过矿物界面氧化还原电对Fe(II)/Fe(III)促进Mn(II)和O2之间的电子传递,即通过Mn(II)-Fe(II,III)-O2络合的电子传递途径;途径二:电子直接在矿物表面相互接触的络合Mn(II)和络合O2之间进行电子传递,即通过Mn(II)-O2络合物进行电子传递的途径;途径三:电子通过半导体矿物的导带在即使不直接相互接触的络合Mn(II)和络合O2之间进行电子传递,即通过矿物表面络合Mn(II)-导带水铁矿-络合O2进行电子传递的途径[17,33,45],前两种传递途径归属于界面催化途径,第三种属于电子传递途径[17,33]。而磁铁矿特有的性质会使Mn(II)的界面催化和电化学催化两个途径都增强。首先,磁铁矿本身内部具有Fe(II)/Fe(III)氧化还原电对,因此不需要满足一定条件形成Fe(II),反应开始即具备此氧化还原电对,故相对于只含Fe(III)的水铁矿和针铁矿,其表面这一电子传递途径的实现就相对容易;另外,磁铁矿的带隙能最小,仅0.1 eV[25],远小于水铁矿的2.7 eV[37]及针铁矿的2.1 eV[36]。故其传递电子、允许电子穿过的能力就相对更强,即磁铁矿表面Mn(II)和O2之间的电子传递更易实现。此外,磁铁矿结构中的Fe(II)在O2存在时可能会通过发生芬顿反应产生强氧化性的ROS,其也会对Mn(II)产生氧化作用,这也可能是造成其具有相对较强催化活性的原因之一[29]。综合以上原因,磁铁矿对Mn(II)氧化的催化能力强于水铁矿和针铁矿。Mn(II)在磁铁矿表面的催化氧化途径包括界面催化氧化、电化学催化氧化和芬顿反应产物氧化催化3 种途径。
3.2 不同环境因素对Mn(II)在磁铁矿体系氧化的影响及机制
以上实验结果表明,AQDS 可以促进Mn(II)在磁铁矿表面的氧化,尤其利于具有更高价态Mn(IV)的锰氧化物的形成,如布塞尔矿。这主要是由于AQDS 具备“电子穿梭体”的特性[46],这一性质使其很容易从Mn(II)捕获电子,形成极易失去电子的还原性AQDS,此中间产物又接着把电子传递给O2,从而使Mn(II)的氧化更容易、更快速。在这一过程中磁铁矿起到电子传递通道的作用[14,17],辅助AQDS 传递电子的实现。另外,Mn(II)的初始反应浓度越高越有利于锰氧化物的形成,尤其是高价的锰氧化物,除了因为较高的反应物浓度更有利于反应过程的推进以外,较高的Mn(II)浓度更有利于电化学催化途径的实现[17]。pH 较高的体系锰氧化物的形成速率和产量都大大增加,这一方面由于较高pH 条件下Mn(II)氧化的反应能减小,使得其氧化反应的实现变的相对容易,另一方面因为Mn(II)在高pH 条件下会发生自我沉淀反应形成锰氧化物,此沉淀本身也会对Mn(II)氧化起到催化促进的作用,即Mn(II)的自催化氧化过程。而温度主要通过影响反应体系中O2的反应浓度及Mn(II)氧化产物的结晶速率影响锰氧化物的种类和产量,较低温度的体系更有利于Mn(II)在磁铁矿表面的氧化及结晶。
4 结论
Mn(II)在磁铁矿表面的催化氧化产物主要为水锰矿和布塞尔矿,且其氧化成矿的速率和氧化锰产物的种类受到不同环境因素的影响,如共存腐殖质(如AQDS)、Mn(II)自身初始反应浓度、环境pH、反应温度及共存铁氧化物的种类等。其中,AQDS、较高的Mn(II)初始反应浓度、较高的反应pH和较低的温度都更有利于Mn(II)催化氧化速率及氧化程度的提高,促进锰氧化物的生成,尤其是含有Mn(IV)的锰氧化物。另外,相较于水铁矿和针铁矿,磁铁矿对Mn(II)氧化的催化能力相对更强,这主要取决于Mn(II)在磁铁矿表面的3 种催化氧化途径,包括界面催化、电化学催化和芬顿反应产物氧化催化3 个途径。磁铁矿同时含有Fe(II)/Fe(III)及其较强的半导体特性加速了以上3 种途径的实现。以上研究为了解和预测富铁锰土壤环境中两元素耦合的地球化学循环行为提供了更深一层的理论基础。
