一株大菱鲆源杀鲑气单胞菌非典型株的分离鉴定及毒力基因型
2022-09-30王鹤王文豪黄华刘晓丹张丽文杨涛胡乐彬李战军
王鹤,王文豪,黄华,刘晓丹,张丽文,杨涛,胡乐彬,李战军
(1.烟台市海洋经济研究院,山东 烟台 264006;2.烟台宗哲海洋科技有限公司,山东 烟台 264006;3.山东省渔业发展和资源养护总站,山东 烟台 264003)
大菱鲆Scophthalmusmaximus隶属于鲽形目Pleuronectiformes鲽亚目Pleuronectoidei鲆科Bothidae菱鲆属Scophthalmus,原产于大西洋,是底栖型冷水鱼类[1]。自1992年中国水产科学研究院黄海水产研究所从英国将其引入中国后,随着规模化苗种繁育技术的突破与工厂化养殖模式的创建,大菱鲆养殖在黄渤海三省一市沿岸迅速发展,大菱鲆亦被誉为中国海水养殖良种引进的典范[2]。但随着集约化养殖规模的不断扩大,细菌性病害日益严重,给大菱鲆养殖业带来了严重经济损失。据报道,可感染大菱鲆发病的病原菌主要有鳗弧菌[3]、哈维氏弧菌[4]、嗜水气单胞菌[5]、迟缓爱德华氏菌[6]和副乳房链球菌[7]等,可引起大菱鲆体表溃疡、皮下及肌肉充血出血、腹水、器官坏死等病征。
疖疮病(furunculosis)是养殖鲑鳟常见的细菌病,病原为气单胞菌科Aeromonadaceae气单胞菌属Aeromonas的杀鲑气单胞菌Aeromonassalmonicida。杀鲑气单胞菌是一种嗜冷、无动力和兼性厌氧革兰氏阴性菌,广泛分布于海、淡水中[8],该菌除感染鲑鳟鱼类外,还可感染鲤科Cyprinidae、鳗鲡科Anguillidae[9]、鳎科Pleuronectidae[10]和鲆科[11]等鱼类。自1992年首次从西班牙养殖大菱鲆中分离到杀鲑气单胞菌以来[12],该菌感染大菱鲆的报道日渐增多[13-14],中国也有大菱鲆感染引起疖疮病的相关报道[11,15]。目前,已得到公认的杀鲑气单胞菌有5个亚种[16]:杀鲑亚种A.salmonicidasubsp.salmonicida、杀日本鲑亚种A.salmonicidasubsp.masoucida、无色亚种A.salmonicidasubsp.achromogenes、史氏亚种A.salmonicidasubsp.smithia和溶果胶亚种A.salmonicidasubsp.pectinolytica。在中国,引起大菱鲆疖疮病的病原多为杀鲑气单胞菌无色亚种,尚未见杀日本鲑亚种感染养殖大菱鲆发病的报道。
2020年,在对山东省烟台市大菱鲆主产区常规病害监测中发现,某养殖场大菱鲆有体色发黑、腹部膨大的患病个体,解剖发现,患病个体腹腔有淡红色腹水、肠肿胀、脾肿大和肾坏死。本研究中,以自然发病大菱鲆为试验材料,分离纯化获得一株优势菌BHAS-1,通过临床症状观察、生理生化鉴定和序列比对分析等方法,鉴定其为杀鲑气单胞菌杀日本鲑亚种。本研究中首次报道了中国杀鲑气单胞菌杀日本鲑亚种对养殖大菱鲆的自然感染致病,通过对分离菌株开展毒力基因检测、药敏试验等,以期为该菌引起的非典型疖疮病的有效防控提供科学参考。
1 材料与方法
1.1 材料
试验用无典型疖疮病症状的大菱鲆样品于2020年10月采自山东省烟台市某深井海水室内流水养殖车间,养殖水温为17 ℃左右,患病个体体质量为83.4~433.3 g,平均体质量为248.3 g。试验用健康大菱鲆购自烟台宗哲海洋科技有限公司。
水解酪蛋白琼脂培养基(muller hinton,MH)、脑心浸液培养基(brian heart infusion,BHI)、革兰氏染色试剂盒和生理生化鉴定管等均购自北京陆桥技术股份有限公司;药敏纸片购自杭州滨和微生物试剂有限公司;细菌基因组提取试剂盒、PCR扩增相关试剂购自宝生物(大连)有限公司;试验引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 病原菌分离纯化 取有典型病征的濒死个体,首先进行体表、鳃等组织的寄生虫检查,然后用体积分数为75%的乙醇擦拭腹部,用无菌工具解剖,取肝、肾、脾等组织。经无菌水冲洗、研磨后,在BHI琼脂平板划线,28 ℃下倒置培养24~48 h,观察记录菌落形态特征,取优势菌纯化2~3次后,用终体积分数为40%的甘油保种,-80 ℃超低温冰箱中保存备用。
1.2.2 菌株鉴定 采用革兰氏染色法对菌株染色观察,并应用生理生化鉴定管测定菌株生理生化特性。按照细菌基因组DNA提取试剂盒要求提取纯化菌株DNA。分别使用16S rRNA通用引物(27F:5′AGAGTTTGATCMTGGCTCAG 3′,1 492R:5′GG- TTACCTTGTTACGACTT 3′)、DNA促旋酶B亚基基因(gyrase B,gyrB)特异性引物(F: 5′TCCGGCGGTCTGCACGGCGT 3′,R: 5′TTGTCCGGGTTGTACTCGTC 3′)和毒力阵列蛋白基因(又称A层蛋白基因,virulence array protein A,vapA)特异性引物(F: 5′ACAGTGCACCGAAGGTTGAT 3′,R: 5′ACGGCAGAGCTTGTCTACCT 3′)进行扩增。
1.2.3 人工回归感染试验 将保存备用的分离株活化后在BHI平板培养24~48 h,用质量分数为0.9%的灭菌生理盐水洗脱纯培养物制成菌悬液,平板计数。将菌悬液分别制成4.1×107、4.1×108、4.1×109、4.1×1010CFU/mL 4个梯度浓度。选择个体大小与患病个体接近的健康大菱鲆作为回归感染对象,在车间暂养1周后,随机分为5组,每组10尾,每尾腹腔注射梯度菌悬液0.1 mL,对照组注射相同体积的无菌生理盐水。人工感染后养殖水温为(17±0.5)℃,每天换水30%并记录发病、死亡情况,取濒死病鱼的内脏器官再次分离鉴定病原菌。按照改良寇氏法[17]计算半致死浓度。
1.2.4 毒力基因检测 用PCR检测分离菌株的气溶素(aer)、封闭条带毒素(zot)、DNA酶(dna)、丝氨酸蛋白酶(ser)、磷脂酶(lip)、S层蛋白(sp)、热不稳定性细胞兴奋性肠毒素(alt)、细胞毒性肠毒素(act)、热稳定性细胞兴奋性肠毒素(ast)、胞外蛋白酶(epa)、鞭毛蛋白(fla)和弹性蛋白酶(ahyB)等12个毒力相关基因的携带情况[18],各毒力基因引物序列、退火温度及目的片段大小见表1。PCR体系同“1.2.2节”,采用10 g/L琼脂糖电泳检测,紫外凝胶成像拍照后,将与预期目的片段大小一致的PCR扩增产物进行测序验证。
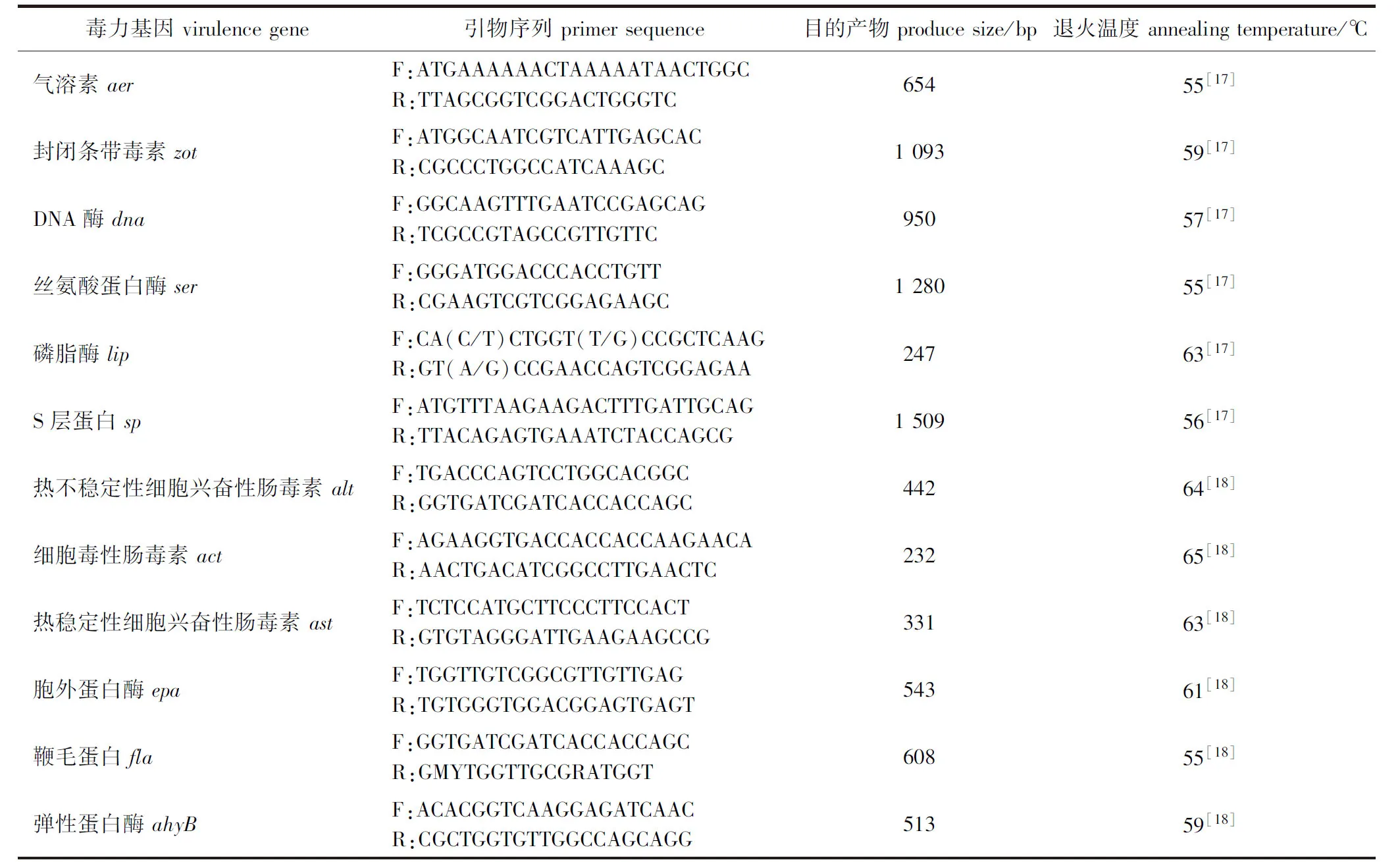
表1 各毒力基因PCR引物、退火温度和目的产物长度Tab.1 Primer sequence, annealing temperature and product sizes of virulence genes
1.2.5 药敏试验 参照美国临床检验标准委员会(CLSI)推荐的纸片扩散法(Kirby-Bauer, K-B)操作标准进行抗生素药物敏感性测试。按照麦氏比浊法将分离株制成浓度为1.0×108CFU/mL的菌悬液,均匀涂布于MH平板后,贴药敏纸片,28 ℃下培养24 h后,根据菌落生长情况测定抑菌圈。测试用抗生素共计10类22种,每种药物设置3个重复。依据CLSI[19]标准判定药物敏感性,标准未涵盖部分参照杨移斌等[20]的判定标准。
2 结果与分析
2.1 病原菌分离鉴定
2.1.1 病原菌分离与形态学观察 在濒死病鱼体表、鳃和内脏处均未观察到寄生虫感染。在内脏组织中分离获得多株形态、大小一致的优势菌,取脾组织获得的优势菌命名为BHAS-1。该菌株在BHI平板上形成圆形、细小、白色的微隆起菌落,生长速度较为缓慢,菌落表面光滑湿润、边缘整齐,直径为0.6~1.0 mm;在5%羊血(体积分数,下同)平板上菌落略大,24 h未发生溶血(图1A),72 h左右可见明显的β溶血环(图1B);革兰氏染色后显微镜检为红色、杆状细菌(图1C)。

A—5%羊血培养基中菌落形态(24 h,未发生溶血);B—5%羊血培养基中菌落形态(72 h,β溶血);C—革兰氏染色显微观察。A—colony morphology cultured with 5% sheep blood plate, no hemolysis occurred after 24 h; B—colony morphology cultured in 5% sheep blood plate in 72 h with β hemolysis; C—observation with microscope.图1 分离株BHAS-1的菌落形态及革兰氏染色形态Fig.1 Colony morphology and micro-morphology of stain in strains BHAS-1
2.1.2 生理生化反应 该菌株在6.5%的NaCl中不能生长,无运动性,氧化酶反应、VP反应(Voges Proskauer,VP)、甲基红反应呈阳性,不产生吲哚,不能利用鸟氨酸、赖氨酸脱羧,精氨酸双水解呈阳性,不能利用苯丙氨酸脱氨,可以利用葡萄糖、麦芽糖、半乳糖、鼠李糖、山梨糖、蜜二糖、蔗糖和木糖产酸,具β-半乳糖苷酶活性,可以还原硝酸盐,不能利用甘露糖、阿拉伯糖、阿拉伯醇、肌醇、枸橼酸和苦杏仁苷,不能水解七叶灵和尿素。该菌株与杀鲑气单胞菌杀日本鲑亚种、杀鲑亚种和无色亚种的部分生理生化指标见表2。
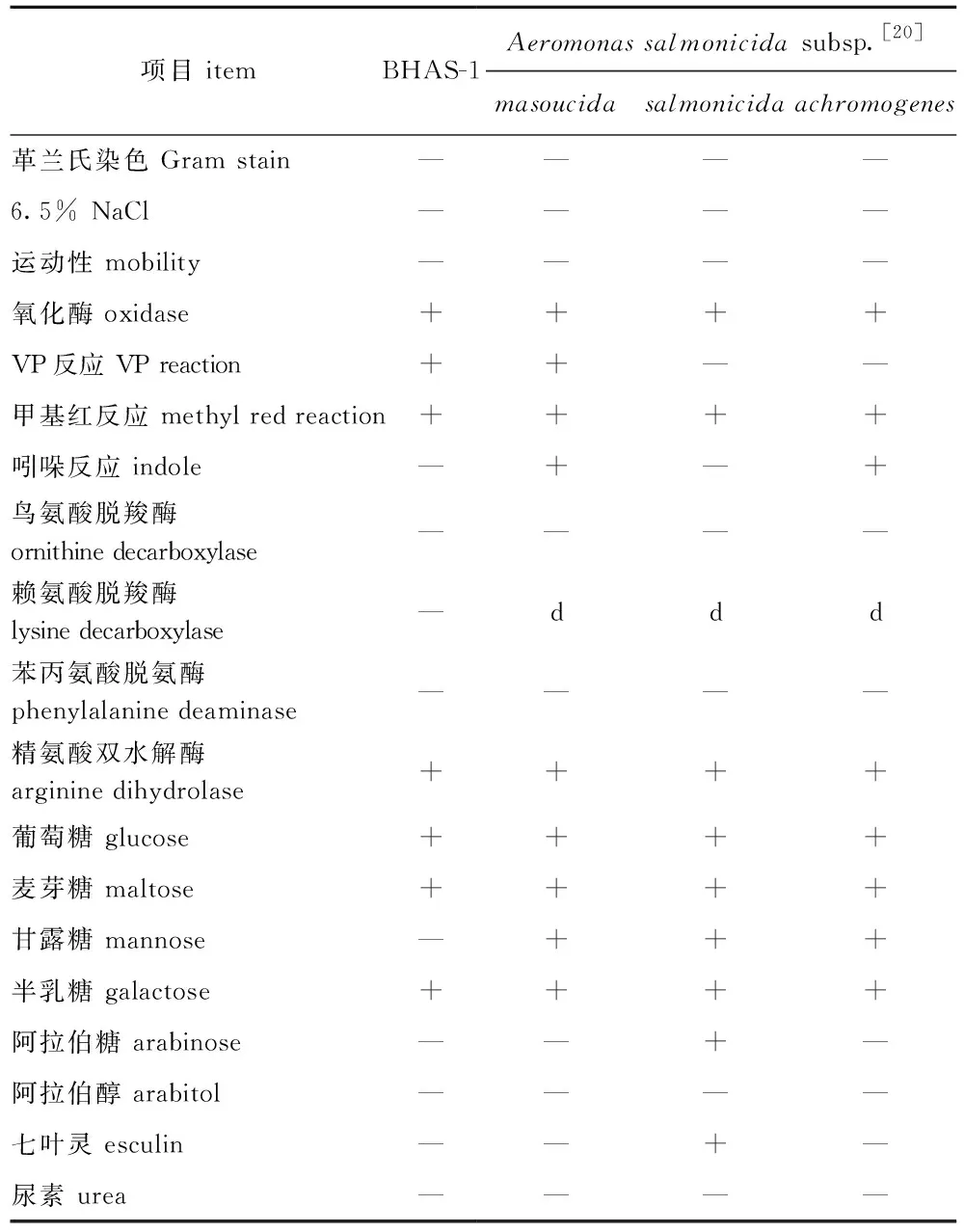
表2 BHAS-1的生理生化特性Tab.2 Physiological biochemical characteristics of BHAS-1
2.2 分子特征鉴定
扩增菌株BHAS-1的16S rRNA、gyrB和vapA基因,分别获得1 452、1 073、1 652 bp的序列。
在线BLAST比对结果显示:BHAS-1的16S rRNA序列与A.salmonicidasubsp.salmonidaATCC 33658株及A.salmonicidasubsp.masoucidaNBRC 13784株的同源性较高,一致性分别为99.84%和99.65%;BHAS-1的gyrB序列与A.salmonicidasubsp.masoucidaRFAS1株及A.salmonicidasubsp.salmonidaSL1株的同源性较高,一致性分别为99.62%和99.53%;BHAS-1的vapA序列与A.salmonicidasubsp.masoucidaRZ6S-1株同源性最高,一致性为99.63%,与其他亚种一致性均低于99%。分别基于杀鲑气单胞菌不同亚种、温和气单胞菌A.sobria、中间气单胞菌A.media、嗜水气单胞菌A.hydrophila等菌株的16S rRNA、gyrB、vapA基因序列构建系统发育树,结果显示,在16S rRNA和gyrB系统发育树中,BHAS-1与杀鲑气单胞菌不同亚种聚为一支,而在vapA系统发育树中,该菌株与杀日本鲑亚种单独聚为一支,而杀鲑亚种则另外聚为一支(图2)。


图2 基于16S rRNA、gyrB和vapA基因序列构建的系统发育树Fig.2 Phylogenetic tree of strains BHAS-1 based on 16S rRNA,gyrB and vapA genes sequence
2.3 人工回归感染试验
人工感染2 d后,部分大菱鲆出现体表及鳍间红斑溃疡、腹部膨大和肛门红肿等症状,解剖可见部分病鱼腹水、肝充血、肠肿胀、脾肿大和肾坏死且内有乳白色脓液等症状,与自然感染发病个体的症状相似,发病个体典型症状见图3。最高浓度组注射后第3天开始出现死亡,死亡高峰在第5~7天,第9天时全部死亡;次高浓度组第4天开始出现死亡,第14天时累计死亡率为90%,对照组无死亡,各浓度组累计死亡情况详见图4。根据各浓度组死亡情况,采用改良寇氏法计算LD50为1.62×108CFU/mL。从人工感染发病鱼体再次分离病原菌,可得到与BHAS-1形态、生理生化结果一致的菌株,因此,认为分离株BHAS-1是引起大菱鲆上述症状的致病菌。
用线支撑连接其墙板顶部、框架梁,把已经预留好的U型插口,选择钢筋从上部内侧插入,同时连接好钢筋和梁,选择现浇混凝土。架起梁主筋,以柱箍筋为支撑,并且套住已经掰开的箍筋,依据自下而上的方式。此方式操作方便快捷、施工简单,可以确保构件满足抗震需求,上端锚起到固定连接作用,下端只是用来限位连接。
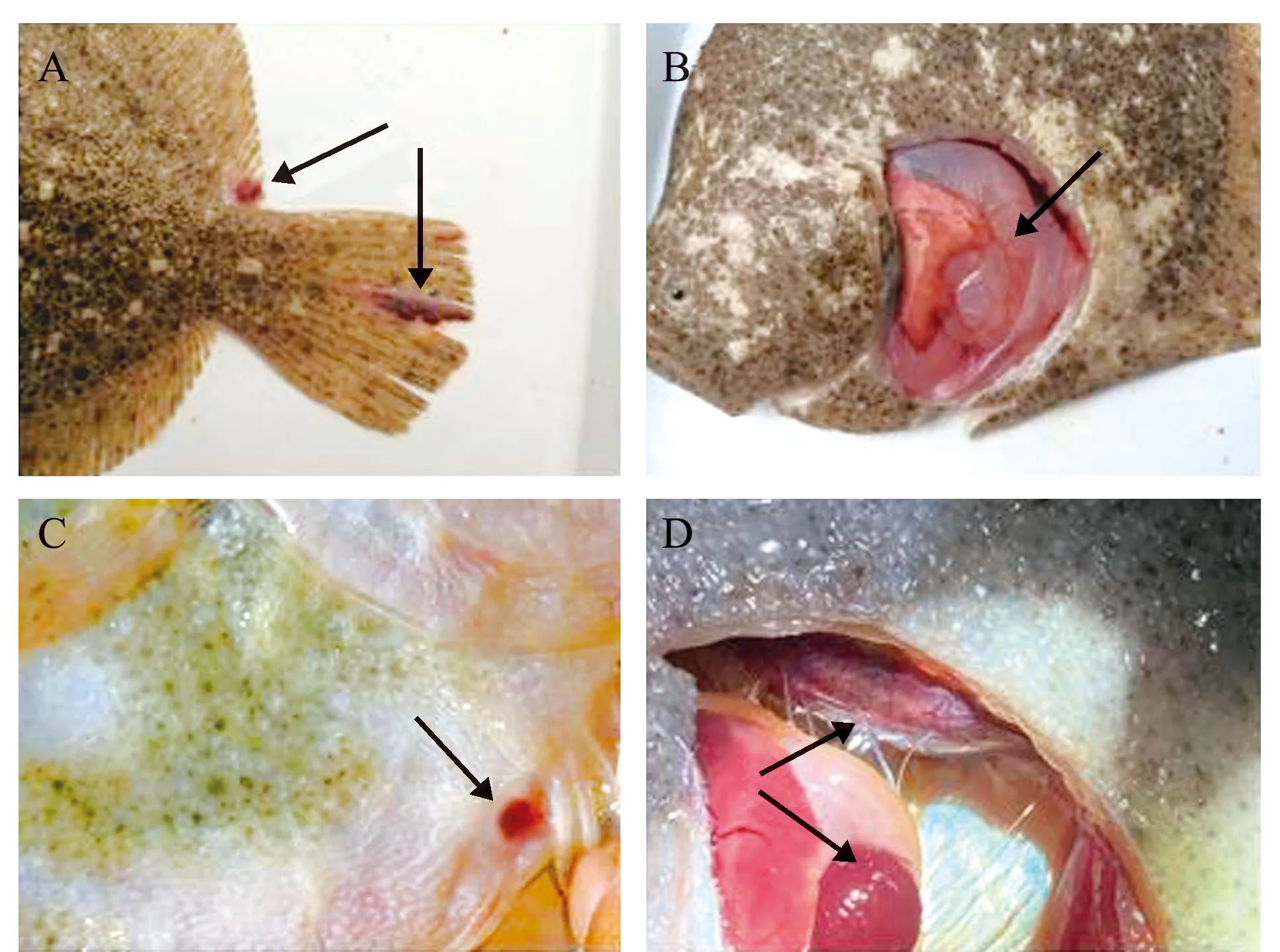
A—鳍间红斑溃疡;B—肠肿胀;C—肛门红肿;D—脾、肾肿大。A—body surface scabies; B—intestinal enlargement; C—red and swollen anus; D—enlarged kidney and spleen.图3 人工感染BHAS-1菌大菱鲆主要症状Fig.3 Main symptoms of challenged with BHAS-1 turbots

图4 人工回归感染累计死亡曲线Fig.4 Accumulative death number of turbot experimentally infected with strains BHAS-1
2.4 分离菌株的毒力基因型
经PCR扩增检测,BHAS-1携带的毒力基因片段长度全部与目的片段长度一致,毒力基因型为aer+-zot+-dna+-ser+-lip+-sp+-alt+-act+-ast+-epa+-fla+-ahyB+(图5)。

M—DNA分子质量标准;1~12分别为aer、zot、dna、ser、lip、sp、alt、act、ast、epa、fla、ahyB基因。M—DNA marker; 1-12,aer,zot,dna,ser,lip,sp,alt,act,ast,epa,fla and ahyB genes.图5 分离株BHAS-1毒力基因的PCR检测Fig.5 PCR products of the virulence genes from the isolated strains BHAS-1
2.5 药敏试验结果
菌株BHAS-1对10类22种测试抗生素的敏感性存在差异,对头孢曲松、头孢拉定、头孢哌酮、庆大霉素、诺氟沙星、恩诺沙星、环丙沙星、氧氟沙星、四环素、盐酸多西环素、红霉素、多黏菌素B和呋喃唑酮等7大类13种抗生素类药物敏感,仅从测试抗生素来看,药物敏感率为59.09%;对青霉素、卡那霉素、磺胺异恶唑、复方新诺明、万古霉素、利福平和氯霉素等6类7种抗生素耐药,耐药率为31.82%;对氨苄西林和链霉素2种抗生素中度敏感,中介率为9.09%(表3)。
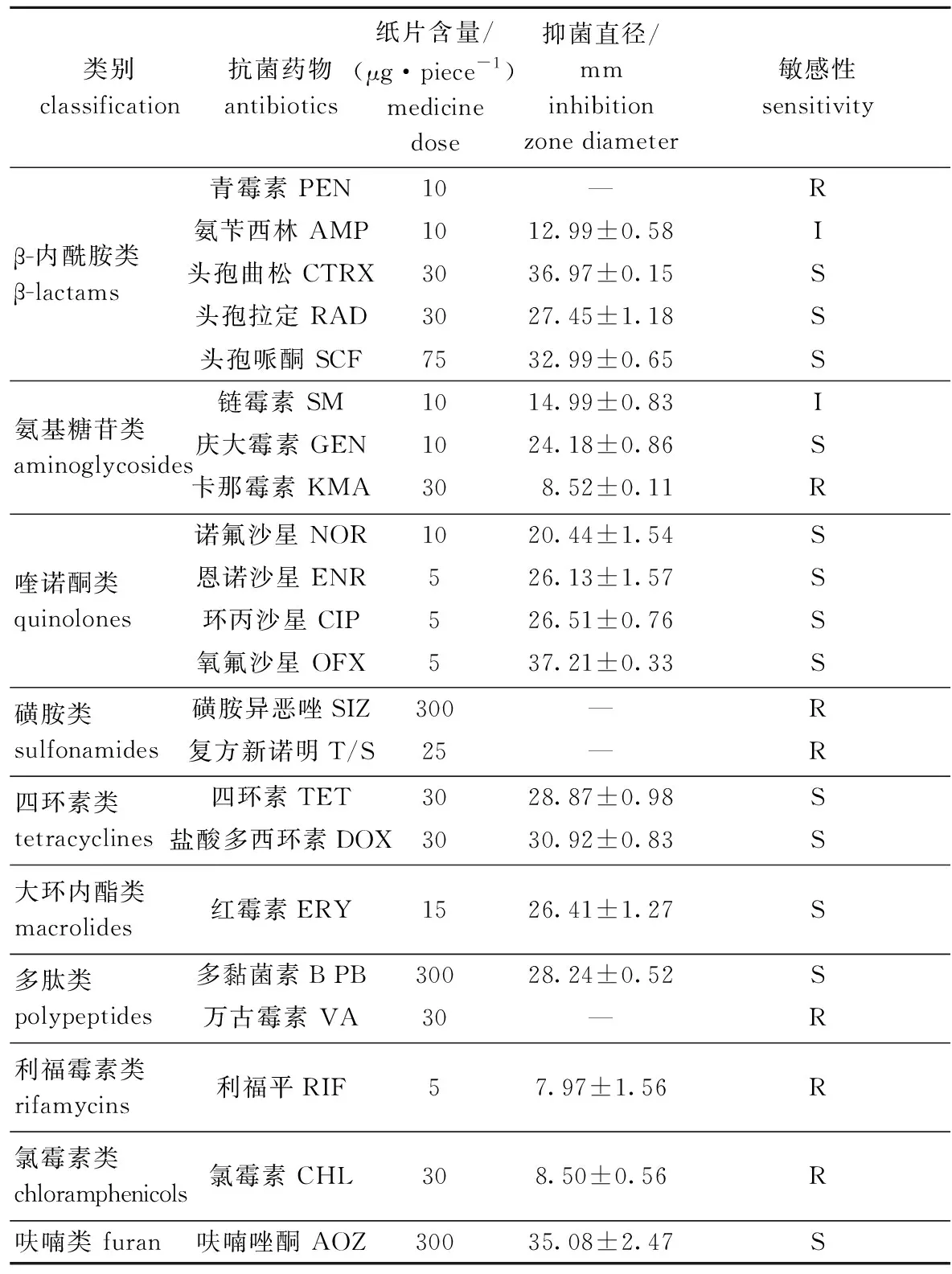
表3 分离株BHAS-1对10类22种抗生素的敏感性Tab.3 Sensitivity of strains BHAS-1 to 22 kinds of antimicrobial drugs
3 讨论
3.1 杀鲑气单胞菌亚种的鉴定
气单胞菌是一类水生革兰氏阴性杆菌,广泛分布于海水和淡水动物及其环境中。其中,嗜水气单胞菌、维氏气单胞菌和杀鲑气单胞菌是重要的水生动物致病菌[21]。杀鲑气单胞菌是已知的最古老的病原菌之一,自1984年作为一个杂交组从嗜水气单胞菌复合物中分离以来,陆续有5个亚种被认定,其中包括4个嗜冷亚种(杀鲑亚种、杀日本鲑亚种、无色亚种、史氏亚种)及1个嗜常温亚种(溶果胶亚种)[22]。不同亚种的形态学和生理生化特性略有差异,根据色素产生能力、溶血性和能否发酵糖等亚种特性,通常将无性系种群——杀鲑亚种称为典型株(typical),其他亚种及不符合亚种特征的菌株称为非典型株(atypical)[23]。
根据Gulla等[24]提出的以发生溶血,在色氨酸酵母培养基中可产生棕色水溶性色素,产生吲哚反应,水解明胶、七叶灵,可利用阿拉伯糖、甘露糖等作为杀鲑气单胞菌典型株的判定标准,本研究中分离获得的BHAS-1株不能同时具备上述特征,系非典型株。与典型株的高度同质化不同,非典型株种类较多且异质化程度高,亚种特性差异较大[25]。本研究中,分离株的吲哚反应、甘露糖发酵两项结果与相关文献结果不同,推测出现偏差可能与宿主来源、菌株变异和环境适应等因素有关。分离株生理生化指标出现与模式株不同结果的报道较多[10-11,17],仅依靠生理生化特性不能对杀鲑气单胞菌非典型株进行准确鉴别,需要其他手段辅助。
不少学者尝试通过扩增各类基因鉴别杀鲑气单胞菌不同亚种。吕俊超等[11]应用16S rRNA对分离的杀鲑气单胞菌鉴定时,分离株与无色亚种聚成一个分支,确定分离株为杀鲑气单胞菌无色亚种。但更多学者分离的菌株与多个亚种聚在一起[10,17,20],无法通过该基因直接鉴定到亚种水平,需结合其他测试结果综合判断,gyrB[11]、ropD[10]、fstA[26]、dnaJ[27]和recA[27]等基因亦是如此。由此可见,上述基因在杀鲑气单胞菌种内高度保守,不能直接用于亚种鉴别,仅可作参考。本研究中得到与上述结论一致的结果,分离株BHAS-1在以16S rRNA和gyrB序列构建的系统发育树中与多个亚种聚为一支,只能得出与杀日本鲑亚种、杀鲑亚种和无色亚种最为接近的结论。近年来,应用vapA对杀鲑气单胞菌进行亚种分类的报道渐多,除溶果胶亚种外,其他亚种均具有明显不同的A层结构[24],许氏平鲉[27]、大菱鲆[28]、鳜鱼[29]来源的分离株均应用该基因实现了亚种水平的有效鉴别。本研究中,扩增测序了分离株的vapA基因片段并构建系统发育树,分离株与杀日本鲑亚种单独聚为一支,通过该系统发育树可以判断分离株系杀日本鲑亚种。vapA在杀鲑气单胞菌种内的高度变异,使得快速、准确鉴别不同亚种或非典型株成为可能,且该基因表现出一定的宿主特异性[24]。
3.2 杀鲑气单胞菌非典型株感染的临床症状与感染途径
有研究认为,杀鲑气单胞菌典型株一般以引起鱼类疖疮为主要病征,而非典型株则以皮肤溃疡或非典型疖疮为主[30],症状主要表现为鳃部、浆膜和鳍基部充血、败血等[31]。在国外已有多种杀鲑气单胞菌非典型株感染大菱鲆致病的报道[28,32],国内仅有无色亚种[1,11,15,33]感染报道。无色亚种感染大菱鲆表现为鳍基部、口周和鳃部出血,腹腔腹水,组织病理主要发生在鳃、皮肤、肌肉、肾脏、脾脏和心脏等组织,肝脏可检出病原菌,但无明显组织病变,肠无病变[32]。值得注意的是,该研究中,人工感染症状与自然感染并不完全一致,人工感染未观察到自然感染发病大菱鲆出现的肝脏、肾脏充血[32]。中国报道的大菱鲆无色亚种感染则有皮下出血[11]、典型化脓疖疮症[15]和红斑溃疡症[33]等不同表现。由此可见,杀鲑气单胞菌非典型株致病临床表现与病理特征存在差异,即使同一亚种感染亦有不同临床症状,这可能与感染菌株毒力特征、宿主反应等有关。本研究中,以自然感染发病大菱鲆为对象,从无典型疖疮病症的濒死大菱鲆内脏分离到一株优势菌,经生理生化和分子生物学鉴定,判定为杀鲑气单胞菌杀日本鲑亚种。回归感染试验中,急性死亡病例未出现明显疖疮,慢性感染死亡有体表、鳍间红斑溃疡的病例,病理特征主要表现为肠道肿胀、脾肿大和肾坏死。鉴于无色亚种感染的不同临床表现,本研究中分离株感染出现的表观特征是否是杀日本鲑亚种的主要感染症状,仍需更多数据支撑。
除此之外,不同感染方式下的临床症状与半致死浓度均有差异。Han等[27]用杀日本鲑亚种人工感染许氏平鲉时发现,肌肉注射比腹腔注射症状更明显且较严重,肌肉注射时注射部位出现明显溃疡,而腹腔注射部位仅发红无溃疡,腹腔注射的半致死浓度可高于肌肉注射10倍甚至100倍。浸泡感染所需浓度更高,且致死率低[34],在确定腹腔注射半致死浓度为105CFU/mL时,用100倍浓度浸泡攻毒,并不能引起大菱鲆感染或死亡[32]。在本研究的人工感染预试验中,用1010CFU/mL的BHAS-1株浸泡大菱鲆24 h,受试动物无发病和死亡,鱼组织中不能分离到病原菌,用同样浓度腹腔注射,24 h内致死率为100%(数据未列出),这说明杀鲑气单胞菌致病与感染途径密切相关。研究表明,杀鲑气单胞菌典型株可通过体表损伤、鳃和肠上皮细胞3条途径入侵鱼体[35]。Du等[34]研究杀日本鲑亚种对大西洋鲑感染的致病机理时得出类似结论,认为上述3条途径亦是杀日本鲑亚种最有可能的感染途径,致病菌通过鳃、皮肤、肠道进入鱼体定植后,通过血液循环或鳃、皮肤、肠上皮进入脾、肝和肾等器官,引发全身感染。值得注意的是,该研究中,在人工感染后未发病存活的鱼体内仍能检出细菌的存在[34],提示在环境恶化时,致病菌可能会再次迅速繁殖,引起鱼体感染或死亡。
3.3 杀鲑气单胞菌的毒力基因与致病力
细菌的毒力因子是决定其致病力的重要因素之一,杀鲑气单胞菌的毒力因子按功能可分为外毒素、胞外酶、黏附因子、抗药基因、分泌系统、铁摄取系统和群体效应7大类[17,23]。外毒素是某些细菌繁殖过程中分泌到菌体外的细菌毒素,常见的外毒素有气溶素、溶血素和肠毒素等[36]。蛋白酶、脂肪酶和甘油磷脂-胆固醇酰基转移酶等蛋白类胞外产物在杀鲑气单胞菌致病性中也发挥着重要作用,这些酶能够帮助细菌破坏并溶解宿主蛋白,导致宿主结构损伤,一些酶之间还可能产生协同作用[37]。气单胞菌的主要黏附因子分为菌毛黏附素和非菌毛黏附素两类,许多黏附因子的毒性由其外膜蛋白产生,如脂多糖、鞭毛蛋白和S层蛋白等[38]。本研究中,选取外毒素、黏附因子和胞外酶3类毒力因子,检测到分离株BHAS-1携带5种外毒素(alt、act、ast、aer、zot)、5种胞外酶(epa、lip、dna、ser、alyB)和2种黏附因子(fla和sp)。
鉴于毒力基因数量、类型与致病力间的关系[39],提示本研究中的分离株BHAS-1具有较强的致病力,但实际上BHAS-1的半致死浓度为1.62×108CFU/mL,并未表现出强毒株的致病能力。有研究证实,仅依据毒力因子的存在不足以预测杀鲑气单胞菌在大菱鲆中的致病力,毒力基因不能作为决定毒力的唯一因素[40],菌株致病能力除与毒力基因的种类数量有关外,还可能与其他因素有关,如温度。温度是影响致病力的重要因素,Wang等[28]通过28 ℃下连续传代培养,获得杀鲑气单胞菌杀日本鲑亚种野生株R26S-1的衍生突变株R26S,衍生突变株LD50是野生株的10 000倍以上,毒力明显减弱。通过基因组测序进一步分析发现,衍生突变株毒力减弱可能与T3SS(type three secretion system)分泌系统相关质粒缺失有关。该系统在杀鲑气单胞菌等革兰氏阴性菌的毒力发挥中起重要作用[41],结构蛋白在高温应激下发生碱基缺失或插入重排,进而导致细菌种群中选择衍生出弱毒株[42]。本研究中的分离纯化均在28 ℃下进行,分离株BHAS-1是否因连续高温传代导致了某些基因突变,进而衍生为弱毒株,还有待进一步验证。
此外,对细菌毒力因子开展深入研究对于细菌检测及病害防控具有重要意义。Beaz-Hidalgo等[26]和Keeling等[22]分别依据杀鲑气单胞菌fstA和vapA两种特异性靶基因,建立了PCR和实时荧光定量PCR检测方法;Chapela等[43]建立了杀鲑气单胞菌、鳗弧菌V.anguillarum和海洋屈挠杆菌Tenacibaculummaritimum多重PCR,上述方法对杀鲑气单胞菌的检测最高灵敏度可达(5±0) fg,实现了基于保守毒力基因的病原菌快速检测;缺少Ⅲ型分泌系统的弱毒株则可作为减毒活疫苗的候选[29]。
3.4 杀鲑气单胞菌的药物敏感性与病害防控策略
国内曾有学者对不同来源的杀鲑气单胞菌分离株进行抗生素敏感性测试,结果略有差异。吕俊超等[11]曾对2007年分离获得的大菱鲆源杀鲑气单胞菌无色亚种db14进行30种抗生素的耐药测试,分离株对23种抗生素耐药,对其中16种具有完全抗性;杨移斌等[20]对来源于斑点叉尾鮰的无色亚种ry01的药敏结果显示,该分离株对测试19种抗生素中的11种高度敏感,仅对磺胺异恶唑、利福平等7种药物耐受;周红霞等[10]测试来源于半滑舌鳎的杀鲑气单胞菌对环丙沙星和恩诺沙星、诺氟沙星等8种药物敏感,对利福平、氟苯尼考和硫酸新霉素等6种抗生素耐药。尽管致病菌分离来源不同,但杀鲑气单胞菌对喹诺酮类和β-内酰胺类药物表现较为敏感,对磺胺类和利福霉素类药物普遍耐受。本研究中也得到一致的结论,分离株对22种抗生素耐药表现不一致,整体耐药率低于35%,对β-内酰胺类、喹诺酮类和四环素类药物较为敏感。在杀鲑气单胞菌病防控中推荐交替使用盐酸多西环素和恩诺沙星,谨防长期单一用药产生耐药。
尽管对分离株的药物敏感性试验可以较为直观地确定敏感药物,但对口服给药来说,药物代谢受其他多种因素影响,具体剂量仍需进一步验证。De Ocenda等[44]研究了静脉注射和口服两种给药方式下大菱鲆对氟苯尼考的药代动力学,提出针对杀鲑气单胞菌感染的最佳给药方案:口服,初始剂量为30 mg/kg,而后调整剂量为18 mg/kg并持续给药6次。在疫苗研究应用中,对大菱鲆接种鲑鳟鱼商品化多价疫苗13周后,大菱鲆并未出现明显免疫保护效果[32]。尽管在大菱鲆中该疫苗可以诱导杀鲑气单胞菌细胞产生显著的抗体反应,但对胞外产物并无作用,病原菌仍可对养殖大菱鲆构成潜在威胁,鲑鳟疫苗并不能对大菱鲆产生同样的免疫保护作用,需针对不同对象开发专用疫苗。Yan等[45]基于杀鲑气单胞菌杀日本鲑亚种研制了大菱鲆专用疫苗,12、24周时免疫保护率均可达84%以上,效果显著,但该研究指出,此疫苗可能对其他亚种无效。经过抗生素选择,长期单一用药可能导致病原菌产生耐药,甚至多重耐药,在生产中应有针对性地选择敏感药物,注重交替使用,重点研发并应用大菱鲆专用疫苗、中草药类免疫增强剂等绿色防治手段,从源头减低病害发生率。
4 结论
1)本研究从患非典型疥疮病大菱鲆脾脏获得一株无运动能力、β溶血的杀鲑气单胞菌非典型株。
2)在分子鉴定中,对比16S rRNA、gyrB、vapA基因扩增、BLAST序列比对结果,表明应用vapA基因可有效鉴别杀鲑气单胞菌不同亚种,据此确定分离株为杀鲑气单胞菌杀日本鲑亚种。
3)在杀鲑气单胞菌引起的非典型疥疮病防治中,推荐交替使用水产用盐酸多西环素粉和恩诺沙星粉,并分别执行750度日和500度日的休药期。
猜你喜欢
——和田盘羊
