舟山近海浮游病毒和异养细菌的生态分布及其与环境因子的关系
2022-09-30杨铭玉刘强王铠赵淑江
杨铭玉,刘强,王铠,赵淑江
(浙江海洋大学海洋科学与技术学院,浙江 舟山 316022)
【研究意义】浮游病毒(Viruses, Vir)是指漂浮于水体中的噬菌体和真核藻类病毒在内的各种群病毒,是绝大多数水体环境中最丰富的浮游物种,它在海洋能流、地球物理化学循环、全球气候、种间遗传物质交换以及控制赤潮方面都有重要的影响[1]。异养细菌(Heterotrophic Bacteria, HB)是海洋微生物群落的重要部分,在维持海洋生态系统多样性与稳定性中起重要作用[2]。1983年Azam等[3]首次提出的“微食物环”,指出异养细菌是可以达到10%~80%初级生产力的“二级生产力”。在Fuhrman等[4]提出的“病毒环”中,浮游病毒可以通过侵染、裂解特定的宿主,从而对微生物群落的结构以及多样性进行调控。浮游病毒和异养细菌在物质循环与能量流中都起到十分重要的作用。舟山位于我国三大边缘海之一的东海,因特殊的地理环境与气候条件,使其成为我国具有典型近岸海洋系统特点的最大渔场[5],但由于近年来人类的肆意捕捞和污水排放等污染现象,使该海域的海洋生态系统受到严重威胁。作为生命系统与非生命系统之间联系的重要环节,同样也是生源要素循环重要驱动力的浮游病毒和异养细菌[6-7],逐渐受到研究者的重视。【前人研究进展】自1999年首次利用荧光计数法对病毒丰度进行调查后,我国也陆续开始使用该技术对长江口、渤海[8]、南黄海[9]、厦门[10]、青岛近岸以及台湾北部沿海[11]等海域进行浮游病毒丰度的调查研究。我国从20世纪80年代开始对长江口[12]、广东大鹏湾[13]、东海[14]等海域进行异养细菌的丰度研究。【本研究切入点】处于长江口的舟山海域不仅是世界重要渔场,同时在营养物质输送、转换,以及海洋碳汇方面具有重要生态价值,海水中的浮游病毒和异养细菌对于这些生态过程具有重要生态功能。【拟解决的关键问题】本研究首次将舟山附近不同功能区划近岸海域与浮游病毒和异养细菌丰度及其环境因子变化的研究相结合,分析浮游病毒和异养细菌在不同人为干预活动下的丰度变化,以期为舟山附近不同功能区划海域生态环境的保护提供有价值的参考资料,为更全面研究舟山近岸海域的生态环境提供基础资料。
1 材料与方法
1.1 采样时间与站位选择
本研究首次根据舟山市海洋功能区划,结合岛礁分布和行政区划,在基本覆盖舟山功能海域的基础上选择6个站位:枸杞岛(GQ),贻贝养殖区;沈家门(SJM),港口航运区;东极岛(DJ),大黄鱼养殖区、旅游区;岱山(DS),盐田区;六横(LH),污染排污区;白峰(BF),工业用海区(图1)。分别于2017年冬季和2018年春、夏、秋进行连续一周年的采样,共获得24个样品。
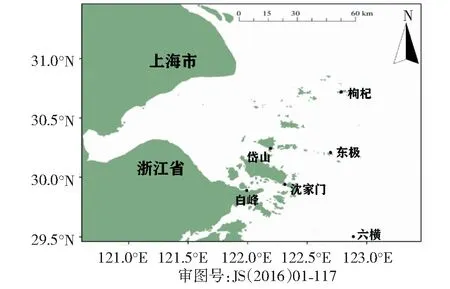
图1 舟山群岛海域采样站位分布Fig.1 The sampling station in Zhoushan Archipelago
1.2 样品采集与保存
利用灭菌便携式采水器采集表层海水(0.5 m)的样品,使用20 μm筛绢对样品进行预过滤至已经润洗过2~3次的小烧杯中,吸取1980 μm预过滤样品至2 mL冻存管中,并加入适量终浓度为0.5%的戊二醛,在4 ℃黑暗环境中固定后放入液氮中速冻,最后转入-80 ℃超低温冰箱保存。
1.3 生态因子的采集及环境因子的测定
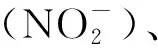
1.4 浮游病毒、异养细菌的丰度检测
浮游病毒:将水样从-80 ℃超低温冰箱中取出,在黑暗避光处用37 ℃水浴解冻,解冻完全后吸取1 mL待测水样转移至流式分析试管中,用Tris-EDTA缓冲液对样品进行稀释,加入SYBR Green I染色,混匀后置于80 ℃水浴锅中加热10 min,取出在室温中黑暗或避光环境下培养5 min,并加入1 μm标准荧光小球当作内部参照,混合均匀,样品浓度保持在1%左右,将样品置入流式细胞仪(贝克曼FC500)进行分析,记录实验数据。
异养细菌:将冻存样品避光在37 ℃水浴解冻,解冻完全后吸取1 mL溶液转移至流式分析试管中,加入SYBR Green I进行染色,混匀后置于黑暗或避光环境下培养15 min,并加入1 μm标准荧光小球当作内部参照,混合,控制样品浓度保持在1%左右,将样品放置入流式细胞仪(贝克曼FC500)进行分析,并且记录实验数据。
1.5 数据分析
运用FCS Express V3软件获得浮游病毒与异养细菌丰度。使用ArcGIS 地理信息系统软件制作采样站位图。使用ArcGIS 将24个样品丰度与站位结合进行分析。并利用SPSS 22软件对24个样品与环境因子间相关性进行分析。
1.6 生物量估算
利用各类微微型浮游生物细胞碳转换系数的不同,计算各类微微型浮游生物的碳生物量。本文使用国际上普遍使用的微微型浮游植物细胞碳转换系数。自养组分:Syn的碳转换系数为250 fg/个;Euk的碳转换系数为1500 fg/个;异养组分:HB的碳转换量系数为20 fg/个[15-17]。
2 结果与分析
2.1 浮游病毒的分布特征
春季浮游病毒的丰度为1.23×105~ 2.26×106个/mL,平均值为8.08×105个/mL。夏季的丰度范围为1.16×106~ 5.84×106个/mL,平均值为2.59×106个/mL。秋季,浮游病毒的丰度为1.34×105~ 1.71×105个/mL,平均值为6.48×105个/mL。冬季,浮游病毒的丰度为1.24×104~ 1.17×107个/mL,平均值为4.83×105个/mL。春、夏、秋、冬4个季节浮游病毒丰度表现为人为干预较少的东极岛和枸杞2个站位较高,污染较为严重的4个功能区站位:六横、白峰、沈家门、岱山丰度相对较低。其中春季、秋季、冬季丰度的峰值均来自东极岛,枸杞站位是夏季浮游病毒的峰值站位。春、夏两季丰度最低值均来自沈家门站位,秋、冬两季的数量丰富度均表现为岱山站位较其他5个站位低(图2)。
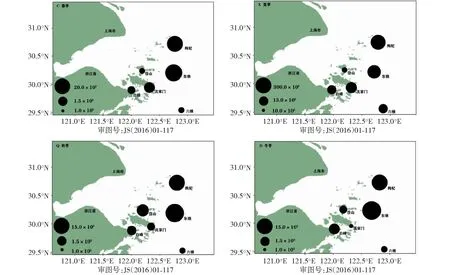
C.春季;X.夏季;Q.秋季;D.冬季C.Spring;X.Summer;Q.Autumn;D.Winter图2 浙江近岸海域浮游病毒丰度分布Fig.2 Distribution of Virioplankton abundance in the coastal water of Zhejiang
对连续一周年的浮游病毒丰度进行独立样本均值检验,得到丰度结果为:夏季>春季>秋季>冬季。
2.2 异养细菌的分布特征
春季异养细菌的丰度范围为0.89×105~6.09×105个/mL,平均值为2.31×105个/mL。夏季,异养细菌的丰度范围为1.06×105~ 4.19×105个/mL,平均值为2.43×105个/mL。秋季,异养细菌的丰度范围为0.68×105~ 5.90×105个/mL,平均值为1.94×105个/mL。冬季,异养细菌的丰度范围为:0.92×105~ 3.08×105个/mL,平均值为1.55×105个/mL。连续一周年内异养细菌丰度表现为东极岛和枸杞2个站位的的丰度相较于六横、白峰、沈家门、岱山丰度高。其中春季、夏季、秋季、冬季丰度的峰值均来自东极岛。春、冬季2个季节丰度最低值均来自白峰站位,夏季的最低值来自六横站位,秋季的最低丰度为沈家门站位(图3)。
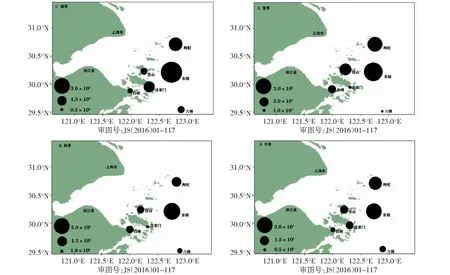
图3 浙江近岸海域异养细菌丰度分布Fig.3 Distribution of HB abundance in the coastal water of Zhejiang
对连续一周年的异养细菌丰度进行独立样本均值检验,得到丰度结果为夏季>春季>秋季>冬季。
2.3 浮游病毒丰度、异养细菌丰度与环境因子的关系
夏季温度最高为23.83~27.87 ℃,平均值25.27 ℃;冬季的温度最低为1.1~4.3 ℃,平均值3.32 ℃。冬季盐度最高为29.56~33.70,平均值31.21;秋季盐度最低为29.02~31.03,平均值为29.34。Chl-a的最高值在夏季(1.39~12.80 mg/m3),平均值为8.95 mg/m3;最低值在冬季(0.83~4.75 mg/m3),平均值为2.42 mg/m3。COD的最高值在夏季(1.26~2.76),平均值为1.93;最低值在冬季(0.71~1.29),平均值为0.87(表1)。春季,浮游病毒与pH、VBR呈显著正相关(P<0.05,r=0.041,r=0.028),与COD呈显著负相关(P<0.05,r=-0.018)。异养细菌与pH呈显著正相关(P<0.05,r=0.913),与COD呈显著负相关(P<0.05,r=0.047,表2)。
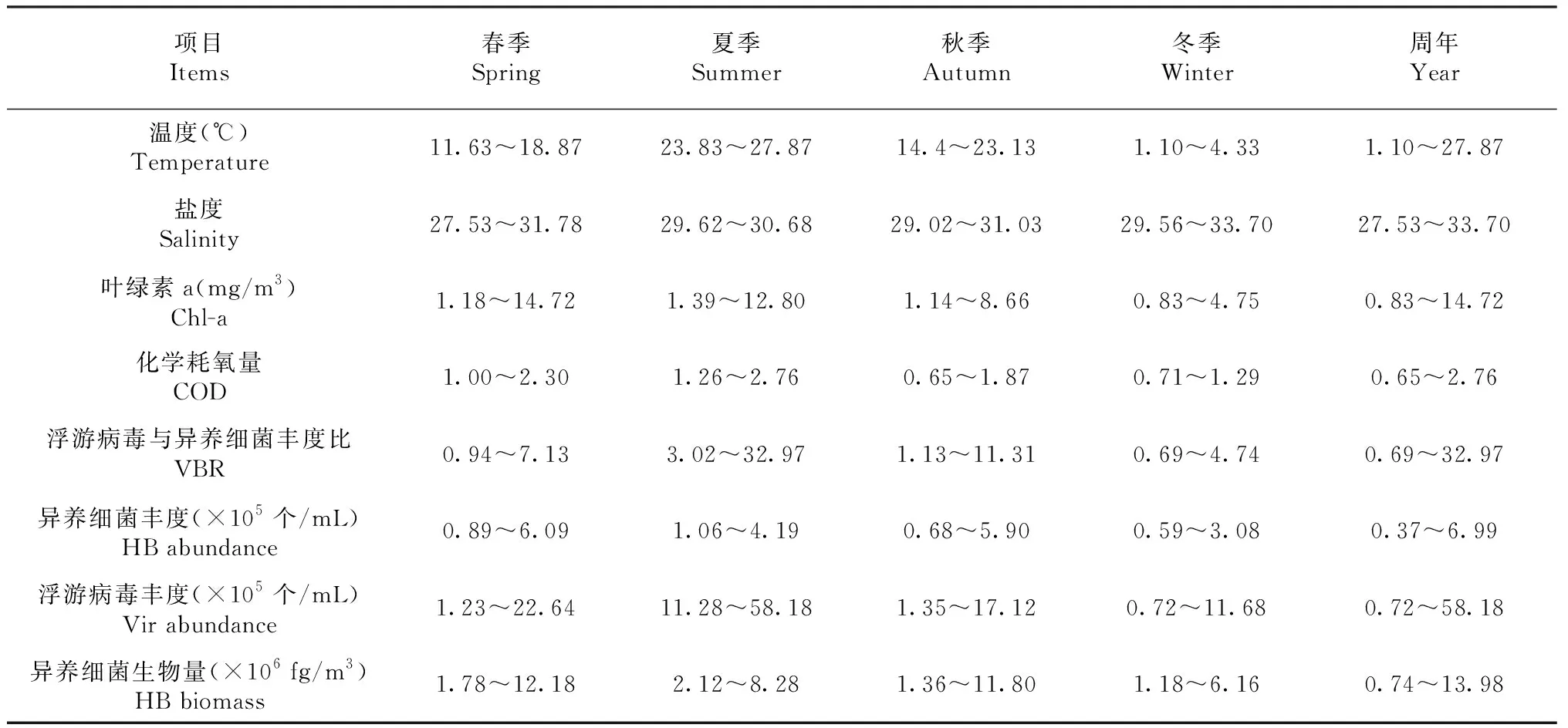
表1 浮游病毒与异养细菌丰度、生物量和相关环境参数
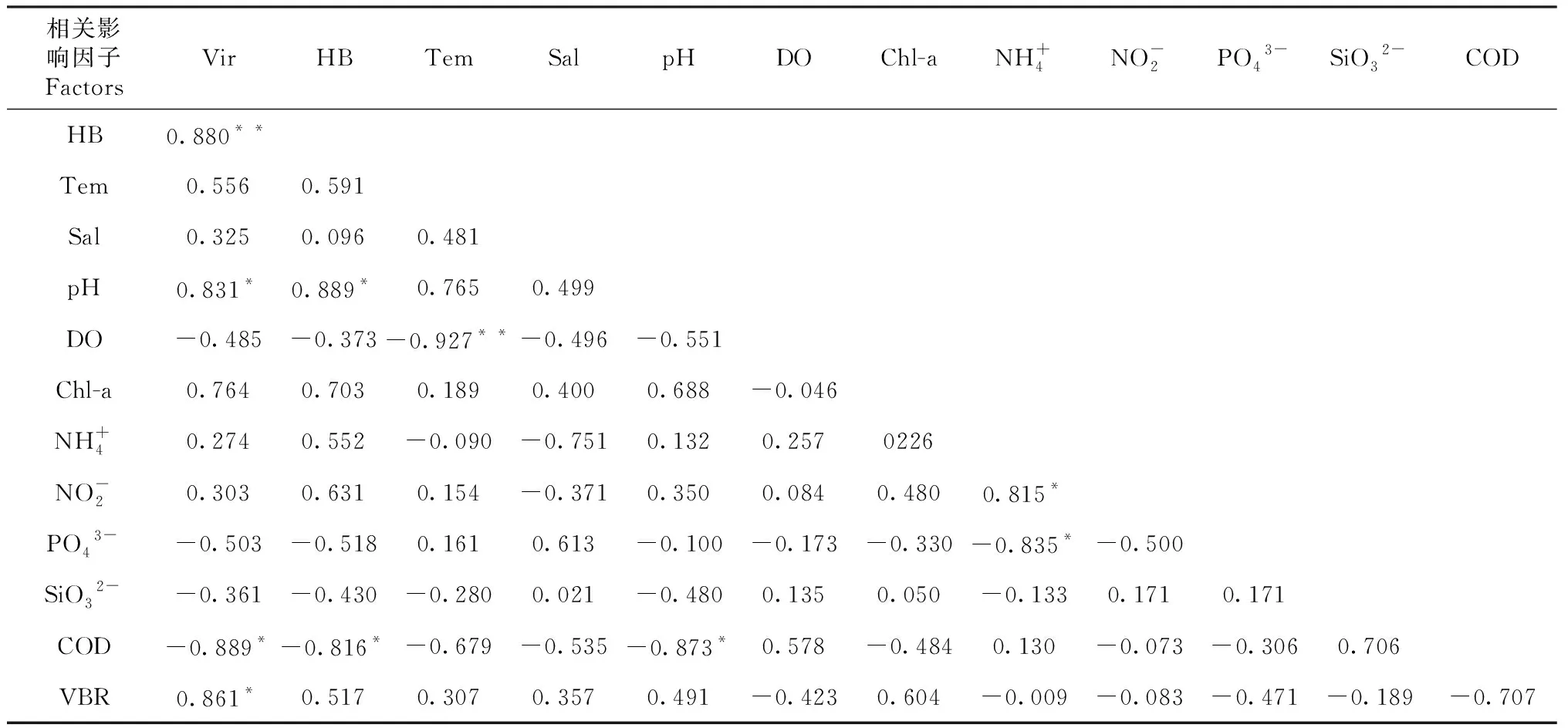
表2 春季浮游病毒和异养细菌之间与环境因子的Pearson 相关系数
夏季,异养细菌与Chl-a呈显著正相关(P<0.05,r=0.042),与COD呈显著负相关(P<0.05,r=0.043,表3)。

表3 夏季浮游病毒和异养细菌之间与环境因子的Pearson 相关系数
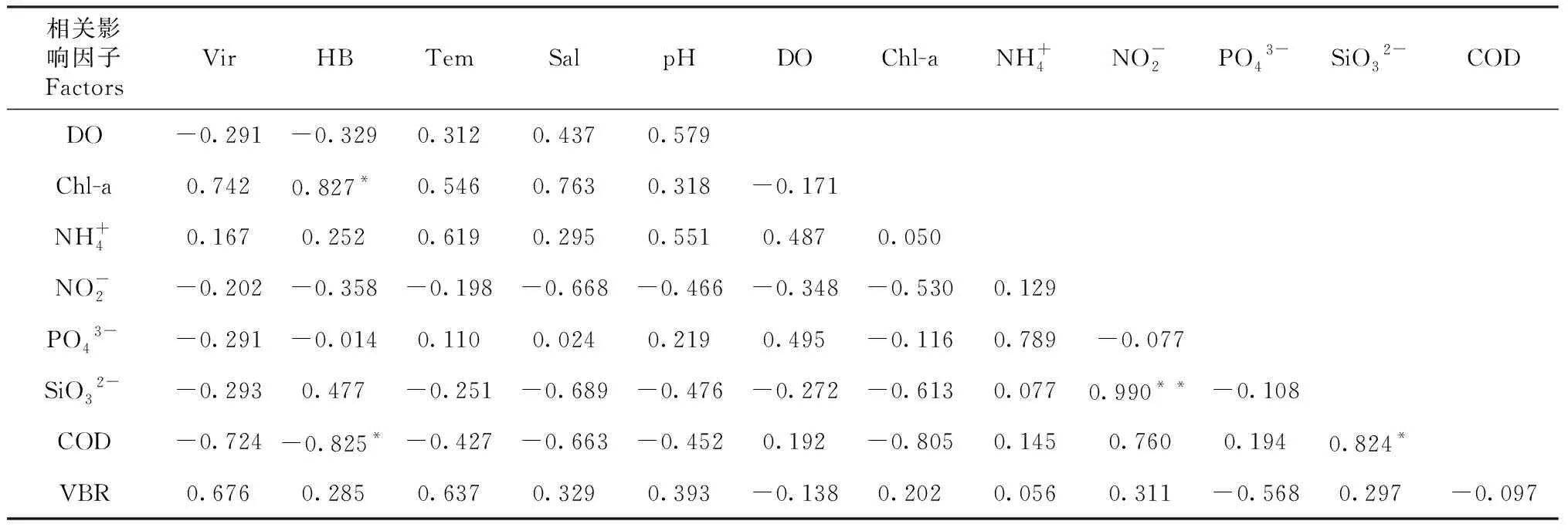
续表3 Continued table 3
秋季,浮游病毒与Chl-a呈显著正相关(P<0.05,r=0.048),与COD呈显著负相关(P<0.05,r=-0.022)。异养细菌与pH呈显著正相关(P<0.01,r=0.0001),与SiO32-呈显著负相关(P<0.01,r=0.0001),COD呈显著负相关(P<0.05,r=-0.022,表4)。
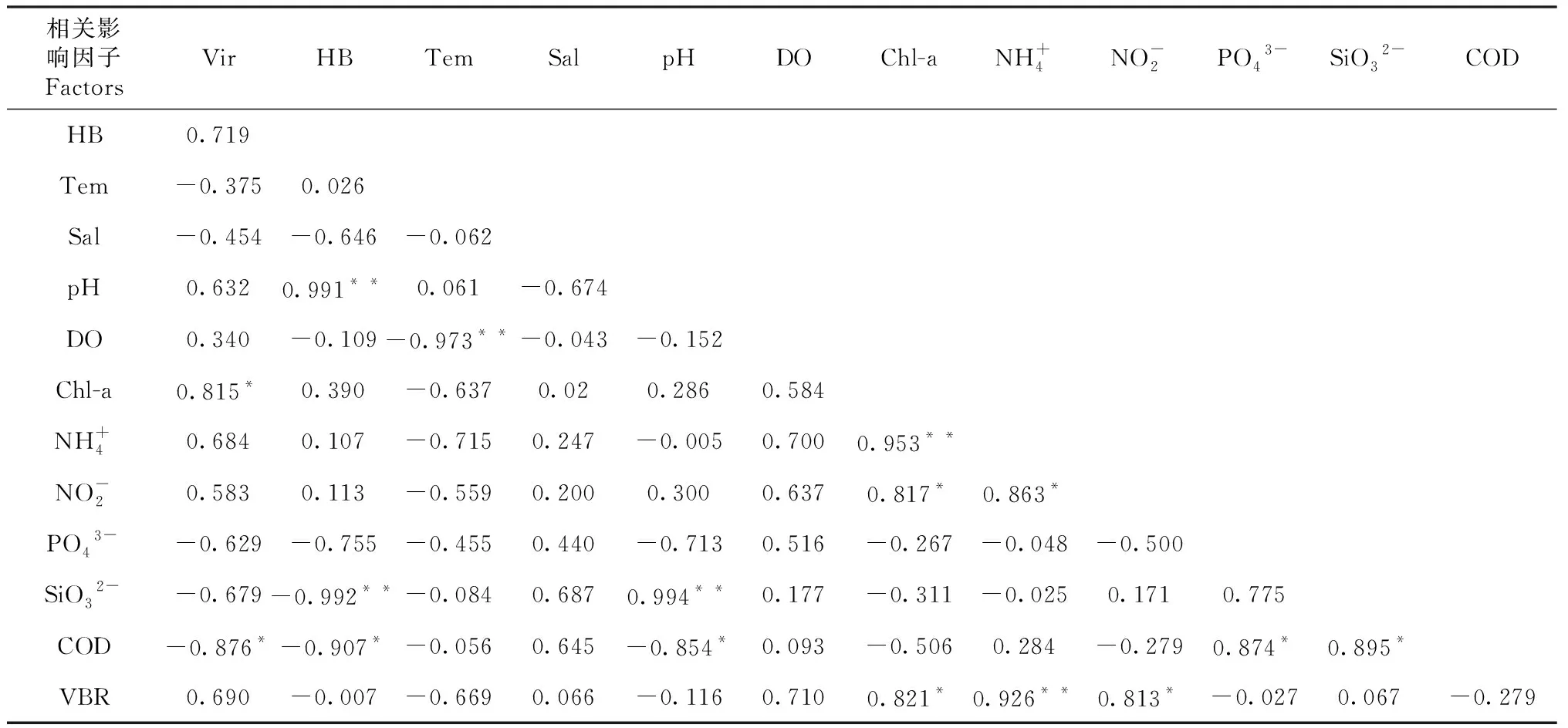
表4 秋季浮游病毒和异细菌之间与环境因子的Pearson 相关系数
冬季,浮游病毒与Chl-a呈显著正相关(P<0.05,r=0.043),与盐度、pH、DO、NH4+、NO2-、VBR呈正相关,与温度、PO43-、COD、SiO32-呈负相关。异养细菌与pH呈显著正相关(P<0.05,r=0.039),与COD呈显著负相关(P<0.05,r=-0.019,表5)。
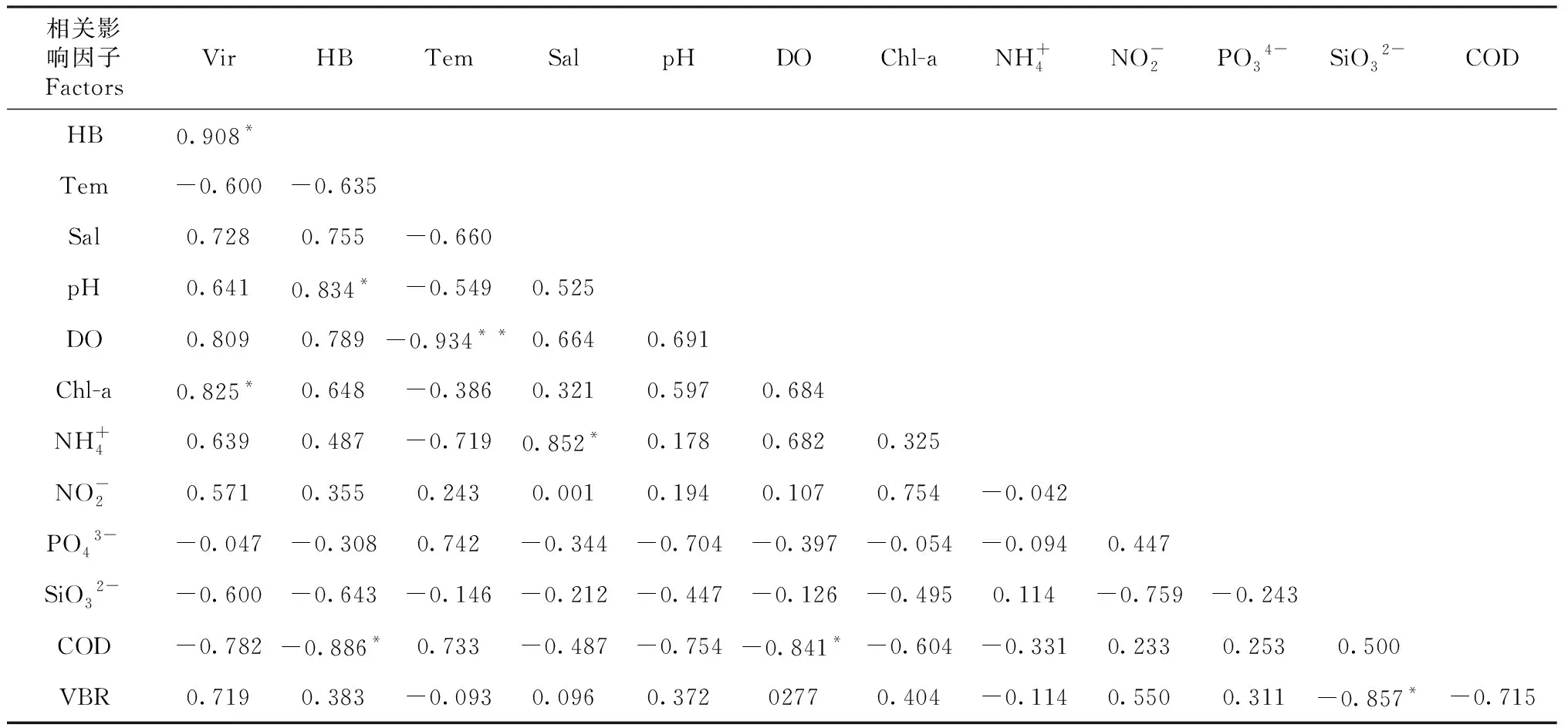
表5 冬季浮游病毒和异养细菌之间与环境因子的Pearson 相关系数
2.4 异养细菌的碳生物量以及比例
微微型浮游生物的生物量来源分为两大部分,一部分是由自养生物提供,另一部分由异养生物提供,而异养细菌产生的生物量是异养部分的主要承担者。春季的生物量为4.62×106fg,夏季为4.86×106fg,秋季为3.88×106fg,冬季为3.10×106fg。占微微型浮游生物总生物量的28.25%、6.24%、11.77%、11.09%(图4)。
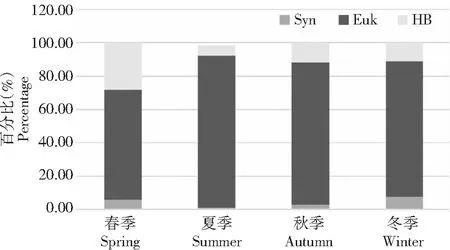
Syn.聚球藻;Euk.微微型真核浮游植物;HB.异养细菌Syn. Synechococcus;Euk. Picoeukaryotes;HB. Heterotrophic bacteria图4 4个季节聚球藻、微微型真核浮游植物和浮游细菌对微微型浮游生物总生物量的贡献Fig.4 The biomass contribution of Syn, Euk and HB to the picoplankton biomass over 4 successive seasons
3 讨 论
3.1 浮游病毒与异养细菌的时空分布差异
3.1.1 浮游病毒丰度的时空分布差异 对舟山附近近岸海域进行连续一周年的采样发现,浮游病毒的丰度均表现为东极岛和枸杞丰度高,六横、白峰、沈家门、岱山丰度低。原因可能是这4个站位均属于污染较严重的站位。根据舟山市海洋功能区划,沈家门为港口区,平时停放大量渔船,有时也会有渔民在此贩卖海货,将一些不新鲜的海货和他们的生活污水排入海水中,造成该海域的水体污染;岱山为盐田区,六横为排污区,也是居民较多的生活区,人类活动频繁,将废水未经处理直接排放入海中是造成该海域污染的原因之一;白峰为工业区,工业废水直接入海造成该海域水体污染严重。
大量的生活废水以及工业废水流入,使浮游植物与异养细菌大量繁殖,同时使浮游病毒的繁殖和释放加快,导致浮游病毒丰度发生变化。但同时这4个站位离岸较近,沿岸多条河流入海,淡水大量流入,并且长江每年都会携带超过50%的悬浮泥沙进入该海域[18],并且大量污水排放,也会造成长江口海域水体透明度下降,影响初级生产力,使生物量减少,进而造成浮游病毒丰度下降。
夏季浮游病毒的丰度是4个季节中最高的,原因可能在于夏季的光照强度更强,光合作用增强,营养盐随长江冲淡水大量流入该海域,进而促使异养细菌和微微型浮游植物的丰度增加,营养盐还会影响病毒宿主的生物量以及代谢率[19],从而导致病毒的大量繁殖和裂解,间接影响夏季水体中浮游病毒的丰度增加。这与以往的研究[20](夏季浮游病毒丰度最高,冬季丰度最低)结果一致。4个季节的浮游病毒丰度均与Chl-a呈正相关,这与Maranger等[21]在加拿大魁北克省的22个湖体浮游病毒丰度与相关叶绿素a含量呈明显正相关的结果一致,可以推测浮游病毒的丰度受浮游植物的丰度影响而变化。
3.1.2 异养细菌丰度的时空分布差异 异养细菌的丰度整体体现为东极岛和枸杞岛2个站位的丰度高于六横、白峰、沈家门以及岱山4个站位。原因可能在于这2个站位相对其他站位离岸较远,且从东海海底地貌来看,二者均处于现代河口水下三角洲之上[22],特殊的地理位置造成其水深较浅,透光性强等特点,并受长江冲淡水的影响,大量有机物与营养盐随长江等多条河流输入,致使初级生产力增强,异养细菌的丰度也随之增加。对于六横、白峰、沈家门和岱山这4个站位,采样点均为离岸较近,长江和其他河流携带大量泥沙流入,致使水体浑浊度较高,水色以及透明度均较低[19],从而初级生产力较低,异养细菌丰度较少。且这4个站位临近人类活动密集区,是污染较为严重的站位。导致该海域悬浮物含量高,因为颗粒物质的沉积率大[23-24],附着在这些颗粒物质上的异养细菌也因此沉降于海底,造成丰度降低。
夏季异养细菌的丰度最高,这可能与7月进入长江丰水期有关,大量的长江水进入该海域,给异养细菌的生长带来了大量的无机物和有机物,这与之前对于东海溶解有机物与异养细菌丰度呈正相关的研究结果基本一致[25]。本研究调查的丰度范围,与2012年Tsai等[26]在东海夏季细菌的丰度范围基本一致。其次,温度是影响微型浮游生物丰度的重要原因之一[27],温度是影响酶活性的重要因素,在一定温度范围内,温度与酶活性呈正比,而酶的活性直接影响生物的新陈代谢,所以温度会间接影响异养细菌的丰度[28-30]。另外,Chl-a浓度也是影响异养细菌丰度的原因之一,Chl-a浓度与溶解有机碳呈正相关,高浓度Chl-a会导致高的溶解有机碳,而溶解有机碳是异养细菌的重要来源[31]。2016年对日本相模湾沿海水域细菌生长的研究也显示,细菌丰度在很大程度上受溶解有机碳影响[32],这也与本研究的结果基本一致。
浮游病毒丰度的数量级一般为105~107个/mL,异养细菌丰度的数量级为104~106个/ mL[33-35],本研究海域浮游病毒和异养细菌丰度范围与其他海域调查结果相近[36-37],但林燕顺等[38]对南极、太平洋海域检测到的浮游细菌最大数量级仍较本研究少2个数量级。其原因可能在于本研究的采样地受工业、渔业以及生活污水等的影响较严重,为异养细菌的繁殖生长提供了丰富的营养物质。
3.2 浮游病毒与异养细菌的相关性
在研究浮游病毒与异养细菌的相关性时常用的指标为浮游病毒与异养细菌丰度比(Virus-to-Bacterium Ratio,VBR), VBR高说明病毒的生产力与细菌裂解量高。一般在高营养盐、高初级生产力的海域,细菌生长迅速,病毒与细菌的碰撞几率高,病毒释放量增加,进而产生大量的浮游病毒颗粒,导致VBR升高[39]。在本研究中,全年VBR为0.69~13.89,平均值为4.75。夏季的VBR明显高于其他三季。李洪波等[8]检测到北戴河和天津沿岸海域的VBR全年均值在6.22。李汝伟等[40]研究浙江近海海域浮游病毒和异养细菌关系中,检测到的VBR全年均值为5.39,且春夏两季VBR明显高于秋冬两季,基本与本研究结果一致。在4个季节中,浮游病毒与异养细菌的丰度均呈正相关,尤其在春季、夏季、冬季3个季节中呈现显著正相关(P<0.05,r=0.021;r=0.041;r=0.012)。表明该海域浮游病毒丰度与异养细菌丰度有较密切的关系,Nuria等[41]在“海洋浮游病毒对异养细菌的向往起重要作用”的理论中提到浮游病毒可能是异养细菌丰度变化的影响因素之一。在对台湾北部沿海、大堡礁等海域、浙江近海海域等其他海域的微生物进行调查研究中得到相似的结果[42-43]。浮游病毒与异养细菌丰度呈正相关的原因也可能在于——作为病毒载体的桡足类等浮游动物可以提高病毒对宿主的接触率,加速宿主的裂解[44]。
3.3 浮游病毒、异养细菌及其生物量与环境因子的关系
异养细菌是该海域内异养组分中重要的生物量贡献者,异养组分中的生物量主要是利用水中的溶解有机物和颗粒有机物,并将氮、磷等有机物释放[45]。也有学者认为,异养细菌可以通过吸收利用水中的无机氮、磷等营养盐,提高自身的生长率和新陈代谢速率[46-47]。但总体来说异养组分与自养组分的生物量产生可能存在竞争关系。研究表明,在营养盐高的海域,自养组分对营养盐的吸收速率明显高于异养组分[46],这与本研究结果一致,调查海域受到污染以及自然环境等因素的影响,营养盐较高,自养组分的生物量转换率明显高于异养组分。
化学需氧量(COD)是衡量海水受污染程度的1个重要检测标准,化学需氧量越大说明水中有机物的污染越严重。在春、秋2个季节,浮游病毒与COD呈现显著负相关。主要原因在于六横、白峰、沈家门和岱山这4个站位均为污染较为严重的站位,有大量的生活、工业污水排放以及受到多条河流的影响,使该海域水体富营养化,造成宿主细菌、藻类大量繁殖,间接影响浮游病毒的丰度[40]。夏季COD最高,也与夏季常出现赤潮存在一定的关系,但总体来看,四季的变化不大。
浮游病毒在秋、冬两季以及异养细菌在冬季均与pH、DO呈正相关,且在夏季和冬季pH与DO呈现正相关,王小平等[48]对广东红海湾水域溶解氧、pH分布特征的研究中发现,溶解氧和pH升高的重要影响在于光合作用,而在本研究中夏季的光合作用最强烈;在石晓勇等[49]对东海溶解氧和pH分布的调查中发现,海水pH与溶解氧之间存在间接正相关的结果一致。
冬、春、秋季3个季节中,浮游病毒与NH4+、NO2-均呈正相关,在张喆[50]对山东近岸浮游病毒丰度的研究中也发现,浮游病毒与海水中的硝酸盐含量呈正相关。产生该现象的原因可能在于病毒裂解细菌和藻类后,将其体内大量的N、P释放到海水中,造成氨氮含量较高[51]。在夏季,异养细菌与氨氮、总磷均呈负相关,这与异养细菌可以利用铵盐作为氮源用于自身的生长和繁殖有关[52],表明氨氮是调节异养细菌丰度的重要因素之一。
4 结 论
海洋微微型浮游生物作为海洋中对环境变化极为敏感的群落,可以通过其丰度反映海域环境变化等情况,将其列为检测水体污染的指标之一。本次调查浮游病毒与异养细菌丰度以期为调查海域的生态环境的保护提供有价值的参考资料,为舟山附近海域不同功能区划生态环境的保护、评估以及治理提供科学的依据,分析海洋浮游病毒与异养细菌在不同人为干预活动的环境下的丰度变化。本论文首次将浮游病毒与异养细菌丰度调查与功能区划相结合,希望可以通过这种方式使人们意识到人类活动与环境变化都在影响着海洋生态健康,也希望引起人们对海洋健康检测机制建立的重视以及政府对海洋健康的监督的力度。
