甘蓝型油菜BnPHL12基因克隆及功能分析
2022-09-30刘志全王璐琳胡建军唐铭霞王克秀马朝芝
李 兵,刘志全,王璐琳,胡建军,唐铭霞,戴 成,王克秀,马朝芝
(1.四川省农业科学院作物研究所,成都 610066;2. 华中农业大学作物遗传育种国家重点实验室,武汉 430070; 3. 湖南省农业科学院蔬菜研究所,长沙 410125)
【研究意义】甘蓝型油菜是世界上重要的油料作物,在食品安全中具有重要作用。随着油菜人工选育进程的推进,甘蓝型油菜的用途越来越多样化,在菜籽榨油、菜薹食用、绿化观赏以及土壤改良等方面具有广泛的应用前景。杂交品种的创制有利于将不同亲本材料的优良性状聚合并发挥作物的杂种优势,对作物的品质改良和产量提高具有重要的作用。我国油菜种植面积和产量占世界的1/3,油菜杂种优势的利用可将油菜产量提高20%~30%[1]。雄性不育系(细胞质雄性不育、细胞核雄性不育、光温敏雄性不育和化学杀雄)及自交不亲和系等材料的选育和应用是油菜杂种优势利用的重要途径[2]。细胞核雄性不育是雄性不育的主要类型之一,由于细胞核基因控制的雄配子在花发育过程中出现异常,导致无法产生花粉或者花粉活力丧失,这些核不育系具有败育彻底、无不良的胞质效应及广泛的恢复系等特点[3]。细胞质雄性不育现象是一种母性遗传的性状,受细胞核基因和细胞质基因的互作调控,不育系的选育及分子机制的解析能够推动众多作物的杂种优势利用[4]。波里马细胞质雄性不育系(pol CMS)的发现及应用,推动了油菜杂种优势的快速利用。尽管自然突变是不育系材料筛选的重要途径,但自然突变频率低,很难有效获得不育系材料;随着分子生物学技术的发展及功能基因组学的研究,利用基因工程的方法创建植物雄性不育材料,不仅能够推动作物育种的发展,也能加速基因功能的解析。【前人研究进展】前人在育种过程中,获得一些具有雄性不育特性的材料,如S45AB、7365AB、pol CMS 等,通过细胞学观察、遗传分析、图位克隆、遗传转化、分子生物学研究等方法,揭示突变体材料雄性不育的分子机制,并通过配制杂交组合及遗传分析,鉴定不育系材料的恢复系及其恢复机制等研究,推动油菜杂种优势的利用[4-8]。拟南芥是双子叶植物的模式植物,具有完善的基因组信息和丰富的突变体库资源,为拟南芥基因功能的解析提供极大的便利。花药是雄胚子发育的场所,由4个花粉囊组成,而花粉囊的囊壁由外向内分别为表皮层、花药内表皮、中层和绒毡层细胞以及小孢子母细胞[9]。Sanders等[10]将拟南芥的花药发育分为15个时期,为细胞生物学方法观察花药发育过程奠定了基础;绒毡层细胞由雄蕊原基的L2层及L3层分化而来,在花药发育的第10期开始以细胞程序性死亡(Programmed Cell Death, PCD)的方式降解,在第11~12期完全降解。绒毡层细胞在小孢子的发育过程中具有十分重要的作用,主要体现在以下几方面:①绒毡层细胞的降解为小孢子发育提供营养物质,如脂类、蛋白质、糖类等[11];②合成胼胝质壁和花粉母细胞初生壁降解所需要的酶类[12];③促进花粉外被的形成[13]。前人研究表明,转录因子在绒毡层细胞的发育及分化过程中起重要作用[14],如DYT1[15]、MYB33/65[16]、TDF1[17]、AMS[18]和 AtMYB103[19-21]等。GAMYB-like的转录因子MYB33和MYB65在绒毡层细胞的PCD过程中功能冗余;myb33myb65双突变体的花粉在花粉减数分裂前败育[16];在拟南芥ams、ms1、tdf1、dyt1等基因的突变体材料中,绒毡层细胞的PCD延迟发生;而在myb80的突变体材料中,绒毡层细胞的PCD会提前发生,这些转录因子在绒毡层细胞的PCD过程中起着关键的作用,绒毡层细胞的PCD的提前或者延迟都会导致花粉发育的异常,最终影响植物的育性[15, 18, 22-24]。MYB-CC转录因子因其含有MYB结构域和Coiled-Coiled结构域而得名,AtPHR1(PHOSPHORUSSTARVATIONRESPONSE1)是植物中鉴定的第一个MYB-CC转录因子,参与拟南芥的磷饥饿胁迫响应;在拟南芥中鉴定到14个与AtPHR1有相似结构的基因[25],其中AtPHR1,AtPHL1(PHR1-LIKE1),AtPHL2(PHR1-LIKE2),AtPHL3(PHR1-LIKE3),AtPHL4(PHR1-LIKE4),在磷饥饿胁迫响应中功能冗余[26-28];在水稻、油菜、番茄、玉米等物种中,AtPHR1同源基因也参与磷饥饿胁迫响应[29-33]。除此之外,MYB-CC转录因子TaMYBsm3参与小麦的干旱胁迫响应[34]以及OsPHL3参与水稻花期的调控过程[35]等生物学过程。然而,关于MYB-CC转录因子调控花发育的报道还较少。【本研究切入点】采用序列比对及同源克隆的方法,以拟南芥AtPHL12(At3G12730)为参考基因,在甘蓝型油菜“Westar”中克隆其同源基因,进行生物信息学及组织表达模式的分析,并将BnA01PHL12在甘蓝型油菜和拟南芥中过量表达,检测在绒毡层细胞中过量表达BnA01PHL12是否影响转基因植株的花药发育。【拟解决的关键问题】本研究采用序列比对和同源克隆的方法克隆了甘蓝型油菜BnPHL12的同源基因,并对其进行组织表达模式的分析,利用基因工程的手段研究其生物学功能,创建了新的雄性不育材料,为花药发育的研究提供新的策略。
1 材料与方法
1.1 实验材料
本实验所用的材料为甘蓝型油菜栽培种“Westar”,用于基因克隆和组织表达模式的分析,由华中农业大学油菜工程研究中心提供。哥伦比亚型拟南芥(Col)由华中农业大学油菜杂种优势利用实验室自交繁种保留,用于遗传转化和拟南芥原生质体的提取。所有材料种植在生长条件为16 h光照,8 h黑暗,22 ℃的恒温温室。
1.2 载体和菌株
TA 克隆使用的载体是pMD18-T,菌株是 DH5α。构建表达载体时,使用的载体为 pMDC83;用于遗传转化的农杆菌为 GV3101。用于酵母实验的菌株为AH109,用于双荧光素酶的载体为pBDGAL4,由华中农业大学油菜杂种优势利用实验室保留。亚细胞定位的载体为pM999载体。
1.3 实验试剂
高保真DNA聚合酶PrimerSTAR购自Takara公司;T4DNA连接酶、限制性内切酶及反转录试剂盒均购自湖北晶茂生物技术有限公司;RNA提取试剂盒购自上海普洛麦格生物制品有限公司;大肠杆菌DH5α感受态细胞购自全式金生物公司;DNA纯化回收试剂盒、质粒快提试剂盒购自天根生化科技(北京)有限公司;双荧光报告(DLR)系统试剂盒购自武汉天源惠达生物科技有限公司;农杆菌GV3101感受态细胞菌株购自上海唯地生物技术公司。AH109菌株由华中农业大学油菜杂种优势利用实验室保存。
1.4 实验方法
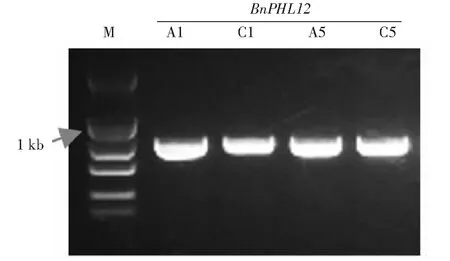
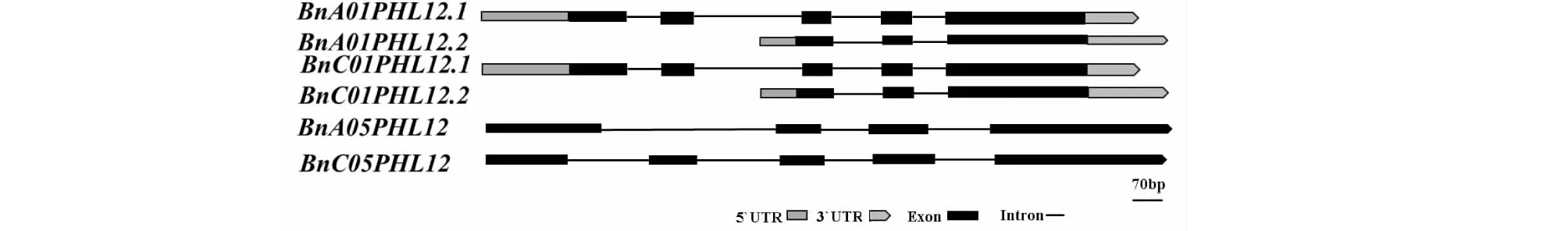
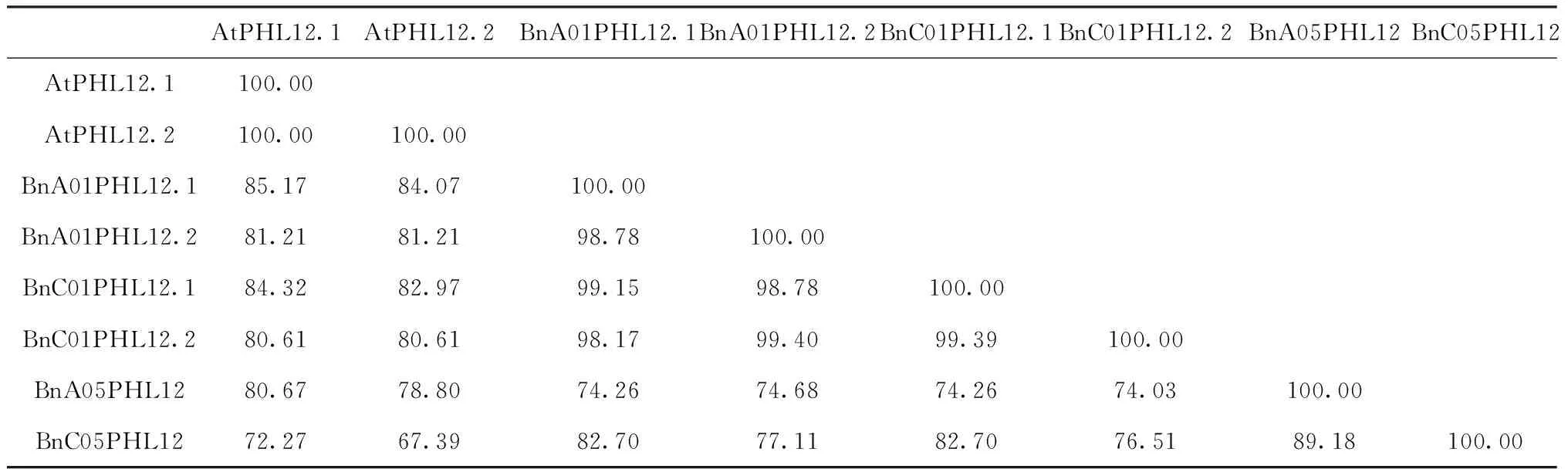
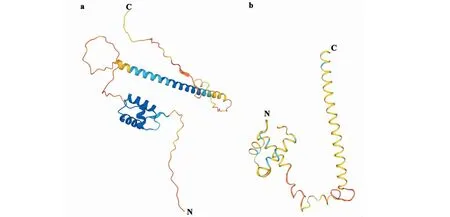
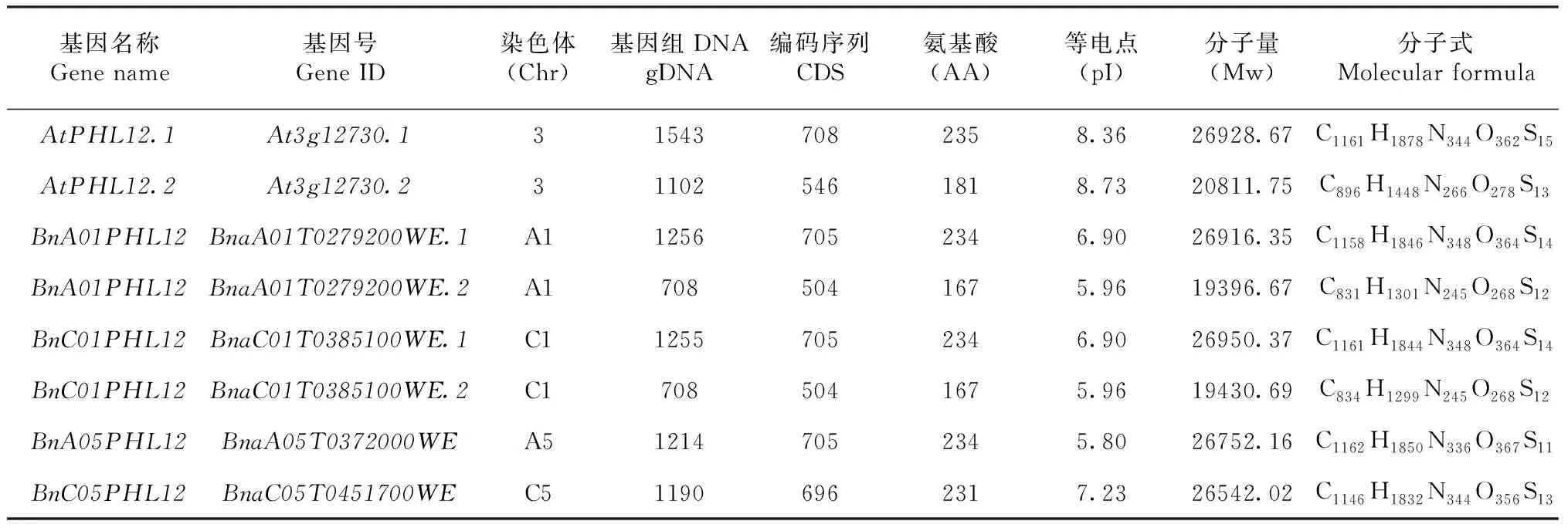
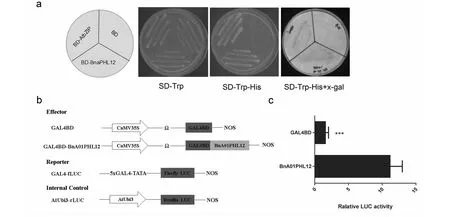
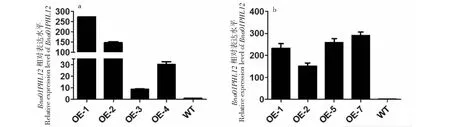
1.4.1 RNA、DNA提取及cDNA第一条链的合成 油菜花蕾、根、茎、叶片组织总RNA抽提均采用Trizol Reagent法。油菜不同发育时期的花药总RNA用promega微量RNA提取试剂盒(https://www.promega.com)提取。取洗脱后的RNA样品1 μL在Nanodrop2000分光光度计上检测其浓度及纯度(1.8 1.4.2BnPHL12同源基因克隆 从拟南芥数据库TAIR(https://www.arabidopsis.org/index.jsp)获得AtPHL12(At3g12730)的序列信息,并在甘蓝型油菜泛基因组数据库BnPIR(http://cbi.hzau.edu.cn/bnapus/index.php)“Westar”基因组中进行AtPHL12同源基因的序列比对分析。根据序列比对结果,获取BnPHL12同源基因的序列信息,设计扩增BnPHL12编码序列的引物(表1),以 “Westar”花蕾的cDNA为模板进行PCR扩增,将PCR产物连接到TA克隆载体pMD18-T上,并进行测序分析。将克隆的测序序列与“Wesatr”基因组中获得的序列信息进行比对分析。 1.4.3BnPHL12同源基因的生物信息学分析及进化分析 利用数据库ExPASy-protParam tool (https://web.expasy.org/protparam)对AtPHL12及BnPHL12同源基因的分子式、分子量、等电点、氨基酸组成等基本信息进行分析。利用PSIPRED Workbench (http://bioinf.cs.ucl.ac.uk/psipred/)对BnPHL12的二级结构进行预测。利用SWISS-MODEL(https://www.expasy.org/resources/swiss-model)对BnPHL12的蛋白结构进行预测。利用十字花科数据库BRAD (http://brassicadb.cn)在白菜、甘蓝、拟南芥以及琴叶拟南芥中鉴定BnPHL12的同源基因,提取相关基因序列。利用MEGA-X软件中的Clustal W对AtPHL12及BnPHL12同源基因进行多重序列比对,利用MEGA-X软件中的Neighbor-Joining构建BnPHL12同源基因(拟南芥、琴叶拟南芥、白菜、甘蓝及甘蓝型油菜)进化树。 1.4.4 启动子扩增及GUS染色分析 根据“Westar”参考基因组中BnA01PHL12的序列信息,设计扩增BnA01PHL12启动子的特异引物(表1)。以“Westar”的叶片DNA为模板,进行BnA01PHL12启动子的扩增,用SalⅠ和BamHⅠ进行酶切、回收并连接在pCAMBIA 2300-GUS(用SalⅠ和BamHⅠ双端酶切)载体上,并将重组质粒转入农杆菌菌株GV3101中。采用农杆菌介导的拟南芥沾花法进行转化,并进行转基因阳性苗的鉴定。在阳性转基因材料的T2代进行GUS染色,分别取生长14 d及开花初期的整株转基因拟南芥进行GUS染色分析,并将染色样品放在装有CCD相机的体式显微镜中照相。 1.4.5 亚细胞定位及转录激活/抑制活性分析 根据BnA01PHL12的序列信息,设计特异引物扩增其全长的CDS(去除终止子)序列(表1),利用XbaⅠ进行单酶切后连接到已经融合了eGFP的pM999载体上,构建BnA01PHL12亚细胞定位的融合表达载体。使用天根的质粒小提中量试剂盒提取用于亚细胞定位的质粒。提取pM999-BnA01PHL12-GFP和pM999-GHD7-RFP质粒,将2种质粒均以5 μg混合后进行拟南芥原生质体瞬时转化,室温黑暗培养12~16 h,用激光共聚焦显微镜进行荧光观察并照相。利用特异引物(表1)扩增BnA01PHL12全长编码序列片段,用KpnⅠ和XbaⅠ进行酶切后连接到pBDGAL4载体上,构建GAL4-BnA01PHL12载体。使用天根的质粒小提中量试剂盒提取GAL4-BnA01PHL12及pBDGAL4质粒。烟草花叶病毒 35S 启动子(CaMV35S)驱动转录因子BnA01PHL12表达,作为效应子;烟草花叶病毒35S 的最小启动子驱动荧火虫LUC(Luciferase)基因表达,作为报告子;拟南芥UBIQUITIN3(AtUBI3)基因启动子驱动海肾RenillaLUC基因载体作为内参。按m(报告子)∶m(效应子)∶m(内参)=6∶6∶1 的比例进行原生质体转化,每个转化重复3次。使用 Promega公司 Dual-Luciferase Reporter Assay System试剂盒对拟南芥原生质体瞬时转化的细胞进行LUC酶活的检测。利用特异引物(表1)扩增BnA01PHL12全长编码序列片段,用NdeⅠ和SalⅠ 酶切后连接到pGBKT7载体上,构建BD-BnA01PHL12载体。将融合蛋白BD-BnA01PHL12、AtbZIP1(具有转录激活活性[36])及pGBKT7(BD分别转化酵母菌株AH109,并将转化液涂布在SD-Trp和SD-Trp/His培养基上,30 ℃培养箱中培养2~3 d,观察不同转化子的生长状况,并将培养皿中的酵母斑点转移到滤纸上添加X-Gal进行染色,观察酵母菌斑的染色情况。 表1 引物序列 1.4.6BnA01PHL12表达载体构建及遗传转化 利用BnA01PHL12的序列信息,设计特异引物扩增BnA01PHL12的全长编码序列(去除终止子,表1),用PstⅠ和KpnⅠ进行酶切并连接到pMDC83-A9-eGFP载体上,该载体用甘蓝型油菜BnA9的847 bp启动子驱动,构建表达载体pMDC83::A9-BnA01PHL12,并将其转入农杆菌菌株GV3101中,采用农杆菌侵染介导的油菜遗传转化方法和拟南芥沾花法,获得绒毡层细胞中高量表达BnA01PHL12的转基因材料,并进行阳性苗的鉴定及转基因材料花药发育情况调查。 1.4.7 实时荧光定量PCR(qRT-PCR)分析 根据BnPHL12同源基因的序列信息,设计特异扩增BnPHL12不同拷贝的定量检测引物(表1),对甘蓝型油菜栽培品种“Westar”的不同组织(根、茎、叶、花蕾及不同发育时期的花药)进行实时荧光定量PCR(qRT-PCR)分析,检测BnPHL12同源基因的组织表达模式。利用BnA01PHL12特异的定量检测引物分析转基因油菜和拟南芥中BnPHL12的表达水平。以BnActin7和AtActin2作为油菜和拟南芥定量检测的内参(表1)。采用2-ΔCt法计算不同组织中的表达量,采用2-ΔΔCt法计算转基因材料的表达水平,3次生物学重复。 在拟南芥数据库网站TAIR中检索MYB-CC家族转录因子AtPHL12(At3G12730),获取其序列及基因结构信息。将AtPHL12的CDS序列信息在甘蓝型油菜泛基因组BnPIR中“Westar”的基因组进行序列比对,鉴定到4个与AtPHL12同源的基因:BnaA01T0279200WE、BnaC01T0385100WE、BnaA05T0372000WE和BnaC05T0451700WE。基因结构注释显示AtPHL12含有2个转录本:AtPHL12.1和AtPHL12.2; 甘蓝型油菜“Westar”基因组注释的BnaA01T0279200WE、BnaC01T0385100WE也通过可变剪切产生2个转录本,将甘蓝型油菜BnPHL12的同源基因命名为BnA01PHL12.1、BnA01PHL12.2、BnC01PHL12.1、BnC01PHL12.2、BnA05PHL12和BnC05PHL12。根据“Westar”参考基因组中BnPHL12同源基因的序列信息,设计特异引物并对其编码序列进行扩增,获得700 bp左右的序列(图1)。将扩增的PCR产物连接到pMD18-T载体上,进行克隆序列的测序分析,结果表明克隆获得CDS序列与 “Westar”参考基因组中BnPHL12同源基因的序列一致。 M: Maker;A1、C1、A5、C5分别代表BnPHL12同源基因克隆的PCR产物M indicates the maker; A1, C1, A5 and C5 indicate the PCR product of BnPHL12 homologous genes图1 BnPHL12同源基因的克隆Fig.1 Molecular cloning of BnPHL12 homologous genes in B. napus 参考“Westar”基因组BnPHL12同源基因的序列信息,绘制BnPHL12同源基因的基因结构示意图(图2)。BnA01PHL12与BnC01PHL12基因结构相似;由5个外显子和4个内含子以及非编码序列组成。核苷酸序列比对显示,两者在基因组上存在26个SNP的差异,但CDS上仅存在4个SNP的差异,导致1个氨基酸的差异(I115-F115)。BnA05PHL12与BnC05PHL12的基因结构差异较大,BnA05PHL12和BnC05PHL12分别由4个外显子和3个内含子及 5个外显子和4个内含子组成(图3)。AtPHL12与BnPHL12同源基因的氨基酸序列比对及蛋白结构预测分析显示,AtPHL12.1与BnA01PHL12.1、BnC01PHL12.1、BnA05PHL12和BnC05PHL12的序列相似性极高,都具有MYB DNA结合结构域和Coiled-Coiled结构域,而AtPHL12.2、BnA01PHL12.2及BnC01PHL12.2因可变剪切,导致N端的MYB DNA 结合结构域丢失,而C端的Coiled-Coiled结构域完整。如表2所示,AtPHL12与BnPHL12同源基因的氨基酸序列相似性大于70%,与BnA01PHL12.1氨基酸序列相似性最高,达到85.17%。BnA01PHL12.1与BnC01PHL12.1的序列相似性高达99.15%。尽管BnA05PHL12与BnC05PHL12基因结构存在较大差异,但氨基酸的序列相似性为89.18%。 黑色和灰色方框分别表示外显子和UTR;黑色短线表示内含子Black and gray boxes indicate exons and UTR (untranslation region); Black lines indicate the introns图2 BnPHL12同源基因结构Fig.2 Genes structure of BnPHL12 homologous genes AtPHL12通过可变剪切产生2个转录本(AtPHL12.1和AtPHL12.2)。AtPHL12.1编码的蛋白含有MYB DNA 结合结构域和MYB CC 结构域。AtPHL12.2编码的蛋白缺失部分MYB DNA 结合结构域。AtPHL12同源基因BnA01PHL12 和BnC01PHL12也产生两个转录本。红色下划线和绿色下划线分别代表MYB DNA 结合结构域和MYB CC 结构域AtPHL12 could produce two transcripts by alternative splicing (AtPHL12.1and AtPHL12.2). The protein encoded by AtPHL12.1 contains MYB DNA binding domain and MYB CC domain. While the protein encoded by AtPHL12.2 deletes partial MYB DNA-binding domain. BnA01PHL12 and BnC01PHL12 also produce two transcripts. The red and green underline represent the MYB DNA binding domain and the MYB CC domain, respectively图3 拟南芥AtPHL12与甘蓝型油菜BnPHL12同源基因氨基酸序列比对Fig.3 Animo acid sequence alignment between homologous genes of BnPHL12 and AtPHL12 表2 拟南芥AtPHL12与甘蓝型油菜BnPHL12同源基因氨基酸序列相似性统计 利用ExPASy-protParam tool对AtPHL12及BnPHL12同源基因的理化性质(gDNA、CDS、氨基酸数目、分子式、分子量、等电点等)进行预测(表3)。利用PSIPRED Workbench 对BnPHL12的二级结构进行预测(表4),统计BnPHL12同源基因中α-螺旋(H)、β-折叠 (E)、无规则卷曲 (C) 组成情况,BnPHL12主要以α-螺旋(H)和无规则卷曲 (C)组成,仅个别基因的编码蛋白有极少数的β-折叠 (E)。利用SWIDD-MODEL 对BnPHL12的蛋白结构进行预测(图4),BnPHL12蛋白与水稻的磷饥饿响应基因(OsPHR2)模型7e40.2.A蛋白一致性为41.22%,由空间立体结构可知,AtPHL12和BnPHL12主要由α-螺旋(H)和无规则卷曲 (C)组成。 a. AtPHL12的蛋白结构预测(UniProt);b. BnA01PHL12蛋白结构预测(SWIDD-MODEL)a. Protein structure prediction of AtPHL12 (UniPort).b. Protein structure prediction of BnA01PHL12 (SWIDD-MODEL)图4 PHL12三维蛋白结构预测Fig.4 Three dimensional protein structure prediction of PHL12 表3 BnPHL12同源基因基本信息统计 利用十字花科数据库BRAD,在白菜、甘蓝、拟南芥以及琴叶拟南芥中比对BnPHL12的同源基因,在白菜中鉴定到2个BnPHL12同源基因:BraA01t04110Z和BraA05t22477Z;在甘蓝中鉴定到2个BnPHL12同源基因:BolC01g050170.2J和BolC05g053970.2J;拟南芥和琴叶拟南芥的同源基因分别为At3g12730和AL3G24410。如图5所示,BnA01PHL12和BnC01PHL12与At3G12730和AL3G24410亲缘关系更近,分别来源于白菜的BraA01t04110Z和BolC01g050170.2J,而BnA05PHL12和BnC05PHL12亲缘关系更近,分别来源于白菜的BraA05t22477Z和甘蓝的BolC05g053970.2J。 甘蓝型油菜、白菜、甘蓝、拟南芥和琴叶拟南芥中BnPHL12同源基因的进化树分析,采用邻接法构建进化树,树枝上的数值代表1000次重复产生的自展值Phylogenetic tree of BnPHL12 homologous gene in B.napus, B.rapa, B.oleracea, Arabidopsis thaliana and Arabidopsis lyrata. The values on the branches represents bootstrap value. Phylogenetic trees are constructed using the neighbor-joining method. Bootstrap values from 1000 replicates are shown图5 甘蓝型油菜BnPHL12同源基因进化树Fig.5 Phylogenetic tree of BnPHL12 homologus genes 为了了解BnPHL12同源基因在甘蓝型油菜中的表达模式,在“Westar”的不同组织中检测其表达水平。如图6-a所示,BnA01PHL12和BnC01PHL12具有相似的表达模式,在“Westar”的根、茎、叶、花蕾中均有表达,叶片中表达水平最高。而BnA05PHL12和BnC05PHL12在根、茎、叶、花蕾等各个组织中的表达水平相对较低。为了进一步了解BnPHL12同源基因在花药不同发育阶段中的表达模式,分别检测0~1 mm的花蕾、1~2、2~4、4~6、6~7及>7 mm花药组织中的表达水平;如图6-b所示,花药发育早期,BnPHL12同源基因均有较高的表达水平;随着花药发育,其表达水平逐渐降低;花药发育中后期,其表达水平逐渐提高,其中BnA01PHL12和BnC01PHL12表达水平升高显著,而BnA05PHL12和BnC05PHL12的表达水平变化不显著。为了进一步了解BnPHL12在植物组织中的表达模式,克隆BnA01PHL12启动子,融合到GUS报告载体上并侵染拟南芥。如图6-c所示,在T2代阳性转基因植株的根、茎、叶等营养器官和花蕾中均检测到明显的GUS染色,在叶片中GUS染色最强,其结果与“Westar”各组织中的表达结果一致。 a. “Westar” 根、茎、叶、成熟花蕾中BnPHL12同源基因的相对表达分析;b. “Westar”不同发育阶段的花药中BnPHL12同源基因的相对表达分析;c. BnA01PHL12的1.5 kb启动子在拟南芥中的GUS染色结果;d. BnA01PHL12在拟南芥原生质中的亚细胞定位a. Relative expression analysis of BnPHL12 homologous genes in roots, stems, leaves and mature flower buds of ‘Westar’; b. Relative expression of BnPHL12 homolog genes in anthers of ‘Westar’ at different developmental stages;c. GUS staining of BnA01PHL12 promoter in Arabidopsis thaliana;d. BnA01PHL12 subcellular localization in the Arabidopsis thaliana protoplast by co-transfection assay图6 BnPHL12同源基因的组织表达模式分析及亚细胞定位Fig.6 Tissue expression analysis and subcellular localization of BnPHL12 homologous genes 为了确定BnA01PHL12是否具有转录因子核定位信号特征,将BnA01PHL12与pM999-GFP融合质粒与已知具有核定位的Marker基因GHD7[37](pM999-GHD7-RFP)共同转化拟南芥原生质体细胞,并用激光共聚焦显微镜观察其亚细胞定位情况。如图6-d所示,BnA01PHL12-GFP和GHD7-RFP共同定位在拟南芥原生质体细胞的细胞核中,表明BnA01PHL12是一个定位在细胞核的转录因子。将BnA01PHL12的全长CDS与pGBKT7载体融合,将融合蛋白BD-BnA01PHL12、BD-AtbZIP1 (具有转录激活活性)[36]及pGBKT7(BD)分别转化酵母菌株AH109,并将转化液分别涂布在SD-Trp和SD-Trp/His培养基上,观察不同转化子的生长状况。如图7-a所示,阳性对照BD-AtbZIP1和BD-BnA01PHL12的转化子在SD-Trp和SD-Trp/His培养基中均正常生长;而阴性对照BD的转化子只在SD-Trp的培养基中正常生长,而在SD-Trp/His培养基中生长受到抑制。利用X-Gal对酵母菌斑进行染色,发现仅BD-AtbZIP1和BD-BnA01PHL12菌株可以被染成蓝色,表明AtbZIP1和BnA01PHL12可以激活报告基因lacZ表达,该结果表明BnA01PHL12具有转录激活活性。同时,采用双荧光报告系统(Dual-Luciferase Reporter,DLR)进行BnA01PHL12转录活性分析。如图7-c所示,与对照相比,pGAL4BD-BnA01PHL12与报告子结合,使Luc酶活性提高7.5倍,进一步表明BnA01PHL12具有转录激活活性。以上结果表明,BnA01PHL12是一个定位在细胞核中且具有转录激活活性的MYB-CC转录因子。 a. BD-BnA01PHL12、BD-AtbZIP1和BD转化AH109后在SD/-Trp和SD/-Trp-His培养基上生长状况;b.DLR系统中效应子和报告子载体构建示意图;c. DLR系统检测BnA01PHL12转录活性, LUC相对酶活性代表BnA01PHL12的转录活性,GAL4BD的LUC相对酶活性作为对照a. Growth status of AH109 transformed by BD-BnA01PHL12, BD-AtbZIP and BD on SD/-Trp and SD/-Trp-His media; b.Schematic diagram of effector and reporter vector construction in DLR system; c. BnA01PHL12 transcription activity was detected in DLR system and indicated by relative LUC activity in DLR system, the value of GALBD effector was used as negative control图7 BnA01PHL12转录激活/抑制活性分析Fig.7 Transcriptional activation/repression analysis of BnA01PHL12 本研究利用BnA9基因的启动子驱动BnA01PHL12在花药绒毡层中表达,研究BnA01PHL12是否参与花药的发育调控过程。构建BnA01PHL12过量表达的融合载体,利用农杆菌介导的转化方法,将融合片段分别转入“Westar”和拟南芥(Col)中,并进行转基因阳性鉴定。在甘蓝型油菜的遗传转化中,共获得56株材料,其中52株为阳性单株,阳性率达92.8%,将这些转基因材料种植于转基因材料种植基地,开花期调查显示35株阳性植株表现为雄性不育。如图8-a~图8-e所示,在花药发育的早期和中期,转基因不育株花蕾的大小及外观与野生型植株没有明显差异;在花药成熟及开裂时,转基因不育植株则表现为花丝不伸长、花药干瘪、不能产生花粉且不育植株的角果不能伸长生长,显现出雄性不育的特性。将野生型花粉与不育植株杂交,将杂交后代种植并进行阳性鉴定和表达水平检测。在杂交种的后代中鉴定出大量的雄性不育植株;以上结果表明,利用绒毡层特异表达基因BnA9的启动子过量表达BnA01PHL12,导致的雄性不育性状可以稳定遗传。qRT-PCR结果表明,不育植株(OE-1 和OE-2)的BnA01PHL12表达水平极显著高于野生型材料;而在某些阳性植株中,BnA01PHL12的表达水平虽然提高了(OE-3和OE-4),但不能导致雄性不育(图9-a)。同时,将BnA01PHL12的融合表达载体转入拟南芥中,获得7株阳性转基因植株;转基因植株在苗期和营养生长时期与野生型植株没有明显差异;在开花期,转基因植株均不能产生花药,角果不能正常伸长,为彻底的雄性不育表型(图8-f~图8-i);qRT-PCR检测表明,不育植株中BnA01PHL12的表达水平显著提高(图9-b)。以上结果说明,利用绒毡层特异表达基因BnA9的启动子驱动BnA01PHL12在花药绒毡层中过量表达,影响花药的正常发育,最终导致转基因甘蓝型油菜和拟南芥的雄性不育表型。 a~e:油菜转基因材料雄性不育表型;f~i:拟南芥转基因材料雄性不育表型a-e indicated the male sterility phenotype in transgenic line of B. napus. f-i indicated the male sterility in Arabidopsis thaliana 图8 野生型和过表达BnA01PHL12植株雄性不育表型调查Fig.8 Investigation of male sterility phenotypes of wild-type and overexpressed BnA01PHL12 plants a.转基因油菜中BnA01PHL12表达水平检测; b.转基因拟南芥中BnA01PHL12表达水平检测a. Relative expression level of BnA01PHL12 in B. napus; b. Relative expression level of BnA01PHL12 in Arabidopsis thaliana 图9 转基因材料中BnA01PHL12的表达水平Fig.9 Relative expression level of BnA01PHL12 in transgenic plants 本研究根据MYB-CC家族转录因子AtPHL12的序列信息,采用序列比对和同源克隆的方法在甘蓝型油菜“Westar”中克隆到4个BnPHL12的同源基因:BnA01PHL12、BnC01PHL12、BnA05PHL12和BnC05PHL12,TA克隆BnPHL12同源基因的测序序列与甘蓝型油菜泛基因组BnPIR提供的序列信息一致,表明“Westar”参考基因组信息的开放为甘蓝型油菜基因克隆及功能验证奠定了良好的基础,加速了甘蓝型油菜基因功能的解析。利用十字花科数据库网站BRAD,获得不同物种BnPHL12同源基因的序列信息并进行进化树分析,BnA01PHL12、BnA05PHL12、BnC01PHL12和BnC05PHL12分别来源于白菜的BraA01t04110Z和BraA05t22477Z及甘蓝的BolC01g050170.2J和BolC05g053970.2J,BnA01PHL12、BnC01PHL12与拟南芥的AtPHL12具有更近的亲缘关系。蛋白结构预测表明,BnPHL12同源基因的编码蛋白均含有保守的MYB DNA结合结构域和Coiled-Coiled结构域。前人研究[26-28]表明,拟南芥中存在15个MYB-CC家族转录因子,该家族基因的编码蛋白均含有MYB DNA结合结构域和Coiled-Coiled结构域,其中AtPHR1、AtPHL1、AtPHL2、AtPHL3、AtPHL4等基因以功能冗余的方式参与拟南芥的磷饥饿胁迫过程,当土壤环境中出现缺磷或低磷胁迫时,AtPHR1及AtPHR1-Like基因快速从转录水平上对磷饥饿胁迫作出响应,并通过其MYB DNA 结合结构域靶向磷饥饿胁迫响应基因启动子的顺式作用原件P1BS(GNATATNC),激活靶基因表达,进而维持植物的正常生命活动。因此,推测BnPHL12的同源基因可能存在某些相似的基因功能,可能参与甘蓝型油菜的磷饥饿胁迫等生物学过程。近期研究[39]表明,生长素响应因子ARF7和ARF19通过生长素信号正向调控PHR1的表达,影响侧根的发育,进而响应磷胁迫。MYC-CC家族的其他转录因子 (AtPHL1、AtPHL3、AtPHL12等)的启动子上也含有生长素响应的顺式原件AuxRE,ChIP实验验证了ARF7和ARF19靶向MYB-CC家族的转录因子,推测BnPHL12也可能受生长素响应,参与磷胁迫响应。 表达水平是一个基因行使正常功能的基础,组织表达模式的研究将促进基因功能的解析。根据基因的表达模式,可以分为组成型表达、诱导型表达以及组织特异性表达,基因的组织表达模式与基因启动子密切相关,据此将启动子类型分为组成型启动子、诱导性启动子、组织特异性启动子。 组成型启动子,如烟草花叶病毒(CaMV)的35S启动子[40],玉米的泛素基因(Ubiquitin)启动子[41];诱导性启动子,如与盐诱导相关的甜菜碱合成相关基因BADH启动子[42],与低温诱导相关的rd29A启动子[43];组织特异性启动子,如根特异表达启动子AtPyk10[44],种子特异表达基因Napin启动子[45],花药特异表达基因(SlLat52[46]、A9[38]、SCR[47])启动子,这些不同类型启动子的鉴定及应用促进了基因功能的解析。前人利用花药绒毡层特异表达基因BnA9的启动子驱动半胱氨酸蛋白酶BnaC.CP20.1以及单酰基甘油酯酶BnaC.MAGL8.b,在拟南芥中异位表达这些基因,破坏了绒毡层的正常功能,导致转基因拟南芥雄性不育现象的产生[48-49]。在本研究中,利用实时荧光定量PCR及GUS染色等方法对BnPHL12同源基因进行组织表达模式分析,结果表明BnPHL12同源基因在根、茎、叶、花蕾及花药中均有表达,推测BnPHL12同源基因可能在植物的多个组织中行使功能,但目前对BnPHL12基因的功能研究较少。PHOSPHATESTARVATIONRESPONSE1(PHR1)是磷饥饿胁迫响应过程的一个关键基因,可特异性结合到磷饥饿响应基因的启动子上调控磷胁迫响应[25]。MYB-CC家族的进化分析显示,AtPHL12与AtAPL(At1g79430)具有更近的亲缘关系,可能参与到微管组织的发育过程[50]。在花药发育的不同时期检测BnPHL12同源基因的表达水平,结果表明BnA01PHL12和BnC01PHL12具有相似的表达模式,在花药发育的早期和晚期有相对较高的表达水平,而BnA05PHL12和BnC05PHL12在花药发育的早期表达水平较高,而在花药发育后期表达水平较低,推测BnPHL12同源基因可能参与花药的发育调控过程。前人在分析甘蓝型油菜半胱氨酸蛋白酶在花药中的表达情况,鉴定出2个基因(BnCP21和BnCP13)仅在可育材料中表达,而2个基因(BnCP1和BnCP20)仅在不育材料中表达。利用绒毡层特异表达启动子BnA9在拟南芥中异位表达BnCP20和BnCP13,导致转基因拟南芥雄性不育现象的产生[3]。同样,利用BnA9启动子在绒毡层中表达BnaC.MAGL8.b基因,在花药发育的后期(第13期),花粉粒无法从花药中释放,也导致转基因拟南芥产生雄性不育[51]。在本研究中,基于BnA01PHL12的表达模式及在花药中的表达水平,利用BnA9启动子驱动转录因子BnA01PHL12在转基因油菜“Westar”和拟南芥(Col)中表达,均获得了雄性不育材料,且其不育特性可稳定遗传,但在绒毡层细胞中过量表达BnA01PHL12导致雄性不育的分子机制有待进一步的研究。转录因子在花药的发育过程中具有重要的作用,AMS和DYT1是bHLH家族转录因子,TDF1、MS188(AtMYB80/MYB103)是R2R3型的MYB转录因子,这些转录因子位于同一条信号通路中,有如下的上下游关系:DYT1、TDF1、AMS、MYB103/MS188。DYT1可结合到TDF1的启动子区域调控下游的AMS表达,而AMS可控制大量花粉壁形成相关基因的表达,包括胼胝质、脂肪酸延长、酚类化合物的合成以及脂类物质运输等[52],MS188/MYB103参与绒毡层发育和花粉外壁的形成,突变该基因直接导致胼胝质无法降解,总之,这些转录因子可参与绒毡层 PCD 过程和花粉壁的形成,突变这些基因均可导致绒毡层的液泡化和花粉壁结构的异常,导致雄性不育的产生[53]。转录激活/抑制活性分析及亚细胞定位结果显示,BnA01PHL12具有转录激活活性且定位在细胞核中,是MYB-CC类型的转录因子。MYB-CC转录因子含有MYB 结构域和Coiled-Coiled结构域,两分子的MYB结构域可特异性结合靶基因顺式元件P1BS(GNATATNC),而Coiled-Coiled结构域在蛋白的二聚体形成中起重要作用[25, 54],推测BnA01PHL12可能形成同源二聚体或与其他转录因子形成异源二聚体,参与植物的花药发育过程。本研究中,利用基因工程的方法,在绒毡层发育过程中过量表达BnA01PHL12,影响了绒毡层发育或降解等相关基因的正常表达,最终导致雄性不育的产生,但MYB-CC家族的转录因子BnA01PHL12如何参与花药发育及影响雄性不育有待进一步的分析。 拟南芥MYB-CC家族的转录因子AtPHL12(At3g12730)在甘蓝型油菜中存在4个同源基因,这些基因均含有MYB DNA结合结构域和Coiled-Coiled结构域,属于甘蓝型油菜MYB-CC家族的重要成员;BnA01PHL12是一个定位在细胞核且具有转录激活活性的转录因子,在营养器官(根、茎、叶)以及生殖器官(花蕾、花药)中均有表达,通过在绒毡层细胞中过量表达BnA01PHL12,创建了油菜和拟南芥新的雄性不育材料,为花药发育和雄性不育的研究提供了良好的基础。
2 结果与分析
2.1 BnPHL12的基因克隆
2.2 BnPHL12同源基因结构分析

2.3 BnPHL12同源基因的理化性质分析
2.4 BnPHL12同源基因进化树分析

2.5 BnPHL12同源基因表达模式分析

2.6 BnA01PHL12亚细胞定位及转录活性分析
2.7 BnA01PHL12过量表达导致甘蓝型油菜和拟南芥的雄性不育

3 讨 论
4 结 论
