图像引导放射治疗在中晚期食管癌的摆位误差分析及临床研究
2022-09-29杨瑜柏会明王婷婷
杨瑜 柏会明 吉 颖 王婷婷
(盐城市第二人民医院放疗科,江苏 盐城 224000)
中国人口众多,食管癌占全球癌症新确诊病例的24.00%和癌症死亡病例的30.00%[1]。在消化道肿瘤中,食管癌比较常见,是全世界癌症相关死亡的重要原因[2]。2020年全球癌症统计:食管癌的发病率排名第7位,总体病死率排名第6位,男性发病率高于女性。食管癌有两种最常见的组织学亚型:鳞状细胞癌(squamous cell carcinoma,SCC)和腺癌(adenocarcinoma,AC)。我国是食管癌的高风险地区,主要病理类型是食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC),随着经济发展和饮食改善,食管癌的发病率有所下降[3]。食管癌的治疗方法有手术切除、化疗、放疗、免疫治疗等,需要根据患者的身体状况以及肿瘤的病理分期选择合适的治疗方案[4]。指南建议晚期无法手术的ESCC患者主要治疗方式是放化疗[5],其主要不良反应有骨髓抑制、放射性食管炎和放射性肺炎,严重影响患者预后及生活质量[6]。放射治疗是ESCC有效的治疗方法之一。放射治疗技术已经从经典的二维方法进化到三维适形和调强放射治疗。然而,如何确保将准确剂量的化疗药物注入到肿瘤,同时最小化正常组织的照射仍然是放射肿瘤学者的巨大挑战,特别是由于部位之间的定位误差和器官的自主运动存在差异。近年来,图像引导的放射治疗(IGRT)大大提高了肿瘤照射的准确性,同时减少了病变周围健康组织和器官的辐照剂量。锥束CT(CBCT)扫描是一种新型的成像方式,具有最小的辐射照射和相对较快的采集时间。计算机断层扫描(CT)通过多选排CT(MDCT)和锥形光束CT(CBCT)的图像引导发展为诊断成像的基本模态。三维图像引导放射治疗(IGRT)与锥束计算机断层扫描(CBCT)相结合,可以实现更精确的目标定位[7]。IGRT通过放射治疗过程中发生的解剖变化,利用影像学、计算机等技术直接或间接显示目标体积,然后采取纠正措施。通过移动治疗台纠正目标的移动,或纠正设置错误,更好地保护了危及器官,减轻了不必要的不良反应[8]。本文观察三维适形及调强放疗对食管癌治疗的临床疗效及不良反应的情况,探究了CBCT引导下的IGRT对食管癌患者放疗疗效及毒性反应的影响,以期为食管癌的临床治疗提供临床依据。
1 材料与方法
1.1 病历选择 以2016年9月至2021年8月盐城市第二人民医院肿瘤放疗科112例食管癌行根治性放射治疗的患者作为研究对象。纳入标准:所有患者均为中晚期食管癌,病理类型为鳞癌,TNM分期为Ⅱ~Ⅳ期。排除标准:①排除合并感染性疾病、血液系统疾病、自身免疫系统疾病、存在放疗禁忌证、严重心肺、肝肾功能不全等患者。②首次进行食管局部放疗。③中途因无法耐受放疗退出本次研究者。入组患者男性62例,女性50例,年龄48~90岁,平均年龄(73.37±7.98)岁。按接受放疗方式的不同分为三维适形组、普通调强组、CBCT引导的强调组3组,三维适形组31例,年龄53~90岁,平均年龄(73.94±8.24)岁,其中同步化疗患者有2例;普通调强组25例,年龄48~83岁,平均年龄(72.16±8.74)岁,其中同步化疗患者有6例;CBCT引导的调强组56例,年龄53~88岁,平均年龄(73.59±7.57)岁,其中同步化疗患者有20例。患者或其家属均于治疗前签署特殊治疗知情同意书。本研究符合《赫尔辛基宣言》的原则。
1.2 CT模拟定位 患者仰卧位,手臂放在头部,用热塑性塑料模具固定。CT定位扫描层厚度为5 mm。除非患者的病情情况不允许或拒绝,否则应使用静脉注射对比剂进行CT定位,造影前至少6 h空腹。将定位图像传输到放疗中心规划系统以勾勒目标区域。
1.3 计划设计 CRT采用前后垂直野40 Gy后为避脊髓改两斜野。定位时以食管钡剂造影下为参照,结合胃镜、CT等检查确定上下界,上下界外放3~5 cm,左右外放1.00~1.50 cm确定照射区域,常规照射,1.80~2.20 Gy/f,5 f/w,照射总量为59.40~68.00 Gy。IMRT治疗:在CT层面上逐层勾画大体肿瘤靶区体积(GTV)和转移淋巴结(GTVnd),临床靶区体积(CTV)和计划靶区体积(PTV),CTV包括沿食管病灶四周外放0.60~0.80 cm食管病灶上下各外扩3~5 cm区域或GTVnd下1 cm,包括高危转移的淋巴引流区域,如有远离原发灶的区域淋巴结转移或不能排除转移的淋巴结也可包括入CTV,PTV指在临床靶区的基础上左右方向外扩0.50 cm的区域。对靶区周围的重要危及器官进行勾画并评价。IGRT采用七叶共面照射,靶区剂量要求:95% PTV受照射剂量不低于处方剂量,最高剂量不高于处方剂量107%,处方剂量在54~68 Gy,单次照射剂量为1.80~2.20 Gy,5次/周。双肺V20≤30%,脊髓受照剂量<45 Gy,心脏V30≤40%。用剂量体积直方图(DVH)评价正常组织的辐射剂量。放射治疗计划确定后,医师、物理学家和技术员应共同定位和验证,以实施放射治疗。CBCT治疗组靶区勾画时,以van Herk[9]推荐公式(MPTV=2.5∑+0.7δ)可以估算摆位外扩边界值。本三维适形组患者PTV外放0.20 cm。余治疗计划等与调强组无差别。
1.4 CBCT图像配准 首次治疗前需由放疗师、物理师及临床医师共同摆位,将热塑膜上标志线与激光线上的线对齐,经共同确认后利用瓦里安加速器自带的锥形束CT进行扫描。扫描参数:将扫描后的CBCT图像与模拟定位扫描的CT图像进行自动配准,然后手动微调,尽量达到两幅图像重合的要求。将CBCT扫描结果与治疗计划靶区位置进行对比,记录患者实际中心位置与治疗计划中心位置在X(左右)、Y(前后)、Z(上下)三维方向上的误差值。
1.5 评价标准 根据食管造影或胸部CT影像学结果对3组患者治疗期间或治疗结束后进行近期疗效及急性不良反应评价,参考《实体瘤疗效评价标准(RECIST)指南1.1版》[10]评估两组患者临床疗效,完全缓解(CR):肿瘤病灶全部消失;部分缓解(PR):肿瘤体积缩小>50%,病灶直径较治疗前缩小≥30%;疾病稳定(SD):肿瘤体积缩小≤50%或增大≤25%,病灶直径缩小<30%或增加≤20%;疾病进展(PD):肿瘤体积增大>25%,或是有新的病灶出现。(CR+PR)/总例数=局部缓解率。
1.5 数据的处理及统计 应用SPSS 25.0统计学软件分析数据,计量资料采用t检验,计数资料采用χ2检验比较分析,当P<0.05时为组间差异具有统计学意义。
2 结果
2.1 摆位误差测量结果 共有56例食管癌患者在放疗前进行CBCT扫描,摆位误差分别为:X轴(左右)方向(-0.09±0.17)cm,Y轴(前后)方向(0.01±0.28)cm,Z轴(上下)方向(-0.03±0.18)cm。结果显示,前后方向上移动度最大,最大值达0.60。当超过0.30 mm时重复配对1次。见表1。
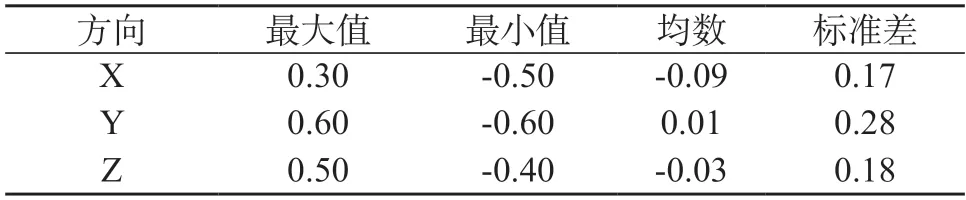
表1 CBCT组不同方向得误差比较
2.2 治疗效果及不良反应结果 结果显示,3组近期局部缓解率对比,差异无显著性(P>0.05)。见表2。3组研究对象顺利接受治疗,治疗后CRT组有1例因低钾血症出现重症,IMRT组有1例出现食管深溃疡,CBCT引导的IMRT组有1例食管深溃疡和1例出现食管瘘,其余患者毒性反应尚可。3组不良反应发生率中骨髓抑制有统计学意义(P<0.05),而3组放射性食管炎、放射性气管或肺炎发生率无显著性差异(P>0.05)。见表3。

表2 3组近期临床缓解率对比
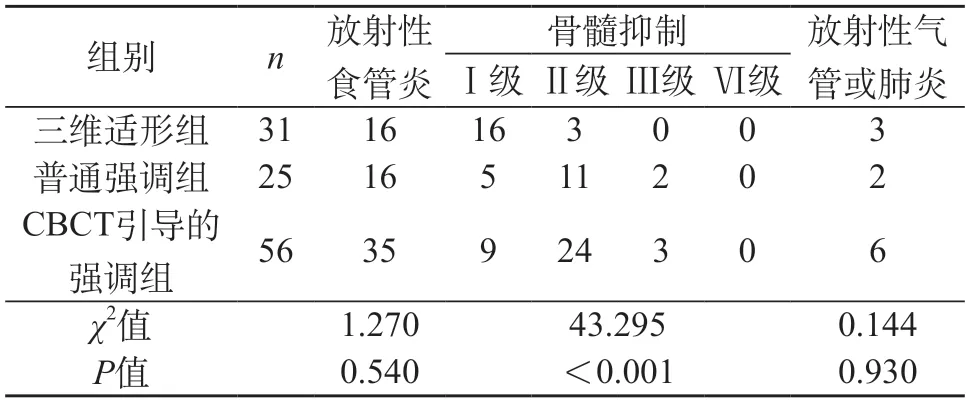
表3 3组不良反应发生率对比
2.3 骨髓毒性结果 鉴于骨髓抑制对3种治疗方法有统计学差异,多篇文献报道化疗可导致骨髓抑制[11-12],因此,为避免这一影响因素的干扰,进一步筛选非化疗患者单独进行比较,发现普通调强放疗组较三维适形组并未改善其骨髓毒性(P>0.05),但CBCT引导下的调强组较普通调强组明显改善了骨髓抑制(P<0.05)。
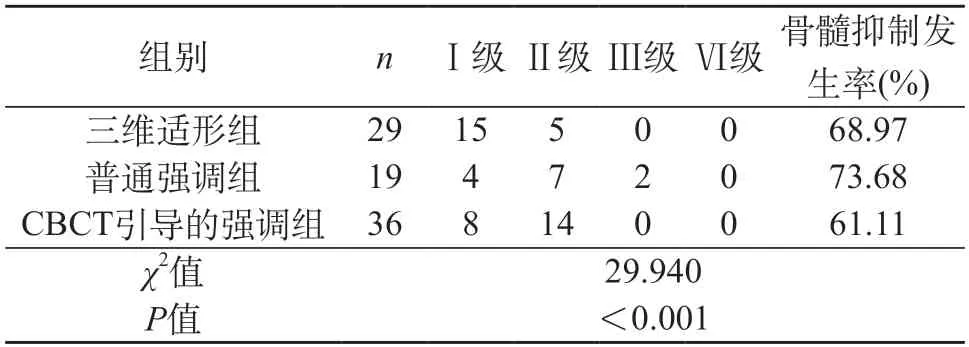
表4 非化疗患者骨髓毒性比较
3 讨论
局部晚期食管癌的治疗仍然是一项重大挑战,因为局部区域复发和远处转移的失败率很高,局部复发的原因之一是肿瘤靶区局部照射剂量不足。虽然同步放化疗可以提高疗效,但是大多数老年食管癌患者不能完成标准同步放化疗,在某些情况下只能选择单独的化学疗法或放射治疗(RT)。Jingu等[13]研究发现,对同步放化疗在≥80岁的食管癌患者进行单纯放射治疗食管癌与联合放化疗患者效果比较,患者的总生存率(OS)并没有显著差异[13]。因此,应在老年患者中慎重选择联合放化疗治疗。尽管NCCN指南推荐50.00~50.40的RT剂量为标准剂量[14],但这一剂量永远无法治愈肉眼可见的肿瘤,所以中国指南仍建议食管癌患者行根治性放疗的剂量为60 Gy[15]。赵晶晶和庞青松[16]证明高剂量的放疗可能会改善局部控制,66~70 Gy的总剂量可以治愈胸外、胸内或食管胃交界处食管癌。虽然高剂量的放疗可能会改善局部控制,但食管剂量的增加可能导致严重的并发症,包括溃疡、穿孔和狭窄等[17]。本研究中有1例食管瘘患者接受放化疗序贯治疗,在放疗剂量达到64 Gy后出现穿孔。食管穿孔是食管癌放疗后或放疗期间的一种致命性并发症,目前,没有令人满意的治疗剂量[18]。因此在食管癌根治性放疗联合化疗的患者中,剂量选择应尤为慎重。
图像引导放射治疗(image-guided radiotherapy,IGRT)是一种先进的放射治疗技术,旨在提高治疗的准确性[19]。有研究显示,同步放化疗与IGRT相结合在非手术局部ESCC患者中可以改善患者的预后[20]。本研究显示,利用CBCT引导下的IGRT技术提供了较为准确的外放边界估计值,减少部分正常组织照射范围,有可能降低食管癌放射治疗中骨髓抑制的剂量,然而在这项使用真实数据的随机研究中,本研究发现了3组间的短期疗效没有统计学差异,本研究仅做了短期疗效分析观察,未对患者进行长期随访,还需进一步研究证实其远期疗效。总之,IGRT患者耐受性良好,可以保护骨髓,值得推荐。
综上所述,食管癌是世界上最致命的癌症之一,由于有限的常规治疗和严重的并发症影响,结果仍不满意。随着食管癌基因组的分子表征,一种新型的治疗方法—靶向治疗在食管癌的治疗中起到了重要的作用。拉莫西单抗(VEGFR)、曲妥珠单抗(HER-2)和派姆单抗(PD-L1)药物已经用于临床治疗食管腺癌[21]。然而,中国的主要食管癌亚型是SCC,尽管具有全面的分子表征,但是,ESCC可用的靶向治疗仍然落后。因此,我国迫切需要制订准确的ESCC防治方案。目前彭布罗利珠单抗可用于局部晚期、转移性或复发性PDL-1阳性ESCC患者。ESCC的靶向治疗有限,免疫治疗仅在二线治疗中是一种选择。未来的靶向疗法可能包括CDK4/6抑制剂,PARP抑制剂和靶向NRF2和Wnt信号通路的抑制剂[22]。此外,Heidari等[23]首次开发了一种抗Periostin64Cu-DOTA-F(ab')2显像PET探针,发现了一种细胞外基质蛋白—骨膜素,在ESCC患者中使用靶向PET示踪剂是可行的。在肿瘤微环境骨膜的检测可以帮助早期发现,手术后随访,并在原发和转移病灶的原位表征。除此之外,硼中子俘获疗法(BNCT)是一种选择性生物靶向核素治疗癌症的技术。与其他传统方法相比,该方法具有靶向性好、效率高、对周围健康组织损伤小等优点。它被认为是治疗各种癌症的有效方法之一[24]。目前,治疗食管癌的相关靶向药物的研究仍是一个热点。然而,尽管靶向药物可以改善治疗效果,但高昂的治疗费用以及药物获取的途径仍然是我们面临的挑战。耐药性一直是临床癌症治疗中的难题。因此,在开发新的食管癌靶向药物时,必须考虑并避免靶向治疗的这些缺点,以提高治疗效果。我们相信,随着新的治疗靶点的发现,将开发出越来越有效的食管癌靶向治疗方法,以克服这一致命疾病。
利益冲突:所有作者声明无利益冲突。
作者贡献声明:杨瑜负责研究的设计和实施、论文的撰写;吉颖、王婷婷负责图像数据的采集和处理;柏会明负责论文的指导与审阅。
